Способ лечения, профилактики или уменьшения системного воспаления у детей на искусственном вскармливании
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к педиатрии, и может быть использована для лечения, профилактики или уменьшения системного воспаления у детей на искусственном вскармливании до уровня, имеющего место при вскармливании грудью. Для этого ребенку вводят терапевтически эффективное количество Lactobacillus rhamnosus GG (LGG) в комбинации, по крайней мере, с одной длинноцепочечной полиненасыщенной жирной кислотой (LCPUFA). Введение комбинации LGG и LCPUFA позволяет значительно снизить системный выброс провоспалительных цитокинов, хемокинов и МРО, обуславливая эффективность предложенной терапии. 4 н. и 10 з.п. ф-лы, 7 ил.
Реферат
Предпосылки создания изобретения
Область техники
Настоящее изобретение в целом относится к использованию пробиотиков в комбинации по крайней мере с одной длинноцепочечной полиненасыщенной жирной кислотой для создания лекарственного средства, предназначенного для лечения, профилактики или уменьшения системного воспаления у детей на искусственном вскармливании.
Описание релевантного уровня техники
Воспалительный ответ представляет собой попытку организма сохранять и поддерживать гомеостаз после инвазии инфекционного агента, антигенного воздействия или физического, химического или травматического повреждения. Ограниченное воспаление локализуется в определенном участке и проявляется различными симптомами, включая покраснение (гиперемию), отек, повышение местной температуры и боль.
Несмотря на то что воспалительный ответ считается нормальной реакцией на повреждение, иммунная система может предоставлять нежелательный физиологический ответ в том случае, если нарушается ее регуляция. В таких ситуациях нормальная иммунная защитная система организма вызывает повреждение собственных тканей организма, за счет восприятия здоровых тканей как инфицированных или анормальных. Альтернативно, если существует повреждение, воспалительный ответ может быть неадекватным или чрезмерным для того, чтобы справиться с существующей угрозой. Указанный воспалительный ответ может причинить больший вред организму, нежели чем сам по себе чужеродный агент.
Было показано, что воспалительный ответ частично опосредован усиленной экспрессией как провоспалительных, так и антивоспалительных цитокинов. Цитокины представляют собой низкомолекулярные биологически активные белки, принимающие участие в координировании иммунологических и воспалительных ответов и осуществляющие взаимодействие между специфическими популяциями иммунных клеток. Цитокины продуцируются множеством указанных клеток, включая нейтрофилы, моноциты и лимфоциты, которые являются основным источником цитокинов во время воспалительных реакций за счет их большого скопления в очаге повреждения.
Существует множество механизмов, за счет которых цитокины, секретируемые в очагах воспаления, влияют на воспалительный ответ. В том случае, если провоспалительный ответ недостаточно подавляется антивоспалительными цитокинами, может возникать неконтролируемое системное воспаление.
В отличие от ограниченного воспаления, системная воспалительная реакция распространяется по всему организму. При указанном типе воспаления могут существовать очаги ограниченного воспаления в специфических участках организма, однако он ассоциирован с так называемыми симптомами "общей воспалительной реакции", к которым относятся лихорадка, озноб, слабость или потеря энергии, головная боль, потеря аппетита и мышечная слабость. Системное воспаление может приводить к деградации белков, катаболизму и гиперметаболизму. Последствием этого является нарушение структуры и функции жизненно важных органов, таких как мышцы, сердце, иммунная система и печень, что, в свою очередь, приводит к полиорганной недостаточности и даже к смерти. См. Jeschke et al. Insulin Attenuates the Systemic Inflammatory Response to Thermal Trauma, Mol. Med. 8(8): 443-450 (2002). Несмотря на то что в настоящее время достигнут существенный прогресс в понимании механизмов развития системной воспалительной реакции, показатели смертности от указанного осложнения остаются недопустимо высокими.
Очень часто характер цитокинного ответа (про- или антивоспалительный) зависит от баланса индивидуальных микроорганизмов, которые колонизируют просвет кишечника в каждый определенный момент времени. Хорошо известно, что слизистая оболочка кишечника колонизирована бесконечно большой, комплексной и динамической популяцией микроорганизмов. Состав кишечной микрофлоры варьирует в различных отделах пищеварительного тракта, а также в различных микроскопических структурах, таких как эпителиальный слизистый слой, глубокий слизистый слой крипт и поверхность мукозных эпителиальных клеток. Специфическая колонизация зависит от многих внутренних и внешних факторов, включая доступные в просвете кишечника молекулы, свойства слизистой и взаимодействий микроб-организм и микроб-микроб. См. Murch S.H. Toll of Allergy Reduced by Probiotics, Lancet, 357:1057-1059 (2001).
Указанные микроорганизмы, которые формируют кишечную микрофлору, активно участвуют в иммунном ответе. Взаимодействие данных микроорганизмов с эпителием происходит двумя возможными способами: когда указанные взаимоотношения являются взаимовыгодными для обоих партнеров (симбиоз) либо когда они являются выгодными для одного партнера, но при этом не причиняют вреда другому партнеру (комменсализм). См. Hooper et al. How Host-Microbiak Interactions Shape the Nutrient Environment of The Mammalian Intestine, Annu. Rev. Nutr. 22: 283-307 (2002). В действительности, существуют строгие доказательства наличия сильного взаимодействия или "перекрестной связи" между кишечной микрофлорой и различными клеточными популяциями слизистой оболочки кишечника. См. Bourlioux et al. The Intestine and its Microflora are Partners for the Host: Report on the Danone Symposium "The Intelligent Intestine", held in Paris, June 14, 2002, Am. J. Clin. Nutr. 78: 675 (2003); Hooper L.V. & Gordon J.I., Commensal Host-Bacterial Relationships in the Gut, Sci. 292:1115 (2001); Haller et al. Non-Pathogenic Bacteria Elicit a Differential Cytokine Response by Intestinal Epithelial Cell/Leucocyte Co-Cultures, GUT 47: 79 (2000); Walker W.A., Role of Nutrients and Bacterial Colonization in the Development of Intestinal Host Defense, J. Pediatr. Gastroenterol. Nutr. 30: S2 (2000). Кроме того, было показано, что кишечная микрофлора обладает способностью вызывать как локальный, так и общий специфический иммунный ответ у взрослых. См. Isolauri E. et al. Probiotics: Effects on Immunity, Am. J. Clin. Nutr. 73:444S-50S (2001).
Известно, что кишечная микрофлора у детей является намного менее развитой, чем у взрослых. В то время как кишечная микрофлора взрослого человека включает более 1013 микроорганизмов и около 500 различных видов, некоторые из которых являются полезными, а некоторые - вредными, кишечная микрофлора ребенка включает только часть указанных микроорганизмов и отличается от микрофлоры взрослого, как абсолютным количеством микроорганизмов, так и видовой специфичностью. При рождении ребенка просвет кишечника является стерильным и заполняется микрофлорой при прохождении родового канала, при взаимодействии с окружающей средой и при потреблении пищи. Поскольку в раннем неонатальном периоде популяция кишечной микрофлоры является очень нестабильной, для незрелого кишечника ребенка очень сложно поддерживать точный баланс между вредными и полезными бактериями, что уменьшает способность иммунной системы нормально функционировать.
Особенно сложно поддерживать указанный баланс у детей, находящихся на искусственном вскармливании, за счет существующих видовых различий микроорганизмов в кишечнике детей, находящихся на искусственном и грудном вскармливании. Стул детей, находящихся на грудном вскармливании, содержит главным образом бактерии рода Bifidobacterium, а также Streptococcus и Lactobacillus, хотя их вклад существенно меньше. В противоположность этому, микрофлора детей, находящихся на искусственном вскармливании, является более разнообразной и включает бактерии рода Bifidobacterium и Bacteroides, а также патогенные микроорганизмы, такие как Staphylococcus, Escherichia coli и Clostridia. Видовой состав бактерий из рода Bifidobacterium также различается у детей на искусственном и грудном вскармливании. Считается, что указанные различия фекальной микрофлоры у детей на искусственном и грудном вскармливании обусловлены множеством факторов, включая низкое содержание и различное сочетание белков в человеческом молоке, большое разнообразие олигосахаридов в человеческом молоке и наличие множества гуморальных и клеточных медиаторов с различными иммунологическими функциями в грудном молоке. См. Agostoni et al. Probiotic Bacteria in Dietetic Products for Infants: A Commentary by the ESPGHAN Committee on Nutrition, J. Pediatr. Gastro. Nutr. 38: 365-374 (Apr. 2004).
Поскольку микрофлора детей на искусственном вскармливании является очень нестабильной, а кишечная микрофлора в существенной степени участвует в стимуляции кишечного иммунитета, дети на искусственном вскармливании более предрасположены к развитию воспалительных заболеваний. Многие заболевания, которые встречаются у детей, включая хронические заболевания легких, перивентрикулярную лейкомаляцию, неонатальный менингит, неонатальный гепатит, сепсис и некротизирующий энтероколит, являются воспалительными по своей природе. В зависимости от каждого определенного заболевания, сопутствующая ему воспалительная реакция локализуется в специфическом органе, таком как легкое, головной мозг, печень или кишечник, либо изначально является системной по своей природе.
Например, при хронических заболеваниях легких воспаление локализуется во внутренних тканях легких, в то время как при неонатальном менингите воспаление затрагивает оболочки головного и спинного мозга. Перивентрикулярная лейкомаляция является следствием воспаления и повреждения перивентрикулярной зоны в развивающемся головном мозге. При некротизирующем энтероколите воспаление локализуется в кишечнике и может приводить к частичному или полному разрушению стенки кишки, а при неонатальном гепатите воспаление локализуется в печени и возникает в раннем детстве. Сепсис, также известный как синдром системной воспалительной реакции, представляет собой очень серьезное заболевание, при котором токсин-продуцирующие бактерии распространяются по кровотоку, при этом наличие патогенов в крови вызывает системный иммунный ответ во всем организме.
У недоношенных и тяжело больных детей серьезной проблемой являются сроки формирования кишечного иммунитета и профилактика системного воспаления. Недоношенных или серьезно больных детей обычно сразу после рождения помещают в стерильные инкубаторы, где они не вступают в контакт с бактериальными популяциями, с которыми в норме контактируют здоровые, доношенные дети. Это приводит к замедлению или нарушению нормального процесса колонизации кишечника. Кроме того, такие дети обычно получают антибиотики широкого спектра действия, которые убивают симбиотические бактерии, которые колонизируют кишечный тракт ребенка. Помимо этого, такие дети обычно находятся на искусственном вскармливании и не получают материнского молока. Каждый из этих факторов может являться причиной неправильного формирования кишечной микрофлоры у ребенка, что, в свою очередь, может приводить или вносить свой вклад в развитие угрожающей жизни системной воспалительной реакции.
Одним из способов стимуляции процесса колонизации кишечника благотворными микроорганизмами у детей, находящихся на искусственном вскармливании, является введение пробиотических бактерий. Пробиотические бактерии представляют собой живующие микроорганизмы, которые оказывают благоприятное влияние на состояние здоровья организма-хозяина. Типичными представителями пробиотических бактерий являются бактерии Lactobacillus spp. и Bifidobacterium spp., которые являются нормальными обитателями здорового кишечника.
К сожалению, в настоящее время имеется очень мало публикаций, касающихся изучения клинических эффектов пробиотической поддержки у детей. См. Agostoni С. et al. Probiotic Bacteria in Dietetic Products for Infants: A Commentary by the ESPGHAN Committee on Nutrition, J. Pediatr. Gastro. Nutr. 38: 365-374 (2004). Также совсем немного известно о способности пробиотиков регулировать кишечное воспаление и влиять на распространение воспалительного процесса на другие органы организма ребенка.
Результаты исследований, направленных на изучение эффектов пробиотиков у детей, являются противоречивыми. Например, результаты исследования, проведенного в 1994 году, говорят о том, что введение стандартного детского питания, обогащенного Bifidobacterium lactis и Streptococcus thermophilus, приводит к уменьшению нозокомиальной диареи по сравнению с плацебо. См. Saavedra J. et al. Feeding of Bifidobacterium bifidum and Streptococcus thermophilus to Infants in Hospital for Prevention of Diarrhea and Shedding of Rotavirus, Lancet 344: 1049-49 (1994). В противоположность этому, однако, результаты исследования, проведенного в 1999 году, свидетельствуют об отсутствии протективного эффекта детского питания, обогащенного только Bifidobacterium или в комбинации с S. Thermophilus, на эпизоды диареи. См. Phuapradit P. et al. Reduction of Rotavirus Infection in Children Receiving Bifidobacteria-Supplemented Formula, J. Med. Assoc. Thai. 82: S43-48 (1999).
Заявка на патент США No. 20040208863, Versalovic et al., относится к соединению, обладающему противовоспалительной активностью и секретируемому молочнокислыми бактериями. В данной заявке описывается использование Lactobacillus rhamnosus GG (LGG) для ингибирования образования провоспалительных цитокинов. Однако данная заявка фокусируется на взрослых моделях и не раскрывает возможность того, что данное изобретение может быть полезным для детей. Как описано выше, пищеварительная и иммунная система детей очень сильно отличается от таковой у взрослых. Поскольку бактериальные популяции и их видовая принадлежность сильно различаются в кишечнике детей и взрослых, также как и зрелость иммунной системы указанных двух популяций, нельзя ожидать того, что у детей будут получены такие же результаты.
Заявка на патент США No. 20040147010, Vidal et al., относится способу уменьшения или профилактики воспалительных процессов, ассоциированных с бактериально-опосредованными заболеваниями желудочно-кишечного тракта, костей, кожи, глаз, ушей, легких и ротовой полости человека. Способ заключается во введении эффективного количества липотейхоевой кислоты (LTA, от англ. LipoTeichoic Acid) молочнокислых бактерий и/или введении молочнокислых бактерий, которые продуцируют LTA. В указанной заявке также сообщается о том, что указанные композиции могут влиять на бактериальную колонизацию и развитие инфекций в неонатальном периоде.
В заявке Видаля использовались бактериальные штаммы Lactobacillus acidophilus и Lactobacillus johnsonii. Видаль не сообщает об использовании LGG. В действительности Видаль сообщает, что "LTAs Грам+ бактерий сильно различается у разных бактериальных штаммов". См. Vidal арр., р. [0006]. Следовательно, можно допустить, что, поскольку L. acidophilus и L. johnsonii оказывают антивоспалительный эффект на изучаемые клетки толстого кишечника взрослых, аналогичный эффект будет наблюдаться и в отношении всех бактерий рода Lactobacillus.
Кроме того, Видаль отмечает, что LTA определенных видов бактерий обладает способностью опосредовать скорее провоспалительный эффект иммунных клеток, нежели чем антивоспалительный. См. Vidal арр., р. [0005]. Следовательно, поскольку LTA могут оказывать как провоспалительное, так и антивоспалительное действие, в зависимости от бактериального штамма, заключение Видаля ограничивается специфическими видами бактерий. В своей статье Видаль говорит о том, что "биологическая активность LTAs [различных бактериальных штаммов] не может быть предсказана". См. Vidal et al. Lipoteichoic Acids from Lactobacillus johnsonii Strain La1 and Lactobacillus acidophilus Strain La10 Antagonize the Responsiveness of Human Intestinal Epithelial HT29 Cells to Lipopolysaccharide and Gram-Negative Bacteria, Infect. Immun. 70: 2057-2064 (2002).
Таким образом, с учетом вышеизложенного, влияние LGG на иммунную систему детей к настоящему времени не раскрыто. Существуют существенные и фундаментальные отличия иммунной и пищеварительной систем у детей и взрослых. Таким образом, исследования, которые нацелены на изучение взрослых людей и их клеточных линий, не могут быть полезными для оценки эффектов LGG у детей. Ранее не сообщалось о том, что LGG оказывает влияние на системный иммунный эффект у детей, находящихся на искусственном вскармливании. Кроме того, также ранее не было показано, что детское питание, обогащенное LGG, может предотвращать или уменьшать системное воспаление в такой же степени, что и грудное молоко. Соответственно, было бы полезно создать способ, позволяющий уменьшать или предотвращать развитие системной воспалительной реакции у детей на искусственном вскармливании и заключающийся во введении LGG.
Сущность изобретения
Таким образом, вкратце, настоящее изобретение относится к новому способу использования LGG в комбинации, по крайней мере, с одной длинноцепочечной полиненасыщенной жирной кислотой (LCPUFA, от англ. Long Chain Polyunsaturated Fatty Acid) для создания лекарственного средства, предназначенного для лечения, профилактики или уменьшения системного воспаления у детей на искусственном вскармливании.
Настоящее изобретение также относится к новому способу использования LGG в комбинации, по крайней мере, с одной длинноцепочечной полиненасыщенной жирной кислотой (LCPUFA) для создания лекарственного средства, которое позволяет предотвратить развитие системного воспаления у детей на искусственном вскармливании или снизить его до уровня, который отмечается у детей на грудном вскармливании.
Кроме того, настоящее изобретение относится к использованию LGG в комбинации, по крайней мере, с одной длинноцепочечной полиненасыщенной жирной кислотой (LCPUFA) для создания лекарственного средства для уменьшения или профилактики воспаления у детей на искусственном вскармливании в одном или более органе, выбранном из группы, включающей: пищеварительный тракт, печень, плазму, легкие и головной мозг.
В другом своем аспекте настоящее изобретение относится к использованию LGG в комбинации, по крайней мере, с одной длинноцепочечной полиненасыщенной жирной кислотой (LCPUFA) для создания лекарственного средства для уменьшения или профилактики физического повреждения слизистой оболочки кишечника у детей на искусственном вскармливании.
Настоящее изобретение также относится к использованию LGG в комбинации, по крайней мере, с одной длинноцепочечной полиненасыщенной жирной кислотой для создания лекарственного средства для уменьшения или профилактики системного выброса одного или более провоспалительного цитокина или хемокина у детей на искусственном вскармливании.
Кроме того, настоящее изобретение относится к использованию LGG в комбинации, по крайней мере, с одной длинноцепочечной полиненасыщенной жирной кислотой (LCPUFA) для создания лекарственного средства для уменьшения или профилактики системного выброса миелопероксидаз (МРО, от англ. Myloperoxidase) у детей на искусственном вскармливании.
Среди многих благоприятных эффектов, которые достигаются при использовании настоящего изобретения, существует один, который позволяет уменьшить или предотвратить развитие системного воспаления у детей на искусственном вскармливании. Кроме того, настоящее изобретение позволяет предотвратить развитие системного воспаления у детей на искусственном вскармливании или снизить его до уровня, который наблюдается у детей на грудном вскармливании. Настоящее изобретение также позволяет уменьшить воспаление в пищеварительном тракте, печени, плазме, легких и головном мозге. Еще одним преимуществом настоящего изобретения является его возможность уменьшать или предотвращать физическое повреждение слизистой оболочки кишечника у детей на искусственном вскармливании. Кроме того, настоящее изобретение уменьшает или предотвращает выброс различных провоспалительных цитокинов и хемокинов у детей на искусственном вскармливании, включая фактор некроза опухолей-α (TNF-α), интерлейкин-1β (IL-1β), IL-6, IL-18 и уровни онкогена, ассоциированного с ростом (GRO/KC). Поскольку настоящее изобретение может использоваться для изменения степени воспаления у детей, оно также может предотвращать развитие вредных инфекций или заболеваний.
Краткое описание чертежей
Для более полного понимания сущности настоящего изобретения ниже представлено более детальное его описание с ссылками на сопроводительные чертежи.
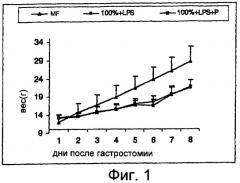
На Фигуре 1 показано влияние LGG на рост крысят, которое оценивают по изменению массы тела в течение всего периода исследования.
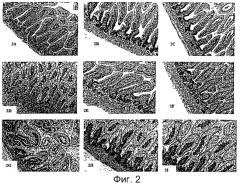
На Фигуре 2 показано влияние LGG на морфологию желудочно-кишечного тракта у крысят, которую оценивают с помощью микрофотографий кишечной ткани в условиях воспаления при введении LGG и без него.
На Фигуре 3 показано влияние LGG на продукцию цитокин-индуцированного хемоаттрактанта нейтрофилов 1 (CINC-1, от англ. Cytokine Induced Neutrophil Chemoattractant-1) в кишечнике (Фиг.А), печени (Фиг.В), плазме (Фиг.С) и легких (Фиг.D), изучаемое с помощью твердофазного иммуноферментного анализа (ELISA).
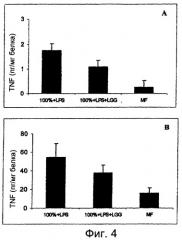
На Фигуре 4 показано влияние LGG на продукцию TNF-α в плазме (Фиг.А) и легких (Фиг.В), изученное с помощью ELISA.
На Фигуре 5 показано влияние LGG на активность МРО в терминальном отделе тонкой кишки (Фиг.А) и легких (Фиг.В).
На Фигуре 6 показано влияние LGG на избыток цитокинов. На Фигуре А показаны уровни цитокинов в легких, на Фигуре В показаны уровни цитокинов в печени, а на Фигуре С показаны уровни цитокинов в плазме.
Описание предпочтительных вариантов осуществления настоящего изобретения
Далее представлено подробное описание наиболее предпочтительных вариантов осуществления настоящего изобретения, которые проиллюстрированы одним или несколькими примерами. Каждый из указанных примеров представлен с целью объяснения вариантов осуществления настоящего изобретения и ни в коем случае не ограничивает его сущность. В действительности, любому специалисту в данной области очевидно, что могут быть внесены различные изменения и модификации заявленного изобретения в пределах представленной ниже формулы изобретения. В частности, свойства и особенности одного варианта осуществления настоящего изобретения могут использоваться для описания или иллюстрации другого варианта осуществления настоящего изобретения.
Следовательно, подразумевается, что настоящее изобретение включает такие свои варианты и модификации, которые попадают под представленную ниже формулу изобретения. Другие объекты, характерные особенности и аспекты настоящего изобретения рассматриваются далее либо являются очевидными из представленного ниже детального описания. Любому специалисту в данной области очевидно, что настоящее обсуждение представляет собой лишь описание примерных вариантов осуществления настоящего изобретения без ограничения всей широты его сущности.
Аббревиатуры
В настоящем описании используются следующие аббревиатуры: LGG, Lactobacillus rhamnosus GG; LCPUFA, длинноцепочечная полиненасыщенная жирная кислота (от англ. Long-chain Polyunsaturated Fatty Acid); LPS, липополисахарид; IL, интерлейкин; TNF, фактор некроза опухолей; CINC-1, цитокин-индуцированный хемоаттрактант нейтрофилов-1; GRO/KC, ростозависимый онкоген; ELISA, твердофазный иммуноферментный анализ; RT-PCR, полимеразная цепная реакция с обратной транскрипцией; ANOVA, вариационный анализ; SD, стандартная девиация; PAF, фактор активации тромбоцитов; RMS, заменитель крысиного молока; МРО, миелопероксидаза; TLRs, Toll-подобный рецептор; ЕРА, эйкозапентаеновая кислота; DHA, докозагексаеновая кислота; ARA, арахидоновая кислота.
Определения
Термин "пробиотик" относится к микроорганизму, который оказывает благоприятный эффект на организм хозяина.
Термин "пребиотик" обозначает неперевариваемый пищевой ингредиент, который стимулирует рост и/или активность пробиотиков.
Используемый здесь термин "лечение" обозначает улучшение течения заболевания, патологического состояния или подавление симптома заболевания или патологического состояния.
Термин "уменьшение" обозначает ограничение продолжительности, количества или уровня.
Термин "профилактика" обозначает прекращение или предотвращение развития заболевания, патологического состояния или симптома заболевания или патологического состояния путем какого-либо действия.
Термин "системный", используемый здесь, относится к организму в целом.
Термин "терапевтически эффективное количество" относится к количеству, при введении которого отмечается улучшение течения заболевания или патологического состояния, или выздоровление от заболевания или патологического состояния, или подавление симптомов заболевания или патологического состояния.
Термин "недоношенный" относится к ребенку, рожденному до 37 недели беременности.
Термин "младенец" относится к ребенку, возраст которого меньше 1 года.
Используемый здесь термин "детское питание" (молочная смесь) относится к композиции, которая полностью удовлетворяет питательные потребности ребенка и представляет собой заменитель женского молока. В США состав молочных смесей регламентируется постановлениями Федерального агентства 21 C.F.R., разделы 100, 106 и 107. Указанные постановления регулируют макронутриентный, витаминный, минеральный состав молочной смеси, а также уровни других компонентов для того, чтобы наилучшим образом воспроизвести свойства женского грудного молока.
В соответствии с настоящим изобретением представляется новый способ использования LGG в комбинации, по крайней мере, с одной длинноцепочечной полиненасыщенной жирной кислотой для создания лекарственного средства для лечения или профилактики системной воспалительной реакции у детей на искусственном вскармливании.
LGG представляет собой пробиотический бактериальный штамм, выделенный из кишечной микрофлоры здорового человека. Это раскрывается в патенте США No. 5,032,399, Gorbach et al., который включен в настоящее изобретение в качестве ссылки. LGG являются устойчивыми к большинству антибиотиков, стабильными в присутствии кислот и желчи и активно прикрепляются к клеткам слизистой оболочки кишечника человека. Они остаются жизнеспособными в течение 1-3 дней у большинства людей и в течение 7 дней у 30% субъектов. Помимо способности к колонизации, LGG также благоприятно влияет на иммунологическую реактивность слизистой. LGG доступны в Американской коллекции типовых культур под номером АТСС 53103.
Согласно способу, заявленному в соответствии с настоящим изобретением, терапевтически эффективное количество LGG для младенца находится в пределах от 1×104 до 1×1012 КОЕ/л/кг/день. Согласно другому варианту осуществления настоящего изобретения заявленный способ включает введение младенцу LGG в количестве приблизительно 1×106 и 1×109 КОЕ/л/кг/день. Согласно еще одному варианту осуществления настоящего изобретения заявленный способ включает введение младенцу LGG в количестве приблизительно 1×108 КОЕ/л/кг/день.
К подходящим LCPUFAs, которые могут использоваться в соответствии с настоящим изобретением, относятся (без ограничений указанными): γ-линолевая кислота, линолевая кислота, линоленовая кислота, эйкозопентаеновая кислота (ЕРА), ARA и DHA. В соответствии с настоящим изобретением эффективное количество LCPUFA варьирует приблизительно от 3 мг на кг массы тела в день до 150 мг на кг массы тела в день. Согласно другому варианту осуществления настоящего изобретения указанное количество составляет приблизительно от 6 мг на кг массы тела до 100 мг на кг массы тела пациента в день. Согласно еще одному варианту осуществления настоящего изобретения указанное количество составляет приблизительно от 10 мг на кг массы тела в день до 60 мг на кг массы тела в день.
В том случае, если вводится терапевтическое количество LGG в комбинации, по крайней мере, с одной LCPUFA, то согласно способу, заявленному в соответствии с настоящим изобретением, путь их введения не является решающим. Чаще всего LGG и LCPUFA включают в состав молочной смеси, которой потом кормят младенца.
Согласно одному варианту осуществления настоящего изобретения молочная смесь, используемая в соответствии с настоящим изобретением, является сбалансированной по питательным веществам и содержит подходящие типы жиров, углеводов, белков, витаминов и минералов в нужных количествах. Количество липидов или жиров может варьировать от 3 до 7 г/100 ккал. Количество белков обычно варьирует от 1 до 5 г/100 ккал. Количество углеводов обычно варьирует от 8 до 12 г/100 ккал. Источниками протеинов могут быть любые известные источники, например обезжиренное молоко, молочная сыворотка, казеин, соевый белок, гидролизированный белок, аминокислоты и т.п. Источниками углеводов могут быть любые известные источники, например лактоза, глюкоза, кукурузный сироп, мальтодекстрины, сахароза, крахмал, рисовый сироп и т.п. Источниками липидов могут быть любые известные источники, включая овощные масла, такие как пальмовое масло, соевое масло, пальмоелин, кокосовое масло, масло триглицеридов средних цепей, высокоолеиновое подсолнечное масло, высокоолеиновое сафлоровое масло и т.п.
Обычно используются коммерчески доступные детские молочные смеси. Например, Enfamil®, Enfamil® Premature Foremula, Enfamil® с железом, Lactofree®, Nutramigen®, Pregestimil® и ProSobee® (производимые компанией Mead Johnson & Company, Evansville, IN, USA) могут быть обогащены LGG в подходящем количестве для реализации способа, заявленного в соответствии с настоящим изобретением.
Согласно одному варианту осуществления настоящего изобретения для лечения или профилактики системной воспалительной реакции у детей на искусственном вскармливании LGG и LCPUFA могут вводиться в комбинации с одним или более подходящим пробиотиком. Любой из известных пробиотиков может использоваться в соответствии с данным вариантом осуществления настоящего изобретения. Согласно определенному варианту осуществления настоящего изобретения пробиотик выбран из группы, включающей Lactobacillus и Bifidobacterium.
Согласно другому варианту осуществления настоящего изобретения для лечения или профилактики системной воспалительной реакции у детей на искусственном вскармливании LGG и LCPUFA могут вводиться в комбинации с одним или более пребиотиком. Любой из известных пробиотиков может использоваться в соответствии с данным вариантом осуществления настоящего изобретения. К пребиотикам, заявленным в соответствии с настоящим изобретением, относятся, например, лактулоза, галакто-олигосахарид, фрукто-олигосахарид, сизомалато-олигосахарид, олигосахариды соевых бобов, лактосукроза, ксило-олигосахарид и гентио-олигосахариды.
Согласно одному варианту осуществления настоящего изобретения LGG вводится в комбинации с DHA. Согласно другому варианту осуществления настоящего изобретения LGG вводится в комбинации с ARA. Согласно еще одному варианту осуществления настоящего изобретения LGG вводится в комбинации с DHA и ARA. Коммерчески доступные молочные смеси, которые содержат DHA, ARA или их комбинацию, могут быть обогащены LGG и использоваться в соответствии с настоящим изобретением. Например, Enfamil®, LIPIL®, которые содержат эффективное количество DHA и ARA, являются коммерчески доступными, могут быть обогащены LGG и использоваться в соответствии с настоящими изобретением.
Согласно одному варианту осуществления настоящего изобретения как DHA, так и ARA используют в комбинации с LGG для лечения системного воспаления у детей. Согласно данному варианту осуществления настоящего изобретения весовое соотношение ARA:DHA составляет обычно от 1:3 до 9:1. Согласно одному варианту осуществления настоящего изобретения указанное соотношение варьирует от 1:2 до приблизительно 4:1. Согласно другому варианту осуществления настоящего изобретения указанное соотношение варьирует от 2:3 до 2:1. Согласно определенному варианту осуществления настоящего изобретения данное соотношение составляет 2:1.
Эффективное количество DHA согласно одному варианту осуществления настоящего изобретения варьирует обычно от 3 мг на кг массы тела в день до 150 мг на 1 кг массы тела в день. Согласно другому варианту осуществления настоящего изобретения указанное количество находится в пределах от 6 мг на 1 кг массы тела в день до 100 мг на 1 кг массы тела в день. Согласно другому варианту осуществления настоящего изобретения указанное количество варьирует от 10 мг на 1 кг массы тела в день до приблизительно 60 мг на 1 кг массы тела в день. Согласно еще одному варианту осуществления настоящего изобретения указанное количество составляет от 15 мг на 1 кг массы тела до 30 мг на 1 кг массы тела в день.
Эффективное количество ARA согласно одному из вариантов осуществления настоящего изобретения составляет обычно от 5 мг на 1 кг массы тела в день до 150 мг на 1 кг массы тела в день. Согласно одному варианту осуществления данного изобретения данное количество варьирует от 10 мг на 1 кг массы тела в день до 120 мг на 1 кг массы тела в день. Согласно другому варианту осуществления настоящего изобретения указанное количество находится в пределах от 15 мг на 1 кг массы тела в день до 90 мг на 1 кг массы тела в день. Согласно еще одному варианту осуществления настоящего изобретения данное количество составляет от 20 мг на 1 кг массы тела в день до 60 мг на 1 кг массы тела в день.
Количество DHA в молочных смесях, используемых в соответствии с настоящим изобретением, обычно варьирует от 5 мг/100 ккал до 80 мг/100 ккал. Согласно одному варианту осуществления настоящего изобретения оно составляет от 10 мг/100 ккал до приблизительно 50 мг/100 ккал; согласно еще одному варианту осуществления настоящего изобретения оно варьирует от 15 мг/100 ккал до 20 мг/100 ккал. Согласно определенному варианту осуществления настоящего изобретения количество DHA составляет приблизительно 17 мг/100 ккал.
Количество ARA в молочных смесях, используемых в соответствии с настоящим изобретением, обычно варьирует от 10 мг/100 ккал до приблизительно 100 мг/100 ккал. Согласно одному варианту осуществления настоящего изобретения количество ARA варьирует от 15 мг/100 ккал до приблизительно 70 мг/100 ккал. Согласно другому варианту осуществления настоящего изобретения количество ARA составляет от 20 мг/100 ккал до приблизительно 40 мг/100 ккал. Согласно определенному варианту осуществления настоящего изобретения количество ARA составляет приблизительно 34 мг/100 ккал.
Молочная смесь, обогащенная маслами, содержащими DHA и ARA, используемая в соответствии с настоящим изобретением, может быть получена с помощью стандартных технологий, хорошо известных специалистам в данной области. Например, указанные соединения могут быть добавлены в формулу путем замещения эквивалентного количества масла, такого как подсолнечное масло с высоким содержанием олеиновых кислот, обычно присутствующее в такой смеси. Или же, например, масла, содержащие DHA и ARA, могут быть добавлены в формулу путем замещения эквивалентного количества всех оставшихся жиров, которые обычно присутствуют в смесях, не включающих DHA и ARA.
Источниками DHA и ARA могут быть любые известные источники. Согласно одному варианту осуществления настоящего изобретения источниками DHA и ARA являются одноцепочечные масла, как описано в патентах США номер 5,374,567 и 5,550,156, которые включены в настоящее изобретение в качестве ссылок. Однако настоящее изобретение не ограничивается только указанными маслами. DHA и ARA могут быть природными или синтетическими.
Согласно одному варианту осуществления настоящего изобретения источник почти полностью очищен от ЕРА. Например, согласно одному варианту осуществления настоящего изобретения молочная смесь содержит менее 16 мг ЕРА/100 ккал; согласно другому варианту осуществления настоящего изобретения - менее 10 мг ЕРА/100 ккал; согласно еще одному варианту осуществления настоящего изобретения - менее 5 мг ЕРА/100 ккал. Согласно одному особенному варианту осуществления настоящего изобретения молочная смесь не содержит ЕРА. Согласно другому варианту осуществления настоящего изобретения молочная смесь не содержит ЕРА, даже в следовых количествах.
Считается, что применение LGG в комбинации с DHA и/или ARA усиливает провоспалительный эффект композиций, содержащих указанные агенты. Считается, что пробиотики оказывают свое антивоспалительное действие за счет взаимодействия со специфическими рецепторами, известными как Toll-подобные рецепторы (TLRs), которые располагаются на поверхности специфических иммунных клеток, однако это всего лишь одна из множества теорий. Прямое или опосредованное взаимодействие между LGG и указанными рецепторами инициирует внутриклеточный каскад передачи сигнала, что приводит к изменению экспрессии генов в клетках-мишенях. Считается, что именно указанное специфическое взаимодействие, приводящее к изменению экспрессии генов и других клеточных эффектов, принимает участие в модуляции воспаления.
В противоположность этому, считается, что ω-3 жирные кислоты, такие как DHA, оказывают противовоспалительное действие за счет изменения продукции провоспалительных медиаторов, производных жирных кислот, широко известных как эйкозаноиды. Во время воспалительного ответа происходит выброс ω-6 жирных кислот, таких как ARA, которые располагаются в фосфолипидном участке клеточных мембран, что приводит к образованию пула свободных ARA. Затем указанный пул ARA расщепляется двумя классами ферментов, известных как липоксигеназы и циклооксигеназы, что приводит к образованию специфического спект