Способ лечения helicobacter pylori ассоциированной хронической язвенной болезни желудка и двенадцатиперстной кишки
Иллюстрации
Показать всеИзобретение относится к медицине и предназначено для лечения Helicobacter pylori (HP) ассоциированной хронической язвенной болезни желудка и двенадцатиперстной кишки. Проводят медикаментозную терапию, включающую пероральное введение субцитрата висмута, омепразола, амоксицилина и фуразолидона, иммуномодулятора микробного происхождения и комплекс бифидо- и лактобактерий. В качестве иммуномодулятора микробного происхождения вводят рибомунил. Доза 750 мг. В первый месяц 1 раз в сутки утром натощак в первые 4 дня каждой недели. В последующие 2 месяца - первые 4 дня каждого месяца. Комплекс бифидо- и лактобактерий (LB-комплекс) по 5 мл, в течение 25 дней с первого дня приема антибактериальных препаратов. Прием за 30 минут до приема пищи. Содержание микробных тел в 1 мл коплекса 1010-1012. Способ позволяет скорректировать вторичный иммунодефицит и уменьшить сроки лечения. 2 з.п. ф-лы, 2 ил.
Реферат
Изобретение относится к медицине, а именно к гастроэнтерологии, и может быть использовано для лечения инфекции Helicobacter pylori (HP) ассоциированной хронической язвенной болезни желудка и двенадцатиперстной кишки.
В последние годы установлена ведущая роль бактерии Helicobacter pylori в этиологии и патогенезе язвенной болезни. При успешной антихеликобактерной терапии язвы рубцуются быстрее и качественнее, чем при традиционном противоязвенном лечении [1, 3, 4]. При этом антихеликобактерная терапия одинаково эффективна при поражении двенадцатиперстной кишки и желудка [1, 3, 4, 5]. Правила эрадикации определены сегодня международным согласительным документом - консенсусом «Маастрихт-3», 2005 [15]. Лечение язвенной болезни, вызываемой Helicobacter pylori, проводится по разработанным стандартам терапии, базисом которых являются схемы эрадикации, состоящие из трех или четырех препаратов [15]. Однако при проведении эрадикационной терапии выявились серьезные проблемы. Появились и стали широко распространены штаммы Helicobacter pylori, резистентные к антибактериальным препаратам [3, 4, 5, 10, 11], которые труднее поддаются эрадикации и снижают эффективность современных способов лечения [2, 3, 5, 6, 12, 13]. Особое место среди факторов риска хронизации заболеваний органов пищеварения отводится подавлению иммунной защиты организма, на фоне которого происходит снижение устойчивости организма к экзо- и эндогенным факторам [10, 11]. Проблема изучения эффективности применения иммуномодуляторов в комплексной терапии заболеваний, ассоциированных с инвазией HP, является актуальной [4, 6, 10, 11].
В связи с вышесказанным актуальными являются исследования, направленные на поиск новых путей эрадикации HP с применением иммуномодуляторов и пробиотиков, которые усиливают репаративные процессы слизистой желудочно-кишечного тракта, повышают показатели специфической и неспецифической иммунной защиты и способствуют восстановлению микробиоценоза у больных хронической хеликобактер-ассоциированной язвенной болезнью желудка и двенадцатиперстной кишки.
Для решения проблемы эрадикации HP известны различные способы, направленные на повышение эффективности лечения данного заболевания.
Так известен способ лечения язвенной болезни желудка и двенадцатиперстной кишки, в котором сочетается общепринятая схема эрадикации с приемом внутрь дополнительно минералосодержащего препарата «Трепелом» в виде водной суспензии, содержащей 4-6 г трепела в 150-200 мл воды [7].
Данный способ позволяет снизить активность соляной кислоты и пепсина, как следствие повысить защитные свойства бикарбонатно-слизистого барьера желудка. Однако при этом не предполагается коррекция вторичного иммунодефицита и дисбиоза пациентов.
Известен также способ лечения хронического гастрита, язвенной болезни желудка и двенадцатиперстной кишки, предполагающий орошение зоны поражения 3 мл 0,5%-ного раствора новокаина в смеси с 2 мл 2%-ного раствора лидокаина с последующим введением через катетер 6-10 мл 1%-ного раствора хитозана на 0,2%-ном растворе водной соляной кислоты 2-4 раза через 3-5 дней. При этом в промежутках между трансэндоскопическим лечением на протяжении двух недель перорально назначают по 1 таблетке хитозана 4 раза в день через 30 мин после еды и на ночь [8].
Данный способ является инвазивным, и всасывание местного анестетика через поврежденную слизистую оболочку повышает риск побочных эффектов.
Известно пероральное введение лекарственных средств, применяемых для эрадикации инфекции Helicobacter pylori в порошкообразной форме, смешанных с апельсиновым соком [9]. В данном случае также не происходит коррекции дисбиоза и вторичного иммунодефицита в системе местного и общего иммунитета.
В качестве прототипа авторами выбран известный способ лечения HP ассоциированной хронической дуоденальной язвы путем медикаментозной терапии, включающей: коллоидный субцитрат висмута - в дозе 240 мг 2 раза в день за 30 минут до приема пищи (завтрака и ужина) в течение 10 дней, омепразол - в дозе 20 мг 2 раза в день до приема пищи (завтрака и обеда) в течение 10 дней, амоксициллин - по 1000 мг 2 раза в день после приема пищи (в 8.00 и 19.00 часов соответственно) в течение 7 дней, фуразолидон - в дозе 200 мг 2 раза в день после приема пищи (завтрака и ужина) в течение 7 дней [10].
Назначение коллоидного субцитрат висмута, обладающего гастропротективным и антибактериальным действием в дозе 240 мг 2 раза в день за 30 минут до приема пищи (завтрака и ужина) в течение 10 дней, омепразола - антисекреторного препарата - в дозе 20 мг 2 раза в день до еды в течение 10 дней, амоксициллина - антибиотика широкого спектра действия, устойчивого к пенициллиназе - по 1000 мг 2 раза в день после завтрака и ужина (в 8.00 и 19.00 соответственно) в течение 7 дней, фуразолидона - антибактериального препарата - в дозе 200 мг 2 раза в день после приема пищи (завтрака и ужина) в течение 7 дней, позволяет добиться эрадикации HP у больных в 85% случаев при минимальной резистентности HP за счет совместного приема данных препаратов.
Однако лечение известным способом не позволяет устранить вторичный иммунодефицит в системе клеточного и гуморального иммунитета и нарушение микробиоценоза желудочно-кишечного тракта, способствующих формированию резистентности и рецидивам заболевания.
Задачей предлагаемого изобретения является разработка эффективного способа лечения инфекции Helicobacter pylori ассоциированной хронической язвенной болезни желудка и двенадцатиперстной кишки, который при этом позволяет скорригировать вторичный иммунодефицит в системе клеточного и гуморального иммунитета и нарушения микробиоценоза желудочно-кишечного тракта, способствующий формированию резистентности к рецидивам заболевания.
Поставленная задача решается предлагаемым способом лечения Helicobacter pylori ассоциированной хронической язвенной болезни желудка и двенадцатиперстной кишки путем медикаментозной терапии, включающей пероральное введение субцитрата висмута, омепразола, амоксицилина и фуразолидона, согласно изобретению в медикаментозную терапию дополнительно включают введение иммуномодулятора микробного происхождения и комплекс бифидо- и лактобактерий.
Предпочтительно, что в качестве иммуномодулятора микробного происхождения вводят рибомунил, при этом прием его в первый месяц лечения осуществляют в дозе 750 мг 1 раз в сутки утром натощак в первые 4 дня каждой недели, а в последующие 2 месяца - первые 4 дня каждого месяца.
Предпочтительно, что комплекс бифидо- и лактобактерий (LB-комплекс) принимают по 5 мл при содержании в 1 мл коплекса 1010-1012 микробных тел за 30 минут до приема пищи (в обед) в течение 25 дней с первого дня приема антибактериальных препаратов.
Новым техническим результатом предлагаемого способа является повышение его эффективности лечения за счет отсутствия побочных эффектов, таких как вторичный иммунодефицит в системе клеточного и гуморального иммунитета и микробиоценоза желудочно-кишечного тракта, способствующих формированию резистентности к рецидивам заболевания.
Достигаемый данный технический результат за счет совместного введения субцитрата висмута, омепразола, амоксицилина, фуразолидона, рибомунила LB-комплекса превосходит суммарный технический результат и обусловлен эффектом синергизма, который возникает вследствие повышения напряженности гуморального и клеточного иммунитета, а также местных неспецифических механизмов защиты слизистой желудка, вследствие чего усиливается элиминация HP и процессы регенерации.
Рибомунил - 1 таблетка содержит: бактериальные рибосомные фракции, титрованные до 70% РНК - 750 мг (включая рибосомы Klebsiella pneumoniae, Streptococcus pneumoniae. Streptococcus pyogenes и Haemophilus influenzae), протеогликаны мембранной части (Klebsiella pneumoniae). Рибомунил - иммуномодулятор специфического и неспецифического иммунитета, эффективность рибомунила определяется сочетанием свойств пероральной вакцины и неспецифического иммунокорректора. Иммуномодуляция обусловлена эффектами входящих в состав рибомунила компонентов. Благодаря наличию в составе рибомунила рибосом, которые несут на себе антигены, идентичные поверхностным антигенам бактерий, в организме развивается специфический иммунный ответ, в сыворотке появляются антитела, специфичные к вышеперечисленным возбудителям (эффект вакцины). Очищенные рибосомы способны также проникать в специфические В-клетки памяти и создавать иммунологическую память. Рибомунил вырабатывает длительную иммунную память к возбудителям, не требует исходного определения иммунного статуса. Применение рибомунила в комплексной терапии позволяет повысить эффективность и сократить продолжительность лечения, значительно уменьшить необходимость применения антибиотиков, ускорить выздоровление и увеличить период ремиссии.
Комплекс живых штаммов LB-КОМПЛЕКС представляет собой: L.plantarum 8-RA3, L. fermentum №39, (штаммов B. bifidum №791). В 1 мл препарата содержится 1010-1012 микробных тел, выращенных на питательной среде, основой которой является обрат молока. Выпускается во флаконах по 5 мл.
Осуществление предлагаемого способа
Больной получает субцитрат висмута в коллоидном виде в дозе 240 мг 2 раза в день за 30 минут до приема пищи (завтрака и ужина) в течение 10 дней, омепразол - в дозе 20 мг 2 раза в день до приема пищи в течение 10 дней, амоксициллин - по 1000 мг 2 раза в день после приема пищи (в 8.00 и 19.00 час соответственно) в течение 7 дней, фуразолидон - в дозе 200 мг 2 раза в день после приема пищи (завтрака и ужина) в течение 7 дней, иммуномодулятор микробного происхождения - рибомунил в дозе 750 мг 1 раз в сутки утром натощак в первые 4 дня каждой недели в течение первого месяца лечения, а в последующие 2 месяца - первые 4 дня каждого месяца и LB-комплекс по 5 мл при содержании в 1 мл комплекса 1010-1012 микробных тел за 30 минут до приема пищи (в обед) в течение 25 дней с первого дня приема антибактериальных препаратов.
Способ конкретного применения предлагаемого способа
В исследование вошли больные язвенной болезнью желудка и двенадцатиперстной кишки, ассоциированной с HP, с локализацией язвенного дефекта в луковице двенадцатиперстной кишки, в острой фазе рецидива, имеющие хронический хеликобактерный антральный гастрит (тип В). Сформированные группы были однородны по возрасту, полу, длительности заболевания и сопутствующей патологии желчного пузыря и поджелудочной железы. На испытание рибомунила и LB-комплекса в схеме антихеликобактерной терапии было получено согласие самих испытуемых и разрешение Этического комитета при учреждениях здравоохранения, в которых проводили исследования.
В зависимости от способа лечения больные были распределены следующим образом. Группа из 9-и человек была пролечена известным способом (по прототипу), больные получили следующее лечение: коллоидный субцитрат висмута в дозе 240 мг 2 раза в день за 30 минут до приема пищи (завтрака и ужина) в течение 10 дней, омепразол - в дозе 20 мг 2 раза в день до еды в течение 10 дней, амоксициллин - по 1000 мг 2 раза в день, после завтрака и ужина (в 8.00 и 19.00 соответственно) в течение 7 дней, фуразолидон - в дозе 200 мг 2 раза в день после приема пищи (завтрака и ужина) в течение 7 дней.
В то же время группа из 10-и человек была пролечена предлагаемым способом и получила следующее лечение: коллоидный субцитрат висмута в дозе 240 мг 2 раза в день за 30 минут до приема пищи (завтрака и ужина) в течение 10 дней, омепразол - в дозе 20 мг 2 раза в день до еды в течение 10 дней, амоксициллин - по 1000 мг 2 раза в день после завтрака и ужина (в 8.00 и 19.00 соответственно) в течение 7 дней, фуразолидон - в дозе 200 мг 2 раза в день после приема пищи (завтрака и ужина) в течение 7 дней и иммуномодулятор - рибомунил в дозе 750 мг 1 раз в сутки утром натощак, в первый месяц лечения в первые 4 дня каждой недели, последующие 2 месяца первые 4 дня каждого месяца и LB-комплекс по 5 мл при содержании в 1 мл комплекса 1010-1012 микробных тел за 30 минут до приема пищи (в обед) в течение 25 дней с первого дня приема антибактериальных препаратов.
Для оценки результатов лечения было проведено обследование больных из обеих групп.
1. Определение исходных показателей до лечения - эндоскопический метод (фибро-гастродуоденоскопия) использовался для выявления изменений на слизистой оболочке желудка, характерных для язвенной болезни (НР-ассоциированный хронический гастрит), а также с целью взятия прицельной биопсии слизистой оболочки антрального и фундального отделов для проведения морфологических исследований.
Морфологический метод применялся с целью определения HP. Биоптаты фундального (2), антрального (2) отделов, угла (1) желудка фиксировались в 10% формалине, проводились по спиртам восходящей крепости, заливались в парафин. Приготовленные на санном микротоме серийные срезы толщиной 5-7 и и окрашенные с применением обзорных окрасок, просматривались в световом микроскопе "Биолам" с увеличением объектива 40×, 90×, окуляр 15. Серии срезов окрашивались гематоксилином и эозином, альциановым-синим и реактивом Шиффа. HP выявлялись в мазках-отпечатках слизистой оболочки желудка, окрашенных по Романовскому. При анализе структурных изменений учитывались активность, тяжесть процесса и характер структурных изменений слизистой оболочки желудка согласно Хьюстонской модификации Сиднейской системы классификации гастритов. Для этого использовалась визуально-аналоговая шкала морфологических изменений слизистой оболочки желудка при хроническом гастрите (по М.Dixon et al., 1996).
На этапе первичной диагностики хеликобактериоза (в момент поступления больных с обострением язвенной болезни) использовался экпресс-тест "FastRead H.pylori" (производитель CQI medical Products Inc., Канада). Экспресс-тест HP является скринингующим иммунохроматографическим тестом для обнаружения антител против HP в сыворотке, плазме и цельной крови. Метод включает уникальную комбинацию конъюгированного белка, специфически связывающего антитела и антигены, сорбированные на твердой фазе. При прохождении тестируемого образца через мембрану антителофиксирующий белок конъюгата связывается с антителами против HP образца. Сформированный таким образом комплекс фиксируется антигенами твердой фазы в зоне "ТЕСТ" на пластинке, образуя красную полоску. Соответственно при отсутствии специфических антител в тестируемом образце в "ТЕСТ"-зоне платины не обнаруживается полосы. При дальнейшей миграции образца через мембрану в зону "КОНТРОЛЬ" проявляется розовая полоса, подтверждающая качество реагента.
Нефелометрический метод применялся для определения активности лизоцима - по изменению степени светопропускания микробной взвеси тест-культуры Micrococcus lysodeicticus под влиянием лизоцима исследуемой жидкости по сравнению с показателем исходной микробной взвеси. Из суточной микробной культуры M. lysodeicticus готовили взвесь в фосфатном буфере. Взвесь стандартизировали на ФЭКе при зеленом светофильтре (длина [волны 540 нм) в кюветах с длиной оптического пути 3 мм. Для определения активности лизоцима наливали в пробирку микробную взвесь, а также разведенные фосфатным буфером желудочный сок или слюну. Один час инкубировали в термостате при 37°С. После чего измеряли на ФЭК длину волны, из показаний вычитали стандарт (% светопропускания исходной взвеси). В норме активность лизоцима слюны соответствует 40%, а желудочного сока - 70%.
Молекулярно-биологический метод полимеразной цепной реакции (ПЦР) применялся с целью выявления в клиническом материале (желудочном соке) специфических фрагментов геномной ДНК хеликобактера. Для выделения ДНК из желудочного сока с помощью центрифугирования готовили супернатант. После двухкратной отмывки супернатант высушивали и повторно ресуспендировали. После этого супернатант содержал очищенную ДНК. Пробирки с готовыми реактивами помещали в гнезда нагревательного прибора ДНК амплификатора и выставляли необходимую программу. Поскольку продукт ПЦР представляет собой фрагмент ДНК, имеющий определенный размер, одним из доступных способов его обнаружения является элекрофоретическое разделение реакционной смеси в аэрозольном геле. Гель фотографируется на пленку Микрат-300 (Фото-250, Фото-125) через красный светофильтр. Положительные образцы должны содержать полосу, располагающуюся на одном уровне с полосой положительного контроля. Отрицательные образцы не должны содержать полос, за исключением тех, которые формируются праймерами и располагаются ниже специфического фрагмента.
Оценка иммунологического статуса включала определение общего количества Т- и В-лимфоцитов, субпопуляций Т-лимфоцитов, уровня иммуноглобулинов А, М, G. Определение показателей клеточного иммунитета (CD3, CD4, CD8, CD3/CD4, CD3/CD8%, CD19, CD3-CD16+CD56, CD3+CD16+CD56,) субпопуляций лимфоцитов с помощью набора моноклониальных антител производства на люминесцентном микроскопе «Leitz», Germany.
Количественное определение показателей гуморального иммунитета (иммуноглобулинов A, M, G) проводилось методом радиальной иммунодиффузии по Манчини с использованием моноспецифических сывороток против IgA, IgM, IgG. Принцип основан на измерении кольца преципитации, образующегося при внесении исследуемой сыворотки в лунки агара, в котором предварительно диспергирована моноспецифическая антисыворотка. Диаметр кольца препицитации прямо пропорционален концентрации исследуемого иммуноглобулина.
Определение функциональной активности гранулоцитов периферической крови - метод спонтанной и индуцированной хемилюминесценции, по ингенсивности хемилюминесцентного ответа в ответ на стимул на аппарате «Dynatech» Germany (лейкоциты выделяют из венозной крови по методике Когана А.Х. результаты в отн. люм. ед. Исследование видового состава микрофлоры толстого кишечника. С целью установления абсолютного и относительного (%) числа [перечисленных микроорганизмов в 1 грамме фекалий человека производился мерный высев материала на элективные и дифференциально-диагностические среды. Подсчет числа живых микробных клеток производился для каждого вида бактерий отдельно по формуле: число живых микробных клеток в 1 г=PR×100/V, где Р - число колоний; R - разведение, из которого выделялся данный вид; 100 - коэффициент при высеве 0,05 мл и 50 при высеве материала в количестве 0,1 мл; V - вес фекалий. Число живых микробных клеток лактобактерий, молочно-кислого стрептококка и стрептобактерий, бифидобактерий, выделенных из жидких сред определялось наибольшим разведением материала. Для микробиологического анализа использовались наиболее оптимальные среды для выделения анаэробов: молочнокислых бактерий - С, бифидобактерий - селективная среда Блаурокка или ГМС (гидролизатно-молочная). На дальнейшем этапе идентификация вида выделенного микроба осуществлялась с помощью разработанных в лаборатории экспресс-методов «биохимического типирования.
2. Контрольное обследование через 6 недель после окончания лечения больных обеих групп, пролеченных предлагаемым способом и известным (по прототипу), включало: эндоскопический метод, морфологический метод с определением HP, молекулярно-биологический метод с определением специфических фрагментов ДНК HP, иммунологический метод, нефелометрический метод с определением лиюцима в слюне и тощаковой порции желудочного сока, бактериологический метод.
На основании полученных результатов в обеих группах больных через 6 недель лечения были сделаны следующие выводы:
- эрадикация наблюдалась выше в группе больных, пролеченных предлагаемым способом;
- количество больных с неактивным гастритом оказалось больше в группе больных, пролеченных предлагаемым способом, в то время как в группе больных, пролеченных известным способом, в меньшей степени имел место переход гастрита в неактивную форму, а у части больных активность гастрита сохранялась и определялись кокковые формы HP.
Указанные изменения наблюдались параллельно с изменениями показателей клеточного и гуморального иммунитета и коррекцией микробного пейзажа кишечника.
Пример конкретного применения предлагаемого способа
Выписка из истории болезни. Больной Гаврилов А.С. 39 лет № статистической карты стационара 891.
Больной Гаврилов А.С., находился в стационаре с 23.07.2009 по 08.09.2009, поступил с диагнозом: Язвенная болезнь с локализацией язвы в луковице двенадцатиперстной кишки, диагноз поставлен при проведении ФГДС в амбулаторных условиях (обследован 21.07.2009). При поступлении жалобы на боли в левом подреберье, эпигастрии, отрыжка воздухом, вздутие живота, урчание, неустойчивый стул, пальпаторная болезненность в эпигастрии. При обследовании: в мазке-отпечатке цитологически была выявлена HP (анализ от 26.07.09), цитологический диагноз был подтвержден полимеразной цепной реакцией (ПЦР) пробы желудочного сока, взятой при повторной ФГДС (анализ от 27.07.2009), одновременно были взяты биоптаты слизистой оболочки желудка на морфологическое исследование, морфологически был выявлен: активный хеликобактер-ассоциированный гастрит в стадии обострения (заключение по образцу биоптата от 27.07.2009) - геморрагии, в наложении слизи, на апикальной поверхности покровного эпителия обнаруживается Helicobacter pylori. Морфологическое заключение: Активный диффузный антрум-гастрит, ассоциированный с HP.
Одновременно у больного был взят образец крови на иммунограмму (анализ от 27.07.2009), при обследовании выявлен вторичный иммунодефицит в системах клеточного (CD3: 24% CD4: 1,9%; CD8: 18,6% CD3/CD4 - 40%, CD3/CD8 - 18%, ИРИ - 0,7%, CD19 - 14%, CD3-CD16+CD56 - 13%, CD3+CD16+CD56 - 1,44%), и гуморального иммунитета [IgA: 0,5 г/л; IgM: 0,2 г/л; IgG: 0,7 г/л), одновременно были проведены анализы лизоцима слюны и желудочного сока (от 27.07.2009), показавшие снижение секреторной активности лизоцима слюны - 23,6%, (норма 40%), желудочного сока 35% (норма 70%).
Больной получал следующие лечение: коллоидный субцитрат висмута - в дозе 240 мг 2 раза в день за 30 минут до завтрака и ужина в течение 10 дней омепразол - в дозе 20 мг 2 раза в день до еды в течение 10 дней, амоксициллин - по 1000 мг 2 раза в день после завтрака и ужина (8.00 и 19.00 час) в течение 7 дней, фуразолидон - в дозе 200 мг 2 раза в день после завтрака и ужина в течение 7 дней, рибомунил - 750 мг 1 раз в сутки утром натощак в первый месяц лечения в первые 4 дня каждой недели, а последующие 2 месяца: первые 4 дня каждого месяца и LB-комплекс по 5 мл за 30 минут до приема пищи (до обеда) в течение 25 дней с первого дня приема антибактериальных препаратов.
Под действием проводимой терапии боли в левом подреберье, зпигастрии, отрыжка воздухом купировались на 3-й день, вздутие живота, урчание на 2-й день, неустойчивый стул отмечался до 9 дня лечения, пальпаторная болезненность в эпигастрии до 4-го дня.
При контрольном вызове через 6 недель больной субъективных жалоб не предъявлял. При эндоскопии гастродуоденальной зоны через 6 недель после окончания терапии отмечалось рубцевание язвы.
При повторном взятии биоптата морфологически: уменьшение лимфо-лейкоцитарной инфильтрации со снижением выраженности сосудистых реакций, отека и гемореологических изменений, кишечной метаплазии как в покровном эпителии, так и в клетках желез. О восстановлении слизеобразующих свойств эпителия свидетельствовали положительные гистохимические тесты, что характеризовало восстановление слизеобразующей функции покровно-ямочного эпителия, отсутствие Helicobacter pylori (данные подтверждались ПЦР от 26.11.2009).
Заключение: поверхностный гастрит
При контрольном анализе крови улучшение показателей клеточного (CD3 - 59%); CD4: до 1,5%); CD8 - 3,3%, CD3/CD4 - 40%, CD3/CD8 - 18%, ИРИ - 2,22%, CD19 - 17%, CD3-CD16+CD56 - 18%, CD3+GD16+CD56 - 4%,) и гуморального иммунитета (IgA: до 2,47 г/л; IgM: до 0,4 г/л; IgG: до 13 г/л). (26.11.09) 26.11.09. Проводимая терапия вызывала коррекцию дисбиотических явлений.
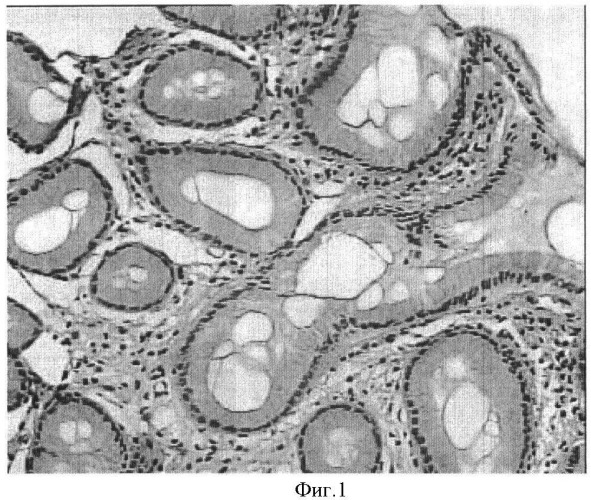
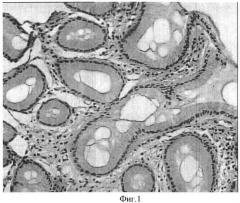
На фиг.1 представлен образец биоптата пациента Г, 39 лет после лечения. Участок слизистой оболочки антралъного отдела желудка с восстановлением структурно-функциональных показателей покровно-ямочного эпителия после лечения: улучшение показателей покровно-ямочного эпителия и эпителия желез. Ядра эпителиоцитов располаются базально, четко определяются границы клеток эпителия. Высота покровно-ямочных эпителиоцитов в пределах нормы, что характеризует восстановление слизеобразующей функции покровно-ямочного эпителия. (Окраска гематоксилином и эозином. Увел. ×7×20).
Пример применения известного способа (прототипа)
Прототип (использование квадросхемы без иммуномодулятора и пробиотика):
Больной Александров К.Е., 32 г. (контрольная группа), № статистической карты стационара 298.
Поступил в стационар 20.08.2009 с диагнозом: Язвенная болезнь с локализацией язвы в луковице двенадцатиперстной кишки, диагноз поставлен при проведении ФГДС в поликлиннике (обследован 17.08.2009). Динамический эпикриз: при поступлении жалобы на боли в области левого подреберья, эпигастрии, носящие постоянный характер и усиливающиеся в ночное время суток, отрыжку воздухом; вздутие живота, урчание, неустойчивый стул, при пальпации выраженная болезненность в эпигастрии. При обследовании: в мазке-отпечатке цитологически - HP, цитологический диагноз подтверждался (ПЦР) пробы желудочного сока, взятой при повторной ФГДС (анализ от 21.08.2009), одновременно были взяты биоптаты слизистой оболочки желудка на морфологическое исследование, морфологически - активный хеликобактер-ассоциированный гастрит в стадии обострения (заключение по образцу биоптата от 21.08.2009) - явления воспаления и изъязвления слизистой, обнаруживается Helicobacter pylori.
Заключение: Активный диффузный антрум-гастрит, ассоциированный с HP.
Одновременно у больного был взят образец крови на иммунограмму (анализ от 24.08.2009), выявлен вторичный иммунодефицит в системах клеточного (CD3: 19% CD4: 1,5%; CD8: 17,4% CD3/CD4 - 38%, CD3/CD8 - 16%, ИРИ - 0,8%, CD19 - 15%, CD3-CD16+CD56 - 14%, CD3+CD16+CD56 - 1,35%),H гуморального иммунитета [IgA: 0,43 г/л; IgM: 0,3 г/л; IgG: 0,6 г/л, одновременно были проведены анализы лизоцима слюны и желудочного сока (от 28.5.2001), показавшие снижение секреторной активности лизоцима слюны - 26%, (норма 40%), желудочного сока 37% (норма 70%).
С 25.08.2009 больной был пролечен известным способом (по прототипу). Медикаментозная терапия включала: коллоидный субцитрат висмута - в дозе 240 мг 2 раза в день за 30 минут до завтрака и ужина в течение 10 дней, омепразол - в дозе 20 мг 2 раза в день до еды в течение 10 дней, амоксициллин - по 1000 мг 2 раза в день после завтрака и ужина (8.00; 19.00) в течение 7 дней, фуразолидон - в дозе 200 мг 2 раза в день после завтрака и ужина в течение 7 дней.
Под действием проводимой терапии спонтанные боли в левом подреберье, эпигастрии, отрыжка воздухом купировались на 8 день, вздутие живота, урчание на 6 день, неустойчивый стул до 15 дня, пальпаторная болезненность в эпигастрии до 6 дня. При контрольном вызове через 6 недель больной предъявлял жалобы на отрыжку воздухом, неустойчивый стул, дискомфорт в области эпигастрия, усиливающийся в ночное время и переходящий в слабовыраженные боли. При эндоскопии гастродуоденальной зоны через 6 недель наблюдалось рубцевание язвы, снижение отека и восстановление поверхностного эпителия, анализ мазка-отпечатка - неполная эрадикация - кокковые формы HP, ПЦР-анализ - слабый сигнал на фрагменты ДНК HP, было выявлено усиление иммунодефицита клеточного (CD3: 22% CD4: 1,6%; CD8: 17,4% CD3/CD4 - 35%, CD3/CD8 - 18,6%, ИРИ - 0,6%, CD19 - 13,3%, CD3-CD16+CD56 - 12,8%, CD3+CD16+CD56 - 1,9%), и гуморального иммунитета (IgA: 0,8 г/л; IgM: 0,9 г/л; IgG: 0,5 г/л) под действием антибиотикотерапии, а также снижение активности лизоцима (слюны 39,8%, желудочного сока 46,3%) 24.10.09. Коррекции дисбиоза не происходило.
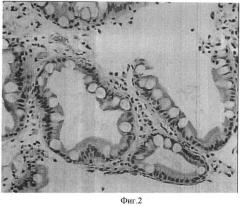
На фиг.2 представлена слизистая оболочка желудка пациента А, 32 года, через 6 недель после окончания терапии. Фокусы кишечной метаплазии, слабо выраженная инфильтрация плазматическими клетками и лимфоцитами (гемотоксилин-эозин, об ×20, ок.15).
Как видно из полученных результатов, предлагаемый способ является эффективным при лечении инфекции Helicobacter pylori ассоциированной хронической язвенной болезни желудка и двенадцатиперстной кишки, который при этом позволяет осуществлять коррекцию вторичного иммунодефицита в системе клеточного и гуморального иммунитета и нарушения микробиоценоза желудочно-кишечного тракта, способствует формированию резистентности к рецидивам заболевания, и как следствие этого, уменьшается срок лечения за счет исчезновения активности и тяжести воспалительного процесса в желудке и двенадцатиперстной кишке и более эффективного восстановления структурно-функциональных показателей слизистой оболочки гастродуоденальной зоны.
Источники информации
1. Аруин Л.И. Качество заживления гастродуоденальных язв: функциональная морфология, роль методов патогенетической терапии // Экспериментальная и клиническая гастроэнтерология. Репринт. 2006 - 50 с.
2. Маев И.В., Самсонов А.А. Современные стандарты лечения кислотозависимых заболеваний, ассоциированных с HP (материалы консенсусу Маастрихт-3) // Гастроэнтерология, Приложение к журналу Consilium medicum №1 2006 с.3-8 с.
3. Китаева Л.В., Михайлова И.А., Семов Д.М. и др. Мукоциты с микроядрами и обсемененность кокковыми формами Helicobacter pylori в слизистой оболочке желудка человека // Цитология. 2008. Т.50. №2. 160-164 с.
4. Корниенко Е.А., Паролова Н.И. Проблема антибиотикорезистентности Helicobacter pylori у детей и выбор терапии. Вопросы современной педиатрии. - 2006. - Том 5, - №5, с.1-4.
5. Логинов А.Ф. «Маастрихт-3» - современная тактика диагностики и лечения Helicobacter pylori. Фарматека 2006; 12 (127): 46-48.
6. Циммерман Я.С., Михалева Е.Н. Состояние иммунной системы у больных язвенной болезнью ДНК и влияние на нее современной фармакотерапии и иммуномодулирующих средств. Клин. мед. 2003: 1: 40-44.
7. Патент РФ №2192867, заявка №2000126729/14, от 24.10.2000, на «Способ лечения язвенной болезни желудка и двенадцатиперстной кишки»
8. Патент РФ №2150271, заявка №99121504/14, от 13.10.1999, на «Способ лечения хронического гастрита, язвенной болезни желудка и двенадцатиперстной кишки»
9. Патент РФ 2253449, заявка №2003133155/14, от 13.11.2003, на «Способ эрадикации Helicobacter pylori в желудке»
10. Яковлев М.Г. с соавт. "Оценка эффективности схемы эрадикации HP "Омепразол, денол, флемоксин, фуразолидон" у больных язвенной болезнью двенадцатиперстной кишки". Материалы III Международного симпозиума "Диагностика и лечение заболеваний, ассоциированных с HP №2, том 10, 2000, с.41.
11. Диагностика и биокоррекция нарушений антиинфекционного гомеостаза в системе «мать-дитя». Книга для практического врача / Под ред. Е.И.Ефимова, К.Я.Соколовой. - Н.Новгород: Изд-во НГМА, 2004. - 376 с.
12. Boyanova L., Gergova G., Nikolov R. et al. Prevalence and evolution of Helicobacter pylori resistance to 6 antibacterial agents over 12 years and correlation between susceptibility testing methods. Diagn. Microbiol. Infect. Dis. 2008; 4: 409-415.
13. Buzas G., Lotz G., Kiss A. et al. The epidemiology of clarithromycin resistance of Helicobacter pylori infection in Hungary. Orv. Hetil. 2007; 31: 1461-1467.
14. Bergman M., Gianfranco Del Prete, Yvette van Kooyk & Ben Appelmelk. Helicobacter pylori phase variation, immune modulation and gastric autoimmunity. // Nature Reviews Microbiology 2006, 4: 151-159.
15. Malfertheiner P, Meagraud F, O′Morain C. Guidelines for the Management of Helicobacter Pylori Infection Business briefing: European gastroenterology review 2005: 59-60, 998-99 с.
1. Способ лечения Helicobacter pylori ассоциированной хронической язвенной болезни желудка и двенадцатиперстной кишки путем медикаментозной терапии, включающей пероральное введение субцитрата висмута, омепразола, амоксицилина и фуразолидона, отличающийся тем, что в медикаментозную терапию дополнительно включают иммуномодулятор микробного происхождения и комплекс бифидо- и лактобактерий.
2. Способ по п.1, отличающийся тем, что в качестве иммуномодулятора микробного происхождения включают рибомунил, при этом прием его в первый месяц лечения осуществляют в дозе 750 мг 1 раз в сутки утром натощак в первые 4 дня каждой недели, а в последующие 2 месяца - первые 4 дня каждого месяца.
3. Способ по п.1, отличающийся тем, что комплекс бифидо- и лактобактерий принимают по 5 мл, при содержании в 1 мл комплекса 1010-1012 микробных тел, за 30 мин до приема пищи (в обед), в течение 25 дней с первого дня приема препаратов.