Фармацевтические соединения
Иллюстрации
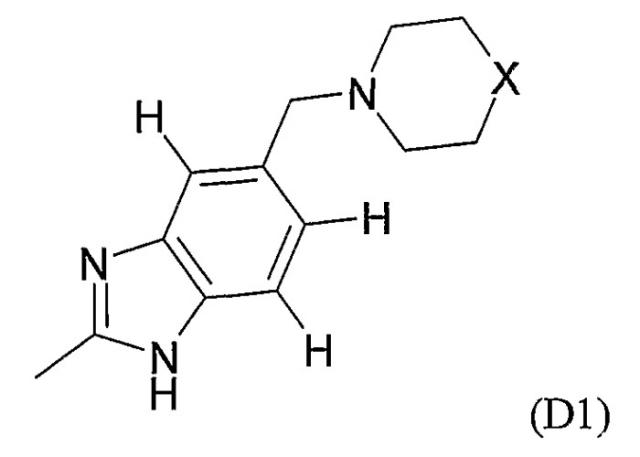
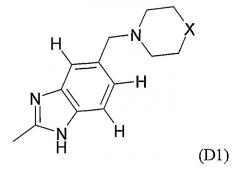
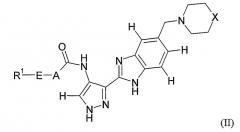
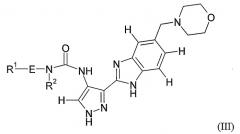
Показать всеИзобретение относится к соединениям формулы (I) или их фармацевтически приемлемым солям, сольватам или таутомерам, где заместитель М выбран из групп D1 и D2, имеющих структурные формулы, приведенные ниже, и R1, Е, А и X соответствуют определениям, приведенным в формуле изобретения. Кроме того, раскрыты фармацевтические композиции, содержащие эти соединения, способы получения этих соединений, промежуточные соединения и способы их получения, а также применение соединений формулы (I) в профилактике или лечении заболеваний, опосредованных CDK киназами, GSK-3 киназами или Aurora киназами. 15 н. и 25 з.п. ф-лы, 8 ил., 18 табл.
Реферат
Изобретение относится к производным пиразола, которые ингибируют или модулируют активность циклин-зависимых киназ (CDK), киназ гликоген-синтазы (GSK) и Aurora киназ, к применению этих соединений в лечении или профилактике опосредованных киназами заболеваний или состояний, а также к новым соединениям, обладающим ингибирующей или модулирующей активностью в отношении киназ. Кроме того, разработаны фармацевтические композиции, содержащие указанные соединения, а также новые химические промежуточные соединения.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Протеинкиназы образуют большое семейство структурно родственных ферментов, которые отвечают за управление самыми разнообразными процессами передачи сигналов в клетке (Hardie, G. and Hanks, S. (1995) The Protein Kinase Facts Book. I and II, Academic Press, San Diego, CA). Киназы могут быть классифицированы на семейства по субстратам, которые они фосфорилируют (например, протеин-тирозин, протеин-серин/треонин, липиды и т.д.). Были идентифицированы характерные фрагменты последовательностей, которые, как правило, соответствуют каждому из этих семейств киназ (например, Hanks, S.K., Hunter, T., FASEB J., 9:576-596 (1995); Knighton, et al., Science, 253: 407-414 (1991); Hiles, et al., Cell, 70: 419-429 (1992); Kunz, et al., Cell, 73: 585-596 (1993); Garcia-Bustos, et al., EMBO J., 13: 2352-2361 (1994)).
Протеинкиназы могут быть охарактеризованы механизмами их регулирующего действия. Эти механизмы включают, например, аутофосфорилирование, трансфосфорилирование другими киназами, взаимодействия белок-белок, взаимодействия белок-липид и взаимодействия белок-полинуклеотид. Отдельные протеинкиназы могут регулироваться более чем одним механизмом.
Киназы регулируют большое количество различных процессов в клетках, включая, но не ограничиваясь перечисленным, пролиферацию, дифференцировку, апоптоз, подвижность, транскрипцию, трансляцию и другие процессы передачи сигнала, путем присоединения фосфатной группы к целевым белкам. Эти акты фосфорилирования действуют как молекулярные переключатели включено/выключено, которые могут модулировать или регулировать биологическую функцию целевого белка. Фосфорилирование целевых белков происходит в ответ на различные внеклеточные сигналы (гормоны, нейромедиаторы, факторы роста и дифференцировки и т.д.), события клеточного цикла, стрессы, связанные с окружающей средой или питанием и т.д. Присущие протеинкиназам функции в путях передачи сигнала состоят в том, чтобы активировать или инактивировать (либо прямо, либо косвенно), например, метаболический фермент, регуляторный белок, рецептор, белок цитоскелета, ионный канал или насос, или фактор транскрипции. Неуправляемая передача сигнала из-за нарушенного управления фосфорилированием белков вовлечена в ряд заболеваний, включая, например, воспаление, рак, аллергию/астму, заболевания и состояния иммунной системы, заболевания и состояния центральной нервной системы и ангиогенез.
Циклин-зависимые киназы
Процесс деления эукариотических клеток может быть в общих чертах разделен на ряд последовательных фаз, именуемых G1, S, G2 и M. Было показано, что правильное прохождение через различные фазы клеточного цикла решающим образом зависит от пространственной и временной регуляции семейства белков, известных как циклин-зависимые киназы (CDK) и многообразной группы родственных им белковых партнеров, именуемых циклинами. CDK являются CDC2 (также известными как CDK1)-гомологичными белками серин-треонин киназы, которые способны использовать АТФ как субстрат при фосфорилировании различных полипептидов в зависимости от окружающей последовательности. Циклины представляют собой семейство белков, характеризующихся гомологичной областью, содержащей приблизительно 100 аминокислот и называемой «циклиновый бокс», которая используется для связывания с конкретными CDK белковыми партнерами и определяет селективность по отношению к ним.
Модуляция уровней экспрессии, скоростей распада и уровней активации различных CDK и циклинов во время клеточного цикла ведет к образованию циклинами ряда комплексов CDK/циклин, в которых CDK являются ферментно-активными. Образование этих комплексов управляет прохождением через отдельные контрольные точки клеточного цикла и, тем самым, делает возможным продолжение процесса деления клетки. Неспособность удовлетворить предварительно установленным биохимическим критериям в данной контрольной точке клеточного цикла, т.е. невозможность образования требуемого комплекса CDK/циклин, может привести к остановке клеточного цикла и/или клеточному апоптозу. Аномальная клеточная пролиферация, которая проявляется при раке, часто может быть отнесена к потере правильного управления клеточным циклом. Следовательно, ингибирование ферментной активности CDK предоставляет средство, с помощью которого можно остановить деление аномально делящихся клеток или убить их. Многообразие CDK и комплексов CDK и их решающая роль в опосредовании клеточного цикла обеспечивают широкий спектр потенциальных терапевтических мишеней, выбранных на основе определенного биохимического обоснования.
Движение от фазы G1 к фазе S клеточного цикла в основном регулируется CDK2, CDK3, CDK4 и CDK6 за счет связывания с циклинами типов D и E. Циклины типа D, по-видимому, делают возможным прохождение через ограничивающую точку G1, тогда как комплекс CDK2/циклин E является ключевым для перехода от фазы G1 к фазе S. Дальнейшее прохождение через фазу S и вхождение в G2, как считается, требует наличия комплекса CDK2/циклин A. Как митоз, так и переход от фазы G2 к фазе M, который запускает его, регулируются комплексами CDK1 и циклинов типов A и B.
Во время фазы G1 белок ретинобластомы (Rb) и родственные pocket-белки («карманные» белки), как, например, p130, являются субстратами для комплексов CDK(2, 4 и 6)/циклин. Прохождение через фазу G1 частично облегчается гиперфосфорилированием и, таким образом, инактивацией Rb и p130 комплексами CDK(4/6)/циклин-D. Гиперфосфорилирование Rb и p130 вызывает высвобождение факторов транскрипции, таких как E2F, и, таким образом, экспрессию генов, как, например, гена циклина E, необходимую для прохождения через G1 и для вхождения в S-фазу. Экспрессия циклина E облегчает образование комплекса CDK2/циклин E, который увеличивает или поддерживает уровни E2F путем дополнительного фосфорилирования Rb. Комплекс CDK2/циклин E также фосфорилирует другие белки, необходимые для репликации ДНК, такие как NPAT, который вовлечен в биосинтез гистона. Прохождение G1 и переход G1/S также регулируются митоген-стимулированным сигнальным путем Myc, который входит в сигнальный путь комплекса CDK2/циклин E. Кроме того, CDK2 связан с опосредованным p53 путем отклика на повреждение ДНК за счет регулирования уровней p21 при действии p53. p21 представляет собой белковый ингибитор комплекса CDK2/циклин E и за счет этого он способен блокировать или задерживать переход G1/S. Комплекс CDK2/циклин E может, следовательно, представлять собой точку, в которой, до некоторой степени, объединены биохимические стимулы для сигнальных путей Rb, Myc и p53. Поэтому CDK2 и/или комплекс CDK2/циклин E являются хорошими мишенями для терапевтических способов, предназначенных для остановки клеточного цикла или возобновления его управлением в аномально делящихся клетках.
Точная роль CDK3 в клеточном цикле неясна. До сих пор не был идентифицирован родственный циклиновый партнер, но доминирующей негативной формой CDK3-задержанных клеток является G1, позволяя, тем самым, предположить, что CDK3 играет определенную роль в управлении переходом G1/S.
Хотя большая часть CDK вовлечена в регулирование клеточного цикла, существует доказательство того, что некоторые члены семейства CDK вовлечены в другие биохимические процессы. Примером таких CDK является CDK5, которая необходима для правильного развития нейронов и которая, кроме того, вовлечена в фосфорилирование нескольких нейронных белков, таких как Tau, NUDE-1, синапсин1, DARPP32 и комплекса Munc18/синтаксин1А. Нейронная CDK5 обычно активируется связыванием с белками p35/p39. Однако активность CDK5 может быть разрегулирована связыванием с p25, т.е. усеченным вариантом p35. Превращение p35 в p25 и последующее нарушение регулирования активности CDK5 может быть вызвано ишемией, эксцитотоксичностью и β-амилоидным пептидом. Следовательно, p25 вовлечен в патогенез нейродегенеративных заболеваний, таких как болезнь Альцгеймера и, следовательно, представляет интерес в качестве мишени для терапевтических способов, направленных против этих заболеваний.
CDK7 представляет собой ядерный белок, который обладает CDC2 CAK активностью, и связывается с циклином H. CDK7 была идентифицирована в качестве компонента TFIIH транскрипционного комплекса, который обладал активностью в отношении C-концевого домена (CTD) РНК полимеразы II. Это было связано с регулированием транскрипции ВИЧ-1 с помощью Tat-опосредованного биохимического сигнального пути. CDK8 связывает циклин C и вовлечена в фосфорилирование CTD РНК полимеразы II. Подобным же образом комплекс CDK9/циклин-T1 (комплекс P-TEFb) вовлечен в управление элонгацией РНК полимеразы II. Кроме того, P-TEFb необходим для активации транскрипции генома ВИЧ-1 вирусным трансактиватором Tat за счет его взаимодействия с циклином T1. Следовательно, CDK7, CDK8, CDK9 и комплекс P-TEFb являются потенциальными мишенями для способов антивирусной терапии.
Опосредование активности комплекса CDK/циклин на молекулярном уровне требует ряда актов стимулирующего и ингибирующего фосфорилирования или дефосфорилирования. Фосфорилирование CDK осуществляется группой CDK-активирующих киназ (CAK) и/или такими киназами, как wee1, Myt1 и Mik1. Дефосфорилирование осуществляется такими фосфатазами, как cdc25(a и c), pp2a или KAP.
Далее активность комплекса CDK/циклин может регулироваться двумя семействами эндогенных клеточных белковых ингибиторов: семейством Kip/Cip или семейством INK. Белки INK специфично связывают CDK4 и CDK6. p16ink4 (известный также как MTS1) является геном, подавляющим потенциальные опухоли, который подвергнут мутации или удален в большом количестве первичных раковых опухолей. Семейство Kip/Cip включает такие белки как, например, p21Cip,Waf1, p27Kip1 и p57Kip2. Как обсуждалось ранее, p21 индуцируется p53, причем он способен инактивировать комплексы CDK2/циклин(E/A) и CDK4/циклин(D1/D2/D3). Атипически низкие уровни экспрессии p27 наблюдались при раке груди, ободочной кишки и простаты. Напротив, избыточная экспрессия циклина E в солидных опухолях, как было показано, коррелирует с неблагоприятным для пациента прогнозом. Избыточную экспрессию циклина D1 связывали с карциномой пищевода, груди, сквамозной карциномой и немелкоклеточной карциномой легкого.
Ключевая роль CDK и связанных с ними белков в координировании и продвижении клеточного цикла в пролиферирующих клетках была подчеркнута выше. Кроме того, были описаны некоторые из биохимических сигнальных путей, в которых CDK играют ключевую роль. Следовательно, разработка способов монотерапии для лечения пролиферативных расстройств, как, например, различных видов рака, использующих разновидности терапии, нацеленные на CDK в общем, или на конкретные CDK, потенциально является в высшей степени желательной. Ингибиторы CDK, предположительно, могли бы также применяться для лечения других состояний, как, например, в числе прочего, вирусных инфекций, аутоиммунных заболеваний и нейродегенеративных заболеваний. Кроме того, терапевтические способы, нацеленные на CDK, могут обеспечить клинические преимущества при лечении указанных выше заболеваний при применении в рамках комбинированной терапии совместно с либо существующими, либо новыми терапевтическими средствами. Нацеленные на CDK способы противораковой терапии потенциально могли бы иметь преимущества над многими существующими противоопухолевыми средствами, т.к. они не взаимодействовали бы непосредственно с ДНК и, следовательно, должны были бы снизить риск развития вторичной опухоли.
Диффузные B-крупноклеточные лимфомы (DLBCL)
Развитие клеточного цикла регулируется комбинированным действием циклинов, циклин-зависимых киназ (CDK) и ингибиторов CDK (CDKi), которые являются отрицательными регуляторами клеточного цикла. p27KIP1 является ключевым CDKi в регулировании клеточного цикла, и его распад необходим для перехода G1/S. Несмотря на отсутствие экспрессии p27KIP1 в пролиферирующих лимфоцитах, сообщалось, что некоторые агрессивные B-клеточные лимфомы демонстрируют аномальное окрашивание p27KIP1. Аномально высокая экспрессия p27KIP1 была обнаружена в лимфомах этого типа. Анализ клинической значимости этих данных показал, что высокий уровень экспрессии p27KIP1 в опухолях данного типа является неблагоприятным прогностическим признаком как при одномерном, так и при многомерном анализе. Эти результаты показывают, что в диффузных B-крупноклеточных лимфомах (DLBCL) имеется аномальная экспрессия p27KIP1, с неблагоприятной клинической значимостью, в предположении, что этот аномальный белок p27KIP1 может приводиться в нефункциональное состояние при взаимодействии с другими белками, регулирующими клеточный цикл (Br. J. Cancer. 1999 Jul; 80(9): 1427-34. p27KIP1 аномально экспрессируется в диффузных B-крупноклеточных лимфомах, и он связан с неблагоприятным клиническим исходом. Saez A, Sanchez E, Sanchez-Beato M, Cruz MA, Chacon I, Munoz E, Camacho FI, Martinez-Montero JC, Mollejo M, Garcia JF, Piris MA. Department of Pathology, Virgen de la Salud Hospital, Toledo, Spain).
Хронический лимфоцитарный лейкоз
B-клеточный хронический лимфоцитарный лейкоз (CLL) является наиболее обычной разновидностью лейкемии в западном полушарии, причем ежегодно диагностируется приблизительно 10000 новых случаев (Parker SL, Tong T, Bolden S, Wingo PA: Cancer statistics, 1997. Ca. Cancer. J. Clin. 47:5, (1997)). По отношению к другим формам лейкемии прогноз CLL в целом является благоприятным, причем даже пациенты с наиболее развитой стадией имеют среднюю продолжительность жизни, равную 3 годам.
Включение флударабина в первичную терапию пациентов с симптомами CLL привело к более высоким показателям полной реакции (27% против 3%) и продолжительности жизни без развития заболевания (33 месяца против 17) по сравнению с применявшимися ранее способами лечения на основе алкилирующих средств. Хотя достижение полной клинической реакции после терапии является первым шагом по направлению к улучшению выживаемости при CLL, большинство пациентов либо не достигают полной ремиссии, либо не реагируют на флударабин. Кроме того, у всех пациентов с CLL, подвергавшихся лечению флударабином, в конце концов возникал рецидив, что делает роль флударабина в качестве единственного средства лечения чисто паллиативной (Rai KR, Peterson B, Elias L, Shepherd L, Hines J, Nelson D, Cheson B, Kolitz J, Schiffer CA: A randomized comparison of fludarabine and chlorambucil for patients with previously untreated chronic lymphocytic leukemia. A CALGB SWOG, CTG/NCI-C and ECOG Inter-Group Study. Blood 88:141a, 1996 (abstr 552, suppl 1). Следовательно, если должен реализоваться дальнейший прогресс в лечении данного заболевания, будет необходимо выявлять новые средства с новыми механизмами действия, которые дополняют цитотоксичность флударабина и устраняют устойчивость CLL к действию лекарственных средств, вызванную внутренними факторами.
Наиболее широко изученным и имеющим постоянную предсказательную силу фактором плохой реакции на терапию и низкой выживаемости CLL-пациентов является аномальная функция p53, характеризующаяся точечными мутациями или делециями хромосомы 17p13. Действительно фактическое отсутствие реакции на терапию как алкилирующими средствами, так и аналогами пурина, для таких CLL-пациентов с аномальной функцией p53 было документально подтверждено в целом ряде отдельных установленных историй болезни. Разработка терапевтического средства, которое способно преодолеть устойчивость к лекарственным средствам, связанную с мутацией p53 при CLL, могло бы потенциально стать значительным прогрессом в лечении данного заболевания.
Флавопиридол и CYC 202, т.е. ингибиторы циклин-зависимых киназ, вызывают in vitro апоптоз злокачественных клеток B-клеточного хронического лимфоцитарного лейкоза (B-CLL).
Действие флавопиридола приводит к стимулированию активности каспазы 3 и к зависимому от каспазы расщеплению p27(kip1), т.е. отрицательного регулятора клеточного цикла, который избыточно экспрессируется при B-CLL (Blood. 1998 Nov 15;92(10):3804-16 Flavopiridol induces apoptosis in chronic lymphocytic leukemia cells via activation of caspase-3 without evidence of bcl-2 modulation or dependence on functional p53. Byrd JC, Shinn C, Waselenko JK, Fuchs EJ, Lehman TA, Nguyen PL, Flinn IW, Diehl LF, Sausville E, Grever MR).
Aurora киназы
Относительно недавно было обнаружено новое семейство серин/треонин киназ, известных как Aurora киназы, которые вовлечены в фазы G2 и M клеточного цикла, и которые являются важными регуляторами митоза. Точная роль Aurora киназ еще должна быть объяснена, но они принимают участие в регулировании контрольной точки митоза, динамике хромосом и цитокинезе (Adams et al., Trends Cell Biol., 11: 49-54 (2001)). Aurora киназы находятся на центросомах интерфазных клеток, на полюсах биполярного веретена и в клеточной пластинке в плоскости экватора веретена митотического аппарата.
До настоящего времени у млекопитающих было обнаружено три члена семейства Aurora киназ (E.A. Nigg, Nat. Rev. Mol. Cell Biol. 2: 21-32, (2001)). А именно:
Aurora A (также именуемая в литературе Aurora 2);
Aurora B (также именуемая в литературе Aurora 1); и
Aurora C (также именуемая в литературе Aurora 3).
Aurora киназы включают высокогомологичные каталитические домены, но значительно отличаются в своих N-концевых частях (Katayama H, Brinkley WR, Sen S.; The Aurora kinases: role in cell transformation and tumorigenesis; Cancer Metastasis Rev. 2003 Dec; 22(4):451-64).
Было установлено, что субстраты Aurora киназ A и B включают подобные кинезину моторные белки, белки аппарата веретена, белок гистон H3, белок кинетохора и подавляющий опухоли белок p53.
Полагают, что Aurora A киназы вовлечены в формирование веретена и во время ранней фазы G2 локализуются на центросоме, где они фосфорилируют белки, связанные с веретеном (Prigent et al., Cell, 114:531-535 (2003). Hirota и соавторы (Hirota et al, Cell, 114: 585-598, (2003)) обнаружили, что клетки, обедненные Aurora A протеинкиназой, были неспособны начать митоз. Кроме того, было найдено (Adams, 2001), что мутация или разрушение гена Aurora A у различных видов ведет к митотическим аномалиям, включая разделение центросом и дефекты созревания, аномалии веретена и дефекты сегрегации хромосом.
Aurora киназы, как правило, экспрессируются в незначительных количествах в большинстве нормальных тканей, причем исключениями являются ткани с высокой долей делящихся клеток, такие как вилочковая железа и яички. Однако повышенные уровни Aurora киназ были обнаружены в большинстве раковых опухолей человека (Giet et al., J. Cell. Sci. 112: 3591-361, (1999) и Katayama (2003)). Кроме того, Aurora A киназа отображает область хромосомы 20ql3, которая, как часто обнаруживается, усилена во многих раковых опухолях человека.
Так, например, значительная избыточная экспрессия Aurora A была обнаружена в раковых опухолях груди, яичников и поджелудочной железы человека (см. Zhou et al, Nat. Genet. 20: 189-193, (1998), Tanaka et al., Cancer Res., 59: 2041-2044, (1999) и Han et al, cancer Res., 62: 2890-2896, (2002).
Кроме того, Isola, American Journal of Pathology 147, 905-911 (1995) сообщил, что амплификация локуса Aurora A (20ql3) коррелирует с неблагоприятным прогнозом для пациентов с раком груди без поражения лимфатических узлов.
Амплификация и/или избыточная экспрессия Aurora A наблюдается при раковых опухолях мочевого пузыря человека, и амплификация Aurora A связана с анеуплодией и агрессивным клиническим поведением, см. Sen et al., J. Natl. Cancer Inst, 94: 1320-1329 (2002).
Увеличенная экспрессия Aurora A была обнаружена более чем в 50% случаев колоректального рака (см. Bischoff et al., EMBO J., 17: 3052-3065, (1998) и Takahashi et al., Jpn. J. Cancer Res., 91: 1007-1014 (2000)), раковых опухолей яичников (см. Gritsko et al., Clin. Cancer Res., 9: 1420-1426 (2003)) и раковых опухолей желудка (Sakakura et al., British Journal of Cancer, 84: 824-831 (2001)).
Tanaka et al., Cancer Research, 59: 2041-2044 (1999) обнаружил доказательства избыточной экспрессии Aurora A в 94% случаев инвазивной аденокарциномы протоков молочной железы.
Кроме того, высокие уровни Aurora A киназы были обнаружены в клеточных линиях опухолей почек, шейки матки, поджелудочной железы и простаты, а также клеточных линиях нейробластомы, меланомы, лимфомы Bischoff et al. (1998), EMBO J., 17: 3052-3065 (1998); Kimura et al. J. Biol. Chem., 274: 7334-7340 (1999); Zhou et al., Nature Genetics, 20: 189-193 (1998); Li et al., Clin Cancer Res. 9 (3): 991-7 (2003)].
Aurora B в значительных количествах экспрессируется во многих линиях клеток опухолей человека, включая лейкемические клетки [Katayama et al., Gene 244:1-7]. При первичных колоректальных раковых опухолях уровни данного фермента возрастают как функция стадии по Дюку [Katayama et al., J. Natl Cancer Inst., 91: 1160-1162 (1999)].
Высокие уровни Aurora-3 (Aurora-C) были обнаружены в нескольких линиях опухолевых клеток, даже несмотря на то, что в нормальных тканях присутствие этой киназы имеет тенденцию ограничиваться зародышевыми клетками (см. Kimura et al., Journal of Biological Chemistry, 274: 7334-7340 (1999)). Кроме того, Takahashi et al., Jpn. J. Cancer Res., 91: 1007-1014 (2001) сообщалось об избыточной экспрессии Aurora-3 приблизительно в 50% случаев колоректального рака.
Другие сообщения о роли Aurora киназ в пролиферативных расстройствах могут быть найдены в Bischoff et al., Trends in Cell Biology 9: 454-459 (1999); Giet et al. Journal of Cell Science, 112: 3591-3601 (1999) и Dutertre, et al. Oncogene, 21: 6175-6183 (2002).
Royce и сотрудники сообщают, что экспрессия гена Aurora 2 (известного как STK15 или BTAK) была отмечена приблизительно в одной четвертой части случаев первичных опухолей груди (Royce ME, Xia W, Sahin AA, Katayama H, Johnston DA, Hortobagyi G, Sen S, Hung MC; STK15/Aurora-A expression in primary breast tumours is correlated with nuclear grade but not with prognosis; Cancer. 2004 Jan 1; 100(1): 12-9).
Внутриматочная карцинома (EC) включает как минимум два типа рака: эндометриоидные карциномы (EEC) представляют собой опухоли, связанные с эстрогеном, которые часто являются эуплоидными и имеют благоприятный прогноз. Неэндометриоидные карциномы (NEEC; серозная и светлоклеточная формы) не связаны с эстрогеном, часто бывают анэуплоидными и являются клинически агрессивными. Также было обнаружено, что уровень Aurora увеличивался на 55,5% при NEEC, но не при всех EEC (P≤0,001) (Moreno-Bueno G, Sanchez-Estevez C, Cassia R, Rodriguez-Perales S, Diaz-Uriarte R, Dominguez O, Hardisson D, Andujar M, Prat J, Matias-Guiu X, Cigudosa JC, Palacios J. Cancer Res. 2003 Sep 15; 63(18): 5697-702).
Reichardt и соавторы (Oncol Rep. 2003 Sep-Oct; 10 (5): 1275-9) сообщали, что количественный анализ ДНК с помощью PCR для поиска амплификации Aurora в глиомах показал, что пять из 16 опухолей (31%) в различных стадиях по классификации ВОЗ (1 в стадии II, 1 в стадии III, 3 в стадии IV) показали амплификацию ДНК гена Aurora 2. Была сформулирована гипотеза, что амплификация гена Aurora 2 может быть неслучайным генетическим изменением в глиомах человека, играющим определенную роль в генетических путях образования опухолей.
Результаты Hamada и сотрудников (Br. J. Haematol. 2003 May; 121 (3): 439-47) также наводят на мысль, что Aurora 2 является эффективным кандидатом для выявления не только активности заболевания, но также и путей образования неходжкинских лимфом. Замедление роста опухолевых клеток, являющееся следствием ограничения функций этого гена, могло бы стать терапевтическим подходом к лечению неходжкинских лимфом.
В исследовании, выполненном Gritsko и соавторами (Clin Cancer Res. 2003 Apr; 9 (4): 1420-6) у 92 пациентов с первичными опухолями яичников были исследованы активность киназ и уровни белка Aurora A. Анализ киназ in vitro выявил повышенную активность Aurora A киназы в 44 случаях (48%). Повышенные уровни белка Aurora A были обнаружены в 52 образцах (57%). Высокие уровни белка Aurora A хорошо коррелировали с повышенной активностью киназы.
Результаты, полученные Li и соавторами (Clin. Cancer Res. 2003 Mar; 9(3): 991-7), показали, что ген Aurora A подвергается избыточной экспрессии в опухолях поджелудочной железы и линиях раковых клеток, и предположили, что повышенная экспрессия Aurora A может играть определенную роль в образовании раковых опухолей поджелудочной железы.
Аналогично было показано, что амплификация гена Aurora A и связанное с этим увеличение экспрессии митотической киназы, которую кодирует этот ген, ассоциируется с анеуплоидией и агрессивным клиническим поведением рака мочевого пузыря человека (J. Natl. Cancer Inst. 2002 Sep 4; 94 (17): 1320-9).
Исследования нескольких групп (Dutertre S, Prigent C., Aurora-A overexpression leads to override of the microtubule-kinetochore attachment checkpoint; Mol. Interv. 2003 May; 3(3): 127-30 и Anand S, Penrhyn-Lowe S, Venkitaraman AR., Aurora-A amplification overrides the mitotic spindle assembly checkpoint, inducing resistance to Taxol, Cancer Cell. 2003 Jan; 3 (1): 51-62) наводят на мысль, что избыточная экспрессия активности Aurora киназы связана с устойчивостью к некоторым современным способам лечения рака. Например, избыточная экспрессия Aurora A в фибробластах мышиных зародышей может понизить чувствительность этих клеток к цитотоксическому действию производных таксана. Следовательно, ингибиторы Aurora киназы могут найти конкретное применение у пациентов с развившейся устойчивостью к существующим видам терапии.
На базе исследований, выполненных к настоящему времени, представляется, что ингибирование Aurora киназ, в частности Aurora киназы A и Aurora киназы B, обеспечит эффективные средства замедления развития опухолей.
Harrington и сотрудники (Nat Med. 2004 Mar; 10 (3) 262-7) продемонстрировали, что ингибитор Aurora киназ подавляет рост опухоли и вызывает регресс опухоли in vivo. В этом исследовании ингибитор Aurora киназы блокировал пролиферацию раковых клеток, и, кроме того, запускал процесс клеточной смерти у целого ряда линий раковых клеток, включая лейкемические и колоректальные клеточные линии и линию клеток рака груди. В дополнение к сказанному показана возможность лечения лейкемии путем индуцирования апоптоза лейкемических клеток. VX-680 эффективно убивает устойчивые к лечению клетки первичной острой миелогенной лейкемии (AML) у пациентов (Andrews, Oncogene, 2005, 24, 5005-5015).
Разновидности рака, которые могут быть особенно подвержены действию ингибиторов Aurora, включают рак груди, мочевого пузыря, колоректальный рак, рак поджелудочной железы, яичников, неходжкинскую лимфому, глиомы и неэндометриоидные внутриматочные карциномы. Разновидности лейкемии, особенно подверженные действию ингибиторов Aurora, включают острую миелогенную лейкемию (AML), хроническую миелогенную лейкемию (CML), B-клеточную лимфому (клетки мантийной ткани) и острый лимфобластный лейкоз (ALL).
Киназа гликоген-синтазы
Киназа-3 гликоген-синтазы (GSK3) представляет собой серин-треонин киназу, которая встречается у людей в виде двух изоформ, экспрессируемых во всех тканях (GSK3α и GSK3β). GSK3 привлекалась к рассмотрению в качестве фермента, обладающего определенной ролью в эмбриональном развитии, синтезе белка, клеточной пролиферации, дифференцировке клеток, динамике микроканальцев, клеточной подвижности и клеточном апоптозе. Как таковая, GSK3 вовлечена в развитие таких болезненных состояний, как диабет, рак, болезнь Альцгеймера, удар, эпилепсия, боковой амиотрофический склероз и/или травма головы. Филогенетически GSK3 наиболее тесно связана с циклин-зависимыми киназами (CDK).
Консенсусная пептидная последовательность субстрата, распознаваемая GSK3, является последовательностью (Ser/Thr)-X-X-X-(pSer/pThr), где X представляет собой любую аминокислоту (в положениях (n+1), (n+2), (n+3)) и pSer и pThr представляют собой фосфосерин и фосфотреонин, соответственно, в положении (n+4). GSK3 фосфорилирует первый серин или треонин в положении (n). Фосфосерин или фосфотреонин в положении (n+4), по-видимому, необходим для стимулирования GSK3 к достижению максимальной скорости превращения субстрата. Фосфорилирование GSK3α по Ser21 или GSK3β по Ser9 приводит к ингибированию GSK3. Исследования мутагенеза и конкурентных реакций с пептидами привели к модели, согласно которой фосфорилированный N-конец GSK3 способен конкурировать с фосфопептидным субстратом (S/TXXXpS/pT) за счет механизма аутоингибирования. Кроме того, имеются данные, дающие возможность предположить, что GSK3α и GSK3β могут в незначительной степени регулироваться фосфорилированием остатков тирозина 279 и 216, соответственно. Мутация этих остатков в Phe вызывала восстановление активности киназы in vivo. Установление кристаллографической структуры GSK3β с помощью рентгеновских лучей помогло пролить свет на все аспекты активации и регулирования GSK3.
GSK3 формирует часть сигнального пути реакции на инсулин у млекопитающих, причем фермент способен фосфорилировать и, тем самым, инактивировать гликоген-синтазу. Таким образом, увеличение активности гликоген-синтазы и за счет этого синтеза гликогена, с помощью ингибирования GSK3, рассматривалось в качестве потенциального средства борьбы с сахарным диабетом типа II или инсулинонезависимым сахарным диабетом (NIDDM): состоянием, при котором ткани тела становятся устойчивыми к стимулированию инсулином. Реакция клеток на инсулин в печени, жировой или мускульной тканях запускается за счет связывания инсулина с внеклеточным рецептором инсулина. Это вызывает фосфорилирование и последующее поступление на плазматическую мембрану белков-субстратов рецептора инсулина (IRS). Дальнейшее фосфорилирование белков IRS инициирует появление фосфоинозитид-3-киназы (PI3K) на плазматической мембране, где она способна высвободить вторичный мессенджер - фосфатидилинозитил 3,4,5-трифосфат (PIP3). Это содействует совместной локализации 3-фосфоинозитид-зависимой протеинкиназы 1 (PDK1) и протеинкиназы B (PKB или Akt) на мембране, где PDK1 активирует PKB. PKB способна фосфорилировать и, тем самым, ингибировать GSK3α и/или GSK3β путем фосфорилирования остатков Ser9 или Ser21, соответственно. Затем ингибирование GSK3 инициирует увеличение активности гликоген-синтазы. Таким образом, терапевтические средства, способные ингибировать GSK3, могут вызвать реакции клеток, сходные с реакциями, наблюдаемыми при стимуляции инсулином. Дополнительным in vivo субстратом GSK3 является эукариотический фактор инициации синтеза белка 2B (eIF2B). eIF2B инактивируется при фосфорилировании и, таким образом, приобретает способность подавлять биосинтез белка. Ингибирование GSK3, например, путем инактивации белка, представляющего собой «молекулу-мишень рапамицина у млекопитающих» (mTOR), может, таким образом, увеличивать биосинтез белка. Наконец, существуют доказательства в пользу регулирования активности GSK3 через сигнальный путь митоген-активированной протеинкиназы (MAPK) за счет фосфорилирования GSK3 киназами, как, например, митоген-активированной протеинкиназой, активированной протеинкиназой (MAPKAP-K1 или RSK). Эти данные позволяют предположить, что активность GSK3 может модулироваться митогенными, инсулиновыми и/или аминокислотными стимулирующими воздействиями.
Кроме того, было показано, что GSK3β является ключевым компонентом в Wnt сигнальном пути позвоночных. Было показано, что этот биохимический путь имеет решающее значение для нормального эмбрионального развития, а также регулирует пролиферацию клеток в нормальных тканях. GSK3 подвергается ингибированию в ответ на стимулирующее воздействие Wnt. Это может вести к дефосфорилированию субстратов GSK3, как, например, аксина, т.е. продукта гена аденоматозного полипоза толстой кишки (APC), и β-катенина. Аномальное регулирование пути Wnt связывалось со многими видами рака. Мутации в APC и/или β-катенине являются обычными при колоректальном раке и других опухолях. Кроме того, было показано, что β-катенин играет важную роль в клеточной адгезии. Таким образом, GSK3 также до некоторой степени может модулировать процессы клеточной адгезии. Помимо уже описанных биохимических путей, существуют данные, которые позволяют предположить участие GSK3 в регулировании деления клеток за счет фосфорилирования циклина-D1, в фосфорилировании факторов транскрипции, таких как c-Jun, CCAAT/энхансер-связывающий белок α (C/EBPα), c-Myc и/или других субстратов, таких как ядерный фактор активированных T-клеток (NFATc), фактор теплового шока-1 (HSF-1) и белок, связывающийся с c-AMP зависимым элементом (CREB). Кроме того, GSK3, по-видимому, играет определенную, хотя и тканеспецифичную, роль в регулировании клеточного апоптоза. Роль GSK3 в модулировании клеточного апоптоза через про-апоптический механизм может иметь особое значение для медицинских состояний, в которых может наблюдаться апоптоз нейронов. Примерами таких состояний являются травма головы, удар, эпилепсия, болезнь Альцгеймера и боковой амиотрофический склероз, прогрессирующий супрануклеарный паралич, кортико-базальная дегенерация и болезнь Пика. Было показано in vitro, что GSK3 способна гиперфосфорилировать микроканальцы, связанные с тау-белком. Гиперфосфорилирование тау-белка прекращает его нормальное связывание с микроканальцами и может также приводить к образованию внутриклеточных нитей тау-белка. Полагают, что последовательное накопление этих нитей ведет к возможной дисфункции и дегенерации нейронов. Ингибирование фосфорилирования тау-белка за счет ингибирования GSK3 может, таким образом, предоставить средства ограничения и/или предупреждения нейродегенеративных эффектов.
УРОВЕНЬ ТЕХНИКИ
В WO 02/34721, поданной Du Pont, раскрыт класс инден[1,2-c]пиразол-4-онов, как ингибиторов циклин-зависимых киназ.
В WO 01/81348, поданной Bristol Myers Squibb, раскрыто применение 5-тио-, сульфинил- и сульфонилпиразол[3,4-b]пиридинов, как ингибиторов циклин-зависимой киназы.
В WO 00/62778, также поданной Bristol Myers Squibb, раскрыт класс ингибиторов тирозиновой протеинкиназы.
В WO 01/72745A1, поданной Cyclacel, описаны 2-замещенные 4-гетероарилпиримидины и их получение, содержащие их фармацевтические композиции и их применение в качестве ингибиторов циклин-зависимых киназ (CDK) и, следовательно, их применение в лечении пролиферативных расстройств, таких как рак, лейкемия, псориаз и т.п.
В WO 99/21845, поданной Agouron, описаны производные 4-аминотиазола, предназначенные для ингибирования циклин-зависимых киназ (CDK), таких как CDK1, CDK2, CDK4 и CDK6. Данное изобретение также направлено на терапевтическое и профилактическое применение фармацевтических композиций, содержащих такие соединения, и на способы лечения злокачественных новообразований и других расстройств путем введения эффективных количеств указанных соединений.
В WO 01/53274, поданной Agouron, в качестве ингибиторов CDK киназы раскрыт класс соединений, которые могут включать амидзамещенное бензольное кольцо, связанное с N-содержащей гетероциклической группой.
В WO 01/98290 (Pharmacia & Upjohn) раскрыт класс производных 3-аминокарбонил-2-карбоксамидотиофена в качестве ингибиторов протеинкиназ. Установлено, что эти соединения обладают активностью в отношении большого числа протеинкиназ.
В WO 01/53268 и WO 01/02369, поданных Agouron, раскрыты соединения, которые опосредуют или ингибируют пролиферацию клеток путем ингибирования протеинкиназ, как, например, циклин-зависимых киназ или тирозиновых киназ.
В WO 00/39108 и WO 02/00651 (обе поданы Du Pont Pharmaceuticals) описаны обширные классы гетероциклических соединений, которые являются ингибиторами трипсиноподобных ферментов сериновых протеаз, в особенности фактора Xa и тромбина. Установлено, что эти соединения применимы в качестве антикоагулянтов или для профилактики тромбоэмболических расстройств.
В каждой из заявок US 2002/0091116 (Zhu et al.), WO 01/1978 и WO 01/64642 раскрыты различные группы гетероциклических соединений, которые обладают активностью против фактора Xa.
В WO 03/035065 (Aventis) раскрыт обширный класс производных бензимидазола в качестве ингибиторов протеинкиназы, но не раскрыта активность против CDK киназ или GSK киназ.
В WO 97/36585 и US 5874452 (заявка и патент принадлежат Merck) раскрыты бигетероарильные соединения, которые являются ингибиторами фарнезил трансферазы.
В WO 03/066629 (Vertex) раскрыты бензимидазолилпиразоламины как ингибиторы GSK-3.
В WO 97/12615 (Warner Lambert) раскрыты бензимидазолы как ингибиторы 15-липоксигеназы.
В WO 2004/54515 (SmithKline Beecham Corporation) раскрыт класс бензимидазолов в качестве миметиков тромбопоэтина.
В WO 2004/41277 (Merck) раскрыт класс аминобензимидазолов как модуляторов рецептора андрогенов.
В WO 2005/028624 (Plexxikon) раскрыты каркасы молекул соединений, обладающих активностью против протеинкиназ.
В поданной ранее авторами настоящего изобретения международной заявке на патент PCT/GB2004/002824 (WO 2005/002552) раскрыт класс замещенных [(1H-бензимидазол-2-ил)-1H-пиразол-4-ил]мочевин в качестве ингибиторов CDK, Aurora киназ и GSK киназ. Одним из соединений, конкретно названных и приведенных в качестве примера в WO 2005/002552, является 1-(2,6-дифторфенил)-N-[3-(5-морфолин-4-илметил-1H-бензимидазол-2-ил)-1H-пиразол-4-ил]мочевина. В экспериментальном разделе WO 2005/002552 описано получение 1-(2,6-дифторфенил)-N-[3-(5-морфолин-4-илметил-1H-бензимидазол-2-ил)-1H-пиразол-4-ил]мочевины в форме свободного основания.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем изобретении разработаны соединения, которые обладают активностью в отношении ингибирования или модулирования циклин-зависимых киназ, активностью в отношении ингибирования или модулирования киназы-3 гликоген-синтазы (GSK3), а также активностью в отношении ингибирования или модулирования Aurora киназы, и которые, как представляется, будут применимы в предупреждении или лечении заболеваний или состояний, опосредованных перечисленными киназами.
Так, например, предусматривается, что соединения по настоящему изобретению будут применимы для облегчен