Поливалентные вирусные векторы и система для их получения
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и генной инженерии. Раскрывается плазмида для получения вирусного вектора, несущего множественные экспрессионные кассеты к мишени. Плазмида содержит нуклеотидные последовательности генома, упаковываемые в поливалентный капсид и несколько способных к переносу кассет. Описан также способ создания вирусного вектора, вирусный вектор и иммуногенная композиция. Предложенная группа изобретений может быть использована для широкомасштабной экспрессии целевых антигенов. 4 н. и 19 з.п. ф-лы, 3 ил.
Реферат
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к использованию вирусных векторов для экспрессии антигенов. Дополнительно описано использование слитых пептидов в качестве антигена.
Векторы на основе слитых пептидов упрощают режим дозирования и создают больше возможностей для гетерологичной бустер-иммунизации. Тем не менее, непредсказуемый характер процессинга слитых пептидов и презентации эпитопа и трудности в создании и репродукции аденовирусов, несущих большие вставки, препятствуют их широкомасштабному использованию.
Существует потребность в прогнозируемых способах создания вирусных векторов, эффективных для доставки генных продуктов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к системе для получения вирусного вектора, несущего по меньшей мере две различные экспрессионные кассеты. В системе используется уникальный поливалентный плазмидный каркас, что позволяет эффективно детектировать и отбирать встроенные экспрессионные кассеты.
Также изобретение относится к способам получения поливалентных вирусных частиц с применением таких поливалентных каркасов по настоящему изобретению.
Ниже приводится более подробное описание этих и других вариантов осуществления и преимуществ настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
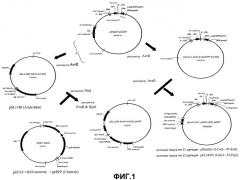
На Фиг.1 показана сборка аденовирусных векторов ΔE1-ΔЕ3.
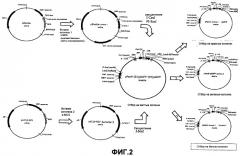
На Фиг.2 показано введение антигенов в локусы делеции Е1 и Е3 аденовирусных векторов.
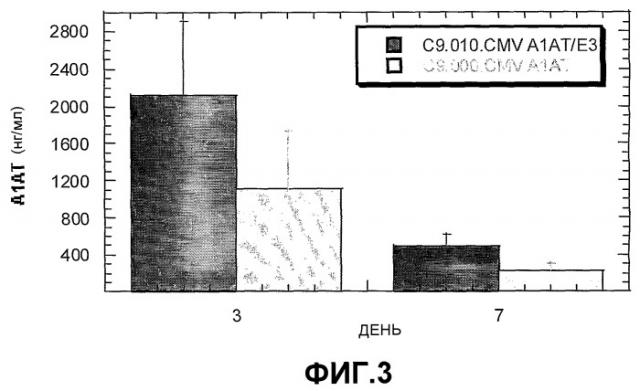
На Фиг.3 представлена гистограмма, отображающая результаты сравнения in vivo экспрессии рекомбинантного аденовируса С9 шимпанзе, экспрессирующего этот же трансген (α1АТ) только из локуса Е1 (темные полосы), или из обоих локусов Е1 и Е3 (светлые полосы).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к системе создания вирусного вектора, несущего множественные экспрессионные кассеты к мишени. В системе используется молекула ДНК, несущая вирусный геном, содержащий кассеты клонирования, способные к переносу, несущие маркерные гены. Эту молекулу ДНК используют для создания вектора переноса, несущего вирусный геном, который содержит множество гетерологичных экспрессионных кассет, расположенных в различных локусах в пределах вирусного генома. Вирусный геном, несущий гетерологичные экспрессионные кассеты, высвобождается из вектора переноса по настоящему изобретению и упаковывается в подходящий вирусный капсид или белок оболочки с получением поливалентных вирусных векторов.
Используемую в настоящем изобретении молекулу ДНК и/или вектор переноса можно получить из любого генетического элемента, который может нести вирусный геном по настоящему изобретению и способного к переносу генома в клетку-хозяин. Можно выбрать любой подходящий генетический элемент (или каркас), включая, например, плазмиду, фаг, транспозон, космиду, эписому и тому подобное. В одном из вариантов осуществления генетический элемент подходит для экспрессии в прокариотических клетках, хотя можно использовать и другие системы клонирования.
Используемый в настоящем изобретении термин "различные локусы" указывает, что гетерологичная экспрессионная кассета первого выбранного продукта-мишени расположена в вирусном каркасе на участке, который не соприкасается со второй гетерологичной экспрессионной кассетой, то есть вирусные последовательности расположены между гетерологичными экспрессионными кассетами. Эти локусы могут находиться в разных областях гена или в разных открытых рамках считывания одной области гена. Альтернативно, в пределах одной открытой рамки считывания может находиться множество локусов, но не граничащих друг с другом, например разделенных спейсерами, нативными последовательностями, сайтами рестрикции или тому подобным.
Используемый в настоящем изобретении термин "экспрессионная кассета" содержит последовательность нуклеиновой кислоты, которая кодирует продукт, доставляемый в клетку-хозяин. Последовательность нуклеиновой кислоты, которая кодирует продукт, находится под контролем регуляторных последовательностей, которые регулируют экспрессию продукта в клетке-хозяине. Соответственно, экспрессионная кассета является гетерологичной для векторных последовательностей, которые фланкируют кассету. В одном из вариантов осуществления регуляторные элементы в каждой гетерологичной экспрессионной кассете отличаются от регуляторных элементов других гетерологичных экспрессионных кассет, что тем самым уменьшает (или устраняет) риск гомологичной рекомбинации в процессе клонирования вируса и при манипулировании в клетках. В одном из вариантов осуществления каждая гетерологичная экспрессионная кассета имеет различные промоторы и/или энхансеры, и/или polyA последовательности. Однако в других вариантах осуществления гетерологичная экспрессионная кассета в поливалентном векторе по настоящему изобретению может иметь один или несколько одинаковых регуляторных элементов с другой гетерологичной экспрессионной кассетой, находящейся в поливалентном векторе. В таком варианте осуществления регуляторный элемент, предпочтительно, представляет собой короткую последовательность, в которой не возможна рекомбинация.
Согласно настоящему описанию кодируемый продукт может быть мишенью для иммунной системы и стимулировать гуморальный и/или клеточный иммунный ответ, может быть адьювантом для другого кодируемого продукта, может оказывать эффект иммуномодуляции и/или терапевтический эффект. Согласно настоящему изобретению с помощью поливалентного вирусного вектора можно доставлять комбинацию таких продуктов.
Термин "функционально делетированный" или "функциональная делеция" означает, что достаточная часть гена удалена или иным образом повреждена, например мутацией или модификацией, так что часть гена больше не способна продуцировать функциональные продукты генной экспрессии. Если желательно, может быть удален весь ген. В настоящем документе описаны и другие подходящие участки повреждения или удаления гена.
I. ПОЛИВАЛЕНТНАЯ ВИРУСНАЯ КОНСТРУКЦИЯ
А. МОЛЕКУЛА ДНК, НЕСУЩАЯ ВИРУСНЫЙ ГЕНОМ И МНОЖЕСТВЕННЫЕ ГЕНЫ-РЕПОРТЕРЫ
В одном из аспектов настоящее изобретение относится к молекуле ДНК, несущей вирусные последовательности, которые будут упаковываться в поливалентный вирусный вектор. В одном из вариантов осуществления такая молекула ДНК является плазмидой. Тем не менее, может быть выбран другой подходящий генетический элемент, как определено выше. Введение вектора в клетку может осуществляться любыми способами, известными в данной области, или как описано в настоящей заявке, в том числе с помощью трансфекции.
Вирусные последовательности выбраны из такого типа вируса(ов), который желательно использовать в качестве носителя для доставки, и которые обладают достаточным пространством для размещения множественных экспрессионных кассет. Такие вирусные последовательности могут быть выбраны из вирусов с капсидным белком, например из аденовирусов или из оболочечных вирусов [например, ретровирусов, таких как вирус кошачьего лейкоза (FeLV), HTLVI и HTLVII], и лентивирусов [например, из вируса иммунодефицита человека (HIV), вируса иммунодефицита обезьяны (SIV), вируса кошачьего иммунодефицита (FIV), вируса инфекционной анемии лошадей и спумавируса], из поксвирусов [например, вируса оспы канареек] и других. Следует учитывать, что специалист в данной области без труда сможет выбрать и другие вирусы.
В одном из вариантов осуществления вирусные последовательности получают из аденовирусов. Соответственно, поливалентная молекула ДНК содержит последовательности нуклеиновых кислот генома аденовируса, который содержит по меньшей мере последовательности, необходимые для упаковки генома вируса в капсид. Обычно поливалентная молекула аденовируса содержит 5'-концевые цис-элементы аденовируса и 3'-концевые цис-элементы аденовируса на внешнем 5'-конце и на 3'-конце генома аденовируса соответственно. На 5'-конце аденовирусного генома содержатся 5'-цис-элементы, необходимые для упаковки и репликации; то есть, 5'-концевые последовательности инвертированного повтора (ITR) (которые действуют в качестве точки начала репликации) и 5'-концевые упаковывающие энхансерные домены (которые содержат последовательности, необходимые для укладки линейных геномов аденовирусов, и энхансерные элементы для E1-промотора). На 3'-конце гена аденовируса находятся 3'-цис-элементы (включая ITR), необходимые для укладки и капсидирования.
Кроме того, поливалентная молекула ДНК может содержать другие последовательности аденовируса или может быть по меньшей мере функционально делетирована в одной или нескольких областях гена аденовируса. В одном из вариантов осуществления аденовирусный вектор, используемый в настоящем изобретении, содержит область Е2 или ее функциональную часть (например, область, кодирующую Е2а и/или E2b) и один или несколько поздних генов, например L1, L2, L3, L4 и L5. В некоторых вариантах осуществления аденовирусные векторы, используемые в настоящем изобретении, могут содержать всю или часть области Е4 (например, ORF6 Е4).
Например, из аденовирусной последовательности, которая образует часть вектора, можно удалить весь или часть запаздывающего раннего гена Е3 аденовируса. Полагают, что функция обезьяньего гена Е3 не имеет отношения к функционированию и продукции рекомбинантных вирусных частиц.
Например, может быть сконструирован аденовирусный вектор с делецией Е1, по меньшей мере с делецией области ORF6 гена Е4, или, из-за избыточности функции этой области, с делецией всей области Е4. Вместе с тем другой вектор по настоящему изобретению содержит делецию в запаздывающем раннем гене Е2а. Соответственно, в этих векторах сохраняют поздние гены (т.е., L1, L2, L3, L4 и L5) и другие элементы, которые являются существенными для укладки аденовирусных векторов в вирусные частицы. Для некоторых целей делецию можно также осуществлять в промежуточных генах IX и IVA2. Делеции можно проводить в других структурных или неструктурных аденовирусных генах. Рассмотренная выше делеция может быть использована самостоятельно, то есть аденовирусная последовательность, используемая в настоящем изобретении, может содержать делецию только в этой одной области. Альтернативно, можно использовать любую комбинацию делеций всего гена или его частей, которая эффективно разрушает их биологическую активность. Например, в одном из примеров вектора в аденовирусной последовательности может быть делеция генов Е1 и гена Е4, или генов Е1, вместе с делецией или без делеций Е3, и тому подобное.
В другом варианте осуществления используют геном лентивируса. Обычно лентивирусная векторная плазмида содержит необходимые для вектора цис-действующие генетические последовательности для инфицирования клетки-мишени и для переноса гетерологичных экспрессионных кассет. Таким образом, удаляют исходные оболочечные белки и промотор для последовательности gag.
Вирусные последовательности в плазмидном каркасе не следует ограничивать последовательностями капсидного или оболочечного типа, в которые они ввведены. Таким образом, плазмидный каркас может содержать вирусные последовательности одного вирусного источника, которые капсидированы или упакованы в оболочку другого источника. Например, поливалентный вектор HIV может быть упакован в оболочку FIV; поливалентный вектор FIV может быть упакован в оболочку HIV; поливалентный аденовирусный вектор может быть упакован в капсид другого серотипа. При этом специалисту в данной области будут очевидны другие псевдотипичные вирусные векторы.
После того как вирусные последовательности клонируют в плазмиду с помощью технологий, известных специалистам в данной области, происходит изменение вирусного генома, и теперь он содержит первую способную к переносу кассету, расположенную в первом делетированном участке вирусного генома, и вторую способную к переносу кассету, расположенную во втором делетированном участке вирусного генома. Плазмида необязательно может содержать большое число способных к переносу кассет, каждая из которых расположена в разных локусах вирусного генома. Каждая способная к переносу кассета фланкирована уникальным набором сайтов рестрикции, что позволяет осуществлять их селективный перенос из плазмиды и быстрое встраивание гетерологичной экспрессионной кассеты.
Все способные к переносу кассеты, используемые в настоящем изобретении, содержат последовательности нуклеиновых кислот детектируемого гена-репортера, функционально связанные с последовательностями, которые регулируют их экспрессию в клетке-хозяине. Соответственно, каждая способная к переносу кассета содержит уникальный ген-репортер, который легко отличим от генов-репортеров других способных к переносу кассет, которые располагаются на плазмидном каркасе. В одном из вариантов осуществления гены-репортеры экспрессируют продукты, которые отличаются друг от друга по цвету.
Подходящие гены-репортеры включают такие продукты кодирования, которые можно отличить от других генов-репортеров, находящихся на поливалентном плазмидном каркасе по настоящему изобретению. Например, флуоресцентные белки различают по цвету после возбуждения их светом с соответствующей длиной волны, и к ним относятся, например, красный флуоресцентный белок, зеленый флуоресцентный белок, синий флуоресцентный белок, голубой флуоресцентный белок, желто-зеленый флуоресцентный белок. Подходящие флуоресцентные белки, которые можно использовать у выбранного типа клеток-хозяев, являются коммерчески доступными, например от компании ClonTech. При этом другие подходящие гены-репортеры, отличающиеся по цвету, включают в себя, например, gusA (синий); DsRed (красный); люциферазу (красный); бета-галактазидазу. Альтернативно, специалист в данной области техники может использовать другой ген-репортер, содержащий метку или таг, большое число которых известно специалистам в данной области.
Подходящие гены-репортеры выбирают в зависимости от системы клетки-хозяина, используемой для клонирования. Саму клетку-хозяин можно выбрать из любых биологических организмов, включая прокариотические клетки (например, бактериальные) и эукариотические клетки, включая клетки насекомых, дрожжевые клетки и клетки млекопитающих, как ниже описано более подробно.
В одном из предпочтительных вариантов осуществления используют прокариотическую систему. Кроме того, клетка-хозяин способна к трансфекции ДНК и к экспрессии трансфектной ДНК, и способна к экспрессии выбранного гена-репортера желательным образом, например колориметрическим способом.
Хорошо известны примеры подходящих прокариотических систем, включая бактериальные клетки. Например, подходящие бактериальные штаммы могут включать в себя, например, Escherichia coli C600-F-, е14, mcrA, thr-1 supE44, thi-1, leuB6, lacY1, tonA21, [[lambda]][-] [Huynh, Young, and Davis (1985) DNA Cloning, Vol.1, 56-110]; DH1-F[-], recA1, endA1, gyrA96, thi-1, hsdR17 (rk[-], mk[+], supE44, relA1, [[lambda]][-] [-Hanahan (1983) J.Mol.Biol. 166, 557-580; XL1Blue-MRF'-D(mcrA)182, D(mcrCB-hsdSMR-mrr)172, endAl, supE44, thi-1, recA, gyrA96, relAl, lac, l-, [F'proAB, lacI[q]ZDM15, Tn10(tet[r])]; SURE Cells [Stratagene]; е14(mcrA), D (mcrCB-hsdSMR-mrr)171, sbcC, recB, recJ, umuC::Tn5 (kan[r]), uvrC, supE44, lac, gyrA96, relA1, thi-1, end A1 [F'proAB, lacI[q]DM15, Tn10(tet[r])]; GM272-F[-], hsdR544 (rk[-], mk[-]), supE44, supF58, lacY1 или [[Delta]]lacIZY6, galK2, galT22, metB1m, trpR55, [[lambda]][-]; HB101-F[-], hsdS20 (rb[-], mb[-]), supE44, ara14, galK2, lacY1, proA2, rpsL20 (str[R]), xyl-5, mtl-1, [[лямбда]][-], recA13, mcrA(+), mcrB(-) [Raleigh and Wilson (1986) Proc. Natl. Acad. Sci. USA 83, 9070-9074]; JM101-supE, thi, [[дельта]](lac-proAB), [F', traD36, proAB, lacIqZ[[Delta]]M15], рестрикция: (rk[+], mk[+]), mcrA+ [Yanisch-Perron et al. (1985) Gene 33, 103-119]; XL-1 blue recA1, endA1, gyrA96, thi, hsdRl7 (rk[+], mk[+]), supE44, relA1, [[lambda]][-], lac, [F', proAB, lacIqZ[[Delta]]M15, Tn10 (tet[R])] [-Bullock, et al. (1987) BioTechniques 5, 376-379]; GM2929 [B.Bachman, Yale E.coli Genetic Stock Center (CSGC#7080)]; штамм M.Marinus; пол F[-]; (ara-14, leuB6, fhuA13, lacY1, tsx-78, supE44, [glnV44], galK2, galT22, 1[-], mcrA, dcm-6, hisG4, [Oc], rftD1, rpsL136, dam-13::Tn9, xyl-5, mtl-1, recF143, thi-1, mcrB, hsdR2); MC1000-(araD139, D[ara-leu]7679, galU, galK, D[lac] 174, rpsL, thi-1); ED8767 (F-, el4-[mcrA], supE44, supF58, hsdS3[rB[-]mB[-]], recA56, galK2, galT22, metBl, lac-3 или lac3Y1. Подходящие прокариотические клетки-хозяева доступны из Американской коллекции типовых культур (American Type Culture Collection), Manassas, VA, US, других общедоступных клеточных депозитариев, а также из различных институтов и коммерческих источников. Выбор подходящей системы клонирования или клеток не ограничивает объем настоящего изобретения.
Каждая способная к переносу кассета, используемая в конструкции по настоящему изобретению, фланкирована уникальным набором сайтов рестрикции крупнощепящих рестриктаз. Каждый набор сайтов рестрикции крупнощепящих рестриктаз имеет первый сайт рестрикции крупнощепящей рестриктазы на 5'-конце кассеты, способной к переносу, и второй сайт рестрикции крупнощепящей рестриктазы на 3'-м конце кассеты, способной к переносу. В одном из вариантов осуществления сайтов рестрикции крупнощепящих рестриктаз обеспечивает направленное клонирование экспрессионных кассет в локус. Однако настоящее изобретение не ограничено направлением вставок. Другими словами, способная к перемещению кассета и/или гетерологичная экспрессионная кассета может располагаться как от 5' к 3', так и от 3' к 5'-конца относительно ориентации рамки считывания прилегающего к ним вирусного генома. Кроме того, в некоторых вариантах осуществления набор сайтов рестрикции крупнощепящих рестриктаз может определить ненаправленное клонирование экспрессионной кассеты в выбранный локус.
В одном из примеров крупнощепящих рестриктаз I-SceI можно выбирать как для 5', так и для 3' сайтов рестрикции крупнощепящих рестриктаз, которые составляют общий набор. Этот фермент обеспечивает направленное клонирование даже при фланкировании обоих концов кассеты. В других вариантах осуществления I-SceI можно использовать в сочетании с другой крупнощепящей рестриктазой с образованием набора сайтов рестрикции крупнощепящих рестриктаз. Соответственно, каждый набор сайтов рестрикции крупнощепящих рестриктаз является уникальным, что обеспечивает расщепление единственного локуса и вставку гетерологичной экспрессионной кассеты в выбранный сайт-мишень.
В другом варианте осуществления крупнощепящую рестриктазу выбирают так, чтобы произошло расщепление только выбранного локуса (локусов) в вирусном геноме, то есть расщепление происходит только на 5' и на 3'-концах способной к переносу кассеты и/или гетерологичной экспрессионной кассеты, и чтобы ни один генетический элемент, несущий вирусный геном, или другие положения в вирусном геноме, расщеплены не были.
В настоящей заявке такую рестриктазу называют крупнощепящей рестриктазой. Примеры таких крупнощепящих рестриктаз включают рестриктазы, имеющие сайты распознавания из семи, восьми или большего числа оснований, включая, например, I-Ceu I, PI-See I, TevII, BmoI, DmoI, FseI, PacT, PmeI, PsrI, BcgI, BglI, BsabI, BstXI, DrdI, EcoNI, FseI, MaM I, Msl I, Mwo I, Psha I, Sfi I, Swa I, Xcm I, а также Xmn I и тому подобные. Подходящие рестриктазы можно идентифицировать с помощью информации, доступной специалистам в данной области из литературных источников и из различных интерактивных баз данных, например из базы данных REBASE™. Рестриктазы, подходящие для способа по настоящему изобретению, можно легко определить с помощью различных компьютерных программ и/или интерактивных баз данных. Подходящие рестриктазы доступны из различных коммерческих источников, включая, например, наряду с другими, England Biolabs, Obiogene, Lift Technology, Roche, BB Clontech, Stratagene, Amersham Pharmacia.
Таким образом, поливалентная плазмида по настоящему изобретению содержит по меньшей мере две способные к переносу кассеты, каждая из которых фланкирована уникальным набором сайтов рестрикции крупнощепящих рестриктаз, что обеспечивает селективную замену способных к переносу кассет на гетерологичную экспрессионную кассету. Такие поливалентные плазмиды трансфецируют в клетки-хозяева, что обеспечивает экспрессию маркерных генов, способных к переносу кассет.
В. ПОЛИВАЛЕНТНЫЙ ВЕКТОР ПЕРЕНОСА, НЕСУЩИЙ ГЕТЕРОЛОГИЧНУЮ ЭКСПРЕССИОННУЮ КАССЕТУ
После выбора соответствующей рестриктазы(рестриктаз) используют общепринятые методики расщепления и лигирования. Обычно плазмидную ДНК смешивают с рестриктазой(рестриктазами) и инкубируют в течение примерно от 12 до около 48 часов. После этого проводят обычную стадию экстракции фенолом/хлороформом. Например, можно использовать экстракцию фенолом/хлороформом, а затем преципитацию этанолом и растворение преципитата (например, в ТЕ (трис-ЭДТА) или другом подходящем буфере) для использования на оставшихся этапах способа. Например, см. руководство Sambrook, Molecular Cloning: A Laboratory Manual, 2nd Ed., 5.28-5.32, Appendix E.3-E.4 (Cold Spring Harbor Press, Cold Spring Harbor, New York, 1989). Другие подходящие способы могут быть предложены производителем или поставщиком используемой рестриктазы или могут быть известны специалистам в данной области из других источников.
Обычно для того чтобы обеспечить надлежащую вставку гетерологичной экспрессионной кассеты, гетерологичную экспрессионную кассету фланкируют на 5' и 3'-конце сайтами рестрикции, комплиментарными набору сайтов рестрикции, которые фланкируют способную к переносу кассету на сайте, в который вводят кассеты экспрессии.
Таким образом, обычно первую гетерологичную кассету экспрессии клонируют в сайт отрезанной способной к переносу кассеты. Предпочтительно, способ по настоящему изобретению позволяет быстро идентифицировать плазмиды, содержащие первую гетерологичную экспрессионную кассету. Такие плазмиды не экспрессируют продукт первого маркерного гена, но экспрессируют продукт второго маркерного гена (а также любой продукт другого присутствующего маркерного гена). Другими словами, если первая способная к переносу кассета экспрессирует зеленый флуоресцентный белок, то отсутствие зеленого цвета после расщепления и лигирования будет указывать на успешное удаление способной к переносу кассеты в сайте первого маркерного гена.
В одном из вариантов осуществления этапы расщепления и лигирования последовательно повторяют для каждой способной к переносу кассеты. Другими словами, для того чтобы ввести экспрессионную кассету в желательный локус, осуществляют первый этап расщепления, используя первый набор рестриктаз для удаления одной способной к переносу кассеты. После этого осуществляют второй этап расщепления, используя второй набор рестриктаз, являющийся уникальным для набора сайтов, фланкирующих вторую способную к переносу кассету. Вторая гетерологичная экспрессионная кассета, фланкированная сайтами рестрикции, соответствующими набору сайтов, фланкирующему вторую способную к переносу кассету, лигирована в каркас плазмиды, и выбирают клоны, которые не экспрессируют второй маркерный ген. Необязательно, осуществляют один или несколько дополнительных этапов расщепления для удаления одной или нескольких других способных к переносу кассет.
Таким образом, способ по настоящему изобретению позволяет эффективно получать поливалентный вектор переноса, который может использоваться для получения инфекционных вирусных частиц.
II. СПОСОБ ПОЛУЧЕНИЯ ПОЛИВАЛЕНТНОГО ВИРУСНОГО ВЕКТОРА
Для получения вирусных частиц с капсидом или оболочкой можно использовать поливалентный вектор переноса по настоящему изобретению, используя способы, известные специалистам в данной области. Такие способы включают хорошо известные способы клонирования кДНК, например способы, описанные в литературе [цитированном выше Sambrook et al.], использование перекрывающихся олигонуклеотидных последовательностей генома аденовируса, полимеразную цепную реакцию и любой подходящий способ, с помощью которого можно получить желательную нуклеотидную последовательность. Используют стандартную трансфекцию и методики одновременной трансфекции, например технологии преципитации CaPO4. Другие используемые известные способы включают гомологичную рекомбинацию вирусных геномов, плакирование вирусов на агаровое покрытие, способы измерения генерации сигнала и тому подобное.
Специалисту в данной области не составит труда подобрать подходящие клеточные линии продуценты. Например, подходящая клетка-хозяин может быть выбрана из любого биологического организма, включая прокариотические клетки (например, бактериальные) и эукариотические клетки, включая клетки насекомых, дрожжевые клетки и клетки млекопитающих. Клетки-хозяева могут быть выбраны из клеток любых видов млекопитающих, включая, но ими не ограничиваясь, такие как А549, WEHI, 3Т3, 10Т1/2, клетки НЕК 293 или PERC6 (каждый тип клеток экспрессирует функциональный Е1 аденовируса) [Fallaux, FJ et al (1998), Hum Gene Ther, 9: 1909-1917], Saos, C2C12, L-клетки, HT1080, HepG2 и первичные фибробласты, гепатоциты и миобластические клетки, полученные у млекопитающих, включая человека, обезьяну, мышь, крысу, кролика и хомяка. Объем настоящего изобретения не ограничен выбором вида млекопитающего, у которого получают клетки; а также не ограничен типом клеток млекопитающих, то есть фибробласт, гепатоцит, опухолевая клетка и тому подобное.
Как правило, при доставке поливалентного вектора переноса, содержащего гетерологичную экспрессионную кассету в клетку-хозяин, каркас берут в количестве от около 5 мкг до около 100 мкг ДНК, или от около 10 до около 50 мкг ДНК, от около 1×104 клеток до около 1×1013 клеток, или около 105 клеток. Однако можно регулировать количество плазмидной ДНК для клетки-хозяина, учитывая такие факторы, как выбранный вектор, способ доставки и выбранные клетки-хозяева.
Обычно поливалентные векторы переноса культивируют в клетках-хозяевах, которые экспрессируют капсидный белок и/или оболочечный белок. В клетках-хозяевах поливалентных вирусов геномы, экспрессирующие гетерологичную экспрессионную кассету, высвобождаются и упаковываются в капсидный белок или оболочечный белок с образованием инфекционной вирусной частицы.
А. Вирусные векторы с капсидными белками
В одном из вариантов осуществления настоящее изобретение относится к способу укладки поливалентного вирусного генома в инфекционный вирусный капсид.
В одном из вариантов осуществления вирусный капсид получают из аденовируса. Аденовирусная частица или вектор по настоящему изобретению состоит из инфекционного белкового капсида аденовируса, в который упакован поливалентный вирусный геном, содержащий две или более гетерологичных экспрессионных кассет, и каждая из этих кассет несет продукт, экспрессирующийся в клетке-хозяине. В другом варианте осуществления такие аденовирусные векторы дефектны по репликации и, таким образом, не реплицируются в клетке-хозяине.
Выбор серотипа аденовирусных последовательностей, присутствующих в векторе, не ограничивает объем настоящего изобретения. Различные аденовирусные штаммы являются доступными из American Type Culture Collection, Manassas, Virginia, или доступны по запросу из различных коммерческих источников и институтов. Кроме того, последовательности многих таких штаммов доступны из различных баз данных, включая, например, PubMed™ и GenBank™. Гомологичные аденовирусные векторы, полученные из аденовирусов обезьян или человека, описаны в опубликованной литературе [например, см. патент США 5240846]. Последовательности ДНК ряда аденовирусных типов, включая тип Ad5 [GenBank™ Accession No. M73260], доступны из GenBank. Аденовирусные последовательности могут быть получены из любого известного аденовирусного серотипа, например такого, как серотипы 2, 3, 4, 7, 12 и 40, и, дополнительно, из любого идентифицированного в настоящее время человеческого типа. Также в векторных конструкциях по настоящему изобретению можно использовать сходные аденовирусы, способные инфицировать животных нечеловеческого происхождения (например, обезьян). В одном из вариантов осуществления по меньшей мере один аденовирус, используемый в настоящем изобретении, получают у примата нечеловеческого происхождения. Примеры подходящих последовательностей примата нечеловеческого происхождения включают аденовирусы обезьян, такие как Pan5 (также С5), Pan6 (также С6), Pan7 (также С7), Pan9 (также С68) и С1. Описаны рекомбинантные аденовирусы для доставки молекул в клетки-хозяева. См. патент США 6083716, в котором описаны аденовирусные векторы, полученные из двух аденовирусов шимпанзе, С1 и С68 (также называемые Pan9), и международную патентную публикацию WO 02/33645 [векторы, полученные из Pan5, Pan6, Pan7]. Однако объем изобретения ими не ограничен.
Различные способы получения аденовирусных частиц хорошо известны специалистам в данной области. Выбор подходящих способов получения не ограничивает объем настоящего изобретения. См., например, патент США 6083716; международную патентную публикацию WO 02/33645; патентную заявку США 10/465302 и ее международную часть WO 2005/001103.
Кратко, поливалентный аденовирусный вектор переноса по настоящему изобретению, который не способен экспрессировать функциональный вариант любого важного генного продукта аденовируса (например, E1a, E1b, Е2а, E2b, и/или Е4 ORF6), можно культивировать в присутствии недостающих генных продуктов аденовируса, необходимых для вирусного инфицирования и размножения аденовирусной частицы. Эти вспомогательные функции можно обеспечивать путем культивирования каркаса в присутствии одной или нескольких хелперных конструкций (например, плазмиды или вируса) или упаковывающей клетки-хозяина. См., например, методики, описанные для получения "минимального" аденовирусного вектора человека в международной патентной публикации WO 96/13597, опубл. 9 мая 1996 года.
1. Хелперные вирусы
Таким образом, в зависимости от состава генов аденовируса в поливалентном векторе переноса, используемом в качестве носителя экспрессионных кассет, может быть необходим вспомогательный аденовирус или нереплицирующийся вирусный фрагмент для предоставления достаточных генных последовательностей аденовируса, необходимых для получения инфективной рекомбинантной вирусной частицы, содержащей кассету экспрессии. Хелперные вирусы, которые могут быть использованы, содержат выбранные генные последовательности аденовируса, отсутствующие в аденовирусной векторной конструкции и/или не экспрессирующиеся упаковывающей клеточной линией, в которую она трансфицирована. В одном из вариантов осуществления хелперный вирус дефектен по репликации и содержит различные гены аденовируса, кроме вышеописанных последовательностей. Такой хелперный вирус по желанию используется в сочетании с E1-экспрессирующей клеточной линией.
Хелперные вирусы могут быть также сформированы в поликатионные коньюгаты, как описано Wu et al, J. Biol Chem., 264: 16985-16987 (1989); К.J.Fisher and J.M.Wilson, Biochem. J., 299:49 (April 1, 1994). Хелперный вирус может необязательно содержать вторую репортерную экспрессионную кассету. В данной области известно большое число таких генов-репортеров. Наличие гена-репортера на хелперном вирусе, который отличается от генного продукта аденовирусного вектора, позволяет независимо контролировать как каркас аденовирусного вектора, так и хелперный вирус. Такой второй репортер используют для разделения получаемого рекомбинантного вируса и хелперного вируса при очистке.
2. Комплементационная клеточная линия
Для получения рекомбинантных аденовирусов, делетированных по любому из вышеописанных генов, функция делетированной области гена, если она важна для репликации и инфицирования вируса, должна быть восстановлена с помощью хелперного вируса или клегочной линии, то есть комплементационной клеточной линией или упаковывающей линией клеток. Во многих случаях можно использовать клеточную линию, экспрессирующую Е1 человека, для транс-комплементирования аденовирусного вектора шимпанзе. Это дает определенное преимущество, так как из-за различий между последовательностями аденовируса шимпанзе по настоящему изобретению и аденовирусными последовательностями Е1 человека, обнаруживаемыми в доступных в настоящее время упаковывающих клетках, использование E1-содержащих клеток настоящего человека по изобретению предотвращает образование способных к репликации аденовирусов в процессе репликации и продуцирования. Однако в некоторых случаях желательно использовать клеточную линию, которая экспрессирует генный продукт Е1 для получения делетированного по Е1 аденовируса обезьян. Такие клеточные линии описаны, например, см. в патенте США 6083716.
Если желательно, можно использовать описанные в настоящем описании последовательности для получения упаковывающей линии клеток или линии клеток, которая экспрессирует по меньшей мере E1-ген аденовируса под контролем промотора транскрипции для экспрессии выбранной линии клеток-предшественников. Для этой цели можно использовать индуцируемые или конститутивные промоторы. Примеры таких промоторов подробно описаны в настоящем описании. Клетку-предшественник выбирают для получения новой клеточной линии, экспрессирующей любой желательный ген аденовируса. Не ограничивая объем настоящего изобретения, такая предшествующая клеточная линия может, наряду с другими, представлять собой HeLa [АТСС Accession No. CCL 2], A549 [ATCC Accession No. CCL 185], НЕК 293, KB [CCL 17], Detroit [например, Detroit 510, CCL 72] и WI-38 [CCL 75]. Все указанные клеточные линии доступны из Американской коллекции типовых культур, American Type Culture Collection, 10801 University Boulevard, Manassas, Virginia 20110-2209. Другие подходящие предшествующие клеточные линии могут быть получены из других источников.
Такие E1-экспрессирующие клеточные линии являются удобными для получения рекомбинантных аденовирусных E1-делетированных векторов. Кроме того или альтернативно, изобретение относится к клеточным линиям, которые экспрессируют один или более генных продуктов аденовируса обезьян, например E1a, E1b, Е2а и/или Е4 ORF6, которые могут быть сконструированы, используя по существу те же методики, используемые для получения рекомбинантных вирусных векторов обезьян. Такие клеточные линии можно использовать для транс-комплементных аденовирусных векторов, делегированных по основным генам, которые кодируют эти продукты. Получение клетки-хозяина по настоящему изобретению включает методики, такие как сборка выбранных последовательностей ДНК. Такую сборку можно осуществлять с помощью обычных методик. Такие методики включают клонирование кДНК и геномное клонирование, которые хорошо известны и описаны в цитированных выше документах Sambrook et al., использование перекрывающихся олигонуклеотидных последовательностей аденовирусных геномов, в сочетании с полимеразной цепной реакцией, способами синтеза и любыми другими подходящими способами, которые обеспечивают желательную нуклеотидную последовательность.
Еще в одном альтернативном варианте основные генные продукты аденовируса получают транс-способом с помощью вектора и/или хелперного вируса. В этом случае подходящую клетку-хозяин можно выбрать из любых биологических организмов, включая прокариотические (например, бактериальные) и эукариотические клетки, включая клетки насекомых, дрожжевые клетки и клетки млекопитающих. Подходящие клетки-хозяева включают в себя клетки, известные специалисту в данной области, а также клетки, описанные в настоящем изобретении.
3. Сборка вирусной частицы и трансфекция клеточной линии
Один или более отсутствующих аденовирусных генов могут быть стабильно интегрированы в геном клетки-хозяина, стабильно экспрессироваться в виде эписом, или временно экспрессироваться. Все генные продукты могут временно экспрессироваться, экспрессироваться в виде эписомы или стабильно интегрироваться, или некоторые из генных продуктов могут стабильно экспрессироваться, а другие экспрессироваться временно.
Кроме того, для каждого аденовирусного гена можно выбрать промотор, независимо от конститутивного промотора, индуцируемого промотора или нативного аденовирусного промотора. Промоторы могут быть регулируемыми промоторами, например специфическим физиологическим состоянием организма или клетки (то есть статусом дифференциации или в реплицирующихся или в покоящихся клетках) или экзогенно-вводимыми факторами. Также можно осуществлять введение молекул (в виде плазмид или вирусов) в клетку-хозяин, используя методики, известные специалистам в данной области техники, и как описано в настоящем описании. В одном из вариантов осуществления используют технологии прямого клонирования. Такие технологии описаны [G.Gao et al., Gene Ther. 2003 Oct; 10 (22): 1926-1930; в опубл. патенте США 2003-0092161-А, 15 мая 2003 года; в международной патентной заявке PCT/US03/12405]. В другом варианте осуществления используют стандартные технологии трансфекции, напри