Метод отверждения радиоактивных и других видов опасных отходов
Иллюстрации
Показать всеИзобретение относится к области охраны окружающей среды от радиоактивного и прочих видов загрязнения и предназначено для использования в технологии обезвреживания радиоактивных отходов и других видов опасных отходов, а также для локализации выбросов различного рода отходов. Метод отверждения радиоактивных отходов и других опасных отходов включает нагрев, насыщение раствором до достижения требуемой степени заполнения, связывание и фиксацию радионуклидов или других опасных отходов внутри блока. Блок изготавливают из кристаллогидратов искусственных минеральных солей путем заливки расплава кристаллогидратов в форму с предварительно размещенными в ней жидкими отходами. Расплав охлаждают до образования твердых кристаллогидратов с получением твердого блока. Изобретение направлено на снижение энергоемкости и трудоемкости работ, а также повышение безопасности проведения работ по перемещению, погрузке и хранению отвержденных отходов. 53 з.п. ф-лы, 5 ил., 1 табл.
Реферат
Изобретение относится к области охраны окружающей среды от радиоактивного и прочих видов загрязнения и может быть использовано в технологии обезвреживания радиоактивных отходов и других видов опасных отходов, а также для локализации выбросов различного рода отходов.
Известен способ отверждения жидких радиоактивных отходов (ЖРО) (патент РФ №2291504, G21F 9/16, G21F 9/04, G21F 9/20, опубл. 2007.01.10, бюл. №21). Способ отверждения ЖРО включает их распылительную сушку и кальцинацию, остекловывание кальцината с флюсующими добавками, слив расплава в емкость и отжиг затвердевшего блока. Предварительно ЖРО в непрерывном потоке нагревают до превращения в пар 30-80 отн.% содержащейся в них воды, полученную парожидкостную смесь под давлением собственного пара распыляют в разогретой до температуры 600-800°С камере. Твердые частицы образовавшегося кальцината отделяют от парогазовой фазы седиментацией при температуре не ниже 300°С и фильтрацией. Недостатками данного способа являются сложность и высокая энергоемкость процесса.
Известен способ отверждения жидких радиоактивных отходов (патент РФ №2197763, G21F 9/16, опубл. 2003.01.27). Сущность изобретения: способ отверждения жидких радиоактивных отходов включает многократную пропитку пористого керамического материала раствором радиоактивных отходов с промежуточным вентилированием и сушкой материала воздухом или перегретым паром. Затем керамический материал обрабатывают раствором осадителей и проводят высокотемпературную обработку при 1350-1500°С. Керамический материал для отверждения жидких радиоактивных отходов выполняют в виде колец Рашига, цилиндров или шаров из тонкодисперсных оксидов с размером частиц не более 20 мкм. Керамический материал включает подвергнутые прессованию и термической обработке при температуре не ниже 900°С оксиды алюминия, кремния, кальция, бария при следующем соотношении компонентов, мас.%: оксид алюминия 50-70; оксид кремния 23-35; оксид кальция 3-7; оксид бария 2-10.
Недостатками данного способа являются сложность и высокая энергоемкость процесса.
Известен метод отверждения жидких радиоактивных отходов (патент РФ №2190890, G21F 9/16, опубл. 2002.10.10). Сущность изобретения: для отверждения жидких радиоактивных отходов используют пористые стеклокристаллические блоки, которые формируют из полых стеклокристаллических микросфер, выделенных из летучих зол от сжигания каменных углей. Блок функционирует как губка и характеризуется высоким значением открытой пористости, однородной пористой структурой, размерами открытых межглобулярных пор в интервале 20-100 мкм, термической стабильностью и высокой устойчивостью в большинстве кислот. Кроме того, на внутреннюю поверхность блока наносят оксид металла. Способ отверждения радиоактивных отходов в пористых керамических блоках протекает за счет осуществления следующих процессов: поглощение растворов в объеме блока, испарение воды при низких температурах, статический нагрев в обычной печи, поворотное насыщение раствором для достижения требуемой степени заполнения, связывание радионуклидов введенными в объем блока устойчивыми оксидами высокой поверхности, полное разложение солей непосредственно во внутреннем перовом пространстве блока, надежная фиксация радионуклидов и других опасных отходов внутри блока путем кальцинации насыщенной стеклокристаллической матрицы, обработка блока при высоких температурах и высоких давлениях и капсулирование блока в стеклянную или керамическую оболочку.
Недостатками данного способа являются сложность и высокая энергоемкость процесса.
Техническим результатом изобретения является упрощение операций способа и снижение затрат энергии.
Технический результат достигается тем, что в методе отверждения радиоактивных и других видов опасных отходов, включающем нагрев, насыщение раствором до достижения требуемой степени заполнения, связывание и фиксацию радионуклидов или других опасных отходов внутри блока, согласно изобретению блок изготавливают из кристаллогидратов искусственных минеральных солей путем заливки расплава кристаллогидратов в форму с предварительно размещенными в ней жидкими отходами, после чего расплав охлаждают до образования твердых кристаллогидратов с получением твердого блока.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют тетраборат натрия Na2B4O4·10H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют ацетат натрия NaC2H3O2·3H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют карбонат натрия Na2CO3·10H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют метасиликат натрия Na2SiO3·9H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют сульфид натрия Na2S·9H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют сульфит натрия Na2SO3·7H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют хромат натрия Na2CrO4·10H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют нитрат меди Cu(NO3)2·6H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют сульфат меди CuSO4·5H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют хлорид магния MgCl2·6H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют нитрат кальция Ca(NO3)2·4H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют хлорид кальция CaCl2·6H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют нитрат цинка Zn(NO3)2·6H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют сульфат цинка ZnSO4·7H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют сульфат цинка ZnSO4·6H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют сульфат алюминия Al2(SO4)3·18H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют нитрат марганца Mn(NO3)2·6H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют сульфат железа (закисного) FeSO4·7H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют нитрат кобальта Co(NO3)2·6H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют нитрат никеля Ni(NO3)2·6H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют нитрат лития LiNO3·3H2O.
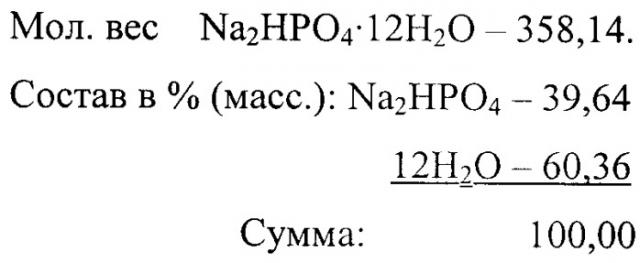
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют фосфат натрия двузамещенный Na2HPO4·12H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют тиосульфат натрия (гипосульфит) Na2S2O3·5H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют сульфат натрия (мирабилит) Na2SO4·10H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют нитрат магния Mg(NO3)2·6H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют сульфат магния MgSO4·7H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы алюмонатриевые Na2SO4 Al2(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы алюмокалиевые K2SO4 Al2(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы алюморубидиевые Rb2SO4 Al2(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы алюмоцезиевые Cs2SO4 Al2(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы алюмоталливые Tl2SO4 Al2(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы алюмоаммонийные (NH4)2SO4 Al2(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы алюможелезные FeSO4 Al2(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы хромонатриевые Na2SO4 Cr2(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы хромокалиевые K2SO4 Cr2(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы хромоворубидиевые Pb2SO4 Cr2(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы хромовоцезиевые Cs2SO4 Cr2(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы хромовоталлиевые Tl2SO4 Cr2(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы хромовоаммонийные (NH4)2SO4 Cr2(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы марганцевые K2SO4 Mn(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы марганцевые Rb2SO4 Mn(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы марганцевые Cs2SO4 Mn(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы марганцевые (NH4)2SO4 Mn(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы железокалиевые K2SO4 Fe2(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы железорубидиевые Rb2SO4 Fe2(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы железоцезиевые Cs2SO4 Fe2(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы железоцинковые ZnSO4 Fe2(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы железомагниевые MgSO4 Fe2(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы железоталлиевые Tl2SO4 Fe2(SO4)3·24H2O.
Технический результат достигается также тем, что в качестве кристаллогидратов искусственных минеральных солей используют квасцы железоаммонийные (NH4)2SO4 Fe2(SO4)3·24H2O.
Технический результат достигается также тем, что в блоке создают каналы для циркуляции хладагента.
Технический результат достигается также тем, что кристаллогидраты искусственных минеральных солей заливают послойно.
Технический результат достигается также тем, что используют смесь кристаллогидратов искусственных минеральных солей.
Применение предлагаемого изобретения по сравнению с прототипом позволяет упростить операции способа и снизить энергетические затраты за счет снижение температуры.
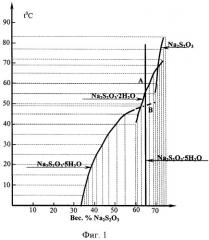
Метод отверждения радиоактивных и других видов опасных отходов поясняется схемами, где на фиг.1 показаны фазовые изменения системы Na2S2O3·H2O при повышении температуры; на фиг.2 показаны фазовые изменения системы Na2HPO4·H2O
при повышении температуры; на фиг.3 показаны фазовые изменения системы Na2SO4·H2O при повышении температуры; на фиг.4 показаны фазовые изменения системы Mg(NO3)2·H2O при повышении температуры; на фиг.5 показаны фазовые изменения системы LiNO3·H2O при повышении температуры.
В качестве материала блоков используются искусственные минеральные соли, обладающие фазовыми превращениями (твердое-жидкое) в интервале температур 20-122°С. В результате проведенной работы найден класс соединений (фосфаты, бораты, силикаты, сульфаты, нитраты), позволяющий использовать их тепловые и физико-химические свойства для быстрой и многократно воспроизводимой изоляции жидких и твердых отходов (таблица).
| Кристалогидраты неорганических солей | ||
| Наименование кристаллогидрата | Химическая формула | t плавления, °С |
| 1. Тетраборат натрия (бура) | Na2B4O7·10H2O | 75 |
| 2. Ацетат натрия | NaC2H3O2·3H2O | 58.5 |
| 3. Карбонат натрия (сода) | Na2CO3·10H2O | 32 |
| 4. Метасиликат натрия | Na2SiO3·9H2O | 47 |
| 5. Сульфид натрия | Na2S·9H2O | 49 |
| 6. Сульфит натрия | Na2SO3·7H2O | 33.4 |
| 7. Хромат натрия | Na2CrO4·10H2O | 23-30 |
| 8. Нитрат меди | Cu(NO3)2·6H2O | 26.4 |
| 9. Сульфат меди | CuSO4·5H2O | 96.110 |
| 10. Хлорид магния (бишофит) | MgCl2·6H2O | 118.7 |
| 11. Нитрат кальция | Ca(NO3)2·4H2O | 42.6 |
| 12. Хлорид кальция | CaCl2·6H2O | 30.2 |
| 13. Нитрат цинка | Zn(NO3)2·6H2O | 36.1 |
| 14. Сульфат цинка | ZnSO4·7H2O | 39 |
| 15. Сульфат цинка | ZnSO4·6H2O | 51.5 |
| 16. Сульфат алюминия | Al2(SO4)3·18H2O | 86.5 |
| 17. Нитрат марганца | Mn(NO3)2·6H2O | 25.8 |
| 18. Сульфат железа (закисного) | FeSO4·7H2O | 64 |
| 19. Нитрат кобальта | Co(NO3)2·6H2O | 57 |
| 20. Нитрат никеля | Ni(NO3)2·6H2O | 56.7 |
| 21. Нитрат лития | LiNO3·3H2O | 30 |
| 22. Фосфат натрия двузамещенный | Na2HPO4·12H2O | 35 |
| 23. Тиосульфат натрия (гипосульфит) | Na2S2O3·5H2O | 48 |
| 24. Сульфат натрия (мирабилит) | Na2SO4·10H2O | 32.4 |
| 25. Нитрат магния | Mg(NO3)2·6H2O | 89.9 |
| 26. Сульфат магния | MgSO4·7H2O | Фазовые переходы |
| 27. Квасцы алюмонатриевые | Na2SO4 Al2(SO4)3·24H2O | 61 |
| 28. Квасцы алюмокалиевые | K2SO4 Al2(SO4)3·24H2O | 92 |
| 29. Квасцы алюморубидиевые | Rb2SO4 Al2(SO4)3·24H2O | 109 |
| 30. Квасцы алюмоцезиевые | Cs2SO4 Al2(SO4)3·24H2O | 122 |
| 31. Квасцы алюмотаталливые | Tl2SO4 Al2(SO4)3·24H2O | 91 |
| 32. Квасцы алюмоаммонийные | (NH4)2SO4Al2(SO4)3·24H2O | 93.5 |
| 33. Квасцы алюможелезные | FeSO4 Al2(SO4)3·24H2O | - |
| 34. Квасцы хромонатриевые | Na2SO4 Cr2(SO4)3·24H2O | При 100 теряют 16 молек. воды |
| 35. Квасцы хромокалиевые | K2SO4 Cr2(SO4)3·24H2O | 89 |
| 36. Квасцы хромоворубидиевые | Pb2SO4 Cr2(SO4)3·24H2O | 107 |
| 37. Квасцы хромовоцезиевые | Cs2SO4 Cr2(SO4)3·24H2O | 116 |
| 38. Квасцы хромовоталлиевые | Tl2SO4 Cr2(SO4)3·24H2O | 92 |
| 39. Квасцы хромовоаммонийные | (NH4)2SO4 Cr2(SO4)3·24H2O | 94+-1 |
| 40. Квасцы марганцевые | K2SO4 Mn(SO4)3·24H2O | - |
| 41. Квасцы марганцевые | Rb2SO4 Mn(SO4)3·24H2O | 20 |
| 42. Квасцы марганцевые | Cs2SO4 Mn(SO4)3 24H2O | 40 |
| 43. Квасцы марганцевые | (NH4)2SO4 Mn(SO4)3·24H2O | Низкая температура |
| 44. Квасцы железокалиевые | K2SO4 Fe2(SO4)3·24H2O | 33 |
| 45. Квасцы железорубидиевые | Rb2SO4 Fe2(SO4)3·24H2O | 53 |
| 46. Квасцы железоцезиевые | Cs2SO4 Fe2(SO4)3·24H2O | 71 |
| 47. Квасцы железоцинковые | ZnSO4 Fe2(SO4)3·24H2O | - |
| 48. Квасцы железомагниевые | MgSO4 Fe2(SO4)3·24H2O | - |
| 49. Квасцы железоталлиевые | Tl2SO4 Fe2(SO4)3·24H2O | 37 |
| 50. Квасцы железоаммонийные | (NH4)2SO4 Fe2(SO4)3·24H2O | 40 |
Метод отверждения радиоактивных и других видов опасных отходов осуществляют следующим образом. Сущность технологии изоляции твердых отходов заключается в том, что используемые химические соединения (одно или несколько) нагреваются до температуры их плавления и далее заливаются в форму, в которой предварительно размещены твердые отходы либо залиты жидкие отходы. Объем отходов определяют опытным, аналитическим или экспериментально-аналитическим путем с учетом насыщения раствором до требуемой степени заполнения.
При охлаждении весь объем расплава превращается в прочный соляной блок. При необходимости возможна выемка блока из формы благодаря вторичному частичному плавлению в контактном слое. Минеральная соль, используемая в качестве наполнителя матрицы, подбирается таким образом, чтобы температура ее плавления превышала температуру изолируемого источника тепла (например, радиоактивных отходов).
Приведенный класс неорганических соединений (таблица) способных образовывать кристаллогидраты, может быть использован для перевода жидких радиоактивных отходов и других опасных отходов в твердое состояние в виде искусственных соляных блоков.
При этом безводные минеральные соли поглощают по весу от 50 и более процентов жидких отходов с образованием кристаллогидратов.
Литье блоков из кристаллогидратов заключается в заполнении формы жидким расплавом или полурасплавленной пульпой данного кристаллогидрата из искусственных минеральных солей.
Литье кристаллогидратов искусственных минеральных солей особенно упрощается в случае стабильного (при некотором перегреве) плавления кристаллогидрата в собственной кристаллизационной воде, то есть при образовании расплава того же состава, что и твердый кристаллогидрат (без выделения низшего кристаллогидрата или безводной соли). При охлаждении весь объем расплава превращается обратно в твердый кристаллогидрат (агрегат кристаллов) без осложнения, которое может возникать при обратной гидратации низшего кристаллогидрата или безводной формы.
Случай полурасплавленной массы кристаллогидрата указанного свойства не вносит осложнений, так как после заполнения формы текучей массой пульпы обратная картина образования кристаллогидрата подобна заключительной стадии отвердевания истинного расплава: отвердевание происходит в межкристаллических порах, состав межкристального расплава идентичен составу твердых кристаллов.
Форма, в которую заливают расплав кристаллогидрата, может быть разборной или иметь рубашку, или каналы для циркуляции охлаждающей воды (хладагента) на стадии отвердевания или пара, на стадии выемки блока из формы. Форма может иметь систему трубчатых вставок для создания системы каналов в отвердевшем блоке.
Выемка блока из формы при подогреве осуществляется благодаря вторичному частичному плавлению кристаллогидрата в тонком контактном слое на границе форма/блок.
Физико-химическое обоснование технологии литья блоков и примеры реализации предлагаемого способа.
Температурно-фазовые превращения ряда кристаллогидратов можно проиллюстрировать несколькими примерами.
Пример 1. Литье блоков из Na2S2O3·5H2O (фиг.1).
При установившемся процессе в раствор состава точки А при 60°С (являющийся ненасыщенным, но по составу отвечающим формуле пентагидрата: 63,7% Na2S2O3+36.3% H2O) вносится твердый Na2S2O3·5H2O. Соответствующая подача тепла должна обеспечит плавление пентагидрата при размешивании смеси и поддержании температуры на уровне 60°С.
После подачи в форму необходимой дозы перегретого до 60°С расплава и ускоренного охлаждения ее практически произойдет затвердевание расплава в агрегат кристаллов пентагидрата, что отображается точкой В, являющейся метастабильной точкой плавления пентагидрата. Появление кристаллов бигидрата без специального внесения затравки маловероятно.
Пример 2. Литье блоков из Na2HPO4·12H2O (фиг.2).
Во всем аналогично примеру с литьем блоков из Na2S2O3·5H2O.
Перегретый расплав при 50°С отображается точкой А. Затвердевание системы в ускоренно охлаждаемой форме начинается при достижении точки В (метастабильная точка плавления кристаллогидрата).
Пример 3. Литье блоков из Na2SO4·10H2O (фиг.3)
При нагревании мирабилита до 32,4°С последующее подведение тепла неизбежно сопровождается легко протекающим разложением его (точка А) на раствор состава точки В и безводный Na2SO4 - тенардит (точка С).
Образующаяся пульпа имеет следующий состав при 32,4°С (вес.%):
| Na2SO4 (кр) | 16,3% |
| Na2SO4+H2O (p) | 83,7% |
| Всего | 100,0% |
Отношение Ж:Т в пульпе равно 83,7:16,3=5,13, такая пульпа легко расслаивается: более плотный тенардит осаждается на дно формы.
Обратное образование однородного мирабилита (точка А) при охлаждении из раствора (В) и кристаллического тенардита (С) практически без перемешивания невозможно, а сам прием перемешивания в данном случае (литье сплошного блока) является неподходящим.
Для получения блока из мирабилита необходимо устранить упомянутое расслаивание, что достигается применением кашеобразной массы для заполнения формы; основным компонентом этой массы (~70%) должен служить готовый кристаллический мирабилит, подогретый до 32,4°С.
Вторым ингредиентом (при 32,4°С) является теплый насыщенный раствор (В), третьим - тонкодисперсный безводный сульфат (С). Последний замешивается перед подачей массы в форму.
Для полного связывания раствора (В) в мирабилит теоретически тенардит должен присутствовать в размере 16,3 вес.% от массы жидкой фазы, а практически - 20% (с некоторым избытком).
Пример 4. Литье блоков из Mg(NO3)2·6H2O (фиг.4)
Как следует из диаграммы, в точке А при 90°С наступает истинное плавление кристаллогидрата. Перегретый его расплав (точка В при 95°С) совершенно стабилен и перед разливкой в формы может храниться практически необходимое время.
По соображениям экономии затрат тепла на плавление и времени на охлаждение форм можно применять полурасплавленную при 90°С массу, обладающую необходимой текучестью.
Смесь Mg(NO3)2·6H2O+Mg(NO3)2·2H2O состава точки С (67,6% Mg(NO3)2) плавится при более низкой температуре 54°С, расплав устойчив при перегреве до 60°С. Будучи разлит по формам, закристаллизуется нацело при охлаждении ниже 54°С в смесь кристаллогидратов Mg(NO3)2·6H2O+Mg(NO3)2·2H2O состава точки С (67,6% Mg(NO3)2+32,4% H2O).
Пример 5. Литье блоков из LiNO3·3H2O (фиг.5).
При температуре 30°С (точка А) тригидрат плавится конгруэнтно, образуя расплав того же состава, что и твердый кристаллогидрат.
Перегретый до 35°С расплав (точка В) устойчив для хранения до момента заполнения форм.
Пример 6. Эпсомит MgSO4·7H2O
При температуре выше 70°С эпсомит должен превратиться в пульпу кизерита MgSO4·H2O, Т:Ж примерно 1:3.
При быстром нагревании, однако, вероятен метастабильный переход эпсомита в тетрагидрат MgSO4·4H2O при температуре около 80°С и образованием малоподвижной пульпы с Т:Ж порядка 1:2.
Пример 7. Тетраборат натрия Na2B4O7·10H2O
Бура - десятиводный тетраборат натрия Na2B4O7·10H2O - встречается как природный минерал и известен издавна. Из всех боратов она больше всего применяется для различных нужд промышленности, науки и в быту.
Растворимость буры довольно незначительна, но при повышении температуры быстро возрастает. В 100 г насыщенного раствора содержится безводной буры при:
| t°С… | 0 | 10 | 20 | 30 | 80 | 100 |
| г Na2B4O7 | 1,23 | 1,58 | 3,75 | 16,7 | 23,9 | 34,3 |
При обезвоживании нагреванием выше 60°С десятиводная бура переходит в пятиводную, выше 90°С получается дигидрат, а выше 130°С - моногидрат. Полное обезвоживание происходит выше 350°С. Интересно отметить, что ни при одном способе обезвоживания не получается тетрагидрат, который встречается в природе как минерал кернит.
Безводная бура плавится при 731°, превращаясь в аморфное стекло. Это аморфное стекло при медленном застывании может закристаллизоваться, причем можно получить три различные модификации, отличающиеся различными точками плавления: модификация А плавится при 710±3°С, В - при 738±4°С и С - при 663±3°С.
Резюмируя краткое рассмотрение вопроса о приготовлении блоков методом литья можно отметить, что наименьшие трудности при практическом освоении этого приема следует ожидать для кристаллогидратов, плавящихся конгруэнтно (без выделения твердой фазы иного состава) стабильно (Mg(NO3)2·6H2O, LiNO3·3H2O) или, при некотором перегреве, метастабильно (Na2HPO4·12H2O, Na2S2O3·5H2O).
Освоение способа литья инконгруэнтно плавящегося мирабилита (Na2SO4·10H2O) связано с отработкой рецепта пульпы и деталей приема охлаждения формы, срока выдерживания в форме и т.п.
Неподходящим материалом для литья (и вообще ускоренных условий плавления) на данной стадии рассмотрения вопроса можно считать эпсомит MgSO4·7H2O и буру Na2B4O7·10H2O, однако в совокупности с другими кристаллогидратами их можно использовать.
Особенности литья блоков из нескольких слоев кристаллогидратов
Пример 8. Литье блоков может быть скомбинировано с последовательным оплавлением ряда кристаллогидратов, путем подбора температурного режима от центра к периферии, а именно, бораты, фосфаты, сульфаты.
Например, при температуре 50°С плавится конгруэнтно Na2HPO4·12H2O с последующим охлаждением в форме. Затем подается в форму необходимая фаза перегретого расплава при 32,4°С сульфата натрия Na2SO4·10H2O. После ускоренного охлаждения произойдет затвердение расплава.
Особенности литья блоков из смеси кристаллогидратов заключаются в следующем.
Наибольший интерес для изоляции отходов различных классов опасности представляют сульфаты, фосфаты и бораты натрия. Потому рассмотрим литье блоков из их смеси.
Пример 9. Литье блоков на основе мирабилита Na2SO4·10H2O
Система Na2SO4-Na2B4O7-H2O
Известно, что мирабилит (Na2SO4·10H2O) плавится в собственной кристаллизационной воде при 32,4°С, а в присутствии Na2B4O7·10H2O при 31,9°С.
Таким образом, при температурах от 31,9° до 49,3°С имеем расплав мирабилита, содержащий в твердой фазе Na2SO4+Na2B4O7·10H2O. Выше 49,3°С происходит частичное плавление буры до пентагидрата (Na2B4O7·10H2O Na2B4O7·5H2O). Суспензия тенардита и пентагидрата фосфата натрия сохраняется и при высоких температурах. При охлаждении суспензии из сульфатов и бората натрия она превращается в соляной блок из кристаллогидратов Na2SO4·10H2O+Na2B4O7·10H2O.
Пример 10. Система Na2SO4 - Na2HPO4 - H2O
Двузамещенный фосфат натрия Na2HPO4·12H2O как и Na2SO4·10H2O плавится в собственной кристаллизационной воде с образованием низших гидратов при температуре более 35°С. При этом, если растворимость двузамещенного фосфата натрия при 0°С равна 1,7 мас.%, то при 100°С составляет 50,6 мас.%
Таким образом, при 100°С двузамещенный фосфат натрия (Na2HPO4·12H2O) полностью превращается в расплав, а в присутствии Na2SO4 получается суспензия сульфата натрия, которая при охлаждении ниже ~32,4°С вновь превращается в соляной блок из Na2SO4·10H2O+Na2HPO4·12H2O.
Пример 11. Литье блоков на основе фосфата натрия Na2HPO4·12H2O.
Система Na2B4O7 - Na2HPO4 - H2O
Как известно, Na2HPO4·12H2O конгруэнтно плавится в соответственной кристаллизационной воде при температуре кипения раствора 106,5°С. В то время как гидрат тетрабората натрия плавится при 58,5°С с образованием тетрагидрата Na2B4O7·4H2O. Однако, учитывая, что растворимость тетрабората натрия при повышении температуры до 100,0°С значительно увеличивается, то в расплаве с фосфатом натрия образуется только незначительная взвесь твердой фазы. Кристаллогидраты Na2B4O7·10H2O и Na2HPO4·12H2O можно смешивать в соотношении 1:1. Расплав смеси кристаллогидрат при охлаждении превращается в прочный соляной блок с небольшим увеличением объема.
Возможны и другие приемы получения крупных блоков из кристаллогидратов.
Пример 12. Особенности литья блоков при отверждении жидких радиоактивных отходов.
Литье блоков с использованием, например, безводного сульфата натрия основано на образовании кристаллогидрата сульфата натрия (Na2SO4·10H2O) при температурах ниже 32,4°С.
таким образом, если взять 44,09 г безводной соли Na2SO4 и добавить 55,91 г воды, то образуется кристаллогидрат Na2SO4·10H2O.
Однако практически не происходит мгновенной реакции образования кристаллогидрата, так как первоначально идет растворение безводной соли в воде, которое сопровождается выделением тепла до 32,4°С, а затем кристаллизация гидрата из пересыщенного раствора.
Для ускорения процесса формирования соляного блока необходимо четырехкратное (практические опыты) увеличение расхода безводной соли на то же самое количество воды.
При этом происходит мгновенная кристаллизация гидрата и получается смесь Na2SO4·10H2O+Na2SO4 безв. Несвязанной воды не будет.
На 1 м3 воды вносится 4 т безводной соли (Na2SO4).
Для придания прочности блоку необходим влажный воздух.
Плотность блока ≈2 г/см3.
Температура плавления 32,38°С.
Плавление инконгруэнтное с образованием безводной соли и ее насыщенного раствора.
Теплота плавления 18873±20 кал/моль. Для уменьшения выветривания соли возможно смачивание блока насыщенным раствором хлорида натрия (образование корки на поверхности). Теплоемкость ~ 60 кал/моль град.
Литье блоков заключается в заполнении формы, содержащей жидкие отходы безводной солью. Данный прием сократит время затвердевания отлитого блока, так как происходит мгновенное образование кристаллогидрата.
Температура реакции 32,4°С. Ниже этой температуры происходит упрочнение соляного камня. Повышение температуры может привести к частичному плавлению кристаллогидрата. Однако последующее охлаждение вновь приводит вновь к образованию кристаллогидрата.
Форма может быть разборной или иметь рубашку для циркуляции охлаждающей воды на стадии отвердевания, и пара, на стадии выемки блока из формы. Форма может иметь вставку для поднятия блока из формы.
Выемка блока из формы при подогреве осуществляется благодаря частичному плавлению кристаллогидрата в тонком контактном слое на границе. Жидкие радиоактивные отходы, превращенные в твердые соляные блоки, могут транспортироваться в контейнерах для последующей закладки в могильники.
Применение данного метода отверждения радиоактивных и других видов опасных отходов обеспечивает следующие преимущества:
- упрощение операций способа;
- снижение энергоемкости операций способа;
- снижение трудоемкости проведения работ;
- повышение безопасности проведения работ по перемещению, погрузке и хранению отвержденных отходов.
1. Метод отверждения радиоактивных и других видов опасных отходов, включающий нагрев, насыщение раствором до достижения требуемой степени заполнения, связывание и фиксацию радионуклидов или других опасных отходов внутри блока, отличающийся тем, что блок изготавливают из кристаллогидратов искусственных минеральных солей путем заливки расплава кристаллогидратов в форму с предварительно размещенными в ней жидкими отходами, после чего расплав охлаждают до образования твердых кристаллогидратов с получением твердого блока.
2. Метод отверждения по п.1, отличающийся тем, что в качестве кристаллогидратов искусственных минеральных солей используют тетраборат натрия Na2B4O7 10Н2О.
3. Метод отверждения по п.1, отличающийся тем, что в качестве кристаллогидратов искусственных минеральных солей используют ацетат натрия NaC2H3O2 3H2O.
4. Метод отверждения по п.1, отличающийся тем, что в качестве кристаллогидратов искусственных минеральных солей используют карбонат натрия Na