Новое применение агонистов печеночного рецептора х
Иллюстрации
Показать всеИзобретение относится к лекарственным средствам и касается применения агониста LXR для изготовления лекарственного средства, полезного для лечения и/или предупреждения диабета типа I и способа повышения жизнеспособности первичных островковых клеток поджелудочной железы ex vivo, при котором приводят в контакт указанные островковые клетки поджелудочной железы с агонистом LXR. Изобретение направлено на расширение арсенала средств для лечения диабета типа I. 2 н. и 11 з.п. ф-лы, 8 ил.
Реферат
Область изобретения
Настоящее изобретение в целом относится к новому терапевтическому применению агонистов печеночного рецептора Х (LXR - от англ. liver X receptor). Более конкретно настоящее изобретение относится к применению агониста LXR для изготовления лекарственного средства, полезного для лечения и/или предупреждения заболевания, обусловленного дегенерацией бета-клеток, такого как диабет, а также к способу повышения жизнеспособности ex vivo островковых клеток поджелудочной железы, при котором приводят в контакт указанные островковые клетки с агонистом LXR.
Предшествующий уровень техники
Диабет, как правило, классифицируют на две основных группы. При диабете типа 1 аутоиммунное разрушение бета-клеток внутри островков Лангерганса приводит к заметному нарушению в продуцировании инсулина. Напротив, диабет типа II характеризуется устойчивостью к инсулину в мышцах, жировой ткани и печени параллельно с относительным ухудшением продуцирования инсулина в бета-клетках. Множественные гены вносят вклад в склонность к обоим типам диабета, типу 1 и типу II, хотя во многих случаях их идентификация остается неизвестной.
Апоптоз представляет собой активный процесс саморазрушения клеток, который регулируется внешними и внутренними сигналами, имеющими место во время нормального развития. Документально хорошо подтверждено, что апоптоз играет ключевую роль в пластичности эндокринных бета-клеток поджелудочной железы. Возрастает количество данных, что у взрослых млекопитающих масса бета-клеток подвергается динамическим изменениям, чтобы адаптировать продуцирование инсулина к поддержанию эугликемии при особых состояниях, таких как беременность и ожирение. Регуляция массы бета-клеток зависит от тонкого равновесия между клеточной пролиферацией, ростом и клеточной гибелью (апоптозом). Нарушение этого баланса может привести к ухудшению гомеостаза глюкозы. Например, примечательно, что непереносимость глюкозы развивается с возрастом, когда скорость репликации бета-клетки снижена, и что у пациентов с инсулиннезависимым сахарным диабетом потеря массы бета-клеток составляет 40-60% по сравнению с субъектами, не являющимися диабетиками. Общепринято, что у субъектов, устойчивых к инсулину, нормогликемия поддерживается за счет компенсаторной гиперинсулинемии до тех пор, пока бета-клетки не становятся неспособными удовлетворять повышенную потребность в инсулине, и в этот момент возникает диабет типа II.
Сахарный диабет типа II, или инсулиннезависимый сахарный диабет (ИНСД), является полигенным заболеванием и составляет >90% случаев диабета. Это заболевание характеризуется устойчивостью к действию инсулина на всасывание глюкозы и нарушенным действием инсулина на ингибирование продуцирования глюкозы печенью.
Регуляция метаболизма глюкозы инсулином является ключевым механизмом, посредством которого поддерживается гомеостаз у животного. Инсулин стимулирует всасывание глюкозы из крови в ткани, в частности в мышечную и жировую. Это происходит за счет повышенного перемещения Glut4, чувствительного к инсулину транспортера глюкозы, от внутриклеточного везикулярного компартмента к плазматической мембране. Glut4 является важнейшим чувствительным к инсулину транспортером глюкозы в этих тканях. Инсулин связывается с его рецептором в плазматической мембране, генерируя серию сигналов, которые приводят к перемещению или движению везикул транспортера Glut4 к плазматической мембране.
Печеночные рецепторы Х (LXR) являются членами надсемейства ядерных рецепторов, которые индуцируют зависимую от лиганда транскрипционную активацию генов-мишеней. Они играют важную роль в метаболизме и гомеостазе холестерина. Известно, что у млекопитающих существует два белка LXR (альфа и бета). Экспрессия LXR альфа является высокой в органах, вовлеченных в гомеостаз липидов, таких как тонкий кишечник, бурая и белая жировая ткань, тогда как LXR бета является более распространенным и обильным в тканях нервного и эндокринного происхождения. Недавно обнаружено, что LXR альфа и бета экспрессируются в островках поджелудочной железы, а также в альфа-клетках и бета-клетках (Efanov et al, Diabetes, 53 (3), S75-78, 2004).
LXR альфа и LXR бета являются близкородственными и обладают 77% аминокислотной идентичностью как в их ДНК-, так и в связывающих лиганд доменах. LXR также являются консервативными у людей и других животных (например, у грызунов). Подобно другим ядерным рецепторам, LXR образуют гетеродимер с рецептором ретиноида Х (RXR) для функционирования. Известно, что LXR активируются некоторыми встречающимися в природе окисленными производными холестерина, включая 22(R)-гидроксихолестерин, 24(S)-гидроксихолестерин и 24,25(S)-эпоксихолестерин.
LXR альфа и бета являются регуляторами печеночных генов, вовлеченных в метаболизм холестерина и жирных кислот (HMGCoA синтазы/редуктазы, фарнезилдифосфатсинтазы, скваленсинтазы, SREBP1c, стеароил-СоА-десатуразы (SCD1 и 2), FAS), ингибируют экспрессию ферментов глюконеогенеза (РЕРСК, фруктозодифосфатазы-1, глюкозо-6-фосфатазы), индуцируют экспрессию трансмембранных транспортеров (АВСА1, Glut1 и Glut4), ингибируют экспрессию ферментов, вовлеченных в гликолиз (6-фосфофрукто-2-киназы) и индуцируют киназу пируватдегидрогеназы-4 (негативный регулятор гликолиза), снижают 11-бетагидроксистероиддегидрогеназу типа 1 (фермент, который повторно активирует неактивный кортизон в активный кортизол у людей). Лептин и UCP-1 идентифицированы как гены-мишени LXR (понижающая регуляция агонистами LXR). Кроме того, LXR имеют перекрывающиеся функции с PPAR (рецепторами активаторов пролиферации пероксисом) при негативной регуляции воспалительного ответа. LXR ингибируют продуцирование TNFα и IL-1β и экспрессию воспалительных медиаторов, таких как СОХ2, iNOS, IL-6. LXR могут играть ключевую роль в ответах на воспаление, и, поскольку показано, что они важны в метаболизме липидов, LXR могут быть также вовлечены в индуцированные ожирением воспалительные ответы (рассмотрено в Steffensen et al, Diabetes, 2004, 53(1), S36-42).
Показано, что у мышей db/db агонист LXR T0901317, описанный здесь ниже, снижает уровень глюкозы в плазме (не у нормальных мышей). Данное соединение ингибирует экспрессию РЕРСК (фосфоенолпируват-карбоксикиназы) с ограничением образования глюкозы печенью (Cao et al, J Biol Chem, 2003, 278, 1131-1136).
Культивирование островков поджелудочной железы или секретирующих инсулин клеток MIN6 с T0901317 вызывало повышение зависимой от глюкозы секреции инсулина и содержание инсулина в островках. Стимулирующий эффект данного соединения на секрецию инсулина наблюдали только после >72 ч культивирования островков с T0901317. В клетках MIN6 Tularik повышал белковую экспрессию липогенных ферментов, синтазы жирных кислот и ацетил-СоА карбоксилазы. Активация LXR также давала повышение уровня активности белков глюкокиназы и пируваткарбоксилазы (PC). LXR могут регулировать секрецию и биосинтез инсулина посредством регуляции метаболизма глюкозы и липидов в бета-клетках поджелудочной железы (Efanov et al, Diabetes, 53 (3), S75-78, 2004).
Панкреатический дуоденальный гомеобоксный ген-1 (Pdx-1) является главным регулятором как развития поджелудочной железы, так и дифференциации клеток-предшественников в фенотип бета-клеток. Кроме того, в дифференцированной бета-клетке Pdx1 является отвечающим на глюкозу регулятором экспрессии гена инсулина, и функция Pdx1 в ответ на глюкозу регулируется как его фосфорилированием, так и ядерной транслокацией. Во время более поздних стадий развития островков экспрессия Pdx-1 становится наиболее ограниченной зрелыми бета-клетками эндокринной поджелудочной железы. В поджелудочной железе взрослых субпопуляции клеток, продуцирующих соматостатин, и клеток, продуцирующих панкреатический полипептид, также экспрессируют Pdx-1, и только немногие клетки, продуцирующие глюкагон, экспрессируют его.
Дефект чувствительности к глюкозе бета-клеток поджелудочной железы наблюдали в нескольких животных моделях диабета типа II, и он коррелировал со сниженной экспрессией гена транспортера глюкозы типа 2 (Glut2). В модели трансгенной мыши показано, что экспрессия Glut2 антисмысловой РНК в бета-клетках поджелудочной железы связана с нарушенной индуцируемой глюкозой секрецией инсулина и развитием диабета. Экспрессия гена-транспортера глюкозы типа 2 (GLUT2) избирательно снижена в бета-клетках поджелудочной железы экспериментальных моделей диабета, и мышиный промотор GLUT2 регулируется PDX-1.
Сущность изобретения
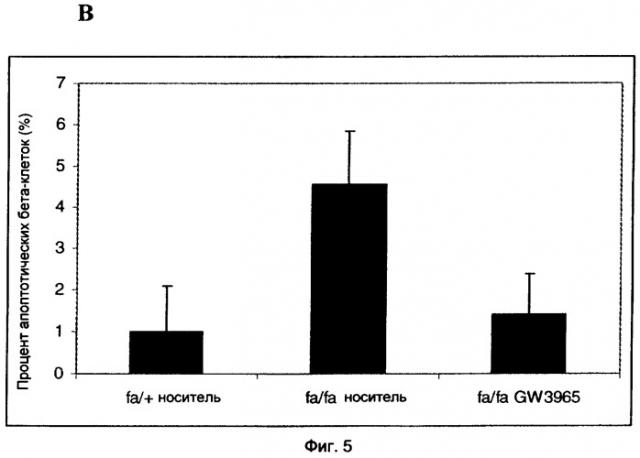
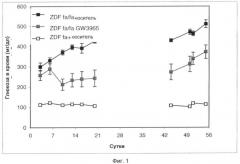
Настоящее изобретение частично основано на неожиданном открытии, что активация LXR у крыс ZDF приводит к улучшению диабетического состояния при значительном снижении гликемии после обработки агонистом LXR. При оценке потенциальных механизмов, лежащих в основе противодиабетического действия агониста LXR, неожиданно обнаружено значительное снижение апоптоза в изолированных островках [Лангерганса] из крыс ZDF, обработанных известным агонистом LXR, названным "GW3965", связанное с увеличением числа островков;
кроме того, эти островки имели значительно более высокое содержание инсулина и лучшую чувствительность к глюкозе, чем островки из крыс ZDF, обработанных носителем. Эти открытия и дополнительная экспериментальная работа показали, что введение агониста LXR in vivo способно стимулировать секрецию инсулина, в то же время защищая островки поджелудочной железы от разрушения.
Кроме того, показано, что значительное повышение уровня мРНК PDX1 и Glut2, двух основных генов, вовлеченных в регенерацию островков, было получено в островках крыс ZDF, обработанных GW3965. Регенерация островков поджелудочной железы также подтверждена гистологическим анализом поджелудочной железы мышей NOD, обработанных GW3965.
Настоящее изобретение также основано на новом открытии, что агонист LXR не только защищает поджелудочную железу диабетиков от дальнейшего разрушения, в частности, посредством снижения апоптоза и инсулита в поджелудочной железе, но также усиливает регенеративные процессы поджелудочной железы и, таким образом, дает возможность восстановления функции поджелудочной железы, когда она подвергается риску. Эти эффекты являются дополнительными к снижению образования глюкозы печенью, описанному в печени (Cao et al, 2003, JBC, 278 (2), 1131-1136), и потенцируют противодиабетические свойства агонистов LXR.
Полезное свойство агонистов LXR увеличивать число островков и снижать апоптоз в островках дает возможность нового режима лечения: он состоит в лечении пациентов в течение ограниченного периода времени до тех пор, пока гликемия и/или HbA1c (гемоглобин А1 с) не снизится до уровня стабильного состояния (HbA1C ≤7% и/или гликемия ≤1,2-1,4 г/л); тогда лечение приостанавливают до тех пор, пока гликемия и/или HbA1c остается в приемлемом интервале (например, на один месяц). Если уровень гликемии и/или HbA1c повышается выше приемлемых значений, тогда лечение агонистом LXR будет назначено снова.
В первом аспекте настоящее изобретение, таким образом, направлено на применение агониста LXR для изготовления лекарственного средства, полезного для лечения и/или предупреждения заболевания, обусловленного дегенерацией бета-клеток.
Настоящее изобретение также направлено на применение агониста LXR для изготовления лекарственного средства, полезного для регенерации бета-клеток и для повышения жизнеспособности бета-клеток.
Применение в соответствии с изобретением предусматривает лекарственное средство, которое можно применять в сочетании с известным противодиабетическим лекарственным средством.
Во втором аспекте настоящее изобретение направлено на способ повышения ex vivo жизнеспособности первичных островковых клеток поджелудочной железы, при котором приводят в контакт указанные островковые клетки с агонистом LXR.
В третьем аспекте в настоящем изобретении предложены способы лечения дегенерации бета-клеток, при которых субъекту вводят агонист LXR.
В первом воплощении в изобретении предложены способы предупреждения диабета типа 1 у субъекта, при которых субъекту вводят эффективное количество агониста LXR.
В другом воплощении в настоящем изобретении предложены способы лечения или облегчения диабета, при которых измеряют уровень циркулирующей глюкозы и/или HbA1c у субъекта и вводят этому субъекту ежесуточно эффективное количество агониста LXR до стабилизации гликемии и/или HbA1c (HbA1C ≤7% и/или гликемии ≤1,2-1,4 г/л, поддерживаемых в течение одного месяца по меньшей мере двумя дозами), затем приостанавливают лечение, как только гликемия и/или HbA1c стабилизируется, при этом ежесуточное лечение, возможно, возобновляют, если необходимо.
В другом воплощении в изобретении предложены способы повышения жизнеспособности трансплантированных донорских островковых клеток поджелудочной железы у реципиента трансплантата, при которых указанному реципиенту трансплантата вводят агонист LXR.
Дальнейшее понимание природы и преимуществ настоящего изобретения может быть реализовано со ссылкой на остальные разделы описания и формулы изобретения.
Подробное описание изобретения
В одном аспекте настоящее изобретение направлено на применение агониста LXR для изготовления лекарственного средства, полезного для лечения и/или предупреждения заболевания, обусловленного дегенерацией бета-клеток.
Применение согласно настоящему изобретению находит приложение при лечении заболеваний, обусловленных, в частности, потерей функции бета-клеток или дисфункции бета-клеток и/или гибели бета-клеток, таких как, но не ограниченных ими, диабет, гипергликемия и ожирение. Настоящее изобретение также полезно для предупреждения или модулирования развития таких заболеваний или расстройств у субъекта, подозреваемого на склонность к таким заболеваниям или расстройствам, либо если эта склонность известна.
Настоящее изобретение, таким образом, относится к применению агониста LXR для изготовления лекарственного средства, полезного для лечения и/или предупреждения диабета типа I и типа II, и предпочтительно диабета типа I.
Как объяснено выше, у пациентов с диабетом типа II могут проявляться в большей или меньшей степени признаки диабета типа I, в основном, связанные с дефицитом продуцирования инсулина. Соответственно, в одном воплощении настоящее изобретение направлено на применение агониста LXR для изготовления лекарственного средства, полезного для предупреждения, остановки или замедления прогрессирования диабета типа II в направлении последующего диабетического состояния, характеризующегося дефицитом продуцирования инсулина.
Поскольку введение in vivo агониста LXR увеличивает число островков и снижает апоптоз в островках, применение агониста LXR для изготовления лекарственного средства, полезного для регенерации бета-клеток и для повышения жизнеспособности бета-клеток, представляет собой два дополнительных воплощения настоящего изобретения.
В отношении применения для повышения жизнеспособности клеток поджелудочной железы должно быть понятно, что жизнеспособные клетки определяют как способные к пролиферации, дифференциации, росту и развитию. Жизнеспособность можно измерить любыми способами, известными в данной области техники, и, например, путем использования окрашивания трипановым синим.
В другом воплощении настоящее изобретение направлено на применение агониста LXR для изготовления лекарственного средства, полезного для повышения жизнеспособности трансплантированных донорских островковых клеток поджелудочной железы у реципиента трансплантата. Островковые клетки поджелудочной железы представляют собой первичные островковые клетки.
Для данного конкретного применения лекарственное средство можно вводить местно в трансплантированную область или предпочтительно вводить системно.
В одном воплощении лекарственное средство вводят реципиенту трансплантата до и/или после трансплантации донорских островковых клеток поджелудочной железы. В другом воплощении лекарственное средство вводят реципиенту трансплантата одновременно с трансплантацией донорских клеток поджелудочной железы.
Любые агонисты LXR, известные и описанные в данной области техники, можно применять для всех применений и способов, как описано здесь в соответствии с настоящим изобретением. Предпочтительно агонист LXR представляет собой агонист LXR альфа, и, в частности, агонист LXR выбран из группы, состоящей из GW3965 и Т0901317.
Кроме того, согласно предпочтительному воплощению, лекарственное средство, которое следует применять для всех применений и способов настоящего изобретения, находится в форме, пригодной для перорального введения.
При всех применениях и способах, описанных здесь, лекарственное средство предпочтительно вводят ежесуточно в течение по меньшей мере 30 суток. Его можно также вводить в течение по меньшей мере 60 суток, 90 суток или дольше.
Кроме того, лекарственное средство согласно настоящему изобретению можно применять в сочетании с известным противодиабетическим лекарственным средством, в частности, выбранным из группы, состоящей из метформина, пиоглитазона, розиглитазона, глимепирида, глипизида, глибурида/метформина, глибурида, миглитола, глипизида + метформина, репаглинида, акарбозы, троглитазона, натеглинида и агониста GLP-1 (глюкагоноподобного пептида-1).
Во втором аспекте настоящее изобретение направлено на способ повышения жизнеспособности первичных островковых клеток поджелудочной железы ex vivo, при котором приводят в контакт указанные островковые клетки поджелудочной железы с агонистом LXR.
Предпочтительно агонист LXR представляет собой агонист LXR альфа, и, в частности, агонист LXR, который следует применять, выбран из группы, состоящей из GW3965 и Т0901317.
В третьем аспекте в настоящем изобретении предложены способы лечения дегенерации бета-клеток. Эти способы включают введение субъекту агониста LXR. При таких способах применяемый агонист LXR может представлять собой агонист LXR альфа, и, в частности, агонист LXR, который следует применять, выбран из группы, состоящей из GW3965 и Т0901317.
В способах согласно изобретению субъект предпочтительно страдает диабетом типа I или типа II. Возможно, агонист LXR вводят субъекту одновременно с известным противодиабетическим лекарственным средством или с любым другим лекарственным средством, снижающим гликемию и/или HbA1c. В частности, известное противодиабетическое лекарственное средство выбрано из группы, состоящей из метформина, пиоглитазона, розиглитазона, глимепирида, глипизида, глибурида/метформина, глибурида, миглитола, глипизида+метформина, репаглинида, акарбозы, троглитазона, натеглинида и агониста GLP-1.
В одном воплощении в изобретении предложены способы предупреждения диабета типа I у субъекта. Эти способы включают введение субъекту эффективного количества агониста LXR. Подобным образом, агонист LXR, применяемый в указанных способах предупреждения диабета типа I, может представлять собой агонист LXR альфа, и, в частности, агонист LXR, который следует применять, выбран из группы, состоящей из GW3965 и Т0901317.
Возможно, агонист LXR вводят субъекту одновременно с известным противодиабетическим лекарственным средством или с любым другим лекарственным средством, снижающим гликемию и/или HbA1c. В частности, известное противодиабетическое лекарственное средство выбрано из группы, состоящей из метформина, пиоглитазона, розиглитазона, глимепирида, глипизида, глибурида/метформина, глибурида, миглитола, глипизида+метформина, репаглинида, акарбозы, троглитазона, натеглинида и агониста GLP-1.
В другом аспекте в настоящем изобретении предложены способы лечения или облегчения диабета, при которых измеряют уровень циркулирующей глюкозы и/или HbA1c у субъекта и вводят этому субъекту ежесуточно эффективное количество агониста LXR до стабилизации гликемии и/или HbA1c (HbA1C ≤7% и/или гликемия ≤1,2-1,4 г/л, поддерживаемая в течение одного месяца по меньшей мере двумя дозами), затем приостанавливают лечение, как только гликемия и/или HbA1c стабилизируется, при этом ежесуточное лечение возможно возобновляют при необходимости.
Ежесуточное лечение может быть возобновлено, если гликемия и/или HbA1c более не стабилизированы или потеряна чувствительность к инсулину.
Способы измерения уровней циркулирующей глюкозы и/или HbA1c представляют собой способы, хорошо известные на предшествующем уровне техники, и можно использовать любой вид способов.
Подобным образом агонист LXR, применяемый в указанных способах лечения или облегчения диабета, может представлять собой агонист LXR альфа, и, в частности, агонист LXR, который следует применять, выбран из группы, состоящей из GW3965 и Т0901317. Возможно, агонист LXR вводят субъекту одновременно с известным противодиабетическим лекарственным средством или с любым другим лекарственным средством, снижающим гликемию и/или HbA1c. В частности, известное противодиабетическое лекарственное средство выбрано из группы, состоящей из метформина, пиоглитазона, розиглитазона, глимепирида, глипизида, глибурида/метформина, глибурида, миглитола, глипизида+метформина, репаглинида, акарбозы, троглитазона, натеглинида и агониста GLP-1.
В указанных способах агонист LXR предпочтительно вводят субъекту по меньшей мере ежесуточно в течение по меньшей мере 30 суток.
В другом воплощении настоящее изобретение направлено на способ повышения жизнеспособности трансплантированных донорских островковых клеток поджелудочной железы реципиенту трансплантата, при котором указанному реципиенту трансплантата вводят агонист LXR.
В последующих разделах приведено руководство по получению и применению лекарственного средства в соответствии с изобретением и по осуществлению способов по изобретению.
Определения
Если не указано иное, все технические и научные термины, используемые здесь, имеют такое же значение, как обычно их понимает обычный специалист в области техники, к которой принадлежит данное определение. Приведенные ниже ссылки дают специалисту в данной области техники общее определение многих терминов, используемых в данном изобретении: Singleton et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY (2d ed. 1994); THE CAMBRIDGE DICTIONARY OF SCIENCE AND TECHNOLOGY (Walker ed., 1988); и Hale & Marham, THE HARPER COLLINS DICTIONARY OF BIOLOGY (1991). Кроме того, приведенные ниже определения приведены, чтобы помочь читателю в осуществлении изобретения.
Термин "LXR" (печеночный рецептор X) или "рецептор LXR" включает все подтипы данного рецептора. Конкретно LXR включает LXR альфа и LXR бета. Ряд названий, таких как LXRU, LXRa, LXR, RLD-1, NR1H3, использовали для обозначения LXR альфа. Он охватывает любой полипептид, кодируемый геном с существенной идентичностью последовательности с номером по каталогу GenBank U22662. Подобным образом, LXR бета включает любой полипептид, кодируемый геном, который называют как LXRb, LXRP, LXR бета, NER, NER1, UR, OR-1, RIP 15, NR1H2, или геном с существенной идентичностью последовательности с номером по каталогу GenBank U07132.
Термин "лиганд" относится к агонисту или частичному агонисту LXR. Лиганд может быть избирательным к LXR альфа или LXR бета, либо он может обладать смешанным связывающим сродством к обоим рецепторам LXR альфа и LXR бета. Хотя лиганд может либо агонизировать, либо антагонизировать функцию рецептора, если не указано иное, лиганд LXR, используемый здесь, прежде всего, относится к агонисту LXR, который активирует рецептор LXR.
Термин "модулировать" в отношении рецептора LXR относится к активации рецептора LXR и его биологических активностей, связанных с биохимическим путем LXR (например, регуляции транскрипции гена-мишени). Модулирование рецептора LXR может представлять собой повышающую регуляцию (то есть агонизм, активацию или стимуляцию) или понижающую регуляцию (то есть антагонизм, ингибирование или подавление). Механизм действия модулятора LXR может быть прямым, например, посредством связывания с рецептором LXR в качестве лиганда. Модулирование также может быть косвенным, например, посредством связывания с другой молекулой и/или модификацией этой другой молекулы, которая в противном случае связывается с рецептором LXR и активирует его. Таким образом, модулирование LXR включает изменение в биологических активностях лиганда агониста LXR (то есть его активности при связывании и/или активации рецептора LXR) или изменение в клеточном уровне лиганда.
Как используют здесь, выражение "скрининг на агонисты LXR" относится к использованию соответствующей системы анализа для идентификации новых агонистов LXR из тестируемых агентов. Анализ может представлять собой анализ in vitro или in vivo, пригодный для идентификации, может ли тестируемый агент стимулировать или активировать одну или более чем одну из биологических функций рецептора LXR. Примеры подходящих биологических анализов включают, но не ограничены ими, анализы на исследование связывания тестируемых агентов с полипептидом LXR (например, фрагментом LXR, содержащий его домен связывания с лигандом), анализы на основе транскрипции, анализы креатинкиназы, анализы, основанные на дифференциации преадипоцитов, анализы, основанные на регуляции захвата глюкозы в адипоцитах, и иммунологические анализы.
"Субъект" предпочтительно представляет собой млекопитающее, более предпочтительно человека.
Термин "дегенерация бета-клеток" предназначен для обозначения потери функции бета-клеток, дисфункции бета-клеток и гибели бета-клеток, такой как некроз или апоптоз бета-клеток.
Термин "лечение заболевания" определяют как помощь и уход за пациентом с целью борьбы с заболеванием, состоянием или расстройством и включают в него введение агониста LXR для предупреждения появления симптомов или осложнений, либо для облегчения симптомов или осложнений, либо для устранения заболевания, состояния или расстройства. Лечение включает модулирование, ингибирование, снижение, уменьшение или остановку дегенерации бета-клеток, такой как некроз или апоптоз бета-клеток, в частности, программируемой гибели бета-клеток, известной как апоптоз бета-клеток, а также предупреждение дегенерации бета-клеток, такой как некроз или апоптоз бета-клеток, в частности, предупреждение апоптоза бета-клеток. Лечение включает также дегенерацию бета-клеток.
Термин "для лечения", как используют здесь, следует понимать как охватывающий прямое применение соединения для лечения или косвенное применение указанного соединения при лечении указанного заболевания.
Термин "дефицит продуцирования инсулина" предназначен для обозначения проявления значимой гипергликемии и нормо- или гипоинсулинемии. Способы измерения уровней гликемии или инсулина и оценки гипергликемии и нормо- или гипоинсулинемии хорошо известны в данной области техники.
Термин "в сочетании с" следует относить либо к лекарственному средству, в котором два активных вещества (агонист LXR и противодиабетическое лекарственное средство) являются существенными составными частями одной и той же композиции, либо к двум отдельным лекарственным средствам, которые можно вводить одновременно или последовательно.
Термины "стабилизация гликемии и/или HbA1c" или "как только гликемия и/или HbA1c стабилизируется", как используют здесь, предназначены для обозначения значения HbA1C ≤7% и/или значения гликемии ≤1,2-1,4 г/л, поддерживаемые в течение одного месяца по меньшей мере двумя дозами.
АГОНИСТЫ LXR
Существуют многие агонисты LXR, которые пригодны для осуществления способов по настоящему изобретению. Они могут представлять собой любые известные агенты, которые активируют рецептор LXR, например GW3965 (см. Примеры ниже) или другие имеющиеся в продаже соединения, такие как F3метилАА (от Merck; см. Menke et al., Endocrinology 143: 2548-58, 2002) и Т0901317 (Tularik, Calif.). Они могут также представлять собой новые агонисты LXR, подлежащие скринингу в соответствии с настоящим изобретением. Как подробно описано ниже, агонисты LXR, пригодные для настоящего изобретения, могут представлять собой полипептиды, пептиды, малые молекулы или другие агенты. Агонисты LXR могут представлять собой агонисты для LXR человека, а также других животных.
Большое число агонистов LXR описано в данной области техники. Примеры низкомолекулярных агонистов LXR включают хорошо известные оксистерины и родственные соединения (Janowski et al., Nature 383: 728-31, 1996); Т0901317 и Т0314407 (Schultz et al., Genes Dev 14: 2831-8, 2000); 24(S)-гидроксихолестерин и 22(R)-гидроксихолестерин (Janowski et al., Nature 383: 728-731, 1996); а также 24,25-эпоксихолестерин (патент США №6316503). Примерные полипептидные агонисты LXR также описаны в данной области техники, например, в WO 02/077229. Дополнительные агонисты LXR описаны в данной области техники, например в патенте США №6316503; Collins et al., J Med Chem. 45: 1963-6, 2002; Joseph et al., Proc Natl Acad Sci USA 99: 7604-9, 2002; Menke et al., Endocrinology 143: 2548-58, 2002; Schultz et al., Genes Dev. 14: 2831-8, 2000 и Schmidt et al., Mol Cell Endocrinol. 155:51-60, 1999.
Многие агонисты LXR эффективны при активации как LXR альфа, так и LXR бета (например, GW3965, как описано в Collins et al., J Med Chem. 45: 1963-6, 2002). Некоторые агонисты LXR активируют LXR альфа и LXR бета в различных условиях. Например, 6-альфа-гидроксилированные желчные кислоты являются агонистами LXR альфа, но также активируют LXR бета при более высоких концентрациях (Song et al., Steroids 65: 423-7, 2000). Некоторые агонисты LXR действуют исключительно на LXR альфа, тогда как некоторые другие активируют только LXR бета. Например, в результате введения атома кислорода на стерольное В-кольцо оксистерина образуется лиганд с избирательностью к LXR альфа-подтипу (Janowski et al., Proc Natl Acad Sci USA 96: 266-71, 1999). С использованием зависимых от лиганда транскрипционных анализов было обнаружено, что 5-тетрадецилокси-2-фуранкарбоновая кислота (TOFA) и гидроксихолестерин трансактивируют химерные рецепторы, состоящие из ДНК-связывающего домена рецептора глюкокортикоидов и связывающих лиганд областей рецепторов LXR бета, PPAR альфа и PPAR бета (Schmidt et al., Mol Cell Endocrinol. 155:51-60, 1999).
Агонисты LXR могут быть также получены из производных известных полипептидных агонистов рецептора LXR. Они могут быть получены с помощью ряда методик, известных в данной области техники. Например, можно синтезировать специфичные олигопептиды (например, 10-25 аминокислотных остатков), охватывающие известный полипептидный агонист LXR (например, химическим или рекомбинантным путем) и тестировать на их способность к активации рецептора LXR. Фрагменты агониста LXR можно синтезировать, используя стандартные методики, такие как описаны в Bodansky, M. Principles of Peptide Synthesis, Springer Verlag, Berlin (1993) и Grant, G. A. (ed.). Synthetic Peptides: A User's Guide, W.H. Freeman and Company, New York (1992). Автоматические синтезаторы пептидов имеются в продаже, например, от Advanced ChemTech Model 396; Milligen/Biosearch 9600. Альтернативно такие агонисты LXR могут быть получены путем ферментативного расщепления нативных или продуцированных рекомбинантным путем полипептидных агонистов LXR, используя протеазу, например трипсин, термолизин, химотрипсин или пепсин. Компьютерный анализ (с использованием имеющегося в продаже программного обеспечения, например MacVector, Omega, PCGene, Molecular Simulation, Inc.) можно использовать для идентификации сайтов протеолитического расщепления.
Полипептидные или пептидные агонисты для применения в способах по настоящему изобретению являются предпочтительно изолированными и по существу свободными от клеточного материала или других загрязняющих белков из клетки или тканевого окружения, из которых выделяют агонисты LXR, или по существу свободными от химических предшественников или других химических веществ при химическом синтезе. Протеолитические или синтетические полипептидные агонисты или их фрагменты могут содержать столько аминокислотных остатков, сколько необходимо для активации рецепторной активности LXR, и могут содержать по меньшей мере 5, 10, 15, 20, 25, 30, 35, 40, 45, 50 или более аминокислотных остатков в длину.
Кроме известных соединений и полипептидов, которые активируют рецептор LXR, агонисты LXR могут быть также получены путем скрининга тестируемых агентов (например, библиотек соединений) для идентификации новых агонистов LXR, которые связываются с рецепторными активностями LXR и/или активируют их. Для скрининга на такие новые агонисты LXR можно использовать человеческий LXR или LXR других животных в системе точного анализа. Полинуклеотидные и аминокислотные последовательности рецепторов LXR известны и описаны в данной области техники. Их структуры и функциональные организации, включая их домены, связывающие лиганд, также охарактеризованы. См., например, Apfel et al., Mol Cell Biol 14: 7025-7035, 1994; Willy et al., Genes Dev 9: 1033-1045, 1995; Song et al., Proc Natl Acad Sci USA 91: 10809-10813, 1994; Shinar et al., Gene 147: 273-276, 1994; Teboul et al., Proc Natl Acad Sci USA 92: 2096-2100, 1995; и Seol et al., Mol Endocrinol 9:72-85, 1995.
Агонисты могут активировать либо LXR, либо LXR альфа. Кроме того, вместо полноразмерной молекулы LXR в некоторых из скрининговых анализов можно использовать полипептид LXR, который содержит фрагмент молекулы LXR. Например, два функциональных домена рецептора LXR, N-концевой ДНК-связывающий домен (DBD) и С-концевой домен, связывающий лиганд (LBD), опосредуют функцию транскрипционной активации ядерных рецепторов. Полипептид LXR, содержащий любой из этих доменов, можно использовать в скрининге на новые агонисты LXR. Ряд аналитических систем можно использовать для скрининга тестируемых агентов на агонисты рецептора LXR. Как подробно описано ниже, тестируемые агенты можно подвергать скринингу на прямое связывание с полипептидом LXR или его фрагментом (например, его доменом, связывающим лиганд). Альтернативно или дополнительно потенциальные агонисты LXR можно исследовать на способность к активации биохимического пути рецептора LXR или к стимуляции других биологических активностей рецептора LXR. в скрининге можно использовать либо систему анализа in vitro, либо систему анализа на клеточной основе.
Избирательность потенциальных агонистов LXR к различным рецепторам (например, LXR альфа, LXR бета, RXR или PPAR) можно тестировать, используя способы, хорошо известные в данной области техники, например конкурентные анализы приближенности сцинтилляции радиоактивного лиганда LXR описаны, например, в WO 01/41704, и конкурентные анализы связывания PPAR описаны, например, в Berger et al., J Biol Chem 274: 6718-6725,1999).
Тестируемые агенты, которые можно подвергать скринингу на новые агонисты LXR, включают полипептиды, бета-вращающие миметики, полисахариды, фосфолипиды, гормоны, простагландины, стероиды, ароматические соединения, гетероциклические соединения, бензодиазепины, олигомерные N-замещенные глицины, олигокарбаматы, полипептиды, сахариды, жирные кислоты, стероиды, пурины, пиримидины, производные, структурные аналоги или их комбинации. Некоторые тестируемые агенты представляют собой синтетические молекулы, а другие природные молекулы.
Тестируемые агенты получают из широкого ряда источников, включая библиотеки синтетических или природных соединений. Комбинаторные библиотеки можно получать для многих типов соединения, которые можно синтезировать ступенчато. Большие комбинаторные библиотеки соединений можно конструировать способом кодируемых синтетических библиотек (ESL), описанным в WO 95/12608, WO 93/06121, WO 94/08051, WO 95/35503 и WO 95/30642. Пептидные библиотеки можно также создавать способами фагового дисплея (см., например, Devlin, WO 91/18980). Библиотеки природных соединений в форме бактериальных, грибных, растительных и животных экстрактов могут быть получены из коммерческих источников или собраны в поле. Известные фармакологические агенты могут быть предметом направленных или случайных химических модификаций, таких как ацилирование, алкилирование, эстерификация, амидирование, с получением структурных аналогов.
Комбинаторные библиотеки пептидов или других соединений могут быть полностью рандомизированными без предпочтений последовательностей или констант в любом положении. Альтернативно библиотека может быть смещенной, то есть некоторые положения в пределах последовательности либо сохраняют постоянными, либо выбирают из ограниченного числа возможностей. Например, в некоторых случаях нуклеотиды или аминокислотные остатки рандомизированы в пределах определенного класса, например, гидрофобных аминокислот, гидрофильных остатков, стерически смещенных (либо малых, либо больших) остатков, в направлении образования цистеинов, для поперечной сшивки, пролинов для SH-3 доменов, серинов, треонинов, тирозинов или гистидинов для сайтов фосфорилирования, либо пуринов.
Тестируемые агенты могут представлять собой встречающиеся в природе белки или их фрагменты. Такие тестируемые агенты могут быть получены из природного источника, например клеточного или тканевого лизата. Библиотеки полипептидных агентов могут