Способ диагностики бруцеллеза животных
Иллюстрации
Показать всеИзобретение относится к области ветеринарии. Способ включает исследование сыворотки крови в реакции иммунодиффузии. В качестве диагностикума используют антиген, приготовленный путем механического смешивания равных частей O-поисахаридного М-антигена, приготовленного из вакцинного штамма В. melitensis Rev-1, и O-полисахаридного А-антигена, приготовленного из вакцинного штамма В. abortus 19. Использование предложенного способа повышает точность и достоверность диагностики бруцеллеза как мелкого рогатого скота, так и крупного рогатого скота. 3 табл.
Реферат
Изобретение относится к ветеринарии, а именно к диагностике инфекционных заболеваний.
Известен способ диагностики бруцеллеза крупного рогатого скота с помощью реакции иммунодиффузии (РИД) с O-полисахаридным антигеном (O-ПС), который готовится из вакцинного штамма В. abortus 19 (автор В.М.Чекишев), (1, 5, 6, 9, 10, 11, 12).
O-полисахаридный (O-ПС) антиген, изготавливавшийся из бруцелл вида abortus (RU 2035188 C1, 20.05.1995), изначально предназначался для дифференциальной диагностики вакцинированных и больных бруцеллезом животных. При этом следует особо отметить, что его использовали в реакции иммунодиффузии в агаровом геле (РИД) при диагностике бруцеллеза как дополнительный метод, позволяющий из числа положительно реагировавших в РА и РСК выявлять только животных, зараженных вирулентными бруцеллами.
Таким образом, за счет использования указанного диагностикума, решалась только проблема дифференциальной диагностики вакцинированных и больных бруцеллезом животных.
Однако при бруцеллезе овец реакция иммунодиф4)узии (РИД) с O-ПС антигеном, изготовленным из бруцелл вида abortus, оказалась недостаточно чувствительной, что объясняется гетерогенностью антигена по отношению к возбудителю инфекции В. melitensis (2, 7, 8).
Разработан способ диагностики бруцеллеза овец в реакции иммунодиффузии (РИД), отличающийся тем, что в качестве диагностикума используют O-ПС М-антиген, приготовленный из вакцинного штамма В. melitensis Rev-1, вместо O-ПС А-антигена, изготовляемого из вакцинного штамма В. abortus 19 (3, 4).
Однако известный способ диагностики может оказаться недостаточно эффективным в случаях, когда крупный рогатый скот заражается бруцеллами не только вида abortus, но и melitensis, а мелкий рогатый скот - abortus.
В настоящее время в стране существует реальная угроза возникновения эпизоотических очагов бруцеллеза как мелкого рогатого скота, так и крупного рогатого скота за счет заноса возбудителей болезни из неблагополучных регионов и даже стран (Монголия, Казахстан и др.). При этом могут иметь место факты циркуляции в стадах крупного рогатого скота бруцелл не только вида abortus, но и melitensis, а в отарах мелкого рогатого скота, наоборот - не только вида melitensis, но и abortus.
Задачей изобретения является повышение точности и достоверности выявления эпизоотически опасных в отношении бруцеллеза животных, которая решается путем исследования сыворотки крови в реакции иммунодиффузии (РИД). При этом в качестве диагностикума используется антиген, приготовленный путем механического смешивания равных частей O-ПС М-антигена, приготовленного из вакцинного штамма В. melitensis Rev-1, и O-ПС А-антигена, приготовленного из вакцинного штамма В. abortus 19.
Предлагаемый способ диагностики позволяет дополнительно выявить эпизоотически опасных животных в РИД до 40% по сравнению с известными способами, используемыми на основе O-ПС М-антигена и O-ПС А-антигена.
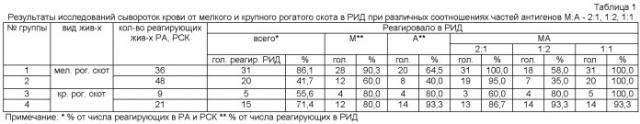
Пример 1. Определяли в РИД оптимальное соотношение частей антигенов при механическом смешивании: O-ПС М-антигена и O-ПС А-антигена. Для опыта использовали следующие соотношения М:А - 1:1, 1:2, 2:1. Предварительно сыворотки крови от крупного и мелкого рогатого скота с естественным течением инфекции исследовали в реакциях: РА и РСК. Из реагирующих на бруцеллез животных сформировали по две группы.
Результаты исследований, приведенные в таблице 1, показывают, что в 1 группе из 36 гол. мелкого рогатого скота в РИД всего реагировало 31 гол. (86%), во 2 группе из 48 гол. - 20 гол. (41,7%). В РИД с помощью O-ПС М-антигена в 1 группе реагировало 28 гол. (90,3%), во 2 группе - 12 гол. (60%). С помощью O-ПС А-антигена в 1 группе реагировало 20 гол.(64,5%), во 2 группе - 8 гол. (40,0%). С помощью O-ПС МА-антигена при соотношении частей М:А 1:2 в 1 группе реагировало 18 гол. (58%), во 2 группе - 7 гол. (35%) от общего числа животных, реагирующих в РИД. С помощью O-ПС МА-антигена при соотношении частей М:А 2:1 в 1 группе реагировало 31 гол. (100%), во 2 группе - 19 гол. (95%). С помощью O-ПС МА-антигена при соотношении частей М:А 1:1 в 1 группе реагировало 31 гол. (100%), во 2 группе - 20 гол.(100%). В 3 группе из 9 гол. крупного рогатого скота в РИД реагировало 5 гол. (55,6), в 4 группе из 21 гол. - 15 (71,4%). В РИД с помощью O-ПС М-антигена в 3 группе реагировало 4 гол. (80%), в 4 гр. - 12 гол. (80%). В РИД с помощью 0-ПС А-антигена в 3 группе реагировало 4 гол. (80%), в 4 группе - 14 гол. (93,3%). С помощью O-ПС МА-антигена при соотношении частей М:А 1:2 в 3 группе реагировало 4 гол. (80%), в 4 группе - 14 гол.(93,3%); при соотношении частей М:А 2:1 в 3 группе - 3 гол. (60%), в 4 гр. - 13 гол. (86,7%); при соотношении частей М:А 1:1 в 3 группе - 5 гол. (100%), в 4 группе - 14 гол. (93,3%).
Таким образом, исследования показали, что оптимальное соотношение частей O-ПС М- и O-ПС А-антигенов при их механическом смешивании является 1:1, так как выявляет максимальное количество (от 90 до 100%) заболевших бруцеллезом животных.
Пример 2. Для опыта исследовали шесть отар овец с естественным течением инфекции. Из реагирующих на бруцеллез в реакциях РА (реакция агглютинации) и РСК (реакции связывания комплемента), сформировали шесть групп животных.
Из таблицы 2 видно: из шести групп животных - 315 голов, исследованных в реакциях РА и РСК, выявлено всего реагирующих в РИД 182 гол. (57,8%), в том числе с помощью O-ПС М-антигена выявлено больных животных - 158 (86,8%), O-ПС А-антигена - 114 (62,6%), O-ПС МА-антигена - 182 т.е. (100%). Проведенные исследования показывают, что O-ПС МА-антиген дополнительно выявляет в среднем до 13% животных, а по отдельным группам от 4 до 40%.
Бактериологические исследования биоматериала, взятого от трех животных, реагирующих на O-ПС МА-антиген, подтвердили носительство возбудителя бруцеллеза.
Пример 3. Для опыта исследовали 4 гурта крупного рогатого скота с естественным течением инфекции. Из реагирующих на бруцеллез в реакциях РА (реакция агглютинации) и РСК (реакция связывания комплемента) сформировали четыре группы животных.
Из таблицы 3 видно, что из четырех групп, исследованных животных в реакциях РА и РСК, выявлено 49 гол., из них реагирующих в РИД - 25 (51,0%), в том числе с помощью О-ПС М-антигена выявлено больных животных - 18 (72,0%), О-ПС А-антигена - 22 (88,0%), О-ПС МА-антигена - 23 т.е. (92,0%). Проведенные исследования показывают, что О-ПС МА-антиген дополнительно выявляет в среднем до 12,0%, а по отдельным группам от 7,0 до 25,0%. Бактериологические исследования биоматериала, взятого от двух животных, реагирующих на О-ПС МА-антиген, подтвердили носительство возбудителя бруцеллеза.
Результаты проведенных исследований доказывают, что предложенный смешанный О-ПС МА-антиген повышает точность и достоверность выявления как мелкого, так и крупного рогатого скота, инфицированного вирулентными бруцеллами, от 90,0 до 100% по сравнению с известными О-ПС А- и М-антигенами.
Литература
1. Антонов Б.И. Реакция иммунодиффузии в агаровом геле (РИД) с О-ПС антигеном ИЭВСиДВ при диагностике бруцеллеза крупного рогатого скота /Б.И.Антонов, В.М.Чекишев, К.М.Шумилов и др. //Ветеринария. - 1994. - №11. - С.19-22.
2. Аракелян П.К. Дифференциация больных и вакцинированных против бруцеллеза овец. /П.К.Аракелян //Ветеринария. - 1996. - №11. - С.10-13.
3. Аракелян П.К. Способ диагностики мелкого рогатого скота. / П.К.Аракелян, И.А.Косилов, Е.Б.Барабанова, К.С.Димов, В.М.Чекишев // Патент РФ №2303458. - 2007.
4. Аракелян П.К., Косилов И.А., Димов К.С., Чекишев В.М., Бондарева О.В. РИД с O-ПС антигеном из В. melitensis для диагностики бруцеллеза у овец. //Ветеринария. - 2007. - №3. - С.23-25.
5. Димов С.К. Система противоэпизоотических мероприятий при бруцеллезе крупного рогатого скота для зон приуроченности болезней. /С.К.Димов, А.Г.Хлыстунов //Материалы науч.-практ. Российско-Монгольской конф. по проблемам развития АПК Монголии. /PACXTI. Сиб. отд-ние. - Новосибирск, 1998. - С.67-68.
6. Киселев Е.А. Дифференциация вакцинированных и больных бруцеллезом животных с помощью 0-полисахаридного антигена. /Е.А.Киселев //Автореф. дис.… канд. вет. наук. - Новосибирск, 1993. - 13 с.
7. Косилов И.А. Изучение специфичности и чувствительности РИД с О-полисахаридным антигеном при бруцеллезе овец. /И.А.Косилов, П.К.Аракелян, Г.С.Клочков //Туберкулез и бруцеллез с.-х. животных, профилактика и организация мероприятий по ликвидации болезней в регионе Сибири. - Новосибирск, 1995. - С.86-87.
8. Морозова Н.А. Значение РИД с О-полисахаридным антигеном при поствакцинальной диагностике бруцеллеза овец. /Н.А.Морозова //Автореф. дис.… канд. вет. наук. - Новосибирск, 2002. - 21 с.
9. Новицкий А.А. Изучение значимости методов серологической диагностики бруцеллеза крупного рогатого скота, привитого вакциной из штамма 82 /А.А.Новицкий, Л.В.Дегтяренко, Т.Г.Попова и др. //Инфекционная патология животных: Сб. науч. тр. - Омск, 2001. - С.44-50.
10. Стеблева Г.М. Усовершенствование дифференциальной диагностики бруцеллеза крупного рогатого скота. /Г.М.Стеблева / Автореф. дис.… канд. вет. наук. - Новосибирск, 1998. - 23 с.
11. Филиппенко М.Л. Способ получения антигена для дифференциальной диагностики вакцинированных и больных бруцеллезом животных. /М.Л.Филипенко, Е.А.Киселев, В.М.Чекишев., Ш.Р.Файзрахманов //Патент РФ №2035188. - 1995.
12. Чекишев В.М. Тест-система для дифференциальной диагностики вакцинированных и больных бруцеллезом животных. /В.М.Чекишев //Зооантропонозные болезни, меры профилактики и борьбы: Материалы Междунар. науч.-практ. конф. - (Гродно, 23-24 октября). - Минск, 1997. - С.107-108.
Способ серологической диагностики бруцеллеза крупного и мелкого рогатого скота с целью выявления эпизоотически опасных животных, включающий исследование сыворотки крови в реакции иммунодиффузии, отличающийся тем, что в качестве диагностикума используют антиген, приготовленный путем механического смешивания равных частей O-полисахаридного М-антигена, приготовленного из вакцинного штамма В. melitensis Rev-1 и O-полисахаридного А-антигена, приготовленного из вакцинного штамма В. abortus 19.