Способы, композиции и препараты для лечения тиреоидной офтальмопатии
Иллюстрации
Показать всеПредложены композиции и способы уменьшения накопления глазничного жира у пациента при лечении тиреоидной офтальмопатии, проптоза и родственных состояний (например, офтальмопатии Грейвса). Композиции включают бета-адренергический агонист в виде суспензии кристаллических микрочастиц (например, с пролонгированным высвобождением) для системного или местного введения и/или метилпреднизолона ацетат, флутиказона пропионат также в форме суспензии кристаллических микрочастиц. Способы включают введение соединения для уменьшения десенсибилизации бета-адренергического рецептора (например, кортикостероида) до введения или совместно с введением бета-адренергического агониста. Показано снижение массы жировых тел и снижение объема глазного жира после применения заявленных композиций и способов. 7 н. и 32 з.п. ф-лы, 7 ил., 7 табл.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА
Данная заявка устанавливает приоритет предварительной заявки на патент США №60/852221, поданной 17 октября 2006; 60/898009, поданной 29 января 2007, и 60/919011, поданной 13 апреля 2007, причем данные заявки включены здесь посредством ссылки во всей их полноте.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Болезнь Грейвса представляет собой общее расстройство с заболеваемостью у женщин 1/1000 человек населения в год. Помимо гипертиреоза у 25-50% индивидуумов с болезнью Грейвса развивается клиническое поражение глаз, т.е. тиреоидная офтальмопатия. Офтальмопатия Грейвса (ОГ) представляет собой типичную форму тиреоидной офтальмопатии. Хотя некоторые пациенты с ОГ испытывают лишь умеренный дискомфорт в глазах, 3-5% страдают от интенсивной боли и воспаления с двоением в глазах или даже потерей зрения.
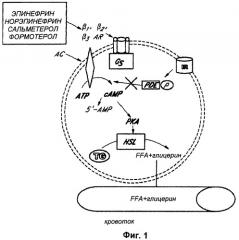
Клинические симптомы и признаки ОГ можно объяснить механически по увеличению объема ткани, выраженному в пределах глазницы. Увеличенные ткани глазницы вызывают смещение глазного яблока вперед и ухудшение венозного и лимфатического оттока из глазницы. Эти изменения в сочетании с локальной продукцией цитокинов и других медиаторов воспаления приводят к проптозу, периорбитальному отеку, конъюнктивальной эритеме и хемозу (Фиг.1).
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Здесь описаны композиции, препараты, способы и системы для лечения тиреоидной офтальмопатии путем приведения в контакт целевого отложения жира в глазу с композицией, содержащей агонист бета-2-адренергического рецептора длительного действия и соединение, которое снижает десенсибилизацию бета-адренергического рецептора в ткани-мишени на агонист бета-2-адренергического рецептора длительного действия. Воплощения данной композиции вводят, например, посредством ретробульбарной (заглазной) инъекции и/или трансокулярно. Глюкокортикостероид имеет дополнительный эффект снижения числа воспалительных клеток и высвобождения воспалительных цитокинов, присутствующих в глазнице и в жировой ткани глазницы.
Соответственно, в одном аспекте здесь предложен способ уменьшения накопления глазничного жира у пациента, нуждающегося в этом (например, у субъекта, страдающего от тиреоидной офтальмопатии), путем введения указанному пациенту терапевтически эффективного количества по меньшей мере одного бета-адренергического агониста и терапевтически эффективного количества по меньшей мере одного соединения для уменьшения десенсибилизации бета-адренергического рецептора. В некоторых воплощениях пациент, нуждающийся в только что описанном лечении, страдает от офтальмопатии Грейвса. В некоторых воплощениях пациент, нуждающийся в лечении, страдает от увеличения внешних мышц глаза. В некоторых воплощениях указанный пациент страдает от проптоза.
В некоторых воплощениях введение по меньшей мере одного бета-адренергического агониста или по меньшей мере одного соединения для уменьшения десенсибилизации является парентеральным, пероральным, внутриглазным, внутриглазничным, внутрироговичным, глазным, ретробульбарным, периорбитальным, местным, внутримышечным, трансдермальным, сублингвальным, интраназальным или введением в дыхательные пути.
В некоторых воплощениях по меньшей мере одно соединение для уменьшения десенсибилизации бета-адренергического рецептора вводят до (например, от примерно 3 суток до примерно 7 суток до) по меньшей мере одного бета-адренергического агониста. В некоторых воплощениях по меньшей мере одно соединение вводят внутриглазным, внутриглазничным, глазным, периорбитальным, ретробульбарным или внутрироговичным путем введения. В некоторых воплощениях по меньшей мере одно соединение вводят в форме суспензии кристаллических микрочастиц.
В некоторых воплощениях по меньшей мере одно соединение вводят перорально и по меньшей мере один бета-адренергический агонист вводят в глаз. По меньшей мере один бета-адренергический агонист, вводимый в глаз, вводят в препарате кристаллических микрочастиц.
В некоторых воплощениях по меньшей мере один бета-адренергический агонист, подлежащий введению пациенту, содержит бета-адренергический агонист длительного действия. В некоторых воплощениях по меньшей мере одно соединение представляет собой глюкокортикостероид и бета-адренергический агонист длительного действия представляет собой сальметерол, формотерол или их комбинацию. В некоторых воплощениях бета-адренергический агонист, подлежащий введению, представляет собой бета-адренергический агонист, который является селективным в отношении бета-2-адренергического рецептора. В некоторых воплощениях по меньшей мере один бета-адренергический агонист содержит сальметерол, формотерол или любую их комбинацию. В некоторых воплощениях по меньшей мере один бета-адренергический агонист содержит сальметерол, и терапевтически эффективное количество сальметерола составляет от примерно 0,01 мкг/сутки до примерно 100 мкг/сутки (например, от примерно 1 мкг/сутки до примерно 100 мкг/сутки, от примерно 10 мкг/сутки до примерно 100 мкг/сутки, или от примерно 50 мкг/сутки до примерно 100 мкг/сутки) сальметерола. В других воплощениях по меньшей мере один бета-адренергический агонист содержит формотерол, и терапевтически эффективное количество формотерола составляет от примерно 0,001 мкг/сутки до примерно 50 мкг/сутки (например, от 0,01 мкг/сутки до примерно 1,0 мкг/сутки, от примерно 0,1 мкг/сутки до примерно 10 мкг/сутки, от примерно 1 мкг/сутки до примерно 20 мкг/сутки или от примерно 5 мкг/сутки до примерно 40 мкг/сутки).
В некоторых воплощениях по меньшей мере одно соединение для уменьшения десенсибилизации бета-адренергического рецептора представляет собой глюкокортикостероид, антигистаминное средство или любую их комбинацию. В некоторых воплощениях по меньшей мере одно соединение для уменьшения десенсибилизации бета-адренергического рецептора содержит дексаметазон, преднизолон, метилпреднизолон, флутиказона пропионат, будесонид, кетотифен или любую их комбинацию.
В некоторых воплощениях перед введением по меньшей мере одного бета-адренергического агониста и по меньшей мере одного соединения для уменьшения десенсибилизации бета-адренергического рецептора пациенту вводят терапевтически эффективное количество иммунодепрессанта внутриглазным, внутриглазничным, глазным, периорбитальным, ретробульбарным или внутрироговичным путем введения. В некоторых воплощениях иммунодепрессант вводят в форме суспензии кристаллических микрочастиц.
В другом аспекте здесь предложен способ лечения проптоза путем введения пациенту, нуждающемуся в лечении, композиции, содержащей терапевтически эффективное количество по меньшей мере одного бета-адренергического агониста.
В некоторых воплощениях по меньшей мере один бета-адренергический агонист содержит бета-адренергический агонист длительного действия. В некоторых воплощениях по меньшей мере один бета-адренергический агонист содержит бета-адренергический агонист, который является селективным в отношении бета-2-адренергического рецептора. В некоторых воплощениях по меньшей мере один бета-адренергический агонист содержит сальметерол, формотерол, бамбутерол, эформотерол, изопротеренол, альбутерол или фенотерол. В некоторых воплощениях композиция содержит смесь по меньшей мере одного бета-адренергического агониста длительного действия и по меньшей мере одного бета-адренергического агониста кратковременного действия. В некоторых воплощениях композиция также содержит терапевтически эффективное количество гиалуронидазы.
В некоторых воплощениях композиция содержит сальметерол, и пациенту вводят терапевтически эффективное количество сальметерола от примерно 0,01 мкг/сутки до примерно 100 мкг/сутки. В других воплощениях композиция содержит формотерол, и пациенту вводят терапевтически эффективное количество формотерола от примерно 0,001 мкг/сутки до примерно 50 мкг/сутки.
В некоторых воплощениях введение данной композиции является парентеральным, пероральным, внутриглазным, внутриглазничным, периорбитальным, глазным, ретробульбарным, внутрироговичным, местным, внутримышечным, трансдермальным, сублингвальным, интраназальным или введением в дыхательные пути.
В другом аспекте здесь предложен способ уменьшения накопления глазничного жира у пациента, нуждающегося в лечении, путем введения указанному пациенту терапевтически эффективного количества одного или более чем одного соединения, стимулирующего путь, ассоциированный с адренергическим рецептором, и терапевтически эффективного количества по меньшей мере одного соединения для уменьшения десенсибилизации бета-адренергического рецептора. В некоторых воплощениях одно или более чем одно соединение, стимулирующее путь, ассоциированный с адренергическим рецептором, содержит катехоламин, альфа-адренергический антагонист, форсколин, аминофиллин или их аналоги.
В еще одном другом аспекте здесь предложена офтальмологическая фармацевтическая композиция, содержащая офтальмологически приемлемый эксципиент и терапевтически эффективное количество метилпреднизолона ацетата или флутиказона пропионата в форме суспензии кристаллических микрочастиц. В некоторых воплощениях данная офтальмологическая фармацевтическая композиция дополнительно содержит солюбилизированный метилпреднизолона ацетат или солюбилизированный флутиказона пропионат. В некоторых воплощениях данная офтальмологическая фармацевтическая композиция дополнительно содержит терапевтически эффективное количество по меньшей мере одного бета-2-агониста длительного действия в форме суспензии кристаллических микрочастиц.
В другом аспекте здесь предложена офтальмологическая фармацевтическая композиция, содержащая офтальмологически приемлемый эксципиент и терапевтически эффективное количество по меньшей мере одного бета-2-агониста длительного действия в форме суспензии кристаллических микрочастиц. В некоторых воплощениях по меньшей мере один бета-2-агонист длительного действия содержит сальметерол или формотерол. В некоторых воплощениях офтальмологическая фармацевтическая композиция дополнительно содержит терапевтически эффективное количество по меньшей мере одного солюбилизированного бета-2-агониста длительного действия. В некоторых воплощениях офтальмологическая фармацевтическая композиция дополнительно содержит терапевтически эффективное количество по меньшей мере одного соединения для уменьшения десенсибилизации бета-адренергического рецептора в форме суспензии кристаллических микрочастиц.
В другом аспекте здесь предложено применение по меньшей мере одного бета-адренергического агониста и по меньшей мере одного соединения для уменьшения десенсибилизации бета-адренергического рецептора для изготовления лекарственного средства для лечения заболевания, включающего накопление глазничного жира.
В другом аспекте здесь предложено применение по меньшей мере одного бета-адренергического агониста и по меньшей мере одного соединения для уменьшения (десенсибилизации) бета-адренергического рецептора для применения в способе лечения заболевания, включающего накопление глазничного жира.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
Все публикации и патентные заявки, упомянутые в данном описании изобретения, включены в данное описание посредством ссылки в такой же степени, как если бы каждая отдельная публикация или патентная заявка была бы конкретно и отдельно указана как включенная посредством ссылки.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Новые отличительные признаки изобретения конкретно изложены в приложенной формуле изобретения. Лучшее понимание отличительных признаков и преимуществ настоящего изобретения будет получено посредством ссылки на следующее подробное описание, в котором изложены иллюстративные воплощения, в которых используются приниципы данного изобретения, и на сопровождающие графические материалы, в которых:
На ФИГ.1 представлена схематическая иллюстрация липолиза в адипоцитах.
На ФИГ.2 представлена гистограмма, иллюстрирующая дозозависимую индукцию липолиза в культивируемых адипоцитах с помощью бета-2-агониста длительного действия формотерола после трехчасовой инкубации.
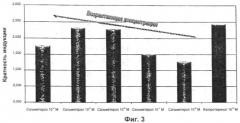
На ФИГ.3 представлена гистограмма, иллюстрирующая дозозависимую индукцию липолиза в культивируемых адипоцитах с помощью бета-2-агониста длительного действия сальметерола после трехчасовой инкубации.
На ФИГ.4 представлена гистограмма, иллюстрирующая дозозависимую индукцию липолиза в культивируемых адипоцитах с помощью глюкокортикостероида будесонида после короткого периода инкубации (три часа) и подавление липолиза после более длительных периодов инкубации (18 часов).
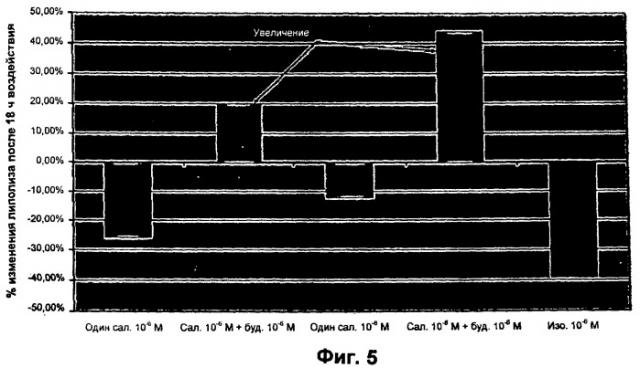
На ФИГ.5 представлена гистограмма, иллюстрирующая дозозависимое подавление липолиза в культивируемых адипоцитах бета-2-агонистом длительного действия сальметеролом, который давали один в течение 18 часов, и дозозависимую индукцию липолиза сальметеролом через 18 часов, когда его давали в комбинации с глюкокортикостероидом будесонидом.
На ФИГ.6 представлена гистограмма, иллюстрирующая среднее значение различий массы эпидидимального жирового тела у животного (левое жировое тело по сравнению с правым жировым телом) в жировых телах, в которые инъецировали раствор носителя (2% ПЭГ (полиэтиленгликоль)), один формотерол или формотерол плюс будесонид в течение трехсуточного периода обработки.
На ФИГ.7 представлена гистограмма, иллюстрирующая дозозависимое уменьшение массы жирового тела для двух разных комбинаций доз бета-2-агониста формотерола и глюкокортикостероида будесонида в течение трехсуточного периода обработки.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВОПЛОЩЕНИЯ
Изображения, полученные с помощью компьютерной томографии, показывают, что большинство пациентов с ОГ имеют увеличение как глазничного жира, так и внешних мышц глаза, тогда как другие, по-видимому, имеют только поражение жировой ткани или внешних мышц глаза. Сами клетки внешних мышц глаза являются интактными при раннем, активном заболевании, что показывает, что сами по себе они не являются мишенями для аутоиммунной атаки. Скорее увеличение тел внешних мышц глаза происходит из-за накопления в перимизиальных соединительных тканях гидрофильных мукополисахаридов, включающих, в частности, гиалуронан. На более поздней стадии заболевания рассасывающийся воспалительный процесс в мышцах может оставить их фиброзными и смещенными.
Увеличение объема жировых/соединительных тканей в глазнице, по-видимому, в большей степени способствует общему увеличению объема ткани глазницы, чем увеличение внешних мышц глаза. Исследования с помощью компьютерной томографии показывают, что у этих пациентов показатели проптоза наиболее точно коррелируют с объемом жирового компартмента. Этот увеличенный объем жировой ткани, по-видимому, происходит как из-за накопления гиалуронана при сопутствующем отеке, так и из-за появления в этих тканях популяции вновь дифференцированных жировых клеток.
Гистологическое исследование тканей глазницы при ОГ выявляет, что характерные изменения происходят, главным образом, из-за накопления гиалуронана при отеке, увеличения жирового компартмента и инфильтрации данных тканей Т-лимфоцитами. Жировые клетки глазницы при этом состоянии, по-видимому, являются дифференцированными, хотя и меньшими, чем другие жировые клетки данного организма (например, подкожные или сальниковые). В жировых клетках глазницы при ОГ экспрессируются более высокие уровни мРНК транскриптов PPAR-гамма, адипонектина и лептина. Кроме того, жировые клетки глазницы могут содержать меньше 11-бета-гидроксистероиддегидрогеназы типа 1, фермента, участвующего в превращении кортизона до активной формы - кортизола.
Исследования с использованием клеток, полученных из этих тканей, показали, что фибробласты глазницы представляют собой клетки глазницы, которые могут участвовать в этих разнообразных клеточных процессах. Эти клетки являются особенно чувствительными к стимуляции цитокинами и другими иммуномедиаторами, реагируя увеличением экспрессии CD40, синтезируя большие количества гиалуронана и секретируя воспалительные цитокины. Кроме того, преадипоцитная субпопуляция фибробластов способна дифференцироваться в зрелые жировые клетки, которые демонстрируют высокие уровни TSHR. Также было показано, что фибробласты демонстрируют IGF-1R (рецептор инсулиноподобного фактора роста 1). При связывании с IgG от пациентов с офтальмопатией Грейвса эти рецепторы инициируют нижележащие стадии передачи сигнала, что приводит к продукции RANTES (Regulated on Activation, Normal T-cell Expressed and Secreted - цитокин, регулируемый при активации, экспрессируемый и секретируемый нормальными Т-клетками) и IL-16 (интерлейкин-16) и приводит к локальной лимфоцитарной инфильтрации. Относительную сайт-специфичность участия глазницы в болезни Грейвса можно объяснить как относительной чувствительностью этих фибробластов к иммуномедиаторам, так и уникальными анатомическими особенностями этих сайтов, которые, по-видимому, предрасполагают их к сжатию лимфатических и венозных каналов низкого давления.
Жировая ткань представляет собой основую, запасающую энергию ткань организма. Жировые клетки или адипоциты хранят эту энергию в виде триглицеридов. Триглицериды мобилизуются из запасов жира для обеспечения организма энергией посредством гормональной индукции гидролиза триглицеридов. Этот процесс высвобождает свободные или неэтерифицированные жирные кислоты и глицерин в кровь для использования другими тканями организма. Расщепление триглицеридов из запасов жира называется липолизом. Также наблюдается рост новых адипоцитов, который называется липогенезом.
Катехоламины являются главными регуляторами жировой ткани посредством адренергических рецепторов. Жировая ткань имеет бета-1, 2 и 3 адренергические рецепторы и альфа-2-адренергические рецепторы. Связывание бета-агонистов с бета-рецепторами в жировой ткани может приводить к липолизу адипоцитов, тогда как связывание агонистов альфа-рецепторов может ингибировать липолиз. Активация бета-рецепторов также может ингибировать липогенез. У людей бета-2 рецептор часто является наиболее распространенным на поверхностях жировых клеток и представляет собой главный медиатор липолиза, стимулируемого бета-рецептором. Стимуляция липолиза бета-агонистами опосредована аденилатциклазой и усиленным образованием циклического аденозинмонофосфата (циклический АМФ, цАМФ). Альфа-2 рецепторы уменьшают липолиз в зрелых жировых клетках. Альфа-2 адренергические рецепторы могут участвовать в пролиферации преадипоцитов. Глюкокортикостероиды могут оказывать пермиссивный эффект на жировую ткань и увеличивать ответ адипоцитов, такой как липолиз, на стимуляцию катехоламинами. Это пермиссивное действие может быть обусловлено активацией бета-адренергических рецепторов и других компонентов, включенных во вторичные внутриклеточные мессенджеры.
Лечение ОГ неизбежно имело бы целью уменьшение объема увеличенной жировой ткани глазницы. Следовательно, препарат для уменьшения объема адипоцитов посредством липолиза может оказаться полезным для этого состояния. Кроме того, уменьшение воспалительного процесса и воспалительных клеток в глазнице, которые могут быть связаны с увеличением жировой ткани, может дополнительно уменьшить объем тканей глазницы. Кроме того, лечение накопления гиалуронана в глазнице может обеспечить дополнительное уменьшение объема и облегчение офтальмопатии. Наконец, ингибирование липогенеза может улучшить данное состояние.
Предложили и показали, что доставка адренергически активных ингредиентов в подкожную ткань как бета-агонистов, так и альфа-2 антагонистов, приводит к потере регионарного жира и к лучшему виду регионарных накоплений жира. Например, показали, что изопротеренол 11 и йохимбин 8 уменьшают окружность бедра у женщин. Так как эти липолитические агенты, особенно бета-агонисты, действуют кратковременно и могут быстро удаляться из жировой ткани, вероятно, что липолиз происходил только в течение короткого времени после инъекции, снижая посредством этого потенциальную величину эффекта, несмотря на многочисленные инъекции. Кроме того, длительное воздействие бета-агонистов на адипоциты приводит к десенсибилизации и понижающей регуляции рецепторов и к потере липолитической активности. Средства для снижения или предупреждения этих эффектов на рецептор также могут улучшать терапию. Тем не менее, стратегия по обработке адипоцитов при ОГ с использованием адренергических агентов и глюкокортикостероидов для индукции липолиза и ингибирования липогенеза может обеспечить эффективное уменьшение массы ткани, ответственной за клинические признаки и симптомы.
Здесь описаны воплощения фармацевтических композиций, препаратов, способов и систем для лечения тиреоидной офтальмопатии (например, офтальмопатии Грейвса или "ОГ") путем уменьшения массы ткани глазницы. Уменьшение массы ткани глазницы может уменьшить проптоз, восстановить или предупредить потерю зрения и диплопию и уменьшить боль. Это уменьшение массы ткани можно осуществлять, делая по меньшей мере одно из следующего, включая: уменьшение массы глазничного жира, уменьшение воспаления (например, воспалительных клеток и цитокинов) и уменьшение накопления гликозаминоглюканов (ГАГ). Уменьшения массы жира можно добиться посредством модуляции адренергической системы. Как использовано и/или процитировано здесь, термин "модуляция" обычно используется в его общем смысле и более конкретно относится к агонизму адренергического рецептора, антагонизму адренергического рецептора и/или к изменениям в рецептор-ассоциированных сигнальных путях. Один пример изменения в рецептор-ассоциированных сигнальных путях включает увеличение (концентрации) циклического АМФ, например, как схематически проиллюстрировано на ФИГ.1. В некоторых воплощениях "модуляция" относится к повышающей регуляции рецептора или к увеличению числа адренергических рецепторов, к уменьшению дезактивации или секвестрации рецептора, к изменениям активности рецептора (например, к увеличению активности) и/или к изменениям аффинности рецептора. Модуляция адренергических рецепторов предпочтительно может производиться с применением глюкокортикостероида или антигистаминного средства, которые также будут работать для уменьшения воспаления. Аналогично, накопление гликозаминогликана можно уменьшить с применением глюкокортикостероида и можно дополнительно уменьшить с применением фермента для деградации гиалуроновой кислоты, такого как рекомбинантная человеческая гиалуронидаза.
Уменьшение массы жира в ткани глазницы предпочтительно достигают неабляционным путем, инициируя липолиз, ингибируя липогенез или уменьшая накопление липидов. Абляционные способы уменьшения (содержания) жира, такого как фосфатидилхолин или дезоксихолат, могут быть проблематичными для применения позади глаза, где неселективное разрушение ткани может привести к повреждению нервов или мышц и может вызвать рубцевание и фиброз. Стимулирование липолиза, ингибирование липогенеза и уменьшение накопления липидов может быть достигнуто через стимуляцию бета-адренергических рецепторов. Стимуляция бета-адренергических рецепторов также может противодействовать некоторым клеточным транскриптам, которые, как известно, активируются в жировых клетках глазницы при болезни Грейвса, такие как PPAR-гамма, адипонектин и лептин. Например, стимуляция бета-адренергического рецептора может уменьшать экспрессию PPAR-гамма и адипонектина в дифференцированных адипоцитах. Считают, что некоторые воплощения пролонгированной модуляции адренергических рецепторов в жировой ткани приводят к некоторой комбинации пролонгированного липолиза, пониженного содержания липидов адипоцитов, уменьшенного размера клеток адипоцитов, уменьшенной массы жировой ткани и/или уменьшенного накопления жира. Некоторые воплощения обеспечивают селективное уменьшение накопления жировой ткани и адипоцитов в глазнице посредством пролонгированной адренергической модуляции. В некоторых воплощениях пролонгированная адренергическая модуляция приводит к пролонгированному ингибированию пролиферации жировых клеток (липогенеза).
Различные воплощения раскрытых фармацевтических композиций включают по меньшей мере один селективный агонист бета-2-адренергического рецептора (например, селективный бета-2-агонист длительного действия) в комбинации с по меньшей мере одним соединением, которое уменьшает десенсибилизацию бета-адренергических рецепторов, например, десенсибилизацию ткани-мишени на агонист(ы) бета-адренергических рецепторов, например, глюкокортикостероиды или кетотифен, или с их аналогами, и также уменьшает воспаление. Термин "десенсибилизация" включает как кратковременную десенсибилизацию (тахифилаксию), так и долговременную десенсибилизацию, а также десенсибилизацию на протяжении других периодов времени. Агонисты бета-2-адренергических рецепторов также называются здесь "бета-2-агонисты" и "агонисты бета-2 рецептора". Если не указано иначе, ссылки на агонисты бета-2-адренергических рецепторов также включают их аналоги, физиологически приемлемые соли и/или сольваты. В некоторых воплощениях данные композиции содержат от примерно 100:1 до примерно 1:100 селективного бета-2-агониста длительного действия к глюкокортикостероиду.
Как обсуждалось выше, считают, что липолитическая активность, ингибирование пролиферации адипоцитов и уменьшение накопления липидов опосредованы модуляцией адренергических рецепторов в жировой ткани и/или на адипоцитах. В некоторых воплощениях редукционная терапия усиливается посредством длительного воздействия или пролонгированной активности одного или более чем одного агониста адренергического рецептора и/или соединения, стимулирующего (сигнальный) путь, ассоциированный с рецептором, например, катехоламинов, бета-агонистов, альфа-антагонистов, форсколина, аминофиллина, их аналогов или комбинаций.
Некоторые воплощения обеспечивают пролонгированную адренергическую модуляцию посредством применения фармацевтических композиций, содержащих один или более чем один по существу селективный агонист бета-2 рецептора длительного действия. В некоторых воплощениях фармацевтическая композиция с пролонгированной активностью содержит один или более чем один подходящий селективный бета-2-агонист длительного действия, например, сальметерол 1, формотерол 2, бамбутерол 3, эформотерол, их физиологически приемлемые соли или сольваты, или их комбинации.
Пролонгированная адренергическая модуляция может не наблюдаться с типичными адренергическими композициями, поскольку адренергическое соединение обычно быстро удаляется из жировой ткани через кровь и/или лимфу, в частности, благодаря их гидрофильности. Кроме того, считают, что длительное воздействие адренергических агентов на жировую ткань, в частности агонистов бета-рецептора, приводит к десенсибилизации рецептора посредством фосфорилирования и секвестрации рецептора. Считают, что эти эффекты ограничивают способность адренергически модулирующей композиции лечить жировую ткань и приводят к тахифилаксии, состоянию, при котором организм демонстрирует быстро ослабевающий ответ на агонист после введения первоначальных доз по отношению к желаемому липолитическому и антилипогенному эффекту. Соответственно, лечебный эффект является кратковременным.
бета-2-Агонисты кратковременного действия часто приводят к тахифилаксии, как обсуждалось выше. Однако, поскольку предпочтительные воплощения селективных бета-2-агонистов длительного действия обладают по существу селективной бета-2-рецепторной активностью и высокой липофильностью, активности бета-2-агонистов длительного действия сохраняются в жировой ткани в течение более длительных периодов времени по сравнению с бета-2-агонистами кратковременного действия. Активность частичного антагониста бета-2 рецептора, которая наблюдается при применении сальметерола, может предотвращать некоторую десенсибилизацию, которая может происходить при непрерывном воздействии полных адренергических агонистов на адипоциты. Кроме того, сальметерол может не полностью активировать аррестиновый сигнальный путь, который приводит к интернализации и деградации рецептора и к долговременной понижающей регуляции рецептора. По сравнению с бета-2-агонистами кратковременного действия, липолиз также происходит в течение более длительного времени после введения, поскольку селективные бета-2-агонисты длительного действия имеют более продолжительные периоды полувыведения. Комбинация более продолжительных периодов полувыведения и активностей может снижать частоту введения фармацевтических композиций. Следовательно, в некоторых воплощениях не требуется ежесуточного введения композиции или ее введения более чем один раз в сутки. Кроме того, предпочтительные воплощения селективных бета-2-агонистов длительного действия демонстрируют также большую селективность в отношении бета-2 рецепторов, обеспечивая по существу аналогичные терапевтические эффекты соединения по сравнению с бета-2-агонистами кратковременного действия, при более низкой дозировке. Кроме того, более селективная бета-2 активность может ограничивать побочные эффекты на сердце, которые часто индуцируются стимуляцией бета-1 рецепторов в сердце.
Как обсуждалось выше, липолиз и/или ингибирование липогенеза и накопления липидов стимулируются бета-1, 2 или 3 подтипами рецептора. Таким образом, агонисты к одному, двум и/или всем трем рецепторам способны стимулировать липолиз и/или ингибировать липогенез. Считают, что у людей активность бета-2 рецепторов является более важной для стимуляции липолиза, особенно в присутствии противовоспалительного стероида или глюкокортикостероида.
Селективные бета-2-агонисты длительного действия, например, сальметерол 1 (±2-(гидроксиметил)-4-[1-гидрокси-2-[6-(4-фенилбутокси)гексиламино]этил]фенол, CAS рег. №94749-08-3) и формотерол 2 (±N-[2-гидрокси-5-[1-гидрокси-2-[1-(4-метоксифенил)пропан-2-иламино]этил]-фенил]метанамид, CAS рег. №73573-87-2), являются предпочтительными в некоторых воплощениях. В некоторых воплощениях данные композиции содержат один или более чем один селективный бета-2-агонист длительного действия в виде физиологически приемлемых солей или сольватов, например, сальметерола ксинафоат и/или формотерола фумарат. Во многих случаях соли и/или сольваты бета-2-агонистов будут иметь желаемую активность. Соответственно, если не указано иначе, ссылки на активный ингредиент, например, на сальметерол 1, формотерол 2, изопротеренол 4, альбутерол 5, фенотерол и форсколин включают сами соединения, а также их физиологически приемлемые аналоги, соли и/или сольваты, или их комбинации.
Некоторые предпочтительные бета-агонисты длительного действия демонстрируют высокую собственную аденилатциклазную активность, которая увеличивает синтез цАМФ. Например, некоторые воплощения включают формотерол 2 в качестве бета-2 селективного агониста длительного действия, который демонстрирует некоторую комбинацию более высокой активности, пониженных системных эффектов, высокой собственной активации аденилатциклазы и/или увеличения (уровня) циклического АМФ, медиатора липолиза.
В некоторых предпочтительных воплощениях формотерол 2 присутствует в виде его физиологически приемлемой соли и/или сольвата. Подходящие физиологически приемлемые соли формотерола 2 включают, например, соли присоединения кислоты, происходящие из неорганических и органических кислот, такие как гидрохлорид, гидробромид, сульфат, фосфат, малеат, фумарат, тартрат, цитрат, бензоат, 4-метоксибензоат, 2-гидроксибензоат, 4-гидроксибензоат, 4-хлорбензоат, пара-толуолсульфонат, метансульфонат, аскорбат, салицилат, ацетат, сукцинат, лактат, глутарат, глюконат, трикарбаллилат, гидроксинафталинкарбоксилат, олеат, их комбинации и тому подобное. Предпочтительные воплощения содержат формотерол 2 в виде его фумаратной соли и/или в виде дигидрата. Подходящая концентрация формотерола 2 в ткани для обработки жировой ткани составляет от примерно 1 пМ до примерно 100 мкМ, более предпочтительно от примерно 0,1 нМ до примерно 10 мкМ, например, от примерно 1 нМ до примерно 1 мкМ, от примерно 40 нМ до примерно 3 мкМ, от примерно 0,1 мкМ до примерно 1 мкМ, или любую другую концентрацию формотерола в ткани от примерно 0,1 нМ до примерно 10 мкМ.
В некоторых воплощениях в описанных здесь композициях и способах используют сальметерол. Сальметерол 1 демонстрирует частичную агонистическую активность, которая, как полагают, уменьшает десенсибилизацию рецептора и может ограничивать аррестиновый сигнальный путь, приводя к меньшей понижающей регуляции рецептора. В некоторых воплощениях сальметерол 1 присутствует в виде его физиологически приемлемой соли и/или сольвата. Подходящие физиологически приемлемые соли сальметерола 1 включают, но не ограничиваются солями присоединения кислоты, происходящими из неорганических и органических кислот, такими как гидрохлорид, гидробромид, сульфат, фосфат, малеат, тартрат, цитрат, бензоат, 4-метоксибензоат, 2-гидроксибензоат, 4-гидроксибензоат, 4-хлорбензоат, пара-толуолсульфонат, метансульфонат, аскорбат, салицилат, ацетат, фумарат, сукцинат, лактат, глутарат, глюконат, трикарбаллилат, гидроксинафталинкарбоксилат, 1-гидрокси-2-нафталинкарбоксилат, 3-гидрокси-2-нафталинкарбоксилат, олеат, их комбинациями и тому подобным. В некоторых воплощениях сальметерол 1 предложен в виде 1-гидрокси-2-нафталинкарбоксилатной соли (гидроксинафтоата).
В некоторых воплощениях подходящая концентрация сальметерола 1 в ткани для обработки жировой ткани варьирует от примерно 1 пМ до примерно 100 мкМ, предпочтительно от примерно 1,0 нМ до примерно 1 мкМ, например, от примерно 10 нМ до примерно 1 мкМ, от примерно 40 нМ до примерно 3 мкМ, от примерно 0,1 мкМ до примерно 1 мкМ, или представляет собой любую другую концентрацию сальметерола в ткани от примерно 1,0 нМ до примерно 10 мкМ.
В некоторых воплощениях селективный бета-2-агонист длительного действия, подлежащий введению, представляет собой формотерол, и терапевтически эффективное количество формотерола составляет от примерно 0,001 до примерно 100 мкг/сутки, например, от примерно 0,001 до примерно 50, от 0,01 до примерно 1,0, от примерно 0,1 до примерно 10, от примерно 1 до примерно 20, от примерно 5 до примерно 40, от примерно 25 до примерно 75, от примерно 50 до примерно 100 мкг/сутки формотерола, или любую другую дозу формотерола от примерно 0,001 мкг/сутки до примерно 100 мкг/сутки.
В некоторых воплощениях селективный бета-2-агонист длительного действия, подлежащий введению, представляет собой сальметерол, и терапевтически эффективное количество сальметерола, подлежащее введению, составляет от примерно 0,01 мкг/сутки до примерно 1000 мкг/сутки, например, от примерно 0,1 мкг/сутки до примерно 100 мкг/сутки, от примерно 1 мкг/сутки до примерно 100 мкг/сутки, от примерно 10 мкг/сутки до примерно 100 мкг/сутки, от примерно 50 мкг/сутки до примерно 100 мкг/сутки, или любую другую дозу сальметерола от примерно 0,01 мкг/сутки до примерно 1000 мкг/сутки.
Используемый здесь термин "терапевтически эффективное количество" относится к достаточному количеству вводимого агента (например, бета-2-агониста длительного действия) или соединения, которое в некоторой степени будет ослаблять один или более симптомов заболевания или состояния, которое лечат. Результатом может быть уменьшение и/или облегчение признаков, симптомов или причин заболевания, или любое другое желаемое изменение биологической системы. Например, "эффективным количеством" для терапевтических применений является количество композиции, содержащей соединение, как здесь раскрыто, не