Способ диагностики воспалительного процесса при раннем ревматоидном артрите
Иллюстрации
Показать всеИзобретение относится к области медицины, биологии и биотехнологии и может быть использовано в качестве дополнительного метода обследования пациентов при ранней диагностике воспалительного процесса при раннем ревматоидном артирите. Сущность способа заключается в том, что из периферической крови или синовиальной жидкости выделяют РНК. Далее на основе количественного определения экспрессии мРНК генов цитокинов иитерлейкин-2 (ИЛ-2), интерлейкин-4 (ИЛ-4) и интерлейкин-10 (ИЛ-10) или интерлейкин-2 (ИЛ-2), интерлейкин-4 (ИЛ-4), интерлейкин-6 (ИЛ-6), интерлейкин-8 (ИЛ-8), интерлейкин-17 (ИЛ-17), интерлейкин-1β (ИЛ-1β), а также на основе количественного определения интерферона-гамма (IFNG) и фактора некроза опухолей (TNF) методом обратной транскрипции и полимеразной цепной реакции с регистрацией накопления продуктов реакции по флоуресценции непосредственно во время реакции оценивают баланс цитокинов. По флоуресценции непосредственно во время реакции оценивают баланс цитокинов. В дальнейшем рассчитывают парный баланс экспрессии различных цитокинов исходя из функциональной взаимосвязи. Применение изобретения снижает ошибку определения, связанную с индивидуальными особенностями экспрессии контрольного гена. 4 ил., 6 табл.
Реферат
Область техники, к которой относится изобретение
Предложенный способ относится к области медицины, биологии и биотехнологии и может быть использован в качестве дополнительного метода обследования пациентов при ранней диагностике воспалительных заболеваний на основе полимеразой цепной реакции с регистрацией накопления продуктов реакции «в реальном времени» (ПЦР «в реальном времени»).
Полимеразная цепная реакция (ПЦР) широко используется для амплификации нуклеиновых кислот и позволяет, в частности, выявить присутствие и определить количество нуклеиновой кислоты с определенной последовательностью нуклеотидов в РНК-образце.
Результаты полимеразной цепной реакции анализируют непосредственно в ходе реакции. Для регистрации результатов ПЦР в ходе процесса ее проводят в детектирующем амплификаторе в присутствии либо флуоресцентных интеркалирующих красителей, либо флуоресцентно меченых олигонуклеотидных праймеров или проб.
Ревматоидный артрит (PA) - аутоиммунное заболевание неизвестной этиологии, характеризующееся симметричным эрозивным артритом (синовитом) и широким спектром внесуставных (системных) проявлений. РА представляет собой яркую модель хронического воспаления, позволяющую изучать фундаментальные проблемы современной медицины, связанные с патогенезом и терапией различных заболеваний человека. PA - чрезвычайно распространенное заболевание, поражающее примерно 1-2% населения земного шара. К кардинальным признакам РА относится неуклонно прогрессирующее поражение суставов, приводящее к инвалидности и снижению продолжительности жизни пациентов. Традиционно РА рассматривают как модель антиген-специфической активации CD4+ Т-лимфоцитов по Тx1 типу, характеризующемуся преобладанием синтеза интерлейкина-2 (ИЛ-2), интерферона-γ (ИФН-γ) над продукцией интерлейкина-4 (ИЛ-4) [1-3]. Дисбаланс Тх1/Тх2 ответа усиливает активацию макрофагов, дендритных клеток, В-лимфоцитов, что сопровождается гиперпродукцией провоспалительных цитокинов (фактор некроза опухолей α (ФНО-α), интерлейкина-1β (ИЛ-1β), интерлейкина-6 (ИЛ-6), интерлейкина-8 (ИЛ-8), интерлейкина-15 (ИЛ-15), интерлейкина-17 (ИЛ-17), интерлейкина-18 (ИЛ-18) и др.) и пониженной экспрессией противовоспалительных цитокинов (ИЛ-4, растворимый антагонист рецептора ИЛ-1, растворимые ФНО-α рецепторы) [4-7].
Существует несколько субпопуляций Т-лимфоцитов, включая Т-хелперы 1 (Тх1) и 2 (Тх2) порядка. Каждая из них выделяет определенные цитокины: Tx1 - ИФН-γ, ИЛ-2, ФНО-α; Тх2 - ИЛ-4, ИЛ-5, ИЛ-6. В организме поддерживается определенное соотношение Tx1- и Тх2-клеток, а соответственно и секретируемых ими цитокинов. При патологиях данный баланс может быть нарушен.
Характеристики различных цитокинов
ФНО-α. Основным источником ФНО-α являются активированные макрофаги, in vitro вызывает лизис клеток лимфомы, некроз саркомы, in vivo активируют полиморфноядерные лейкоциты, проявляют антивирусную активность. Под влиянием ФНО-α резко увеличивается образование макрофагами и нейтрофилами перекиси водорода и других свободных радикалов.
ИЛ-1β. Основным источником продукции ИЛ-1β являются моноциты и макрофаги различной тканевой локализации, а также эндотелиоциты, Т-лимфоциты и В-лимфоциты, фибробласты, НК-клетки, кератиноциты и нейтрофилы. Является медиатором острого и хронического воспаления. Выполняет много важных функций, включая стимуляцию и выход нейтрофилов из костного мозга; активацию лимфоцитов и нейтрофилов.
ИЛ-2. ИЛ-2 является важным провоспалительным цитокином, который стимулирует пролиферацию и дифференцировку активированных Т-лимфоцитов в эффекторные Тх-лимфоциты или цитотоксические Т-клетки. ИЛ-2 может стимулировать крупные гранулярные лимфоциты, макрофаги и В-клетки. ИЛ-2 секретируется Т-лимфоцитами CD4+, а также Т-клетками некоторых других субпопуляций лимфоцитов. ИЛ-2 относится к группе гемопоэтинов, он был открыт одним из первых. В середине 60-х годов было показано, что культура стимулированных митогеном или антигеном лимфоцитов накапливает в надосадочной жидкости фактор, который значительно усиливает пролиферацию свежевыделенных лимфоцитов периферической крови in vitro. Особый интерес вызвал тот факт, что надосадок от культуры стимулированных лимфоцитов способен длительное время поддерживать пролиферацию интактных Т-клеток и обеспечивать функциональную активность клонов таких клеток. Активным соединением в культуральной жидкости стимулированных лимфоцитов оказался цитокин Т-клеточной природы, названный первоначально Т-клеточным ростовым фактором. Основным результатом действия ИЛ-2 на покоящиеся или стимулированные антигеном или митогеном клетки является обеспечение их пролиферации. Именно эта биологическая активность ИЛ-2 определяет его в качестве типичного ростового фактора клеток лимфо-миелоидного комплекса.
ИЛ-4 относится к группе гемопоэтинов. Раньше его называли фактором роста В-клеток. Источником ИЛ-4 являются Т-хелперы, стимулированные митогеном, тучные клетки, неидентифицированные клетки стромы костного мозга. Известно, что ИЛ-4 усиливает экспрессию антигенов гистосовместимости II класса (МНС II) в покоящихся В-клетках, а также синтез иммуноглобулинов IgG и IgE после стимуляции липополисахаридом (ЛПС), поддерживает жизнеспособность и рост интактных Т-клеток, повышает активность цитотоксических Т-лимфоцитов, усиливает пролиферацию предшественников гемопоэза при ответе на ростовые факторы. По отношению к В-клеткам ИЛ-4 выступает в качестве костимулятора пролиферации. Так, он не оказывает какого-либо влияния на покоящиеся В-клетки, однако достаточно подействовать на них одним из специфических для данных клеток индуктором активации, чтобы проявилось биологическое действие ИЛ-4: резкое повышении пролиферации данного типа клеток. Изначально ИЛ-4 был описан как В-клеточный ростовой фактор I. В последующем выяснилось, что он способен усиливать пролиферацию и Т-клеток, относящихся к различным субпопуляциям. Его действие на Т-клетки, как и на В-клетки проявляется только после предварительной их активации антигеном или митогеном. По своей природе ИЛ-4 выступает в качестве плейотропного регулятора, так как взаимодействует с самыми разнообразными типами клеток. Так, его действие на макрофаги проявляется в усилении экспрессии молекул II класса МНС и Fc-рецептора для IgG, приобретении противоопухолевой активности по отношению к фибросаркоме, усилении антигенпредставляющей функции.
ИЛ-6. Интерлейкин-6 продуцируется активированными моноцитами или макрофагами, эндотелиальными клетками, фибробластами, активированными Т-клетками, а также рядом клеток, не являющихся иммуноцитами. Некоторые эффекты, вызываемые ИЛ-6, аналогичны наблюдаемым при действии ИЛ-1 и ФНО. Однако основное действие ИЛ-6 связано с его участием в качестве кофактора при дифференцировке В-лимфоцитов, их созревании и преобразовании в плазматические клетки, секретирующие иммуноглобулины. Помимо этого, ИЛ-6 способствует экспрессии рецептора ИЛ-2 на активированных иммуноцитах, а также индуцирует производство ИЛ-2 Т-клетками. Этот цитокин стимулирует пролиферацию Т-лимфоцитов и реакции гемопоэза.
ИЛ-8. Интерлейкин-8 относится к группе хемокинов, основное свойство которых обеспечивать хемотаксис в зону воспаления различных типов клеток: нейтрофилов, моноцитов, эозинофилов, Т-клеток. ИЛ-8 обладает выраженными провоспалительными свойствами, вызывая экспрессию молекул межклеточной адгезии и усиливая прилипание нейтрофилов к эндотелиальным клеткам и субэндотелиальным матричным белкам, что свидетельствует о его основной роли в опосредовании воспалительного процесса. Клетками-продуцентами ИЛ-8 являются макрофаги, лимфоциты, эпителиальные клетки, фибробласты, клетки эпидермиса. Основная функция ИЛ-8 - выступать в качестве хемоаттрактанта для нейтрофилов, макрофагов, лимфоцитов, эозинофилов. Помимо этого биологического действия, ИЛ-8 усиливает адгезивные свойства нейтрофилов, изменяя экспрессию интегринов и других соединений с адгезивными свойствами. Свойства ИЛ-8 вызывать миграцию клеток и способствовать их адгезии определяют его как активного участника острой воспалительной реакции.
ИЛ-10. Является ключевым регулятором иммуного ответа, обладающим иммуносупрессорными свойствами. Синтезируется в основном Т-лимфоцитами, тучными клетками и макрофагами.
ИЛ-17 охарактеризован как провоспалительный цитокин, продуцируется субпопуляцией лимфоцитов Тх17, функционирует как фактор защиты организма от патогенов. Стимулирует синтез ИЛ-6, ИЛ-8, ФНО-α, ИЛ-1β, предполагают участие в поддержании количества нейтрофилов (гипотеза Stark M., 2005).
ИФН-γ обладает противовирусной активностью. Основное же свойство - регуляция иммунитета. Продуцируется главным образом активированными Т-лимфоцитами и НК-клетками. Основные функции: активация макрофагов; стимуляция экспрессии молекул II класса МНС; активация НК-клеток; регуляция синтеза изотипов иммммуноглобулинов В-лимфоцитами; прямая антивирусная активность.
Прогрессирование РА является динамически развивающимся процессом, который условно подразделяется на несколько стадий: ранняя (бессимптомная) стадия, характеризующаяся сосудистой и клеточной активацией; развернутая стадия (быстрая хронизация воспаления), проявляющаяся нарушением ангиогенеза, активацией эндотелия, клеточной миграцией, инфильтрацией активированными СВ4+Т-лимфоцитами синовиальной ткани, образованием ревматоидных факторов и иммунных комплексов, синтезом «провоспалительных» цитокинов, простагландинов, коллагеназы, металлопротеиназ; поздняя стадия, для которой характерны индуцированные хроническим воспалением автономные "опухолеподобные процессы", обусловленные соматической мутацией и дефектами апоптоза синовиальных клеток.
Одной из важнейших проблем современной ревматологии является постановка верного диагноза РА на его ранней стадии и дифференцирование данного заболевания от других ревматических болезней. Диагноз РА в первую очередь ставится на основании клинической картины. В связи с недостаточной специфичностью клинических критериев для постановки объективного диагноза необходимо проводить дополнительные лабораторные исследования (определение антител к ревматоидному фактору (IgM РФ) и аутоантител к циклическому цитруллированному пептиду (АЦЦП)), а также исследования, результаты которых позволяют более точно оценить состояние больного и скорректировать терапию. Одним из таких исследований может служить оценка цитокинового профиля в клетках периферической крови (далее «ПК») и синовиальной жидкости (далее «СЖ») с помощью полимеразной цепной реакции "в реальном времени" с предварительной постановкой реакции обратной транскрипции (далее «ОТ-ПЦР»).
Метод ОТ-ПЦР "в реальном времени" широко используется в научно-исследовательской работе, в том числе и для количественной оценки при изучении экспрессии мРНК генов цитокинов человека. При этом уровень экспрессии мРНК оценивается относительно экспрессии мРНК генов, обеспечивающих жизнеспособность клеток (именуемые как «гены домашнего хозяйства», контрольные гены, нормировочные гены, референсные гены), методами ΔCt (способ 1) или ΔΔCt (способ 2) [8]. Значение Ct - это автоматически определяемое программным обеспечением прибора значение цикла в точке пересечения с базовой линией.
К недостаткам этих способов относятся отсутствие «идеального контрольного гена», удовлетворяющего всем требованиям (прежде всего постоянство экспрессии во всех органах и тканях). Поэтому на практике нормировку осуществляют по нескольким контрольным генам, определяют фактор нормировки и сравнивают уровни экспрессии в различных образцах между собой (способ 2). К недостаткам 2 способа следует отнести необходимость проведения полного объема исследования со всеми образцами, что крайне неудобно в условиях клинически значимого приложения в рутинной практике.
Задача, решаемая предложенным изобретением, заключается в устранении указанных недостатков, в достижении более быстрого, более достоверного и более легкого диагностирования наличия воспалительного процесса при раннем ревматоидном артрите за счет анализа всего одного биологического материала.
Предложенный способ диагностики воспалительных заболеваний (модель ревматоидного артрита на ранней стадии) на основе количественного определения транскриптов генов цитокинов методом ПЦР "в реальном времени" предусматривает:
- использование контрольного гена (гипоксантин-гуанин фосфорибозилтрансферазы 1 - HPRT1) в большей степени для оценки качества выполнения всех этапов реакции, чем для нормировки при определении уровня экспрессии мРНК (матричной РНК) генов цитокинов,
- определение спектра цитокинов, характеризующихся повышенной экспрессией мРНК в ПК и СЖ,
- определение спектра цитокинов, характеризующихся пониженной экспрессией мРНК в ПК и СЖ (т.е. тех цитокинов, которые наиболее информативны для определения состояния пациента),
- поиск функциональных связей и связей, обуславливающих молекулярные процессы взаимного влияния в сети цитокинового каскада, отражающего развитие и течение воспалительного процесса при раннем ревматоидном артрите (далее «рРА»),
- вычисление маркеров (т.е. наиболее информативных цитокинов), учитывающих зависимость интенсивности воспалительного процесса при рРА, по формуле
[IL1]/[IL2]=Eil2 Ct2/Ei11 Ct1 (формула 1),
где
[IL1] - концентрация мРНК гена цитокина, характеризующегося повышенной экспрессией в ПК или СЖ;
[IL2] - концентрация мРНК гена цитокина, характеризующегося пониженной (или постоянной) экспрессией в ПК или СЖ;
Е - эффективность амплификации - величина, характеризующая прирост матрицы на каждом цикле амплификации (формула 2);
Ct1 и Ct2 - значение пороговых циклов, автоматически определяемое прибором, в исследуемом образце для соответствующего цитокина.
На практике эффективность амплификации определяется экспериментально по формуле
Е=10-(1/slope) (формула 2),
где
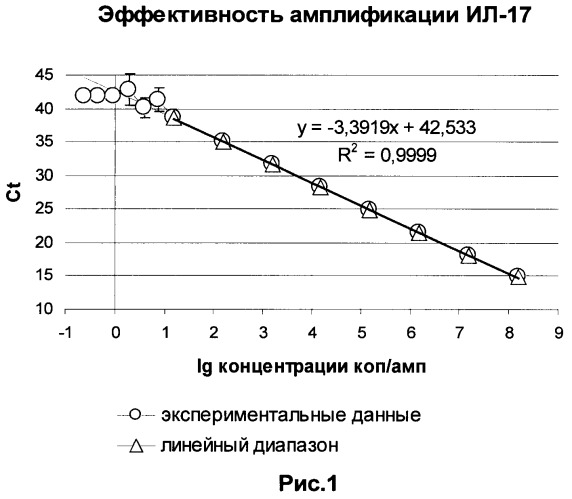
slope - разница в значениях Ct при 10 х кратном разведении образца (угловой коэффициент уравнения линейной зависимости Ct от логарифма (lg) концентрации матрицы) (рис.1).
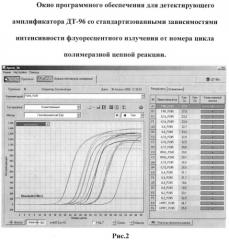
Таким образом, непосредственно в ходе ПНР «в реальном времени» получают стандартизованные зависимости интенсивности флуоресцентного излучения от номера цикла полимеразной цепной реакции (рис.2). Программное обеспечение автоматически осуществляет вычисление порогового цикла. Данные значения могут быть подставлены в формулу 1.
Технический результат, достигаемый при осуществлении предложенного изобретения, заключается, во-первых, в возможности оценки тяжести воспалительного процесса при рРА непосредственно сразу после проведения реакции; во-вторых, при расчетах во внимание не принимается значение Ct по нормировочному гену, что снижает вероятность ошибки метода, связанную с индивидуальными особенностями экспрессии контрольного гена в данном типе ткани; в-третьих, для более точной оценки уровней экспрессии актуальность использования нескольких нормировочных генов ставится под сомнение.
Краткое описание чертежей
На рис.1 приведен график зависимости Ct от логарифма (lg) концентрации матрицы. Угловой коэффициент равен -3,3919. Соответственно эффективность амплификации составляет 1,97. Эффективность амплификации определяется в серии экспериментов с разведением матрицы в области концентраций линейного диапазона тест-систем как среднее значение.
На рис.2 показаны стандартизованные зависимости интенсивности флуоресцентного излучения от номера цикла полимеразной цепной реакции для всего исследуемого спектра цитокинов. Значение порогового цикла определяется автоматически прибором, как точка пересечения данных графиков с базовой линией (Threshold).
В табл.1 приведены значения эффективности амплификации для всех тест-систем.
В табл.2 приведены показатели, свидетельствующие о воспалительном процессе.
В табл.3 показан объем проведенных исследований: было обследовано 116 человек, при этом исследовался 101 образец ПК и 91 образец СЖ.
На рис.3 показано соотношение уровней экспрессии цитокинов в периферической крови, выявленное в результате исследования ПК, где левая шкала - это соотношение уровня экспрессии ИЛ-10/ИЛ-4 и ИЛ-10/ИЛ-2 при раннем ревматоидном артрите у пациентов.
На рис.4 показано соотношение уровней экспрессии цитокинов в синовиальной жидкости, выявленное в результате исследования СЖ, где левая шкала - это соотношение уровня экспрессии провоспалительных цитокинов (ФНО-α, ИЛ-6, ИЛ-8, ИЛ-17, ИФН-γ, ИЛ-2) и ИЛ-4 при ревматоидном и раннем ревматоидном артрите у пациентов.
В табл.4 приведены соотношения статистических показателей уровней экспрессии цитокинов в синовиальной жидкости у пациентов группы сравнения с остеоартрозом, где М и σ - это соответственно средние значения и средние квадратичные отклонения.
В табл.5 показаны коэффициенты корелляции С-реактивного белка (СРБ) и ревматоидного фактора (РФ) с соотношением цитокинов (по Спирмену).
В табл. 6 представлены показатели цитокинового профиля на примере пациентов со слабым (пациент №Р11/12) и резко выраженным (пациент №31/32) воспалительным процессом.
Осуществление изобретения
1 этап. Взятие материала
Материалом исследования является периферическая кровь (ПК) или синовиальная жидкость (СЖ) больных с подозрением на рРА.
Тяжесть воспалительного процесса при рРА можно определять по любой из этих жидкостей. Наиболее информативной является СЖ.
Взятие материала осуществляется в пробирки с ЭДТА (антикоагулянт, препятствующий свертыванию крови) в конечной концентрации 2 мг/мл.
ПК берут из вены обычным способом, СЖ берут из пораженного сустава шприцем.
2 этап. Выделение клеток
1 вариант: из ПК выделяют мононуклеары.
Разделение клеточных элементов крови проводят путем центрифугирования в градиенте плотности фиколла-урографина (плотность 1,077 г/мл). Выделение лимфоцитов проводят из 1 мл цельной крови. Полученные клетки ресуспендируют в 100 мкл физ. раствора.
Методика выделения лимфоцитов крови на фиколле: Boyum A. Separation of leukocytes from blood and bone marrow //Scand.J.Clin.Lab.Investig. - 1968. - Vol.21. - Suppl.97. p.1-9
2 вараинт: из СЖ осаждают все клетки.
- к 1 мл СЖ добавить 1 мл физиологического раствора;
- осадить клетки путем центрифугирования при 6000 об/мин в течение 10 минут;
- супернатант удалить,
- полученные клетки ресуспендировать в 100 мкл физ.раствора.
3 этап. Выделение РНК.
Для выделения РНК используют наборы "Проба НК" (производства ЗАО «НПФ ДНК-технология») с модификацией (фенольная депротеинизация). Метод основан на лизисе образцов в 4М растворе гуанидинтиоционата, фенольной депротеинизации, осаждении нуклеиновых кислот изопропанолом в присутствии соосадителя, с последующими отмывками этанолом и ацетоном.
Объем образцов после выделения 50 мкл.
Различий применительно к ПК и СЖ нет.
Методика выделения РНК:
- подготовить одну пробирку для отрицательного контрольного образца - «К-»;
- добавить в каждую пробирку с клетками ПК и СЖ, а также «К-» 300 мкл лизирующего раствора;
- плотно закрыть крышки пробирок, встряхнуть на вортексе в течение 3-5 с;
- термостатировать пробирки 15 мин при 65°С, осадить конденсат центрифугированием при 13000 об/мин в течение 30 с;
- добавить 400 мкл насыщенного фенола, встряхнуть пробирки на вортексе в течение 30 с;
- осадить капли со стенок пробирки центрифугированием при 13000 об/мин в течение 30 с;
- добавить 160 мкл раствора хлороформ:изоамиловый спирт в соотношении 24:1, встряхнуть пробирки на вортексе в течение 30 с;
- центрифугировать пробирки при 13000 об/мин в течение 10 мин;
- отбирать супернатант в новую пробирку;
- добавить 400 мкл насыщенного фенола, встряхните пробирки на вортексе в течение 30 с;
- осадить капли со стенок пробирки центрифугированием при 13000 об/мин в течение 30 с;
- добавить 160 мкл раствора хлороформ:изоамиловый спирт в соотношении 24:1, встряхнуть пробирки на вортексе в течение 30 с;
- центрифугировать пробирки при 13000 об/мин в течение 10 мин;
- добавьте 400 мкл реагента для преципитации (изопропанол) и встряхнуть пробирки на вортексе в течение 3-5 с;
- центрифугировать пробирки при 13000 об/мин в течение 15 мин;
- не задевая осадок, полностью удалить надосадочную жидкость (отдельным наконечником из каждой пробирки);
- добавить к осадку 500 мкл промывочного раствора №1 (70%-этанол) и 3-5 раз аккуратно перевернуть каждую пробирку;
- центрифугировать пробирки при 13000 об/мин в течение 5 мин;
- не задевая осадок, полностью удалить надосадочную жидкость (отдельным наконечником из каждой пробирки);
- добавить к осадку 300 мкл промывочного раствора №2 (ацетон) и 3-5 раз аккуратно перевернуть каждую пробирку;
- центрифугировать пробирки при 13000 об/мин в течение 5 мин;
- не задевая осадок, полностью удалить надосадочную жидкость (отдельным наконечником из каждой пробирки);
- открыть крышки пробирок и высушить осадок при 65°С в течение 5 мин;
- добавить к осадку 50 мкл буфера для растворения;
- прогреть пробирки при 65°С в течение 10 мин;
- встряхнуть образцы на вортексе для растворения материала, осадить капли центрифугированием пробирок при 13000 об/мин в течение 30 с.
Препарат РНК готов для постановки реакции обратной транскрипции.
Полученный препарат РНК рекомендуется сразу использовать для постановки реакции обратной транскрипции. Препарат РНК можно хранить при температуре минус 20°С в течение 1 месяца или при минус 70°С в течение 1 года.
4 этап. Обратная транскрипция
Реакция обратной транскрипции осуществляется ферментом обратной транскриптазой в определенном буфере в присутствии матричной РНК (мРНК), дезоксинуклеотидтрифосфатов и праймеров при температуре 40°С в течение 60 мин. Инактивация обратной транскриптазы осуществляется при 95°С в течение 15 минут.
В ходе реакции фермент обратная транскриптаза с матрицы РНК (мРНК) синтезирует комплиментарную ей ДНК (кДНК) путем полимеризации дезоксинуклеотидтрифосфатов, используя в качестве затравки комплиментарной цепи праймеры.
В качестве праймеров для обратной транскрипции используют специфические олигонуклеотиды.
Состав реакционной смеси в пробирке при проведении реакции обратной транскрипции:
- тридистиллированная вода, обработанная DEPC - 0,7 мкл;
- реакционный буфер* - 4 мкл
- смесь дезоксирибонуклеотидтрифосфатов четырех типов в концентрации 25 мкМ каждого дезоксирибонуклеотидтрифосфата- 0,2 мкл;
- праймеры** (11 специфических олигонуклеотидов) в концентрации 100 мкМ каждого - 0,1 мкл;
- обратная транскриптаза в концентрации 500 международных единиц активности - 1 мкл;
- исследуемый образец мРНК - 33 мкл.
*состав реакционного буфера: 0,5 М Tris-HCl рН 8,3, 0,75 М КСl, 30 мМ MgCl2, 50 мМ DTT, 0,1% DEPC.
** праймеры:
ФНО-α 5'-ggg TTC gAg AAg - 3';
ИЛ-1β 5'- gTC CAT ggC CAC - 3';
ИЛ-2 5'- gTT gTT TCA gAT С - 3';
ИЛ-4 5' - ССТ TCA CAg gAC - 3';
ИЛ-6 5' - CAC CAg gCA AgT С - 3';
ИЛ-8 5' - СТС ТСТ ТСС АТС - 3';
ИЛ-10 5' - CAC Agg gAA gAA - 3';
ИЛ-17 5' - Cgg CAC TTT gCC - 3';
ИФН-γ 5' - Tgg АСА TTC AAg - 3';
HPRT1 5' - ТСС АСА АТС Aag - 3'.
Для увеличения объемов образцов после обратной транскрипции кДНК разводят в 5 раз деионизованной водой.
5 этап. ПЦР.
Праймеры и зонды для ПЦР подобраны с учетом структур экзонов и интронов таким образом, чтобы исключить отжиг на матрице геномной ДНК цитокинов и HPRT1 (контрольного гена). Это позволяет не использовать дополнительный этап обработки нуклеиновых кислот ДНК-азой.
В стандартных ранее предлагаемых протоколах данный этап проводился, чтобы убрать из образца ДНК, т.к. реакция может идти не на кДНК, полученной в ходе реакции обратной транстрипции, а на геномной ДНК. Нужно было исключить реакцию на геномной ДНК, например убрав ее ДНК-азой. Предлагаемая методика за счет специфичности праймеров к мРНК исключает отжиг матрицы на геномной ДНК, поэтому данный этап не нужен.
ДНК-зонды, использовавшиеся для детекции продуктов амплификации генов цитокинов и HPRT1, помечены FAM. Реакции амплификации цитокинов и HPRT1 ставят в разных пробирках. Для повышения чувствительности и специфичности ПЦР был применен "горячий старт", который обеспечивается использованием парафина. Оптимальную температуру отжига праймеров и зондов подбирали экспериментально с использованием режима «градиент температур», для всех тест-систем температура была унифицирована и составила 62°С.
Амплификацию осуществляют в режиме "реального времени" в объеме 35 мкл по следующей программе: 1 цикл - 80°С 30 сек, 94°С 1 мин; 50 циклов - 94°С 10 сек, 62°С 20 сек, использовали приборы "ДТ-322" и "ДТ-964" производства фирмы ЗАО "НПО ДНК-Технология". Измерение уровня флуоресценции проводят на каждом цикле при температуре 62°С.
Состав реакционной смеси в пробирке при проведении ПЦР:
- бидистиллированная вода - 25,37 мкл
- реакционный буфер* - 3,5 мкл
- смесь дезоксирибонуклеотидтрифосфатов четырех типов в концентрации 25 мкМ каждого дезоксирибонуклеотидтрифосфата- 0,24 мкл
- праймер №1** в концентрации 100 мкМ - 0,125 мкл
- праймер №2** в концентрации 100 мкМ - 0,125 мкл
- детектирующая проба** в концентрации 50 мкМ (реагент, меченный флуорофором, для определения искомой мишени) - 0,07 мкл
- Taq - полимераза в концентрации 5 международных единиц активности - 0,5 мкл
- исследуемый образец кДНК, полученный в ходе реакции обратной транскрипции (см. 4 этап выше) - 5 мкл.
* состав реакционного буфера: 100 мМ Tris-HCl (pH 8.8 при 25°С), 500 мМ КСl, 0.8% Р40, 20 мМ MgCl2
** праймеры и детектирующие пробы: для ФНО-α праймер №1 -5'- gAT Cgg CCT CCA gAg ggA Ag - 3'; праймер №2- 5'- ggg TTC gAg AAg ATg АТС - 3'; детектирующая проба- (FAM)-5'- gCC CTC Tgg CCC AggCAg-3'-(BHQ1);
ИЛ-1β праймер №1 5'- gCC СТА AAC AgA TgA AgT - 3';
праймер №2 -5'-gTC CAT ggC CAC AAC AAC - 3'; детектирующая проба - (FAM) -5'- gCg gCC TgC CTg AAg CCC - 3'-(BHQ1);
ИЛ-2 праймер №1 -5'-CCC AAA CTC ACC Agg ATg С - 3';
праймер №2 -5'- gTT gTT TCA gAT CCC TTT Ag-3'; детектирующая проба - (FAM)- 5'- CAg TTC TgT ggC CTT CTT gg - 3'-(BHQ1);
ИЛ-4 праймер №1 -5'-gAC АТС TTT gCT gCC TCC AAg - 3';
праймер №2 -5'-CCT TCA CAg gAC Agg AAT Т-3'; детектирующая проба - (FAM)-5'- TTT GCC GGA GCA CAG TCG CAG - 3'-(BHQ1);
ИЛ-6 праймер №1 -5'- gAA CTC CTT CTC CAC AA - 3';
праймер №2 -5'-CAC CAg gCA AgT CTC CTC - 3'; детектирующая проба (FAM)-5'- GCC TGC TGC CTT CCC TGC С - 3'- (BHQ1);
ИЛ-8 праймер №1 -5' - TgC AgC TCT gTg TgA Ag - 3'; праймер №2 - 5' - CTC TCT ТСС АТС AgA AAg CTT - 3'; детектирующая проба - (FAM)- 5'- gCg Cag TgT ggT CCA CTC TCA - 3'- (BHQ1);
ИЛ-10 праймер №1 -5'- CTT gCT ggA ggA CTT TAA gg-3'; праймер №2 -5'- CAC Agg gAA gAA АТС gAT gA - 3'; детектирующая проба -(FAM)5'-CCT ggA ggA ggT gAT gCC С - 3'-(BHQ1);
ИЛ-17 праймер №1 -5'- Tgg gAA gAC CTC ATT ggT - 3'; праймер №2 5'- Cgg CAC TTT gCC ТСС CAg A-3'; детектирующая npoбa(FAM)- 5'- CCA CgA AAT CCA ggA TgC CC - 3'- (BHQ1);
ИФН-γ праймер №1 -5'- gAA gAA TTg gAA AgA ggA gAg - 3'; праймер №2 5'- Tgg АСА ТТС AAg TCA gTT AC - 3'; детектирующая проба - (FAM)-5'- gTC ТСС АСА CTC TTT Tgg AT -3'-(BHQ1);
HPRT1 праймер №1 5'- ggA СТА ATT ATg gAC Agg ACT g - 3'; праймер №2 -5'- ТСС АСА АТС AAg АСА ТТС - 3'; детектирующая проба - (FAM)-5'- CAG ССС ССС TTG AGC АСА CAG - 3'-(BHQ1).
Пробирки помещают в детектирующий амплификатор (прибор, позволяющий одновременно проводить ПЦР и регистрировать флуоресцентное излучение в пробирке), например детектирующий амплификатор ДТ-96 (производства ЗАО «НПФ ДНК-Технология», Россия), и проводят ПЦР с регистрацией результатов «в режиме реального времени».
6 этап: анализ результатов
Как отображено на рис.2, для каждого образца ПК или СЖ получают набор значений Ct (автоматически определяемое программным обеспечением прибора значение цикла в точке пересечения с базовой линией) для каждого цитокина. Данные значения Ct подставляют в формулу 1:
[IL1]/[IL2]=Eil2 Ct2/Eil1 Ct1
Еффективность амплификации определена экспериментально (табл.1). Для различных тест-систем она составила 1,96-1,98, за исключением ИЛ-4 (1,92).
В ходе проведения исследования было установлено, что при рРА может быть повышена экспрессия мРНК провоспалительных цитокинов (ФНО-α, ИЛ-1β, ИЛ-6, ИЛ-8 и ИЛ-17), а также иммуносупрессорного ИЛ-10 и снижена экспрессия мРНК противовоспалительного ИЛ-4. Наиболее информативной для оценки воспалительного процесса при рРА является СЖ (вариант 2). Следующие показатели (табл.2) в ПК и СЖ могут являться предиктом воспалительного процесса:
вариант 1 для ПК: интерлейкин - 10/интерлейкин - 2>1,5
интерлейкин - 10/интерлейкин - 4>1,0
вариант 2 для СЖ: интерлейкин - 2/интерлейкин - 4>10
интерферон-γ/интерлейкин - 4>300
фактор некроза опухолей-α/интерлейкин - 4>2000
интерлейкин - 1β/интерлейкин - 4>5 000
интерлейкин - 6/интерлейкин - 4>10
интерлейкин - 8/интерлейкин - 4>10000
интерлейкин - 17/интерлейкин - 4>5
Принципиальным отличием предлагаемого метода является то, что нет необходимости использовать нормировочный ген.
Примеры осуществления предложенного способа
Было обследовано 116 человек, исследован 101 образец ПК и 91 образец СЖ (табл.3). Сформировано 4 группы исследования:
- в 1 группу вошли условно-здоровые пациенты (контроль). В момент обследования инфекционные, респираторно-вирусные, аутоиммунные, аллергические и др. заболевания были исключены. Численность группы составила 25 человек. Ввиду сложности взятия у этой группы СЖ в исследование была взята только ПК.
- во 2 группу были включены пациенты с диагнозом ревматоидный артрит (РА). Численность группы составила 49 человек. В исследование была взята СЖ и ПК.
- в 3 группу были включены пациенты с диагнозом ранний ревматоидный артрит (рРА). Численность группы составила 27 человек. В исследование была взята СЖ и ПК.
- в 4 группу были включены пациенты с диагнозом остеоартроз (ОА). Численность группы составила 15 человек. В исследование была взята только СЖ. Данная группа была выбрана в качестве группы сравнения, поскольку взятие материала в данном случае было возможно, а также в силу того, что данное заболевание является хроническим невоспалительным заболевание суставов в отличие от ревматоидного артрита.
Результаты исследования ПК представлены на рис.3. Соотношение уровня экспрессии ИЛ-10/ИЛ-4 и ИЛ-10/ИЛ-2 при раннем ревматоидном артрите было достоверно выше (соответственно р=0,0063, р=0,00009), чем в контрольной группе. На рис.3 представлены медианы в группах, а также 25% и 75%-квартили для контрольной группы. Среднее значение (М) в контрольной группе ИЛ-10/ИЛ-4 составило 0,4, среднее квадратичное отклонение (σ) 0,2. Общая формула (табл.2) для всех соотношений была рассчитана как
Интерлейкин-1/интерлейкин-2≥М+3σ (формула 3).
Среднее значение (М) в контрольной группе ИЛ-10/ИЛ-2 составило 0,4, среднее квадратичное отклонение (σ) 0,3.
Таким образом, расчеты по формуле 3 в контрольной группе ИЛ-10/ИЛ-4=1, ИЛ-10/ИЛ-2=1,3. При наличии воспалительного процесса данные показатели будут выше.
Результаты исследования СЖ представлены на рис.4. Соотношение уровня экспрессии провоспалительных цитокинов (ФНО-α, ИЛ-6, ИЛ-8, ИЛ-17, ИФН-γ, ИЛ-2) и ИЛ-4 при ревматоидном и раннем ревматоидном артрите было достоверно выше, чем в группе сравнения с остеоартрозом. На рис.4 представлены медианы в группах, а также 25% и 75%-квартили для контрольной группы и группы ревматоидного артрита. Средние значение (М) и средние квадратичные отклонения (σ) в контрольной группе представлены в табл.4. На основании них и была выведена формула изобретения.
Сопоставление полученного цитокинового профиля с активностью воспалительного процесса при рРА.
Для оценки активности воспалительного процесса при рРА был выбран такой лабораторный маркер воспаления, как С-реактивный белок (СРБ). В качестве иммунологического маркера РА использовался IgM ревматоидный фактор (РФ). Уровень СРБ и РФ измерялся высокочувствительным методом на лазерном нефелометре "BN-100" (Dade Behring, США), единицы измерения мг/л.
Получены умеренные и хорошие положительные корреляции данных показателей с показателями цитокиновых соотношений (табл.5).
Рассмотрим два примера
Пациент № Р11/12. Мужчина, возраст 54 года. Количество пораженных суставов - 14. На момент обследования показатели СРБ в крови 0,67, в СЖ 0,26 мг/л; РФ в крови и СЖ 0,1 мг/л, что свидетельствует о низкой активности воспалительного процесса. Показатели соотношения цитокинов (табл.6) также свидетельствуют о низкой активности воспалительного процесса в данный момент.
Пациент № Р31/32. Женщина, возраст 59 лет. Количество пораженных суставов 1. На момент обследования показатели СРБ в крови 20,88, в СЖ 19,28 мг/л; РФ в крови 247,2; СЖ 324,7 мг/л, что свидетельствует о высокой активности воспалительного процесса. Показатели соотношения цитокинов (табл.6) также свидетельствуют о высокой активности воспалительного процесса в данный момент.
Источники информации
1. Dolhain R.J.E.M., van der Heiden A.N., ter Haar N.T. et al. Shift toward Т lymphocytes with a T helper 1 cytokine-secretion profile in the joints of patient with rheumatoid arthritis // Arthritis Rheum. - 1996. - Vol.39. - P.1961-1969.
2. Morita Y., Yamamura M., Kawashima M. et al. Flow cytometric singl-cell analisis of cytokine production by CD4+ T cell in synovial tissue and periferal blood from patients with rheumatoid arthritis // Arthritis Rheum. - 1998. - Vol.41. - P.1669-1676.
3. Simon A.K., Seipelt E., Sieper J. Divergent T-cell cytokine patterns in iflammatory arthritis // Proc Nati Acad Sci USA. - 1994. - Vol.91. - P.8562-8566.
4. Abbas A.K. Murphy K.M., Sher A. Functional diversity of Т helper lymphocytes. //Nature. - 1996. - Vol.383. - P.787-793.
5. Miosses P., van den Berg W. Th1/Th2 cytokine balance inarthritis // Arthritis Rheum. - 1997. - Vol.40. - P.2105-2115.
6. Van Roon J.A., van Roy J.L., Duits A. et al. Proinflammatory cytokine production and cartilage damage due to rheumatoid synovial T-helper-1 activition is inhibited by interleukin-4.// Ann Rheum Dis. - 1995. - Vol.54. - P.836-840.
7. Насонов Е.Л., Гукасян Д.А., Насонова М.Б. Иммунопатология ревматоидного артрита и остеопороз: новые данные. // Остеопороз и остеопатии. - 2000. - №2. - С.4-7.
8. Vandesompele J., De Preter K., Pattyn F. et al. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes.// Genome Biology. - 2002. - Vol.3 (7).
1. Способ диагностики воспалительного процесса при раннем ревматоидном артрите, заключающийся в том, что из периферической крови выделяют мононуклеары, из которых выделяют РНК, на основе количественного определения экспрессии мРНК генов цитокинов иитерлейкин-2 (ИЛ-2), интерлейкин-4 (ИЛ-4) и интерлейкин-10 (ИЛ-10) методом обратной транскрипции и полимеразной цепной реакции с регистрацией накопления продуктов реакции по флоуресценции непосредственно во время реакции оценивают баланс цитокинов по формуле[ИЛ']/[ИЛ'']=Е ИЛ''^Сt''/Е ИЛ'^Сt',где [ИЛ'] - концентрация мРНК гена цитокина, характеризующегося повышенной экспрессией;[ИЛ''] - концентрация мРНК гена цитокина, характеризующегося пониженной экспрессией;Е - эффективность амплификации - величина, характеризующая прирост матрицы на каждом цикле амплификации;Ct' и Ct'' - значение пороговых циклов для соответствующего цитокина, и констатируют наличие воспалительного процесса при получении следующих балансов:ИЛ-10/ИЛ-2>1,5;ИЛ-10/ИЛ-4>1,0.
2. Способ диагностики воспалительного процесса при раннем ревматоидном артрите, заключающийся в том, что из клеток синовиальной жидкости осаждают все клетки, из которых выделяют РНК, на основе количественного определения экспрессии мРНК генов цитокинов интерлейкин-2 (ИЛ-2), интерлейкин-4 (ИЛ-4), интерлейкин-6 (ИЛ-6), интерлейкин-8 (ИЛ-8), интерлейкин-17 (ИЛ-17), интерлейкин-1β (ИЛ-1β), а также на основе количественного определения интерферона-гамма (IFNG) и фактора некроза опухолей (TNF) методом обратной транскрипции и полимеразной цепной реакции с регистрацией накопления продуктов реакции по флоуресценции непосредственно во время реакции оценивают баланс цитокинов по формуле[ИЛ']/[ИЛ'']=Е ИЛ''^Сt''/Е ИЛ'^Сt',где [ИЛ'] - концентрация мРНК гена цитокина, характеризующегося повышенной экспрессией;[ИЛ''] - концентрация мРНК гена цитокина, характеризующегося пониженной экспрессией;Е - эффективность амплификации - величина, характеризующая прирост матрицы на каждом цикле амплификации;Ct' и Ct'' - значение пороговых циклов для соответствующего цитокина, и констатируют наличие воспалительного процесса при получении следующих балансов:ИЛ - 2/ИЛ - 4>10;IFNG/ИЛ - 4>300;TNF/ ИЛ - 4>2000;ИЛ - 1β/ИЛ - 4>5000;ИЛ - 6/ИЛ - 4>10;ИЛ - 8/ИЛ - 4>10000; ИЛ - 17/ИЛ - 4>5.