Способ идентификации тучных клеток в гистологическом препарате
Иллюстрации
Показать всеИзобретение относится к медицине и биотехнологии. Образец ткани фиксируют и помещают в парафин, изготавливают срезы, их депарафинизируют, отмывают в Трис-буфере, инкубируют с реагентом и проводят обработку проявляющим агентом. Отличие способа заключается в том, что в качестве реагента используют антитела к VEGFR1 в разведении 1:50, длительность инкубации с реагентом во влажной камере при температуре 25°С составляет 60 минут. Способ позволяет дифференцированно окрашивать тучные клетки на гистологическом препарате. 5 ил.
Реферат
Предлагаемое изобретение относится к области медицины и биологии.
Известно, что тучные клетки являются регуляторами местного гомеостаза соединительной ткани. Функция этих клеток заключается в поддержании структурного, биохимического и функционального постоянства микроокружения.
Известны различные способы идентификации тучных клеток в ткани, основанные на метахроматичном окрашивании содержащихся в них гранул гистологическими красителями, такими как гематоксилин-эозин, толуидиновый синий. Так, известен способ селективной окраски тучных клеток 1% раствором толуидинового синего в 0,5 М HCl при pH 0,5 [Enerback L., Miller H.R.P., Mayrohfer G. Methods for the identification and characterization of mast cells by light microscopy. In Mast Cell Differentiation and Heterogeneity / Ed. Befus A.D., Bienenstock J., Denburg J.A. - New York: Raven Press, 1986. - P.405-417].
К недостаткам данного способа следует отнести окрашивание не только тучных клеток, но и других клеток, содержащихся в гистологическом препарате, что существенно затрудняет их идентификацию.
Также известен способ идентификации тучных клеток в тканях путем иммуногистохимического окрашивания, направленного на выявление биологически активных веществ, содержащихся в гранулах тучных клеток, - серотонина, гистамина и мелатонина [Хайкин М.Б., Дмитриенко С.В., Осадчук М.А. Клинические и морфофункциональные особенности течения воспалительных заболеваний пародонта у больных с гастродуоденальными язвами // Вестник СамГУ. Естественно-научная серия. - 2006. - Т.46, №6/2. - С.153-158].
Недостатком известного способа является необходимость применения не менее трех панелей окрашивания, так как каждое из исследуемых биологически активных веществ - серотонин, гистамин и мелатонин - окрашивают отдельным набором реагентов.
Известен также метод выявления тучных клеток, основанный на сочетании иммуногистохимического окрашивания на серотонин и исследования полутонких срезов методом трансмиссионной электронной микроскопии [Фомина Н.К. Действие ионизирующего излучения и пептидного биорегулятора эпиталона на кинетику роста и функциональную морфологию саркомы М-1 / Автореф. дис. … канд. биол. наук, 03.00.01. - Радиобиология. - Обнинск, 2007. - 17 с.].
Недостатком известного способа является трудоемкость и длительность исследования, а также низкая доступность оборудования для проведения электронно-микроскопического исследования в лабораториях лечебно-профилактических учреждений.
Наиболее близким по технической сущности к предлагаемому является способ идентификации тучных клеток путем окрашивания гранулярного гепарин-протеинового комплекса тучных клеток 5-НТ антисывороткой [Michaloudi H.C., Papadopoulos G.C. Mast cells in the sheep, hedgehog and rat forebrain // J. Anat - 1999. - Vol.195. - P.577-586].
Известный способ осуществляют следующим образом. Образцы исследуемой ткани фиксируют и заливают в парафин. Из парафиновых блоков готовят срезы толщиной 6 мкм, которые депарафинируют, отмывают в течение 1 часа в 0.05 М Трис-буфере, после чего преинкубируют 60 минут в 10% нормальной козьей сыворотке, а затем инкубируют с реагентом. В качестве реагента используют 5-НТ антисыворотку в разведении 1:1500. Инкубацию с реагентом проводят при 4°C в течение 48 часов. После инкубации применяют авидин-биотиновый метод связывания вторичных антител, затем для выявления пероксидазного сигнала обрабатывают в растворе, содержащем 7.5 мг/1.4 мл 3,3' диаминобензидинтетрахлорид с 0.01% H2O2 в Трис-буфере в течение 5-10 минут. Затем срезы дегидратируют и помещают под покровные стекла с этеланом.
К недостаткам известного способа следует отнести то, что он может быть использован только для идентификации тучных клеток в тканях животных (овца, крыса, еж). Известный способ не может быть использован для выявления тучных клеток в тканях человека, так как в этом случае наблюдают отсутствие окрашивания тучных клеток человека. К недостаткам известного способа следует также отнести и длительность процедуры окрашивания - более 2 суток.
Задачей заявляемого изобретения является разработка способа идентификации тучных клеток на гистологических препаратах.
Техническим результатом предлагаемого способа является снижение трудоемкости и сокращение сроков изготовления препарата, а также обеспечение возможности специфического окрашивания тучных клеток человека и лабораторных животных (крысы, кролика) на гистологических препаратах.
Технический результат достигается тем, что способ идентификации тучных клеток на гистологическом препарате включает фиксацию и помещение в парафин образца ткани, изготовление срезов, их депарафинизацию, отмывание в Трис-буфере, инкубирование с реагентом и обработку проявляющим агентом.
Отличительные приемы заявляемого способа заключаются в том, что в качестве реагента используют антитела к VEGFR1 в разведении 1:50, после чего препарат инкубируют во влажной камере при температуре 25°C в течение 60 минут.
Сопоставительный анализ заявляемого технического решения с прототипом позволяет сделать вывод о соответствии заявляемого технического решения критерию изобретения «новизна».
Заявляемый способ обеспечивает достижение усматриваемого заявителем технического результата, а именно - обеспечение возможности дифференцированного окрашивания тучных клеток человека и лабораторных животных на гистологических препаратах при снижении трудоемкости и сокращении сроков изготовления препарата.
Авторами установлено, используемые в заявляемом способе первичные антитела связываются с веществами, синтезируемыми тучными клетками, и не связываются с веществами, продуцируемыми другими клетками организма млекопитающего, которые по морфологическим характеристикам сходны с тучными клетками.
Применение при иммуногистохимическом окрашивании гистологических препаратов в качестве первичных антител антител к VEGFR1 позволило авторам заявляемого способа добиться хорошего дифференцированного окрашивания тучных клеток в таких тканях, как соединительная, мышечная и другие.
Преимуществом предлагаемого способа является также то, что вся процедура окрашивания занимает 5 часов, что существенно меньше по сравнению с прототипом (2 суток).
Преимуществом предлагаемого способа является также и то, что он позволяет окрашивать тучные клетки в тканях как лабораторных животных (крыса, кролик), так и человека.
Изложенное позволяет сделать вывод о соответствии технического решения критерию «изобретательский уровень».
Способ, составляющий заявляемое изобретение, предназначен для использования в медицине и биологии. Возможность его осуществления подтверждена описанными в заявке приемами и средствами.
Вышеизложенное дает основание считать, что заявляемое техническое решение соответствует критерию изобретения «промышленная применимость».
Осуществление заявляемого способа поясняется примером конкретного выполнения. Приведенный ниже пример служит для иллюстрации, но не ограничивает данное изобретение.
Пример
Образцы ткани (человека, крысы или кролика) фиксировали 10% раствором нейтрального формалина и заливали в парафиновые блоки по общепринятой методике [Меркулов Г.А. Курс патогистологической техники. - Л.: Медицина, 1969. - С.13-15, 52-59]. Готовили гистологические срезы толщиной 5 мкм и монтировали их на стекла, покрытые поли-L-лизином. Препараты депарафинировали в толуоле - 5 минут, а затем последовательно в спиртах 100°, 96°, 90°, 70° и 50° по 1 минуте. После чего препараты выдерживали в дистиллированной воде 10 минут, затем помещали в цитратный буфер (pH=6.0) и проводили обработку в микроволновой печи мощностью 800 Вт, которую нагревали при 100%-ной мощности 8 минут, затем при 60%-ной мощности 10 минут. Потом препараты охлаждали до 25°C в нитратном буфере и промывали дистиллированной водой 2 раза по 5 минут. На каждый препарат наносили по 50 мкл 3% H2O2, выдерживали 5 минут. Отмывали Трис-буфером (pH=7.6) 2 раза по 5 минут. Затем наносили 50 мкл 0.4% раствора казеина, инкубировали 5 минут, отмывали Трис-буфером (pH=7.6) 2 раза по 5 минут. После чего на каждый препарат наносили первичные антитела, в качестве которых использовали антитела анти-VEGFRl, в рабочем разведении 1:50. Инкубировали препараты во влажной камере при температуре 25°C в течение 60 минут, потом отмывали Трис-буфером (pH=7.6) 2 раза по 5 минут. Затем на препараты наносили по 50 мкл раствора, содержащего 10% сыворотку в Трис-буфере (pH=7.6), инкубировали во влажной камере при температуре 25°C 30 минут, отмывали Трис-буфером (pH=7.6) 2 раза по 5 минут. Затем наносили вторичные антитела, меченные пероксидазой, по 50 мкл, инкубировали во влажной камере при температуре 25°C 30 минут, отмывали Трис-буфером (pH=7.6) 2 раза по 5 минут. После чего добавляли по 50 мкл субстратной смеси, содержащей 50 мкл 1.74% 3'3'-диаминобензидина в 1 мл 0.05% H2O2, выдерживали 5 минут, отмывали водой. Срезы докрашивали 0.02% раствором гематоксилина 3 минуты. Отмывали водой. Дегидратировали последовательно в спиртах 70°, 90°, 96°, 100° по 1 минуте, затем в толуоле 5 минут. Помещали в заключающую среду под покровные стекла. Микроскопировали в световом микроскопе.
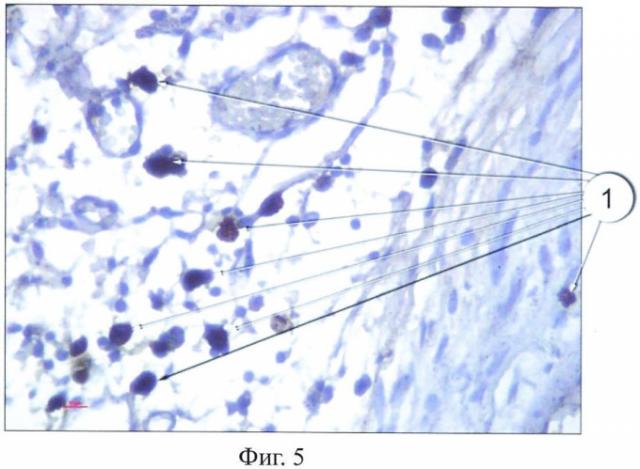
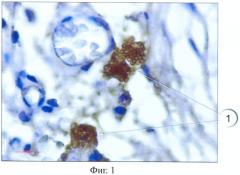
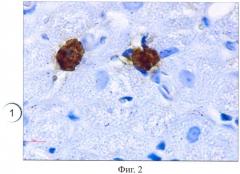
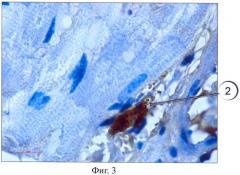
Результаты окрашивания представлены на фиг.1-5, где тучные клетки 1 четко выявляются как в соединительной ткани крысы (фиг.1), так и в мышечной ткани человека (фиг.2), благодаря специфическому окрашиванию. При этом на полученных гистологических препаратах тучные клетки 1 выглядят как заполненные гранулами клетки с неровной поверхностью. Часть клеток 2 в мышечной ткани крысы дегранулирует (фиг.3).
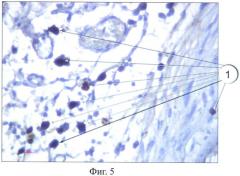
Всего данным способом окрашено 75 препаратов. При этом авторами предлагаемого способа не отмечено специфического окрашивания других клеток со сходной морфологией. Авторы отмечают воспроизводимость предлагаемого способа - при окрашивании серийных срезов в разных партиях достигнуты идентичные результаты окрашивания. В сравнении со стандартным методом окрашивания гематоксилин-эозином достигнуто достоверно более четкое окрашивание тучных клеток. Так, на фиг.4 и фиг.5 представлены препараты соединительной ткани крысы: препарат, окрашенный стандартным способом, - фиг.4; препарат, окрашенный предлагаемым способом, - фиг.5.
Таким образом, предлагаемый иммуногистохимический способ идентификации тучных клеток позволяет четко и дифференцированно окрашивать тучные клетки на гистологическом препарате. Данный способ может быть использован в медицине и биологии.
Способ идентификации тучных клеток на гистологическом препарате, включающий фиксацию и помещение в парафин образца ткани, изготовление срезов, их депарафинизацию, отмывание в Трис-буфере, инкубирование с реагентом и обработку проявляющим агентом, отличающийся тем, что в качестве реагента используют антитела к VEGFR1 в разведении 1:50, а инкубацию с реагентом проводят во влажной камере при температуре 25°С в течение 60 мин.