Способ культивирования клеток
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может быть использовано в цитологии, гистологии, трансплантологии, микробиологии, медицинских исследованиях. Способ предусматривает выделение клеток из источника клеточного материала. Нанесение выделенных клеток на ростовую среду, в качестве которой используют биоматериал на основе полимера нативной формы гиалуроновой кислоты, в который непосредственно перед помещением клеток добавляют физиологический раствор (0,9 NaCl %), а потери жидкости компенсируют добавлением фосфатного буферного раствора каждые 1-1,5 ч. Культивирование клеток с образованием монослоя выделенных клеток с последующим приготовлением гистологических препаратов для контроля жизнеспособности клеток. Изобретение позволяет получить культуру клеток с сохранением их функциональной активности и образованием монослоя клеток в стандартных лабораторных условиях. 11 ил., 2 табл.
Реферат
Изобретение относится к биотехнологиям и может быть использовано в цитологии, гистологии, трансплантологии, микробиологии, медицинских исследованиях.
Известен способ культивирования клеток, разработанный на примере стволовых клеток человека (Патент РФ №2323252, заявка №2006137581/13 от 25.10.2006, опубл. 27.04.2008, БИ №12). Способ заключается в следующем. Стволовые клетки культивируют в ростовой среде RPMI в культуральном сосуде до образования сплошного монослоя, который извлекают из культурального сосуда путем обработки монослоя стволовых клеток раствором трипсина. В процессе каждого цикла культивирования регулярно определяют рН ростовой среды и заменяют ростовую среду на новую. Для обработки монослоя стволовых клеток используют 0,03-0,1%-ный раствор трипсина, причем перед и после указанной обработки стволовые клетки отмывают в изотоническом растворе или растворе Хэнкса, не содержащий солей кальция и магния, от следов ростовой среды и следов трипсина, соответственно. В качестве физиологически приемлемых условий, необходимых для жизнедеятельности стволовых клеток, используют атмосферу, содержащую от 4 до 7,5% углекислого газа, остальное - воздух, и температуру в интервале от 33 до 38°С.
Приведённый способ имеет существенные недостатки. В качестве ростовой среды используется среда RPMI, представляющая собой многокомпонентную жидкую питательную среду. При истощении какого-либо компонента среды RPMI или за счет контактного торможения при образовании плотного монослоя культивируемыми клетками в большинстве случаев деление клеток замедляется [Y.Kikawa, K.Yoneda, Lab. Invest 30, 76 (1974); C.P.Terzic, A.M. Gacy, R.Bortolon, P.P.Dzeja, M.Puceat, M.Jaconi, F.G.Prendergast, A.Terzic, Circulation research 84 (11), 1292 (1999)]. В таком покоящемся состоянии далеко не все виды клеток могут сохранять жизнеспособность длительное время. Использование трипсина может привести к нарушению целостности клеток, повреждению их цитоплазмы. Процесс замены ростовой среды значительно усложняет процесс.
Техническим результатом способа является получение культуры клеток с сохранением их функциональной активности и с образованием монослоя клеток в стандартных лабораторных условиях.
Поставленная задача решается тем, что в способе культивирования клеток, включающем выделение клеток и осуществление их культивирования в ростовой среде, в процессе которого высеивают выделенные клетки в ростовую среду, увеличивают популяцию клеток с образованием их монослоя, в качестве ростовой среды используют биоматериал на основе полимера нативной формы гиалуроновой кислоты, в которую непосредственно перед помещением клеток наливают физиологический раствор (0,9% NaCl), потери жидкости компенсируют добавлением фосфатного буферного раствора каждые 1-1,5 ч, а контроль за жизнеспособностью клеток осуществляют приготовлением гистологических препаратов.
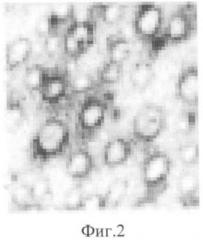
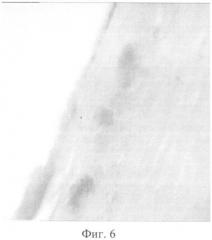
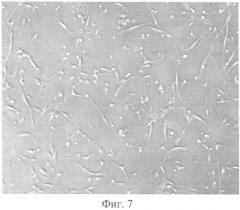
На фиг. 1 изображено распределение клеток по поверхности биоматериала, показывающее обеспечение биоматериалом из гиалуроновой кислоты уникальной адгезии прививаемых на его поверхности клеток. На фиг. 2 изображено распределение клеток в жидкой культуральной среде. На фиг. 3 показано пятно клеточной массы спустя 30 минут после нанесения на биоматериал клеток. На фиг. 4 показан рост пятна клеточной массы спустя 120 минут после нанесения на биоматериал клеток. На фиг. 5 показано деление клетки молочной железы мышей линии BYRB на биоматериале спустя сутки после нанесения клеток на биоматериал. На фиг. 6 изображен монослой фибробластов в процессе мейоза на поверхности биоматериала спустя сутки после высадки их на биоматериал. На фиг. 7 изображены две клетки фибробластов сразу после деления. На фиг. 8 изображена культура бактериальных клеток Е.coli на биоматериале. На фиг. 9 изображена культура бактерий E.coli в чашке Петри спустя сутки после посева с поверхности биоматериала. На фиг. 10 изображена культура бактериальных клеток, сфотографированная методом атомно-силовой микроскопии. На фиг. 11 изображен монослой клеток молочной железы мышей линии BYRB.
Способ осуществляют следующим образом.
Выделенные клетки наносят на биоматериал на основе полимера нативной формы гиалуроновой кислоты (толщиной 0,25 мм, плотностью 340,13 кг/м3), представляющий собой смесь полимера гиалуроновой кислоты нативной формы и белков. Этот биоматериал отвечает основным критериям биологически совместимой матрицы: отсутствие цитотоксичности, поддержание адгезии, фиксации, пролиферации и дифференцировки помещенных на ее поверхность клеток; отсутствие воспалительной реакции на материал и иммунного ответа; достаточная механическая прочность в соответствии с назначением; биорезорбируемость обычными метаболическими путями (Agrawal CM, et al. Biodegradable PLA/PGA polymers for tissue engineering in orthopaedica.// Material Science Forum. - 1997. - P.115-128; Burg KJL, et al. Biomaterials development for bone tissue engineering. // Biomaterials. - 2000. №21. - P.2347-2359). Биоматериал на основе полимера нативной формы гиалуроновой кислоты с клетками хранят при температуре 25-37°С в эксикаторе с открытым отверстием для постоянного доступа воздуха, в который непосредственно перед помещением клеток наливали физиологический раствор (0,9% NaCl), для содержания клеток во влажной среде. Возможность использования такого температурного диапазона была показана еще более 20 лет назад (Э.И.Лежнев, В.П.Панкратов, Ю.В.Кошевой. Управляемое культивирование клеток М.: Наука, 1974, 245 с.). Помещение клеток во влажную среду является необходимым из-за потребления воды клетками и создания условий, в которых коэффициент диффузии кислорода близок к таковому в организме. Постоянный доступ воздуха обеспечивают для поддержания метаболических аэробных процессов, происходящих в клетках в процессе их жизнедеятельности. Сразу после нанесения клеточной взвеси на поверхность биоматериала на основе полимера нативной формы гиалуроновой кислоты клетки равномерно распределяются по поверхности с образованием монослоя, сохраняя жизнеспособность и функциональную активность. В отличие от распределения на биоматериале большая часть клеток в жидкой культуральной среде RPMI (прототип) распределялась по всей её толщине, а не по поверхности. Уменьшение жидкости в капле раствора клеток за счет испарения, метаболических процессов в клетках и впитывания влаги биоматериалом компенсируют добавлением фосфатного буфера каждые 1-1,5 часа, обеспечивающего поддержание в среде нужного клеткам рН. В процессе культивирования наблюдали рост пятна. Для осуществления контроля над жизнеспособностью клеток были приготовлены гистологические препараты и окрашены гематоксилином, на которых показан рост культуры клеток.
Способ осуществляли при 20-60% влажности хранения биоматериала на основе полимера нативной формы гиалуроновой кислоты с нанесёнными клетками. Зависимость состояния биоматериала от влажности, которая отражается на жизнеспособности клеток, отражена в таблице 1.
Таблица 1.
| Диапазон влажности, % | Состояние структуры биоматериала | Жизнеспособность клеток, мин |
| 20 | Нарушена (низкая адгезия клеток, отсутствие образования монослоя клеток) | Менее 10 |
| 30 | Сохранена (адгезия клеток оптимальная, образуется монослой клеток) | 1440 |
| 40 | Сохранена (адгезия клеток оптимальная, образуется монослой клеток) | 1440 |
| 50 | Сохранена (адгезия клеток оптимальная, образуется монослой клеток) | 1440 |
| 60 | Нарушена (биоматериал становится гелеобразным, отсутствие монослоя клеток) | Менее 15 |
Выбор условий влажности продиктован гидрофильными свойствами биоматериала. При влажности менее 30% структура биоматериала не позволяет клеткам оптимально адгезироваться на его поверхности, в результате чего клетки жизнеспособны в пределах менее 10 минут. При влажности более 50% нарушается структура биоматериала, он становится гелеобразным и непригодным для наслоения клеток на его поверхность.
Пример 1. Культивирование клеток молочной железы мышей линии BYRB.
В качестве источника клеточного материала для исследования выбраны клетки молочной железы мышей линии BYRB, поскольку данные лабораторные животные являются эталонными для подобных исследований.
Выделенные клетки в количестве 106 шт. наносят на предварительно размоченный в физиологическом растворе (0,9% NaCl) биоматериал на основе полимера нативной формы гиалуроновой кислоты (толщиной 0,25 мм, плотностью 340,13 кг/м3 и размером 2×3 см). Затем клетки культивировали в течение нескольких дней при температуре 25-37°С в чашках Петри, расположенных в эксикаторе с открытым отверстием для постоянного доступа воздуха, в который непосредственно перед помещением клеток наливали 200 мл физиологического раствора (0,9% NaCl). Потери жидкости компенсировали добавлением фосфатного буферного раствора каждый час для поддержания объема жидкости в размере 200 мл. В процессе культивирования наблюдали рост диаметра пятна клеточной взвеси (фиг. 3, фиг. 4). Для осуществления контроля над жизнеспособностью клеток были приготовлены гистологические препараты и окрашены гематоксилином (фиг. 5). Клетки равномерно распределяются по поверхности, образуя их монослой (фиг.6). Спустя сутки после начала культивирования проводился подсчёт клеток с помощью оптической микроскопии. Количество клеток составило 2,2×106 шт.
Пример 2. Культивирование фибробластов.
Фибробласты брали из банка клеток в количестве 1,2×106 шт. и наносились на предварительно размоченный в физиологическом растворе (0,9% NaCl) биоматериал на основе полимера нативной формы гиалуроновой кислоты (толщиной 0,25 мм, плотностью 340,13 кг/м3 и размером 2х3 см). Затем фибробласты культивировали в чашках Петри при температуре 25-37°С в течение 7 дней в условиях постоянного доступа воздуха (фиг. 7). Поверхность биоматериала на фигуре не ровная за счёт содержания в ней веществ белковой природы, выполняющих роль питательных веществ в клетке. На фигуре - образование монослоя клеток, а также удвоение генетического материала и разделение клетки на две дочерние. Контроль жизнеспособности фибробластов на биоматериале на основе полимера нативной формы гиалуроновой кислоты производили с помощью оптического микроскопа с возможностью выполнения видеозаписи. Потери жидкости компенсировали добавлением фосфатного буферного раствора каждый 1 час 15 минут для поддержания объёма жидкости в размере 200 мл. На таком микроскопе возможно определение количества делений фибробластов и их процесс (фиг.8). Спустя сутки после начала культивирования проводился подсчёт клеток с помощью оптической микроскопии. Количество клеток составило 4,1×106 шт.
Пример 3. Культивирование бактерий Е.соli.
Бактерии Е.соli. брали из банка клеток в количестве 1,4×106 шт. и наносили на биоматериал на основе полимера нативной формы гиалуроновой кислоты (толщиной 0,25 мм, плотностью 340,13 кг/м3 и размером 2×3 см). Затем бактерии культивировали в чашках Петри, расположенных в эксикаторе, в который непосредственно перед помещением клеток наливали 200 мл физиологического раствора (0,9% NaCl), при температуре 37°С в течение 7 дней (фиг.8). Потери жидкости компенсировали добавлением фосфатного буферного раствора каждые 1,5 часа для поддержания объема жидкости в размере 200 мл. Контроль жизнеспособности бактерий E.coli производили ежедневно стандартным способом посева полученной культуры бактерий Е.coli на питательную среду агар с последующим культивированием в агаре в течение суток. По количеству выросщенных колоний на среде агар судили о количестве жизнеспособных клеток бактерий E.coli (фиг.10). Микробиологическую чистоту полученной культуры бактерий E.coli контролировали с помощью атомно-силового микроскопа (фиг.11). Спустя сутки после начала культивирования количество клеток составило 22×106 шт.
Период деления клеток молочной железы мышей, фибробластов, бактерий E.coli на биоматериале на основе полимера нативной формы гиалуроновой кислоты определялся с помощью микроскопа с возможностью видеозаписи, и результаты отражены в таблице 2.
Таблица 2.
| Вид клеток | Период деления, час |
| Клетки молочной железы мышей | 12 |
| Фибробласты | 6 |
| Бактерии E.coli | 3 |
Таким образом, становится возможным получение культуры клеток с сохранением их функциональной активности и с образованием монослоя клеток в стандартных лабораторных условиях.
Способ культивирования клеток, включающий выделение клеток и осуществление их культивирования в ростовой среде, в процессе которого высеивают выделенные клетки в ростовую среду, увеличивают популяцию клеток с образованием их монослоя, отличающийся тем, что в качестве ростовой среды используют биоматериал на основе полимера нативной формы гиалуроновой кислоты, в которую непосредственно перед помещением клеток наливают физиологический раствор (0.9 % NaCl), потери жидкости компенсируют добавлением фосфатного буферного раствора каждые 1-1,5ч, а контроль за жизнеспособностью клеток осуществляют приготовлением гистологических препаратов.