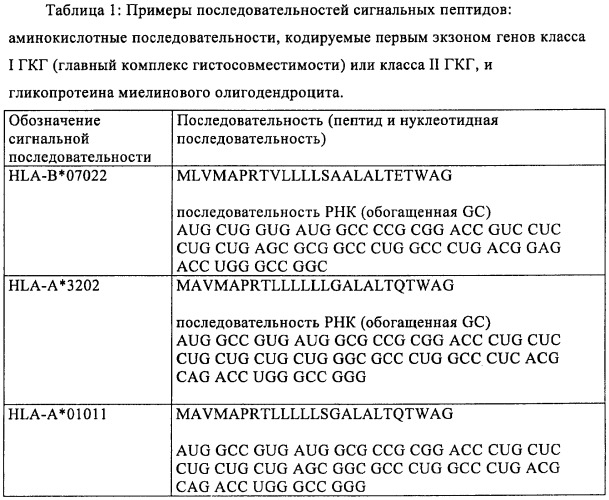
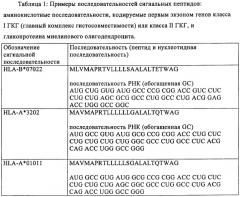
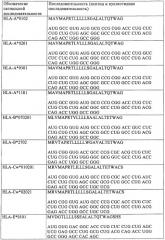
Оптимизированная композиция для инъекции рнк
Иллюстрации
Показать всеИзобретение относится к области медицины и касается оптимизированной композиции для инъекции РНК. Сущность изобретения включает применение мРНК и водного инъекционного буфера для приготовления раствора для инъекции РНК, предназначенного для увеличения переноса мРНК и/или для ее трансляции в организме хозяина, инъекционный раствор включает Na+ с содержанием 50 мМ, Са2+ по меньшей мере 0,01 мМ, содержание К+ - 3 мМ и необязательно лактат. Преимущество изобретения заключается в повышении стабильности мРНК. 4 н. и 15 з.п. ф-лы, 17 ил., 1 табл.
Реферат
Настоящее изобретение относится к применению РНК и водного инъекционного буфера, содержащего натриевую соль, кальциевую соль, необязательно калиевую соль и необязательно также лактат, для приготовления раствора для инъекции РНК, предназначенного для увеличения переноса РНК и/или трансляции РНК в организм(е)-хозяин(е).
Медицинские методы, основанные на молекулярной биологии, такие как генная терапия и генетическая вакцинация, играют главную роль в лечении и предупреждении многочисленных заболеваний. Такие методы основаны на интродукции нуклеиновых кислот в клетки или ткани пациента и последующей обработке информации, кодируемой интродуцированными нуклеиновыми кислотами, т.е. трансляции в требуемые полипептиды или белки. В качестве предназначенных для интродукции нуклеиновых кислот можно применять как ДНК, так и РНК.
Генетические вакцинации, которые заключаются в инъекции «оголенной» плазмидной ДНК, впервые были осуществлены в начале 1990-х годов на мышах. Однако при проведении фазы I/II клинических исследований на человеке стало ясно, что эта технология не может удовлетворить ожидания, которые пробудили исследования на мышах1. С тех пор были разработаны многочисленные методы генетических вакцинаций, основанных на использовании ДНК, и методы интродукции ДНК в клетки (среди прочего такие методы, как трансфекция с использованием фосфата кальция, трансфекция с использованием полипрена, слияние протопластов, электропорация, микроинъекция, липофекция, применение ДНКовых вирусов в качестве носителей ДНК).
15 лет назад Wolff с соавторами продемонстрировали, что инъекция «оголенной» генетической информации в форме плазмидной ДНК (пДНК) или мРНК мышам может приводить к экспрессии белка2. После получения этих результатов были проведены исследования, в которых было установлено, что «оголенную» ДНК можно использовать для вакцинации3-5. Однако применению мРНК для вакцинации уделялось мало внимания вплоть до конца 1990-х годов, когда было продемонстрировано, что перенос мРНК в дендритные клетки запускает иммунные ответы6. Однако непосредственной инъекции «оголенной» мРНК с целью вакцинации уделялось мало внимания, и она была обсуждена только в четырех статьях, опубликованных тремя группами исследователей7-10. Одной из главных причин этого была нестабильность мРНК, обусловленная быстрым расщеплением рибонуклеазами, и связанная с этим недостаточная эффективность мРНК в качестве генетического инструмента in vivo. Между тем из существующего уровня техники известны многочисленные методы стабилизации мРНК, описанные, например, в ЕР-А-1083232, WO 99/14346, US 5580859 и US 6214804.
Однако как нуклеиновая кислота РНК в качестве носителя генетической информации обладает многочисленными преимуществами по сравнению с ДНК, к которым относятся следующие:
(I) РНК, интродуцированная в клетку, не интегрируется в геном (в то время как ДНК в определенной степени интегрируется в геном и тем самым может встраиваться в интактный ген генома клетки-хозяина, в результате чего этот ген может подвергаться мутации и это может приводить к частичной или полной потере генетической информации или появлению ошибочной информации),
(II) для эффективной транскрипции РНК не требуется никаких вирусных последовательностей, таких как промоторы и т.д. (в то время как для экспрессии интродуцированной в клетку ДНК требуется сильный промотор (например, промотор CMV (вирус мозаики цветной капусты)). Интеграция таких промоторов в геном клетки-хозяина может приводить к нежелательным изменениям регуляции экспрессии гена,
(III) расщепление интродуцированной РНК происходит в течение ограниченного периода времени (несколько часов)11,12, поэтому можно достигать кратковременной экспрессии гена, которую можно прерывать после требуемого периода обработки (в то время как это невозможно в случае ДНК, интегрированной в геном),
(IV) РНК не приводит к индукции патогенных антител к РНК в организме пациента (в то время как известно, что индукция антител к ДНК вызывает нежелательный иммунный ответ),
(V) РНК находит широкое применение, поскольку для вакцинации можно очень быстро получать любую требуемую РНК для любого представляющего интерес белка, даже для индивидуального пациента.
В целом, следует отметить, что мРНК представляет собой кратковременную копию кодируемой генетической информации во всех организмах, служит моделью при синтезе белков и в отличие от ДНК обладает всеми предпосылками для получения пригодного вектора для переноса экзогенной генетической информации in vivo.
Наиболее пригодной процедурой для описанного переноса нуклеиновых кислот в организм-хозяин, прежде всего организм млекопитающего, является их инъекция. В то время как ДНК для таких инъекций, как правило, разбавляют в воде, NaCl или ЗФР в качестве инъекционного буфера, РНК, как правило, разбавляют только в инъекционном буфере. В качестве буферов для инъекции РНК применяют стандартные буферы, такие как забуференные фосфатом физиологические растворы, прежде всего ЗФР и забуференный HEPES физиологический раствор (HBS). В случае переноса мРНК такой раствор для инъекции РНК предпочтительно нагревают в течение короткого промежутка времени для нарушения вторичных структур мРНК. Недостатком использования таких стандартных буферов для растворов, предназначенных для инъекции РНК, является очень малая эффективность внутрикожного переноса РНК. Еще одним недостатком является очень низкая скорость трансляции переносимой РНК. Следующим недостатком является то, что при использовании таких стандартных буферов РНК часто образует вторичную структуру (например, так называемую структуру «шпильки»), которая может сильно снижать эффективность проникновения РНК в цитозоль.
Таким образом, целью настоящего изобретения является создание системы, позволяющей, с одной стороны, улучшать внутрикожный перенос РНК в организм-хозяин, а с другой стороны, повышать скорость трансляции перенесенной РНК.
Эта цель достигается с помощью вариантов осуществления изобретения, описанных в формуле изобретения.
Один из вариантов осуществления настоящего изобретения относится к применению РНК и водного инъекционного буфера, содержащего натриевую соль, предпочтительно натриевую соль в концентрации по меньшей мере 50 мМ, кальциевую соль, предпочтительно кальциевую соль в концентрации по меньшей мере 0,01 мМ, и необязательно калиевую соль, предпочтительно калиевую соль в концентрации по меньшей мере 3 мМ, для приготовления раствора для инъекции РНК с целью усиления переноса РНК и/или трансляции РНК в организм(е)-хозяин(е). Следующий объект настоящего изобретения относится также к полученному таким путем инъекционному раствору. Таким образом, инъекционный раствор получают из инъекционного буфера и РНК, которую растворяют в инъекционном буфере.
Согласно предпочтительному варианту осуществления изобретения натриевые соли, кальциевые соли и необязательно калиевые соли, содержащиеся в инъекционном буфере, находятся в форме галогенидов, например хлоридов, йодидов или бромидов, в форме их гидроксидов, карбонатов, бикарбонатов или сульфатов. В качестве примеров следует отметить: для натриевой соли - NaCl, NaI, NaBr, Na2CO3, NaHCO3, Na2SO4; для необязательно присутствующей калиевой соли - KCl, KI, KBr, K2СО3, KНСО3, K2SO4; и для кальциевой соли - СаСl2, CaI2, СаВr2, СаСО3, CaSO4, Са(ОН)2. Инъекционный буфер может содержать также органические анионы указанных выше катионов.
В наиболее предпочтительном варианте осуществления предлагаемого в изобретении применения РНК и инъекционного буфера инъекционный буфер, предлагаемый в изобретении, содержит в качестве солей хлорид натрия (NaCl), хлорид кальция (CaCl2) и необязательно хлорид калия (KCl), причем в дополнение к хлоридам он может содержать также другие анионы. Указанные соли, как правило, присутствуют в инъекционном буфере в концентрации, составляющей по меньшей мере 50 мМ для хлорида натрия (NaCl), по меньшей мере 3 мМ для хлорида калия (KCl) и по меньшей мере 0,01 мМ для хлорида кальция (CaCl2).
Инъекционный буфер, предлагаемый в изобретении, может представлять собой как гипертонический, так и изотонический или гипотонический инъекционный буфер. В контексте настоящего изобретения инъекционный буфер является гипертоническим, изотоническим или гипотоническим по отношению к соответствующей среде, с которой производится сравнение. Это означает, что инъекционный буфер, предлагаемый в изобретении, имеет более высокое, одинаковое или более низкое содержание солей по отношению к соответствующей среде, с которой производится сравнение, применяемые концентрации указанных выше солей предпочтительно должны быть такими, чтобы они не приводили к повреждению клеток, вызываемому осмосом или другими зависящими от концентрации эффектами. Среды, с которыми производится сравнение, представляют собой, например, жидкости, участвующие в процессах in vivo, такие, например, как кровь, лимфатическая жидкость, цитозольные жидкости или другие жидкости, присутствующие в организме, или жидкости или буферы, которые обычно применяют в процессах, осуществляемых in vitro. Такие жидкости и буферы известны специалисту в данной области.
Инъекционный буфер может содержать другие компоненты, например сахара (моно-, ди-, три- или полисахариды), прежде всего глюкозу или маннит. Однако в предпочтительном варианте осуществления изобретения сахара не присутствуют в инъекционном буфере, который предназначен для применения, предлагаемого в изобретении. Предпочтительно также, чтобы буфер, предлагаемый в изобретении, не содержал каких-либо незаряженных компонентов, таких, например, как сахара. Буфер, предлагаемый в изобретении, как правило, содержит только катионы металлов, прежде всего из группы щелочных или щелочно-земельных металлов, и анионы, прежде всего указанные выше анионы.
Значение рН инъекционного буфера, предлагаемого в настоящем изобретении, предпочтительно составляет от 1 до 8,5, предпочтительно от 3 до 5, более предпочтительно от 5,5 до 7,5, наиболее предпочтительно от 5,5 до 6,5. Инъекционный буфер необязательно может содержать также буферную систему, которая фиксирует инъекционный буфер при забуференном значении рН. Такой системой может служить, например, фосфатная буферная система, HEPES или Na2HPO4/NaH2PO4. Однако наибольшее предпочтение следует отдавать инъекционному буферу, применяемому согласно изобретению, который не содержит никаких из указанных выше буферных систем или совсем никакой буферной системы.
Инъекционный буфер, применяемый согласно изобретению, содержит, как указано выше, соли натрия, кальция и необязательно калия, причем натрий и калий, как правило, присутствуют в инъекционном буфере в форме одновалентных катионов (Na+, K+), а кальций присутствует в форме двухвалентного катиона (Са2+). Согласно предпочтительному варианту осуществления изобретения в дополнение к ним или в качестве альтернативы одновалентным и двухвалентным катионам, содержащимся в инъекционном буфере, который предназначен для применения, предлагаемого в изобретении, могут присутствовать двухвалентные катионы металлов, прежде всего из группы щелочно-земельных металлов, таких, например, как магний (Mg2+) или также железо (Fe2+), и одновалентные катионы металлов, прежде всего из группы щелочных металлов, таких, например, как литий (Li+). Такие одновалентные катионы предпочтительно присутствуют в форме их солей, например в форме галогенидов, например хлоридов, йодидов или бромидов, в форме их гидроксидов, карбонатов, бикарбонатов или сульфатов. В качестве примеров следует отметить: для литиевой соли - LiCl, LiI, LiBr, Li2CO3, LiHCO3, Li2SO4; для магниевой соли - MgCl2, MgI2, MgBr2, MgCO3, MgSO4 и Mg(OH)2; и для соли железа - FeCl2, FeBr2, FeI2, FeF2, Fe2O3, FeCO3, FeSO4, Fe(OH)2. Таким образом, можно применять также все комбинации двухвалентных и/или одновалентных катионов, как указано выше. Таким образом, под объем изобретения подпадают инъекционные буферы, которые содержат только двухвалентные, только одновалентные или и одновалентные и двухвалентные катионы. Под объем изобретения подпадают также инъекционные буферы, которые содержат только один тип двухвалентных или одновалентных катионов, наиболее предпочтительно, например, только катионы Са2+ или его соли, например CaСl2.
Предпочтительно следует также учитывать молярности, указанные выше для Са2+ (в качестве двухвалентного катиона) и Na1+ (в качестве одновалентного катиона) (а именно, типичные концентрации, составляющие по меньшей мере 50 мМ для Na+, по меньшей мере 0,01 мМ для Ca2+ и по меньшей мере 3 мМ для необязательно присутствующего K+), в инъекционном буфере, когда вместо некоторых из или всех ионов Ca2+ или Na1+, в инъекционном буфере, который применяют согласно изобретению при приготовлении инъекционного раствора, используют другой двухвалентный или одновалентный катион или другие двухвалентные или одновалентные катионы, прежде всего другие катионы металлов из группы щелочно-земельных металлов или щелочных металлов. Хотя, как указано выше, Са2+ и Na1+ в инъекционном буфере, который предназначен для применения, предлагаемого в изобретении, можно полностью заменять другими двухвалентными или одновалентными катионами, например также на комбинацию других двухвалентных катионов (вместо Са2+) и/или на комбинацию других одновалентных катионов (вместо Na1+) (прежде всего, на комбинацию других двухвалентных катионов из группы щелочно-земельных металлов или на комбинацию других одновалентных металлов из группы щелочных металлов), предпочтительно осуществлять частичную замену Са2+ или Na1+, т.е. это означает, что по меньшей мере 20%, предпочтительно по меньшей 40%, более предпочтительно по меньшей мере 60% и еще более предпочтительно по меньшей мере 80% соответствующих общих молярностей одновалентных или двухвалентных катионов в буфере для инъекций приходится на долю Ca2+ или Na1+. Однако, наиболее предпочтительно, чтобы инъекционный буфер, который предназначен для применения, предлагаемого в изобретении, содержал только Ca2+ в качестве двухвалентного катиона и Na1+ в качестве одновалентного катиона, это означает, что на долю Са2+ приходится 100% общей молярности двухвалентных катионов, а на долю Na1+ приходится 100% общей молярности одновалентных катионов.
Приготовление инъекционного буфера предпочтительно осуществляют при комнатной температуре (25°С) и атмосферном давлении. Приготовление можно осуществлять с помощью любого пригодного процесса, известного из существующего уровня техники. Предпочтительно ионы или содержащие их соли разбавляют в водном растворе, при этом соотношения концентраций следует выбирать в соответствии с конкретными условиями (организм-хозяин, представляющий, прежде всего, млекопитающее, в который требуется инъецировать содержащий РНК раствор для инъекции, состояние здоровья, возраст и т.д. организма-хозяина и условия растворимости и взаимодействия компонентов, температура реакции, время реакции и т.д.).
Концентрации компонентов, представляющих собой ионы натрия, кальция и хлорида и необязательно ионы калия и необязательно лактат (см. приведенное ниже описание варианта осуществления изобретения), содержащиеся в водном инъекционном буфере, зависят, прежде всего, от их растворимости в воде, взаимодействия компонентов друг с другом, а также от температуры реакции и давления в реакционной смеси в процессе приготовления инъекционного буфера или раствора для инъекций РНК.
Основой инъекционного буфера, применяемого согласно настоящему изобретению, является водный раствор, т.е. раствор, состоящий из воды и солей, который применяют согласно изобретению при приготовлении инъекционного раствора, и необязательно лактат. Соли указанных выше одновалентных или двухвалентных катионов необязательно могут быть слаборастворимыми или даже нерастворимыми в таком водном растворе. Степень растворимости солей можно рассчитывать на основе произведения растворимостей. Методы точного определения растворимости и произведения растворимостей известны специалисту в данной области. Такой водный раствор может содержать вплоть до 30 мол.% растворенных солей, предпочтительно вплоть до 25 мол.%, предпочтительно вплоть до 20 мол.%, предпочтительно также вплоть до 15 мол.%, более предпочтительно вплоть до 10 мол.%, еще более предпочтительно вплоть до 5 мол.%, более предпочтительно также вплоть до 2 мол.%, нерастворимых или слаборастворимых солей. Соли, для которых произведение растворимостей составляет <10-4, рассматриваются в контексте настоящего изобретения как слаборастворимые. Соли, для которых произведение растворимостей составляет >10-4, рассматриваются как легкорастворимые.
Растворимость соли, или иона, или содержащего ионы соединения в воде зависит от энергии его кристаллической решетки и энергии гидратации, при этом необходимо принимать во внимание обусловленные энтропией эффекты, которые имеют место. Применяют также понятие «произведение растворимостей», более точно равновесие, которое устанавливается, когда соль, или ион, или содержащее ионы соединение растворяется в воде. Произведение растворимостей обычно определяют как произведение концентраций ионов в насыщенном растворе электролита. Например, соли щелочных металлов (такие, например, как содержащие Na+, K+ соли) растворимы в воде в более высоких концентрациях, чем соли щелочно-земельных металлов (такие, например, как содержащие Ca2+ соли), это означает, что они имеют более высокое значение произведения растворимостей. Это означает, что калиевые и натриевые соли, содержащиеся в водном растворе инъекционного буфера, предлагаемого в изобретении, более легко растворимы, чем присутствующие в нем кальциевые соли. Следовательно, при определении концентрации этих ионов необходимо принимать во внимание, среди прочего, взаимодействие между калиевыми, натриевыми и кальциевыми солями.
Предпочтительным является применение, предлагаемое в изобретении, в котором инъекционный буфер содержит хлорид натрия (NaCl) в концентрации от 50 до 800 мМ, предпочтительно от 60 до 500 мМ, более предпочтительно от 70 до 250 мМ, наиболее предпочтительно от 60 до 110 мМ, хлорид кальция (CaCl2) в концентрации от 0,01 до 100 мМ, предпочтительно от 0,5 до 80 мМ, более предпочтительно от 1,5 до 40 мМ, и необязательно хлорид калия (KCl) в концентрации от 3 до 500 мМ, предпочтительно от 4 до 300 мМ, более предпочтительно от 5 до 200 мМ.
Помимо указанных выше неорганических анионов, например галогенидов, сульфатов или карбонатов, в качестве дополнительных анионов могут присутствовать также органические анионы. Среди них можно отметить сукцинат, лактобионат, лактат, малат, малеонат и т.д., которые могут присутствовать также в виде комбинаций. Инъекционный буфер, предназначенный для применения, предлагаемого в изобретении, предпочтительно содержит лактат, наиболее предпочтительно такой инъекционный буфер, в котором присутствует органический анион, содержит в качестве органического аниона только лактат. В контексте изобретения лактат может представлять собой любой требуемый лактат, например L-лактат и D-лактат. Применительно к настоящему изобретению в качестве солей молочной кислоты (лактатов), как правило, применяют лактат натрия и/или лактат кальция, прежде всего в том случае, когда инъекционный буфер содержит в качестве одновалентного катиона только Na+ и в качестве двухвалентного катиона только Са2+.
В предпочтительном варианте применения, предлагаемого в изобретении, инъекционный буфер, предлагаемый в изобретении, содержит лактат предпочтительно в концентрации от 15 до 500 мМ, более предпочтительно от 15 до 200 мМ и еще более предпочтительно от 15 до 100 мМ.
При создании изобретения было установлено, что применение инъекционного буфера, содержащего указанные выше компоненты, в котором необязательно присутствует или отсутствует лактат (ниже в настоящем описании обозначен как «инъекционный буфер RL», когда компонент, представляющий собой лактат, отсутствует, или как «инъекционный буфер RL с лактатом», когда присутствует компонент, представляющий собой лактат), для приготовления растворов для инъекции РНК (т.е. инъекционных растворов, которые содержат РНК и пригодны для инъекции указанной РНК) существенно усиливает как перенос, так и трансляцию РНК в клетки(ах)/ткани(ях) организма-хозяина (млекопитающего) по сравнению с инъекционными буферами, обычно применяемыми согласно существующему уровню техники.
Раствор, содержащий указанные выше компоненты, представляющие собой хлорид натрия (NaCl), хлорид кальция (CaCl2), лактат, прежде всего в форме лактата натрия, и необязательно также хлорид калия (KCl), обозначают также как «раствор Рингера» или «лактат Рингера». Лактат Рингера представляет собой кристалловидный полный электролитный раствор, который применяют в качестве раствора для возмещения объема и раствора-носителя, например, для совместимых с ним лекарственных средств. Например, лактат Рингера применяют в качестве основного агента для возмещения объема в случае потери жидкости и электролита (в результате рвоты, диареи, непроходимости кишечника или ожогов), прежде всего у младенцев и маленьких детей, и для поддержания открытого доступа к периферическим и/или центральным венам. Однако предлагаемое в изобретении применение лактата Рингера в качестве инъекционного буфера в растворах для инъекции РНК неизвестно из существующего уровня техники.
В контексте настоящего изобретения РНК представляет собой любую требуемую РНК, например мРНК, тРНК, рРНК, siRNA, одно- или двухцепочечную РНК, гетеродуплексную РНК и т.д. В качестве РНК можно применять РНК, кодирующую любой представляющий интерес белок. РНК, которую используют для применения, предлагаемого в изобретении, предпочтительно представляет собой «оголенную» РНК. Особенно предпочтительно она представляет собой мРНК, более предпочтительно «оголенную» мРНК.
В контексте изобретения подразумевается, что «оголенная» РНК, прежде всего «оголенная» мРНК, представляет собой РНК, которая не находится в составе комплекса, например, с поликатионными молекулами. «Оголенная» РНК может находиться в одноцепочечной форме, а также в двухцепочечной форме, т.е. в виде вторичной структуры, например в виде так называемой структуры «шпильки». Такие двухцепочечные формы встречаются, прежде всего, у «оголенных» РНК, прежде всего «оголенных» мРНК, когда в молекуле присутствуют комплементарные рибонуклеотидные последовательности.
Однако согласно изобретению РНК, прежде всего мРНК, могут присутствовать также в составе комплекса. В результате такой комплексации/конденсации РНК, прежде всего мРНК, предлагаемой в изобретении, эффективный перенос РНК в предназначенные для обработки клетки или предназначенную для обработки ткань организма, предназначенного для обработки, может быть усилен благодаря ассоциации или связыванию РНК с (поли)катионным полимером, пептидом или белком. Такую РНК (мРНК) предпочтительно комплексируют или конденсируют по меньшей мере с одним катионным или поликатионным агентом. Такой катионный или поликатионный агент предпочтительно представляет собой агент, выбранный из группы, включающей протамин, поли-L-лизин, поли-L-аргинин, нуклеолин, спермин и гистоны или производные гистонов или протаминов. В качестве поликатионного связывающегося с нуклеиновой кислотой белка наиболее предпочтительно применяют протамин. Такая процедура стабилизации РНК описана, например, в ЕР-А-1083232, соответствующее содержание которой во всей его полноте включено в настоящее изобретение.
РНК, предлагаемую в изобретении, можно подвергать дополнительным модификациям. Эти модификации служат, прежде всего, для повышения стабильности РНК. Предпочтительно РНК имеет одну или несколько (встречающихся в естественных условиях или не встречающихся в естественных условиях) модификаций, прежде всего химических модификаций, которые, например, способствуют увеличению времени полужизни РНК в организме или улучшают эффективность трансляции мРНК в цитозоле по сравнению с эффективностью трансляции немодифицированной мРНК в цитозоле. Предпочтительно эффективность трансляции улучшают с помощью модификации, предлагаемой в изобретении, по меньшей мере на 10%, предпочтительно по меньшей мере на 20%, также предпочтительно по меньшей мере на 40%, более предпочтительно по меньшей мере на 50%, еще более предпочтительно по меньшей мере на 60%, также более предпочтительно по меньшей мере на 75%, наиболее предпочтительно по меньшей мере на 85%, наиболее предпочтительно по меньшей мере на 100%, по сравнению с эффективностью трансляции немодифицированной мРНК в цитозоле.
Например, можно увеличивать содержание G/C в кодирующей области модифицированной мРНК по сравнению с содержанием G/C в кодирующей области соответствующей мРНК дикого типа, при этом аминокислотная последовательность, кодируемая модифицированной мРНК, предпочтительно остается неизмененной по сравнению с аминокислотной последовательностью, кодируемой мРНК дикого типа. Такая модификация основана на том факте, что последовательность области мРНК, предназначенной для трансляции, важна для эффективной трансляции мРНК. В этом случае имеет важное значение состав и последовательность расположения различных нуклеотидов. В частности, последовательности, которые имеют высокое содержание G (гуанозин)/С (цитозин), являются более стабильными, чем последовательности, имеющие высокое содержание А (аденозин)/U (урацил). Поэтому целесообразно при сохранении транслируемой аминокислотной последовательности изменять кодоны по сравнению с мРНК дикого типа таким образом, чтобы они имели более высокое содержание G/C-нуклеотидов. Благодаря тому факту, что несколько кодонов кодируют одну и ту же аминокислоту (так называемая «вырожденность генетического кода»), оказывается возможным определять кодоны, которые полезны с точки зрения стабильности, предпочтительно имеющие максимальное содержание G/C. В результате этого РНК в буфере для инъекций предпочтительно имеет содержание G/C, увеличенное предпочтительно по меньшей мере на 30%, более предпочтительно по меньшей мере на 50%, еще более предпочтительно по меньшей мере на 70%, более предпочтительно на 80%, в пересчете на максимальное содержание G/C (т.е. содержание G/C после модификации всех потенциальных триплетов в кодирующей области последовательности, встречающейся в естественных условиях, с использованием вырожденности генетического кода для максимизации содержания G/C без изменения кодируемой аминокислотной последовательности), и наиболее предпочтительно максимальное содержание G/C, где максимальное содержание G/C присутствует в последовательности, в которой содержание G/C максимизировано без изменения при этом кодируемой аминокислотной последовательности.
В зависимости от аминокислотной последовательности, которая должна кодироваться модифицированной мРНК, существуют различные возможности для модификации последовательности мРНК по сравнению с последовательностью дикого типа. В том случае когда аминокислоты кодируются кодонами, которые содержат только нуклеотиды G или С, не требуется осуществлять модификацию кодонов. Примерами таких кодонов являются для Pro (ССС или CCG), Arg (CGC или CGG), Ala (GCC или GCG) и Gly (GGC или GGG).
С другой стороны, кодоны, которые содержат нуклеотиды А и/или U, можно изменять путем замены на различные кодоны, которые кодируют ту же самую аминокислоту, но которые не содержат А и/или U. Такими примерами являются:
- кодоны для Pro можно изменять с CCU или ССА на ССС или CCG;
- кодоны для Arg можно изменять с CGU, или CGA, или AGA, или AGG на CGC или CGG;
- кодоны для Аlа можно изменять с GCU или GCA на GCC или GCG;
- кодоны для Gly можно изменять с GGU или GGA на GGC или GGG.
В определенных случаях, хотя и нельзя исключать из кодонов нуклеотиды А и U, оказывается возможным уменьшать содержание А и U путем использования кодонов, которые имеют меньшее содержание нуклеотидов А и/или U. Такими примерами являются:
- кодоны для Phe можно изменять с UUU на UUC;
- кодоны для Leu можно изменять с UUA, UUG, CUU или CUA на CUC или CUG;
- кодоны для Ser можно изменять с UCU, или UCA, или AGU на UCC, UCG или AGC;
- кодон для Тyr можно изменять с UAU на UAC;
- кодон для Cys можно изменять с UGU на UGC;
- кодон для His можно изменять с CAU на САС;
- кодон для Gln можно изменять с САА на CAG;
- кодоны для Ilе можно изменять с AUU или AUA на AUC;
- кодоны для Thr можно изменять с ACU или АСА на АСС или ACG;
- кодон для Asn можно изменять с AAU на ААС;
- кодон для Lys можно изменять с ААА на AAG;
- кодон для Val можно изменять с GUU или GUA на GUC или GUG;
- кодон для Asp можно изменять с GAU на GAC;
- кодон для Glu можно изменять с GAA на GAG,
- стоп-кодон UAA можно изменять на UAG или UGA.
Перечисленные выше замены можно применять индивидуально или во всех возможных комбинациях для повышения содержания G/C в модифицированной мРНК по сравнению с мРНК дикого типа (исходная последовательность). Предпочтительно, например, использовать следующие комбинации возможных замен:
- замену всех кодонов, кодирующих Thr в исходной последовательности (мРНК дикого типа), на АСС (или ACG) и замену всех кодонов, кодирующих Ser в исходной последовательности, на UCC (или UCG, или AGC);
- замену всех кодонов, кодирующих Ilе в исходной последовательности, на AUC, и замену всех кодонов, кодирующих Lys в исходной последовательности, на AAG, и замену всех кодонов, кодирующих Тyr в исходной последовательности, на UAC;
- замену всех кодонов, кодирующих Val в исходной последовательности, на GUC (или GUG), и замену всех кодонов, кодирующих Glu в исходной последовательности, на GAG, и замену всех кодонов, кодирующих Аlа в исходной последовательности, на GCC (или GCG), и замену всех кодонов, кодирующих Arg в исходной последовательности, на CGC (или CGG);
- замену всех кодонов, кодирующих Val в исходной последовательности, на GUC (или GUG), и замену всех кодонов, кодирующих Glu в исходной последовательности, на GAG, и замену всех кодонов, кодирующих Аlа в исходной последовательности, на GCC (или GCG), и замену всех кодонов, кодирующих Gly в исходной последовательности, на GGC (или GGG), и замену всех кодонов, кодирующих Asn в исходной последовательности, на ААС;
- замену всех кодонов, кодирующих Val в исходной последовательности, на GUC (или GUG), и замену всех кодонов, кодирующих Phe в исходной последовательности, на UUC, и замену всех кодонов, кодирующих Cys в исходной последовательности, на UGC, и замену всех кодонов, кодирующих Leu в исходной последовательности, на CUG (или CUC), замену всех кодонов, кодирующих Gln в исходной последовательности, на CAG, и замену всех кодонов, кодирующих Pro в исходной последовательности, на ССС (или CCG), и т.д.
В том случае когда изменение содержания G/C осуществляют в области модифицированной мРНК, которая кодирует белок, то это содержание следует увеличивать по меньшей мере на 7%, более предпочтительно по меньшей мере на 15%, также более предпочтительно по меньшей мере на 20%, еще более предпочтительно по меньшей мере на 30% по сравнению с содержанием G/C области мРНК дикого типа, кодирующей белок. В этом случае наиболее предпочтительно увеличивать содержание G/C в модифицированной мРНК, прежде всего в области, кодирующей белок, до максимального уровня по сравнению с последовательностью дикого типа.
Кроме того, предпочтительно увеличивать содержание A/U в области сайта связывания рибосомы в модифицированной мРНК по сравнению с содержанием A/U в области сайта связывания рибосомы в соответствующей мРНК дикого типа. Эта модификация повышает эффективность связывания рибосом с мРНК. В свою очередь, эффективное связывание рибосом с сайтом связывания рибосомы (последовательность Козака (Kozak): GCCGCCACCAUGG, AUG представляет собой стартовый кодон) позволяет осуществлять эффективную трансляцию мРНК. Увеличение заключается в том, что интродуцируют по меньшей мере одну дополнительную единицу A/U, как правило, по меньшей мере 3 единицы A/U, в область сайта связывания, т.е. область, простирающуюся от положения -20 до положения +20 относительно А стартового кодона AUG.
Модификация, которая также является предпочтительной, относится к мРНК, в которой кодирующая область и/или 5'- и/или 3'-нетранслируемая область модифицированной мРНК изменена по сравнению с мРНК дикого типа таким образом, что она не содержит никаких элементов, дестабилизирующих последовательность, при этом кодируемая аминокислотная последовательность модифицированной РНК предпочтительно не имеет изменений по сравнению с мРНК дикого типа. Известно, что элементы, дестабилизирующие последовательность (DSE), встречаются, например, в последовательностях мРНК эукариотических организмов, с которыми связываются сигнальные белки, представляющие собой элементы, дестабилизирующие последовательность, и осуществляют регуляцию ферментативного расщепления мРНК in vivo. Таким образом, для дополнительной стабилизации модифицированной мРНК, предлагаемой в изобретении, необязательно можно осуществлять одно или несколько таких изменений в области, кодирующей белок, по сравнению с соответствующей областью мРНК дикого типа, в результате которых она не будет совсем иметь или практически не будет иметь никаких элементов, дестабилизирующих последовательность. Путем таких изменений можно также согласно изобретению исключать из мРНК DSE, присутствующие в нетранслируемых областях (3'- и/или 5'-UTR).
Такими дестабилизирующими последовательностями являются, например, последовательности, богатые AU («AURES»), которые встречаются в 3'-UTR-участках многочисленных нестабильных мРНК (Caput и др., Proc. Natl. Acad. Sci. USA, 83, 1986, c.1670-1674), а также мотивы последовательности, которые распознаются эндонуклеазами (см., например. Binder и др., EMBO J., 13, 1994, c.1969-1980).
Предпочтительной является также модифицированная мРНК, которая имеет стабилизирующую структуру, представляющую собой кэп, расположенный с 5'-конца (5'-кэп-структуру). Примерами кэп-структур, которые можно применять согласно изобретению, являются m7G(5')ppp, 5'(А,G(5')ррр(5')А и G(5')ppp(5')G.
Предпочтительно также, чтобы модифицированная мРНК имела хвост поли-(А), предпочтительно состоящий по меньшей мере из 25 нуклеотидов, более предпочтительно по меньшей мере из 50 нуклеотидов, еще более предпочтительно по меньшей мере из 70 нуклеотидов, также более предпочтительно по меньшей мере из 100 нуклеотидов, наиболее предпочтительно по меньшей мере из 200 нуклеотидов.
Предпочтительно также, чтобы модифицированная мРНК имела по меньшей мере один IRES и/или по меньшей мере одну 5'- и/или 3'-стабилизирующую последовательность. Согласно изобретению в модифицированную мРНК можно интродуцировать один или несколько так называемых IRES («внутренний рибосомальный сайт проникновения»). Таким образом, IRES может функционировать в качестве единственного сайта связывания рибосомы, но может также служить для того, чтобы получать мРНК, кодирующую несколько белков, пептидов или полипептидов, которые должны транслироваться рибосомами независимо друг от друга («мультицистронная мРНК»). Примерами последовательностей IRES, которые можно применять согласно изобретению, являются последовательности IRES пикорнавирусов (например, вирус ящура (FMDV)), вирусов чумы (CFFV), вирусов полиомы (PV), вирусов энцефаломиокардита (ECMV), вирусов ящура (FMDV), вирусов гепатита С (HCV), вирусов классической лихорадки свиней (CSFV), вируса мышиного лейкоза (MLV), вируса иммунодефицита обезьян (SIV) или вирусов паралича сверчков (CrPV).
Предпочтительно также, чтобы модифицированная мРНК имела по меньшей мере одну 5'- и/или 3'-стабилизирующую последовательность. Указанные стабилизирующие последовательности, локализованные в 5'- и/или 3'-нетранслируемых областях, приводят к увеличению времени полужизни мРНК в цитозоле. Такие стабилизирующие последовательности могут быть на 100% гомологичны встречающимся в естественных условиях последовательностям, которые присутствуют в вирусах, бактериях