Изолированные популяции миелоидоподобных клеток костного мозга и способы лечения с ними
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, клеточной инженерии и медицине. Способ выделения миелоидоподобных клеток костного мозга осуществляют путем обработки клеток костного мозга антителами против CD44 (рецептора гиалуроновой кислоты), против CD11b или против того и другого и с использованием проточной цитометрии. Далее проводят позитивный отбор из них клеток, экспрессирующих CD44 и/или CD11b. Изолированные миелоидоподобные клетки костного мозга можно трансфицировать геном, кодирующим терапевтически применимый белок, для доставки гена в сетчатку. Полученные клетки обладают благоприятной васкулотрофической и нейротрофической активностью, когда введены интраокулярно в глаз млекопитающего, в частности млекопитающего, страдающего от дегенеративной болезни глаз. 2 н. и 19 з.п. ф-лы, 46 ил., 3 табл.
Реферат
Перекрестная ссылка на родственные заявки
По данной заявке испрашивается приоритет предварительной заявки на патент США №60/656037, поданной 24 февраля 2005, включенной в данное описание в виде ссылки.
Заявление о государственном интересе
Часть работы, описанной в данном описании, поддержана грантами за номерами EY11254 и EY12598 от National Eye Institute of the National Institutes of Health. Правительство Соединенных Штатов имеет некоторые права на данное изобретение.
Область техники, к которой относится изобретение
Данное изобретение относится к изолированным клеткам костного мозга млекопитающих. Конкретнее, изобретение относится к изолированным популяциям клеток костного мозга, которые имеют характеристики миелоидных клеток и способны к внедрению в сосудистую сеть сетчатки при интравитреальной инъекции в глаз. Изобретение также относится к способам лечения глазных дегенеративных болезней путем введения изолированных клеток костного мозга в глаз млекопитающего.
Предпосылки создания изобретения
Связанная с возрастом дегенерация желтого пятна (ARMD) и диабетическая ретинопатия (DR) являются ведущими причинами потери зрения в индустриальных странах и являются результатом аномального образования новых сосудов в сетчатке. Так как сетчатка состоит из хорошо установленных слоев нейронных, глиальных и васкулярных элементов, относительно небольшие нарушения, такие как нарушения, заметные при разрастании сосудов или отеке, могут привести к существенной потере зрительной функции. Наследственные дегенерации, такие как пигментный ретинит (RP), также ассоциируются с сосудистыми аномалиями, такими как артериолярное сужение и васкулярная атрофия. Большинство наследственных дегенераций сетчатки специфически влияет на фоторецепторы палочки, но также имеется сопутствующая потеря колбочек, принципиального компонента пятна, участка сетчатки у людей, который ответственен за остроту центрального тонкого зрения. Специфичные факторы выживания колбочек недавно описаны (Mohand-Said et al., 1998, Proc. Natl. Acad. Sci. USA, 95: 8357-8362) и могут облегчить выживание колбочек на мышиных моделях дегенерации сетчатки.
Наследственные дегенерации сетчатки поражают 1 из 3500 индивидуумов и характеризуются прогрессирующей куриной слепотой, скотомой, атрофией зрительного нерва, артериолярной аттенуацией, измененной проницаемостью сосудов и дефектом центрального зрения, часто прогрессирующим до полной слепоты (Heckenlively J.R., editor, 1988; Retinitis Pigmentosa, Philadelphia: JB Lippincott Co.). Молекулярный генетический анализ таких заболеваний идентифицирует мутации в более чем 110 различных генах для только относительно небольшого процента известных пораженных индивидуумов (Humphries et al., 1992, Science, 256: 804-808; Farrar et al., 2002, EMBO J., 21: 857-864). Многие такие мутации ассоциируются с ферментативными и структурными элементами механизма фототрансдукции, включая родопсин, cGMP-фосфодиэстеразу, rds-периферин и RPE65. Несмотря на такие сведения, пока не имеется эффективных способов лечения для замедления или реверсии развития таких дегенеративных болезней сетчатки. Последние достижения в области генной терапии привели к успешной реверсии фенотипов rds (Ali et al., 2000, Nat. Genet., 25: 306-310) и rd (Takahashi et al., 1999, J. Virol., 73: 7812-7816) у мышей и фенотипа RPE65 у собак (Acland et al., 2001, Nat. Genet., 28: 92-95), когда к фоторецепторам или пигментированному эпителию сетчатки (RPE) животных со специфической мутацией доставляется трансген дикого типа.
На протяжении многих лет известно, что популяция стволовых клеток существует в нормальных зрелых кровотоке и костном мозге. Различные субпопуляции таких клеток могут дифферицировать дальше в направлении гемопоэтической позитивной линии (Lin+) или негативной линии (Lin-). Более того, недавно показано, что популяция негатиной гемопоэтической клеточной линии стволовых клеток (HSC) содержит эндотелиальные клетки-предшественники (ЕРС), способные образовывать кровеносные сосуды in vitro и in vivo (см. Asahara et al., 1997, Science, 275: 964-7). Такие клетки могут принимать участие в нормальном и патологическом постнатальном ангиогенезе (см. Lyden et al., 2001, Nat. Med., 7, 1194-201; Kalka et al., 2000, Proc. Natl. Acad. Sci. U.S.A., 97: 3422-7; и Kocher et al., 2001, Nat. Med., 7: 430-6), а также дифференцировать в различные неэндотелиальные типы клеток, включая гепатоциты (см. Lagasse et al., 2000, Nat. Med., 6: 1229-34), микроглии (см. Priller et al., 2002, Nat. Med., 7: 1356-61), кардиомиоциты (см. Orlic et al., 2001, Proc. Natl. Acad. Sci. U.S.A., 98: 10344-9), и эпителий (см. Lyden et al., 2001, Nat. Med., 7, 1194-1201). Хотя такие клетки используют в некоторых экспериментальных моделях ангиогенеза, механизм нацеливания ЕРС на новую сосудистую сеть не известен и не определена стратегия, которая будет эффективно повышать число клеток, которые вносят вклад в определенную сосудистую сеть.
Гемопоэтические стволовые клетки из костного мозга в настоящее время являются единственным типом стволовых клеток, обычно используемых для лечебных применений. HSC костного мозга используются в трансплантатах свыше 40 лет. В настоящее время исследуются передовые методы сбора очищенных стволовых клеток с целью разработки способов лечения лейкоза, лимфомы и наследственных изменений крови. Исследуются клинические применения стволовых клеток для лечения диабета и запущенного рака почек у ограниченного числа больных людей.
Сущность изобретения
Настоящее изобретение относится к изолированной популяции миелоидоподобных клеток костного мозга (MLBM), продуцируемых клетками позитивного отбора, которые экспрессируют CD44, CD11b или оба антигена, из костного мозга млекопитающего. Такие клетки обнаруживают благоприятную васкулотрофическую и нейротрофическую активность при интраокулярном введении в глаз млекопитающего, страдающего от дегенеративной болезни глаз. Популяцию клеток MLBM по настоящему изобретению можно изолировать обработкой костного мозга антителами против CD44 (рецептор гиалуроновой кислоты), антителами против CD11b или антителами против обоих антигенов, и случаем могут быть клетки позитивного отбора, которые вступают в иммунную реакцию с антителами одного или обоих видов. Большинство клеток клеточной популяции MLBM по изобретению являются негативной линией и экспрессируют как антиген CD44, так и антиген CD11b.
Настоящее изобретение также относится к способу лечения васкулотрофических и нейротрофических болезней сетчатки у млекопитающего. Способ включает введение изолированных клеток из популяции клеток MLBM в больной глаз млекопитающего, предпочтительно, внутриглазной инъекцией. Предпочтительно, популяция клеток MLBM является аутологичной млекопитающему, которого лечат (т.е. популяцию клеток MLBM выделяют из костного мозга индивидуума млекопитающего, которого лечат). Способ лечения по настоящему изобретению уменьшает интенсивность дегенерации сосудов и дегенерации нейронов фоторецепторов в сетчатке млекопитающего, которое страдает от болезни глаз. Клетки вводят в количестве, достаточном для задержки сосудистой и нейронной дегенерации в сетчатке. Благоприятно клетки из популяции MLBM проникают в сосудистую сеть сетчатки и дифференцируют в эндотелиальные клетки, причем в то же время проникают в нейронную сеть и уменьшают интенсивность дегенерации клеток колбочек в сетчатке. Изолированная популяция клеток MLBM млекопитающего включает клетки, которые селективно нацеливаются на активированные ретинальные астроциты, когда инъецированы интравитреально в глаз, и устойчиво остаются в новой сосудистой сети и нейронной сети глаза. Предпочтительно, млекопитающим является человек.
В предпочтительном воплощении, по меньшей мере, примерно 75% клеток в изолированной популяции миелоподобных клеток костного мозга экспрессируют CD44, предпочтительнее, по меньшей мере, примерно 90%.
В одном предпочтительном воплощении клетки из популяции клеток MLBM трансфицируют терапевтически применимым геном. Например, клетки можно трансфицировать полинуклеотидами, которые операбельно кодируют нейротрофические средства или средства против ангиогенеза, которые селективно нацеливаются на новую сосудистую сеть и ингибируют образование новых сосудов, не поражая уже установившиеся сосуды, через форму генной терапии на основе клеток. В одном предпочтительном воплощении изолированная популяция клеток MLBM по изобретению включает ген, кодирующий пептид, ингибирующий ангиогенез. Ингибирующие ангиогенез клетки из популяции клеток MLBM применимы для модуляции аномального роста кровеносных сосудов при заболеваниях, таких как ARMD, DR и некоторые дегенерации сетчатки, связанные с аномальной сосудистой сетью. В другом предпочтительном воплощении изолированные клетки из популяции клеток MLBM по настоящему изобретению трансфицируют для включения гена, кодирующего нейротрофический пептид. Нейротрофические трансфицированные клетки MLBM применимы для промотирования спасения нейронов при болезни глаз, в том числе нейронной дегенерации сетчатки, такой как глаукома, пигментный ретинит и т.п.
Особым преимуществом лечения глаз изолированной популяцией клеток MLBM по настоящему изобретению является эффект васкулотрофического и нейроторофического спасения, наблюдаемый в глазах, обработанных интравитреально клетками из популяции клеток MLBM. Нейроны и фоторецепторы сетчатки, в частности колбочки, сохраняются, и можно поддерживать в некотором объеме зрительную функцию глаз, обработанных клетками из популяции клеток MLBM по изобретению.
Настоящее изобретение также относится к способу изоляции популяции миелоподобных клеток костного мозга негативным отбором клеток с маркером. Способ включает контактирование множества клеток костного мозга с антителами, специфичными для Ter119, CD45RB220 и CD3e, удаление клеток из множества клеток костного мозга, вступающих в иммунную реакцию с антителами к Ter119, CD45RB220 и CD3e, и извлечение миелоподобных клеток костного мозга, делетированных в клетках, экспрессирующих Ter119, CD45RB220 и CD3e. С использованием такого способа можно извлечь клеточную популяцию, в которой более 90% клеток экспрессируют CD44.
Предпочтительно, пораженная сетчатка, которую лечат популяцией клеток MLBM и способами по изобретению, содержит активированные астроциты. Этого можно достичь ранним лечением глаза, когда имеется ассоциированный глиоз, или использованием лазера для стимуляции локальной пролиферации активированных астроцитов.
Кроме лечебных применений, изолированная популяция миелоподобных клеток костного мозга по изобретению применима в качестве исследовательского инструмента для исследования физиологии развития сосудов в глазу и для доставки специфических генов к определенным местам размещения (например, в астроциты) в глазу. Такие применения дают ценный инструмент для исследования функции генов и возможных лечебных механизмов.
Краткое описание чертежей
На прилагаемых чертежах приводится описанное далее.
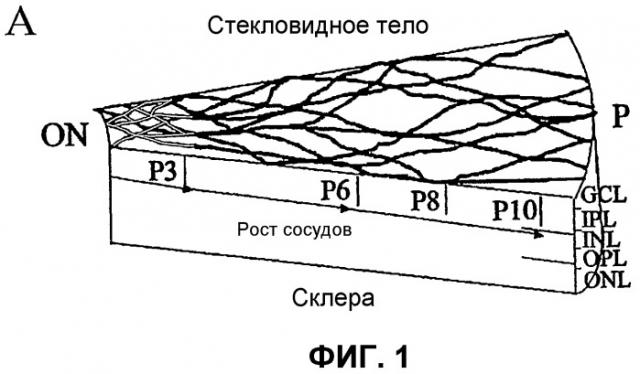
Фиг.1 отображает принципиальные схемы развития сетчатки у мыши. (А) Развитие первичного сплетения. (В) Вторая фаза образования сосудов сетчатки. GCL - слой ганглиозных клеток; IPL - внутренний слой сплетения; INL - внутренний ядерный слой; OPL - наружный слой сплетения; ONL - наружный ядерный слой; RPE - ретинальный пигментный эпителий; ON - зрительный нерв; Р - периферия. Часть (С) отображает характеризацию методом проточной цитометрии выделенных полученных из костного мозга клеток Lin+ HSC и Lin- HSC. Верхний ряд: точечный график распределения клеток, не меченных антителами, где R1 определяет определяемую количественно площадь дискриминационного окна РЕ-позитивного окрашивания; R2 показывает GFP-позитивное окрашивание; средний ряд - клетки Lin- HSC (С57В/6), и нижний ряд - клетки Lin+ HSC (С57В/6), каждую клеточную линию метят РЕ-конъюгированными антителами к Sca-1, c-kit, Flk-1/KDR, CD31. Данные по Tie-2 получают на мышах Tie-2-GFP. Проценты показывают процент позитивно меченых клеток из всей популяции Lin- HSC или Lin+ HSC.
Фиг.2 отображает внедрение HSC Lin- в развивающуюся сетчатку мыши. (а) На четвертые сутки после инъекции (Р6) интравитреально инъецированные клетки eGFP+ Lin- HSC присоединяются и дифференцируют на сетчатке. (b) Lin- HSC (мыши В6.129S7-Gtrosa26, окрашивание антителами β-gal) сами определяют будущее сосудистой сети, окрашенной антителами к коллагену IV (звездочка показывает верхнюю границу сосудистой сети). (с) Большинство клеток Lin+ HSC (eGFP+) на четвертый день после инъекции (Р6) неспособны к дифференцировке. (d) Мезентериальные мышиные ЕС eGFP+, четыре дня после инъекции (Р6). (е) Lin- HSC (eGFP+), инъецированные в зрелые глаза мышей. (f) Lin- HSC eGFP+ при малом увеличении, возвращающиеся и дифференцирующие вдоль предсуществующей астроцитарной матрицы в трансгенной мыши GFAP-GFP, (g) Ассоциация клеток Lin- (eGFP) и нижележащих астроцитов (стрелки) при большем увеличении. (h) Контроль - трансгенные неинъецированные GFAP-GFP. (i) На четвертые сутки после инъекции (Р6) Lin- HSC eGFP+ мигрируют и претерпевают дифференцировку на месте будущего глубокого сплетения. На чертеже слева - активность Lin- HSC во всей препарированной сетчатке; на чертеже справа показано местоположение клеток Lin- (стрелки) в сетчатке (верхняя часть со стороны стекловидного тела, нижняя часть - со стороны склеры). (j) Двойное мечение антителами к α-CD31-PE и α-GFP-alexa 488. Семь дней после инъекции, инъецированные Lin- HSC (eGFP, красный цвет) включаются в сосудистую сеть (CD31). Стрелки-указатели показывают области включения. (k) Клетки Lin- HSC eGFP+ образуют сосуды на четырнадцатый день после инъекции (Р17). (l и m) Интракардиальная инъекция родамина-декстрана показывает, что сосуды являются интактными и функционируют как в первичном (l), так и в глубоком сплетении (m).
Фиг.3 показывает, что клетки Lin- HSC eGFP+ возвращаются к глиозу (показано астроцитами, экспрессирующими GFAP, крайнее левое изображение), индуцированному повреждением, вызванным как лазером (а), так и механически (b), в зрелой сетчатке (звездочка показывает место повреждения). Изображения, крайние справа, получены при большем увеличении и показывают тесную связь Lin- HSC и астроцитов. Масштабная полоса = 20 мкМ.
Фиг.4 показывает, что клетки Lin- HSC спасают сосудистую сеть мыши с дегенерацией сетчатки. (a-d) Сетчатки на 27 сутки после инъекции (Р33) антигенами к коллагену IV; (a) и (b), сетчатки, инъецированные клетками Lin+ HSC (Balb/c), не показывают отличия в сосудистой сети от здоровой мыши FVB; (с) и (d), сетчатки, инъецированные клетками Lin- HSC (Balb/c), обнаруживают сильно развитую сосудистую сеть, аналогичную сети мыши дикого типа; (а) и (с), замороженные срезы целой сетчатки (верхняя часть со стороны стекловидного тела, нижняя часть со стороны склеры), окрашенные DAPI; (b) и (d) - глубокое сплетение во всем объеме сетчатки; (е) гистограмма, иллюстрирующая разрастание сосудистой сети глубокого сосудистого сплетения, образовавшегося в сетчатках, инъецированных клетками Lin- HSC (n=6). Степень глубокой ретинальной васкуляризации определяют количественно, вычисляя общую длину сосудов на каждом изображении. Сравнивают отношения (средняя длина сосудов)/область высокой степени (в микронах) для сетчаток с Lin- HSC, Lin+ HSC или контрольных. (f) Сравнение длины глубокого сосудистого сплетения после инъекции клеток Lin- HSC (R, правый глаз) или Lin+ HSC (L, левый глаз) у мышей rd/rd. Показаны результаты, полученные с шестью независимыми мышами (каждый цвет представляет отдельную мышь). (g) и (h) - клетки Lin- HSC также спасают сосудистую сеть rd/rd, когда инъецированы в глаза Р15. Показано промежуточное и глубокое сосудистое сплетение сетчаток, инъецированных клетками Lin- HSC (G) или Lin+ HSC (Н) (один месяц после инъекции).
Фиг.5 отображает микрофотографии ткани сетчатки мыши: (а) глубокий слой препарата всей сетчатки (rd/rd мыши) виден через 5 дней после инъекции (Р11) Lin- HSC eGFP+ (серый цвет); (b) и (с) - сосудистая сеть сетчатки Р60 мышей Tie-2-GFP (rd/rd), которые получили инъекцию клеток Lin- (b) или Lin+ HSC Balb/c, в Р6. В левых частях (b) и (с) видны только эндотелиальные клетки (окрашенные GFP). Средние части (b) и (с) показывают окрашивание антителами CD31; стрелки показывают сосуды, окрашенные CD31, но не GFP, правые части (b) и (с) показывают окрашивание как GFP, так и CD31. (d) Окрашивание α-SMA сетчатки, инъецированной Lin- HSC (левая часть), и контрольной сетчатки (правая часть).
Фиг.6 показывает, что трансфицированные Т2-TrpRS Lin- HSC ингибируют развитие сосудистой сети мыши. (а) Схематическое представление TrpRS, Т2-TrpRS и Т2-TrpRS с сигнальной последовательностью Igk человека по аминоконцам. (b) Сетчатки, инъецированные трансфицированными Т2-TrpRS Lin- HSC, экспрессируют белок Т2-TrpRS in vivo. (1) Рекомбинантный Т2-TrpRS, продуцированный в E. coli; (2) рекомбинантный Т2-TrpRS, продуцированный в E. coli; (3) рекомбинантный Т2-TrpRS, продуцированный в E. coli; (4) контрольная сетчатка; (5) сетчатка, инъецированная Lin- HSC + pSecTag2A (только вектор); (6) сетчатка, инъецированная Lin- HSC + pKLe135 (Igk-Т2-TrpRS в pSecTag). (а) Эндогенный TrpRS. (b) Рекомбинантный TrpRS. (с) Т2-TrpRS сетчатки, инъецированной Lin- HSC. (е-f) Характерные первичные (поверхностные) и вторичные (глубокие) сплетения инъецированных сетчаток, семь дней после инъекции; (с) и (d) - глаза, инъецированные Lin- HSC, трансфицированными пустой плазмидой, развиваются нормально; (е) и (f) - в большинстве глаз, инъецированных Lin- HSC, трансфицированными Т2-TrpRS, обнаруживают подавление глубокого сплетения; (с) и (е) - первичное (поверхностное) сплетение; (d) и (f) - вторичное (глубокое) сплетение. Отмеченные на (f) слабо выраженные сосуды являются "кровоточащими" изображениями первичных сосудов сети, показанных на (е).
Фиг.7 показывает последовательность ДНК, кодирующую Т2-TrpRS, меченный His6, SEQ ID NO: 1.
Фиг.8 показывает аминокислотную последовательность Т2-TrpRS, меченного His6, SEQ ID NO: 2.
Фиг.9 представляет микрофотографии и электроретинограммы (ERG) сетчаток мышей, получивших в глаза инъекцию Lin- HSC и Lin+ HSC (контроль).
Фиг.10 представляет статистические графики, показывающие корреляцию между спасением нейронов (ось Y) и спасением сосудов (ось X) как для промежуточных (Int.), так и для глубоких слоев сосудов глаз мыши rd/rd, обработанных Lin- HSC.
Фиг.11 представляет статистические графики, показывающие отсутствие корреляции между спасением нейронов (ось Y) и спасением сосудов (ось X) для глаз мыши rd/rd, обработанных Lin+ HSC.
Фиг.12 представляет собой диаграмму длины сосудов (ось Y) в произвольных относительных единицах в случае обработанных Lin- HSC (темные столбики) и необработанных (светлые столбики) глаз мыши rd/rd в моменты времени 1 месяц (1 М), 2 месяца (2 М) и 6 месяцев (6 М) после инъекции.
Фиг.13 включает три гистограммы, показывающие число ядер в наружном нейронном слое (ONR) мышей rd/rd через 1 месяц (1 М), 2 месяца (2 М) и 6 месяцев (6 М) после инъекции, и показывает существенное увеличение числа ядер в случае глаз, обработанных Lin- HSC (темные столбики), относительно контрольных глаз, обработанных Lin+ HSC (светлые столбики).
Фиг.14 представляет графики числа ядер в наружном нейронном слое отдельных мышей rd/rd, причем правый глаз (R, обработан Lin- HSC) сравнивают с левым глазом (L, контрольный глаз, обработан Lin+ HSC), в моменты времени (после инъекции) 1 месяц (1 М), 2 месяца (2 М) и 6 месяцев (6 М); каждая линия на данном графике соответствует сравнению глаз отдельной мыши.
Фиг.15 отображает изменения сосудистой сети и нейронов сетчатки у мышей rd1/rd1 (C3H/HeJ, левый ряд изображений) или мышей дикого типа (C57BL/6, правый ряд). Показана ретинальная сосудистая сеть промежуточных (верхний ряд) или глубоких (средний ряд) сосудистых сплетений в препаратах цельных сетчаток (красный цвет - коллаген IV, зеленый - CD31) и срезах (красный цвет - DAPI, зеленый - CD31, нижний ряд) одних и тех же сетчаток (Р - постнатальный день). (GCL - слой ганглиозных клеток, INL - внутренний ядерный слой, ONL - наружный ядерный слой).
Фиг.16 показывает, что инъекция Lin- HSC спасает от дегенерации нейроны у мышей rd1/rd1. (А, В и С) - Ретинальная сосудистая сеть промежуточного (Int.) или глубокого сплетения и срезы глаза, инъецированного Lin- HSC (правый ряд), и контралатерального контрольного глаза, инъецированного клетками (CD31-) (левый ряд), в Р30 (А), Р60 (В) и Р180 (С). (D) - средняя общая длина сосудистой сети (среднее + или - среднеквадратическая ошибка) в сетчатках, инъецированных Lin- HSC или контрольными клетками (CD31-), в Р30 (слева, n=10), P60 (посередине, n=10) и Р180 (справа, n=6). Данные для промежуточного (Int.) и глубокого сплетения показаны отдельно (ось Y - относительная длина сосудистой сети). (Е) - Средние числа ядер клеток в ONL в Р30 (слева, n=10), P60 (посередине, n=10) или Р180 (справа, n=6) сетчаток, инъецированных контрольными клетками (CD31-) или Lin- HSC (ось Y - относительное число ядер клеток в ONL). (F) - Линейная корреляция между длиной сосудистой сети (ось Х) и числом ядер клеток в ONL (ось Y) в Р30 (слева), P60 (посередине) и Р180 (справа) сетчаток, инъецированных Lin- HSC или контрольными клетками.
Фиг.17 показывает, что функция сетчатки спасается инъекцией Lin- HSC. Используют электроретинографическую (ERG) запись для измерения функции сетчаток, инъецированных Lin- HSC или контрольными клетками (CD31-). (А и В) - Характерные случаи спасенных и неспасенных сетчаток через 2 месяца после инъекции. Показаны срезы сетчатки правого глаза, инъецированного Lin- HSC (А), и левого глаза, инъецированного контрольными клетками CD31- (В), одного и того же животного (зеленый цвет - сосудистая сеть, окрашенная CD31, красный - ядра, окрашенные DAPI). (С) - Результаты ERG для того же животного, к которому относятся (А) и (В).
Фиг.18 показывает, что популяция клеток костного мозга человека может спасать дегенерирующие сетчатки у мыши rd1 (А-С). Спасение также наблюдают на другой модели дегенерации сетчатки rd10 (D-K). А - Lin- HSC человека (hLin- HSC), меченные зеленым красителем, могут дифференцировать в клетки сосудистой сети сетчатки после интравитреальной инъекции мышам C3SnSmn. CB17-Prkdc SCID. (В и С) - сосудистая сеть сетчатки (левые изображения; верх - промежуточное сплетение, низ - глубокое сплетение) и нейроны (правые изображения) в глазу, инъецированном hLin- HSC (В), или контралатеральном контрольном глазу (С), через 1,5 месяца после инъекции. (D-K) - Спасение мышей rd10 Lin- HSC (инъецированных в Р6). Показаны характерные сетчатки в Р21 (D - Lin- HSC, Н - контрольные клетки), Р30 (Е - Lin- HSC, I - контрольные клетки), Р60 (F - Lin- HSC, J - контрольные клетки) и Р105 (G - Lin- HSC, K - контрольные клетки) (обработанные и необработанные глаза одного и того же животного в каждый момент времени). Сосудистую сеть сетчатки (верхние изображения на каждой части представляют собой промежуточное сплетение; средние изображения на каждой части представляют собой глубокое сплетение) окрашивают CD31 (зеленый цвет) и коллагеном IV (красный). Нижние изображения на каждой части показывают поперечный срез той же сетчатки (красный цвет - DAPI, зеленый - CD31).
Фиг.19 показывает, что кристаллин αA позитивно регулируется в спасенных клетках наружного ядерного слоя после обработки Lin- HSC, но не в контралатеральных глазах, обработанных контрольными клетками. Левое изображение - контроль IgG в спасенной сетчатке, среднее изображение - кристаллин αA в спасенной сетчатке, правое изображение - кристаллин αA в неспасенной сетчатке.
Фиг.20 включает таблицы генов, которые позитивно регулируются в сетчатках мышей, обработанных Lin- HSC по настоящему изобретению. (А) - Гены, экспрессия которых возрастает в 3 раза в сетчатках мышей, обработанных мышиными Lin- HSC. (В) Гены кристаллина, которые позитивно регулируются в сетчатках мышей, обработанных мышиными Lin- HSC. (С) Гены, экспрессия которых возрастает в 2 раза в сетчатках мышей, обработанных Lin- HSC человека. (D) - Гены для нейротрофических факторов или факторов роста, экспрессия которых позитивно регулируются в сетчатках мышей, обработанных Lin- HSC человека.
Фиг.21 иллюстрирует распределение CD31 и поверхностных антигенов интегрина α6 в популяциях CD133-позитивных (CD133+) и CD133-негативных (CD133-) Lin- HSC человека. Левые изображения показывают графики рассеяния по результатам проточной цитометрии. Центральные и правые части представляют собой гистограммы, показывающие уровень экспрессии специфических антител в клеточной популяции. Ось Y представляет число событий, и ось Х показывает интенсивность сигнала. Заштрихованная гистограмма, смещенная вправо от контурной (контрольной) гистограммы, представляет возросший сигнал флуоресценции и экспрессию антител выше фонового уровня.
Фиг.22 иллюстрирует постнатальное развитие сетчатки у мышей дикого типа С57/В16, происходящее при нормальных уровнях кислорода (нормоксия), в постнатальные дни Р0-Р30.
Фиг.23 иллюстрирует модель вызванной кислородом ретинопатии у мышей С57/В16, возникшей при высоких уровнях кислорода (гипероксия; 75% кислорода) в дни Р7-Р12 с последующей нормоксией в Р12-Р17.
Фиг.24 показывает спасение сосудов путем обработки популяциями Lin- HSC на модели ретинопатии, вызванной кислородом (OIR).
Фиг.25 показывает, что спасенные фоторецепторы в наружном ядерном слое (ONL) мыши rd1 после интравитреальной инъекции Lin- HSC представляют собой, преимущественно, колбочки. Небольшой процент фоторецепторов сетчатки мышей дикого типа (верхние изображения) составляют колбочки, как показывает экспрессия красного/зеленого опсина колбочек (А), в то время как большинство клеток ONL позитивны в отношении красного специфического родопсина (В). Сосудистая сеть сетчатки показывает аутофлуоресценцию с неиммунной сывороткой (С), но ядерные слои полностью негативны для окрашивания специфическими опсинами палочек или колбочек. Сетчатки мышей rd/rd (нижние изображения) имеют уменьшенный внутренний ядерный слой и почти полностью атрофированный ONL, которые оба негативны в отношении опсина колбочек (D) или палочек (часть G). Контроль - глаза, обработанные CD31-HSC, идентичен сетчаткам rd/rd, не получавшим инъекцию, без окрашивания для опсина кобочек (Е) или палочек (Н). Контралатеральные глаза, обработанные Lin-HSC, показывают заметно уменьшенный, но явно присутствующий слой ONL, который состоит преимущественно из колбочек, что показывает позитивная иммунореактивность в отношении красного/зеленого опсина колбочек (F). Также отмечают небольшое число палочек (I).
Фиг.26 показывает графики рассеяния по определению проточной цитометрией свойств популяций стволовых клеток негативной линии и позитивной линии (верхние левые и нижние левые графики, соответственно), показывающие проценты клеток, экспрессирующих антиген CD44 (красные точки); а также графики популяций CD31-негативных и CD31-позитивных клеток (верхние правые и нижние правые графики, соответственно), показывающие проценты клеток, экспрессирующих антиген CD44 (красные точки).
Фиг.27 показывает графики рассеяния по определению проточной цитометрией свойств популяций клеток негативной линии, экспрессирующих антиген CD44 (левый ряд графиков), и субпопуляций клеток костного мозга, которые не экспрессируют антиген CD44 на значительном уровне (правый ряд графиков), иллюстрирующие относительные проценты клеток, экспрессирующих другие антигены клеточной поверхности.
Фиг.28 показывает микрофотографические изображения сетчатки мыши, интравитреально инъецированной клетками популяции клеток MLBM по изобретению (слева), в сравнении с сетчаткой мыши, интравитреально инъецированной клетками CD44lo.
Фиг.29 показывает микрофотографические изображения сетчатки глаз, инъецированных клетками популяции клеток MLBM (CD44hi) и клетками CD44lo.
Фиг.30 показывает графики, демонстрирующие благоприятное действие популяции клеток MLBM для уменьшения интесивности патогенного ангиогенеза и промотирования благоприятной физиологической реваскуляризации сетчаток мышей на модели вызванной кислородом ретинопатии - ретролетальной фиброплазии. На верхнем графике сравниваются площадь пучков преретинальных новых образовавшихся сосудов в случае контрольной сетчатки (первый столбик), сетчатки, обработанной клетками CD44lo (средний столбик), и сетчаток, обработанных клетками из популяции клеток MLBM (правый столбик). На нижнем графике сравнивается площадь сосудистой облитерации контрольной сетчатки (первый столбик), сетчатки, обработанной клетками CD44lo (средний столбик), и сетчаток, обработанных клетками из популяции клеток MLBM (правый столбик).
Фиг.31 представляет собой микрофотографическое изображение, показывающее, что только клетки из популяции клеток MLBM включаются в сосудистую сеть сетчатки, клетки экспрессируют васкулярный эндотелиальный фактор роста (VEGF), как показывает окрашивание в зеленый цвет клеток в нижней части изображения.
Фиг.32 представляет микрофотографические изображения, показывающие, что клетки из популяции клеток MLBM CD11b+ по изобретению селективно выбирают мишенью сосудистую сеть сетчатки.
Фиг.33 представляет микрофотографические изображения, показывающие, что клетки костного мозга CD44-CD11b- сосудистую сеть сетчатки селективно мишенью не выбирают.
Фиг.34 показывает последовательность аминокислотных остатков фрагмента Т2 TrpRS (SEQ ID NO: 3) и его вариации Т-2-TrpRS-GD (SEQ ID NO: 4).
Фиг.35 показывает последовательность аминокислотных остатков мини-TrpRS (SEQ ID NO: 5).
Фиг.36 показывает последовательность аминокислотных остатков Т1-TrpRS (SEQ ID NO: 6).
Фиг.37 показывает нормальное развитие сосудов сетчатки у мыши-модели, вызванной кислородом ретинопатии (OIR), и эффект спасения после интравитреальной трансплантации клеток, полученных из линии клеток костного мозга. Мышь рождается с бессосудистой сетчаткой, как видно в постнатальный день 2 (Р2) (изображение а, тотальный препарат сетчатки), когда сосуды обнаруживают на поверхности сетчатки, занимающей одну плоскость, как видно на b. Изображения b, d и f представляют собой изображения, взятые из наборов данных трехмерного (3D) исполнения анфас конфокальной z-серии, повернутых на 90%. В течение первой недели после рождения поверхностная сосудистая сеть сетчатки растет радиально от диска зрительного нерва, почти достигая периферии в Р10 (с). Затем в течение второй недели создается глубокая ретинальная сосудистая сеть из ответвления поверхностного слоя (d). Наконец, между первыми двумя сплетениями образуется третье сплетение сосудов, и зрелая сосудистая сеть сетчатки устанавливается в примерно Р30 (е, f). Изображение g показывает, что воздействие гипероксии на модель OIR вызывает центральную вазооблитерацию, как в данном случае видно в Р10. Изображение h показывает, что после возвращения к нормоксии в Р12 в центральной сетчатке начинается реваскуляризация, и характерные пучки преретинальных новых сосудов образуются на поверхности между васкуляризованной (периферической) и бессосудистой (центральной) сетчаткой. Такие пучки интенсивно окрашиваются изолектином. Части i-n показывают, что гемопоэтические клетки-предшественники Lin- промотируют восстановление сосудов на модели OIR. Клетки Lin-, инъецированные интравитреально перед интенсивным воздействием кислорода, существенно ускоряют реваскуляризацию центральной сетчатки при сравнении с другим глазом, обработанным носителем, в Р17. В то время как сетчатка, обработанная носителем, показывает частичное отсутствие поверхностной сосудистой сети (i) и полное отсутствие глубокой ретинальной сосудистой сети (k, m), обработанный клетками Lin- другой глаз показывает относительно нормальную сосудистую сеть (j) с наличием всех трех сплетений (k, m). Часть о показывает, что в Р17 глаза OIR, обработанные клетками Lin-, полностью реваскуляризуются значительно чаще, чем глаза, не подвергавшиеся инъекции, или глаза с инъекцией носителя. Сосуды визуализируют кардиальной перфузией флуоресцеина-декстрана, как показано на изображениях a-f, i j, и лектином GS, изображения g, h, k-n. Ядра на изображениях k-n мечены DAPI.
Фиг.38 показывает, что клетки Lin- ускоряют ретинальную реваскуляризацию и уменьшают образование пучков преретинальных новых сосудов при OIR. Изображения a-d показывают применение метода компьютерного анализа изображений для вычисления площади облитерации сосудов сетчатки, а также образования пучков преретинальных новых сосудов (красный цвет) на тотальных препаратах сетчатки из глаз OIR в постнатальный день 17. Часть е показывает, что сетчатки, обработанные клетками Lin- перед гипероксией, показывают почти 6-кратное снижение площади облитерации относительно контрольных не подвергавшихся инъекции образцов и приблизительно 5-кратное снижение по сравнению с сетчатками глаз, обработанных одним носителем. Часть f показывает, что обработка клетками Lin- существенно уменьшает двухмерную площадь пучков новых сосудов по сравнению с сетчатками необработанных глаз и обработанных одним носителем. Часть g показывает, что трансплантация клеток Lin- эффективна для снижения площади облитерации не только когда клетки вводят до гипероксии, но также в Р9-Р12 во время гипероксии и также после возвращения в условия нормоксии (графики представляют среднее ± SEM, *p<0,001).
Фиг.39 показывает, что обработка клетками костного мозга оказывает незначительное или непродолжительное токсическое действие. Сетчатки, оцененные через 5 или 6 месяцев после обработки клетками Lin-, имеют нормальную на вид сосудистую сеть, и нейронная сетчатка на поперечных срезах гистологически выглядит сохранившейся (a-f, сетчатка, не подвергавшаяся инъекции, против инъецированной клетками Lin-, 6 месяцев после трансплантации). Опухолей не отмечают, и единственной аномалией является случайная "розетка" в нейронной сетчатке, которую также можно видеть в случае контрольных глаз, не подвергавшихся инъекции (g, h).
Фиг.40 показывает, что клетки CD44HI превалируют в популяции Lin- и эффективно промотируют восстановление сосудов на модели OIR. Часть а показывает, что костный мозг содержит фракции CD44HI и CD44LO, и популяция обогащена клетками CD44HI по сравнению с контрольными клетками CD. Вставки показывают свойства слабого рассеяния клеток CD44HI, которые являются типично моноцитами и гранулоцитами, в то время как свойства слабого рассеяния клеток CD44LO являются свойствами типичных лимфоцитов. Часть b показывает в Р17 характерные сетчатки глаз, обработанных клетками костного мозга CD44LO и CD44HI перед воздействием кислорода. Нижние части представляют примеры количественного определения площадей облитерации и образования новых сосудов в Р17, используемых для представления данных, показанных на фрагменте с. Часть с показывает, что облитерация сосудов и преретинальное образование новых сосудов уменьшаются в случае глаз, обработанных клетками CD44HI, с эффективностью, схожей со случаем, когда глаза обрабатывают клетками Lin-. Площади облитерации сосудов (*) и преретинального образования новых сосудов (**) существенно меньше при инъекции в глаз CD44HI и Lin- по сравнению с инъекцией носителя или без инъекции (p<10-5 во всех случаях). Площадь облитерации для глаз, обработанных Lin-, также уменьшается по сравнению с CD44HI (р=0,03), но в значительно меньшей степени. Площади преретинального образования новых сосудов для глаз, обработанных Lin- и CD44HI, существенно не отличаются (р=0,25).
Фиг.41 показывает, что субпопуляция CD44HI экспрессирует маркеры миелоидных линий. На части а отражается применение проточной цитометрии с использованием двухцветной маркировки для дополнительной характеризации популяций CD44. Все клетки метят антителами против CD44 и метят совместно указанными антителами. Популяция клеток CD44HI показывает сильное мечение в случае CD11a, CD11b и Ly6GC. Фракции клеток CD44hi позитивны в отношении CD14, F4/80, cKit и CD115. Большинство указанных антигенов присутствует в миелоидных клеточных линиях. Клетки CD44lo сильно метятся Ter119 и CD45R B220, которые являются маркерами для эритробластов и В-клеток соответственно.
Фиг.42 показывает, что клетки CD44HI закрепляются в периваскулярном пространстве сетчатки. Конфокальное изображение используют для создания ряда изображений в z-измерении, которые приводят к 3D. На части а показана проекция этого и показаны меченый CD31 сосудистый эндотелий и экспрессия GFP из введенных клеток костного мозга. Предполагается, что клетка костного мозга появляется в периваскулярной позиции. Данные 3D показывают, что визуализируются прос