Ингибитор dpp-iv, включающий бета-аминогруппу, способ его получения и содержащая его фармацевтическая композиция для предупреждения и лечения диабета или ожирения
Иллюстрации
Показать всеИзобретение относится к соединению формулы 1
где Х представляет собой OR1, SR1 или NR1R2, где R1 и R2 независимо представляют собой С1-С5 низший алкил, и R1 и R2 в NR1R2 могут образовывать 5-7-членное кольцо, включающее гетероатом О; или к его стереоизомеру, фармацевтически приемлемой соли, гидрату или сольвату. Изобретение также относится к способу его получения и к фармацевтической композиции на его основе, обладающей ингибиторной активностью в отношении DPP-IV. Технический результат - получены новые соединения, которые могут найти свое применение в медицине для предупреждения или лечения связанных с DPP-IV заболеваний, таких как диабет или ожирение. 6 н. и 6 з.п. ф-лы, 1 табл., 2 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к гетероциклическому соединению, содержащему бета-аминогруппу, которое обладает превосходной ингибиторной активностью в отношении дипептидилпептидазы-IV (в дальнейшем в настоящем документе обозначаемой как "DPP-IV") и высокой биодоступностью, и к фармацевтической композиции, содержащей указанное гетероциклическое соединение или его фармацевтически приемлемую соль в качестве активного ингредиента.
УРОВЕНЬ ТЕХНИКИ
Фермент дипептидилпептидаза IV, сокращаемый в настоящем документе как DPP-IV (и в других документах как DP-IV, DP-4 или DAP-IV) а также по классификации известный как EC. 3.4.14.5, представляет собой сериновую протеазу (Barrett A. J. et al., Arch. Biochem. Biophys., 1995, 247-250), которая отщепляет N-концевой дипептид от пептидов, которые начинаются с последовательности H-Xaa-Pro-Y или H-Xaa-Ala-Y, где Xaa представляет собой любую липофильную аминокислоту, Pro представляет собой пролин и Ala представляет собой аланин (Heins J., et al., Biochim. et Biophys. Acta 1988, 161). DPP-IV широко распространен и встречается в различных тканях млекопитающих, таких как почка, печень и тонкий кишечник (Hegen M. et al., J. Immunol, 1990, 2908-2914). Впервые DPP-IV был идентифицирован как мембраносвязанный белок. Позднее была идентифицирована растворимая форма (Duke-Cohan J. S. et al., J. Biol. Chem., 1995, 14107-14114). Согласно недавно опубликованному исследованию и отчету, было выявлено, что такая растворимая форма DPP-IV обладает той же структурой и функцией, что и мембраносвязанная форма фермента, и она находится в крови без определенного мембраносвязанного домена (Christine D. et al., Eur. J. Biochem., 2000, 5608-5613).
Первоначальный интерес к DPP-IV был сфокусирован на его роли в активации T-лимфоцитов. DPP-IV, ответственный за активацию T-лимфоцитов, был конкретно обозначен как CD26. В отчете, в котором показано, что CD26 связывается или взаимодействует с вирусом иммунодефицита человека (HIV) (Guteil W. G. et al., Proc. Natl. Acad. Sci., 1994, 6594-6598), было сделано предположение, что ингибиторы DPP-IV могут быть пригодны для лечения СПИД (Doreen M. A. et al., Bioorg. Med. Chem. Lett., 1996, 2745-2748).
В дополнение к ключевой роли участия в иммунной системе основная функция DPP-IV связана с его пептидолитической активностью, как описано выше. В частности, роли DPP-IV уделяется внимание, поскольку было выявлено, что DPP-IV является ключевым ферментом, вовлеченным в деградацию глюкагон-подобного белка-1 (в дальнейшем в настоящем документе обозначаемого как "GLP-1") в тонком кишечнике (Mentlein R. et al., Eur. J. Biochem., 1993, 829-835). GLP-1 представляет собой пептидный гормон из 30 аминокислот, который секретируется L-клетками кишечника в качестве ответа тонкого кишечника на прием пищи (Goke R. et al., J. Biol. Chem., 1993, 19650-19655). Поскольку известно, что GLP-1 оказывает усиливающие эффекты на действие инсулина в отношении контроля уровней глюкозы в крови после приема пищи (Hoist J. J. et al., Diabetes Care, 1996, 580-586), было предположено, что ингибиторы DPP-IV также могут быть подходящим образом использованы для лечения диабета 2 типа. Исходя из этого предположения, была разработана ранняя форма ингибитора DPP-IV, и в некоторых отчетах была продемонстрирована терапевтическая эффективность лекарственного средства в экспериментах на животных (Pauly R. P. et al., Metabolism, 1999, 385-389). Кроме того, у дефицитных по DPP-IV мышей или крыс сохранялась активность GLP-1 и высокие уровни инсулина, что приводило к снижению уровней глюкозы в крови, и такое генетическое нарушение или мутация гена DPP-IV не оказывала существенного эффекта на выживаемость отдельных животных (Marguet D. et al., Proc. Natl. Acad. Sci., 2000, 6874-6879). Следовательно, было предположено, что DPP-IV является возможным сильнодействующим лекарственным средством для лечения диабета 2 типа, что привело к ускоренному исследованию и разработке ингибитора DPP-IV.
Связывание GLP-1 с рецептором в различных тканях приводит к сытости (ощущению наполненности), замедленному опорожнению желудка и ускоренному росту бета-клеток поджелудочной железы. Таким образом, постепенно увеличивается количество клинических испытаний лечения диабета 2 посредством внутривенного введения непосредственно GLP-1 (Verdich C. et al., J. Clin. Endocrinol. Metab., 2001, 4382-4389). Время полужизни GLP-1 составляет только 2 мин (Kieffer T. J., et al., Endocrinology, 1995, 3585-3596), так что короткое время полужизни является основным препятствием для прямого применения GLP-1 в качестве лекарственного средства. После этого большим количеством исследовательских групп и институтов было предпринято множество попыток получения производных GLP-1, что привело к разработке и коммерциализации пептида, который способен удлинять короткое время полужизни in vivo (Deacon C. F., Diabetes, 2004, 2181-2189). Однако такое производное GLP-1 все еще обладает существенным ограничением, состоящим в том, что оно представляет собой инъецируемый состав. Кроме того, значительный интерес все больше и больше фокусируется на разработке эффективного ингибитора DPP-IV, поскольку активный GLP-1 (7-36) деградируется посредством DPP-IV, а затем превращается в неактивный GLP-1 (9-36) только в течение короткого периода времени, например 2 мин.
Начало разработки ингибиторов DPP-IV было сходным с путем развития других ингибиторов. Это значит, что большинство результатов исследований было получено для аналогов субстратов. Репрезентативным аналогом субстрата является дипептидное производное, которое было получено в качестве результата раннего исследования, которое проводили на исходном ядре, имеющем структуру, сходную со структурой пролина (Pro), на основании того факта, что DPP-IV обладает выраженной аффинностью к пептиду, содержащему конкретную аминокислоту - пролин (Chinnaswamy T. et al., J. Biol. Chem., 1990, 1476-1483). Типичные примеры пролиноподобных структур включают пирролидид и тиазолидид, и производные, содержащие эти соединения с исходными ядрами, обладают обратимой и конкурентной ингибиторной активностью в отношении фермента DPP-IV (Augustyns KJL., et al., Eur. J. Med. Chem., 1997, 301-309).
В число результатов таких обширных исследований и разработки входят продолжающиеся эксперименты по механизму действия и эффективности определенных соединений, конкретно Val-Pyr (валин-пирролидид), Ile-Thia (изолейцин-тиазолидид) и т.п. В частности, большое внимание уделено Ile-Thia, поскольку структура Val-Pyr оказывает относительно слабую ингибиторную активность на DPP-IV (Hanne B. R., et al., Nat. Struct. Biol., 2003, 19-25), что, по существу, вызвало интенсивное исследование и изучение производных соединения Ile-Thia.
Из производных соединений Ile-Thia, на которых было сосредоточено указанное выше изучение и исследование, и которые были получены, соединение, обладающее наиболее выраженной активностью, представляло собой соединение серии тиазолидидов бета-аминокислот, которое попытались получить в Merck & Co., Inc. Однако, согласно результатам фармакодинамических и фармакокинетических экспериментов, проведенных у крыс, полученное соединение обладало в значительной степени низкой биодоступностью в сочетании с очевидным ограничением в ингибировании ферментативной активности (Jinyou Xu, et al., Bioorg. Med. Chem. Lett., 2004, 4759-4762). Следовательно, последующая разработка соединений этого класса была прервана вследствие существенных недостатков.
В ходе указанного выше исследования в Merck было отмечено, что бета-аминокислота, в дополнение к тиазолидидному исходному ядру, также является ключевым фактором, оказывающим выраженные эффекты на ингибиторную активность DPP-IV. Это открытие было применено в подходе с заменой тиазолидидного исходного ядра отличающимся соединением исходного ядра (Linda L. B., et al., Bioorg. Med. Chem. Lett., 2004, 4763-4766). В таком последовательном исследовании было синтезировано множество производных, имеющих замену тиазолидидного исходного ядра пиперазиновым исходным ядром, с тестированием эффективности лекарственных средств и фармакодинамическими исследованиями. К сожалению, пиперазиновые производные Merck все еще обладали в значительной степени недостаточной биодоступностью. На основании оптимизации соединения для устранения такого недостатка был разработан продукт MK-0431 (торговая марка: JANUVIA) с модификацией пиперазиновой группы до триазолопиперазиновой группы. Этот продукт в настоящее время доступен в рамках одобрения новых лекарственных средств US FDA в 2006. Кроме того, после MK-0431, в настоящее время разрабатывается соединение с включением группы диазепанона (семичленное кольцо) (WO 2004037169; WO 2005011581; WO 2006104997; и Bioorg. Med. Chem. Lett, 2007, 49-52). В частности, согласно статье, опубликованной в журнале (Bioorg. Med. Chem. Lett., 2007, 49-52), было показано, что имидазолон (пятичленное кольцо) и пиперазинон (шестичленное кольцо) обладают значительно более низкой активностью in vitro по сравнению с диазепаноном, что, таким образом, привело к усиленному сосредоточению внимания на оптимизации диазепанона.
[MK-0431]
В результате множества обширных и интенсивных исследований и экспериментов для решения проблем, описанных выше, и для достижения оптимизации представляющего интерес соединения авторы настоящего изобретения открыли, что когда в группе пиперазинона сделана замена, включающая гетероатом, модифицированное таким образом соединение не только обладает превосходной ингибиторной активностью в отношении DPP-IV, но также способно достигать значительно повышенной биодоступности по сравнению с общепринятым ингибитором DPP-IV, а затем успешно провели синтез нового гетероциклического соединения, содержащего бета-аминогруппу. Настоящее изобретение было сделано на основании этих открытий.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
Задачей настоящего изобретения является предоставление гетероциклического соединения, содержащего бета-аминогруппу и обладающего ингибиторной активностью в отношении DPP-IV, или его фармацевтически приемлемой соли, гидрата или сольвата.
Другой задачей настоящего изобретения является предоставление фармацевтической композиции для предупреждения и лечения диабета или ожирения, содержащей в качестве активного ингредиента указанное выше гетероциклическое соединение или его фармацевтически приемлемую соль, гидрат или сольват.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
Далее настоящее изобретение описано более подробно. Настоящее изобретение относится к гетерциклическим соединениям с бета-аминогруппой, представленным формулой 1:
где X представляет собой OR1, SR1 или NR1R2, где R1 и R2 независимо представляют собой C1-C5 низший алкил, и R1 и R2 в NR1R2 могут образовывать 5-7-членное кольцо с включением гетероатома O; или к их фармацевтически приемлемой соли.
Предпочтительно, соединение формулы 1 в соответствии с настоящим изобретением включает соединение формулы 2, которое представляет собой стереоизомер, индуцирующий оптическую активность на атоме углерода в 3 положении кольца пиперазинона, и соответствует формуле 2, ниже.
где X является таким, как определено для формулы 1.
Следовательно, соединение формулы 1 может иметь два асимметричных центра. Конкретно, соединение формулы 1, как показано на формуле 2, может иметь асимметричные центры на бета-углероде и на углероде в 3 положении кольца пиперазинона, так что оно может быть представлено в форме одного диастереоизомера, рацемата, рацемической смеси или диастереоизомерной смеси, все из которых относятся к соединению формулы 1 в соответствии с настоящим изобретением.
Кроме того, соединение формулы 1 может частично присутствовать в качестве таутомера. Также в соединение формулы 1 включены отдельные таутомеры, а также их смеси.
Стереоизомерную форму соединения формулы 1 можно получать стереоселективным синтезом в соответствии с общепринятым способом, известным в данной области, с использованием оптически чистого исходного материала или известного реагента.
Предпочтительные примеры содержащего бета-аминогруппу гетероциклического соединения формулы 1 в соответствии с настоящим изобретением могут включать следующие соединения:
1) гидрохлорид (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(трет-бутоксиметил)пиперазин-2-она;
2) гидрохлорид (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(метоксиметил)пиперазин-2-она;
3) гидрохлорид (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(этоксиметил)пиперазин-2-она;
4) гидрохлорид (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(изопропоксиметил)пиперазин-2-она;
5) гидрохлорид (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(циклопентилоксиметил)пиперазин-2-она;
6) дигидрохлорид (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-[(диэтиламино)метил]пиперазин-2-она;
7) дигидрохлорид (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-[(этилметиламино)метил]пиперазин-2-она;
8) дигидрохлорид (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(морфолинометил)пиперазин-2-она;
9) гидрохлорид (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(трет-бутилтиометил)пиперазин-2-она;
10) гидрохлорид (S)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(трет-бутоксиметил)пиперазин-2-она;
11) (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(трет-бутоксиметил)пиперазин-2-он;
12) тартрат (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(трет-бутоксиметил)пиперазин-2-она;
13) цитрат (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(трет-бутоксиметил)пиперазин-2-она;
14) фосфат (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(трет-бутоксиметил)пиперазин-2-она;
15) ацетат (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(трет-бутоксиметил)пиперазин-2-она;
16) малат (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(трет-бутоксиметил)пиперазин-2-она;
17) сукцинат (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(трет-бутоксиметил)пиперазин-2-она; и
18) адипат (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(трет-бутоксиметил)пиперазин-2-она.
Содержащее бета-аминогруппу гетероциклическое соединение формулы 1 в соответствии с настоящим изобретением включает его фармацевтически приемлемую соль, а также гидрат и сольват, которые можно получать из него.
Фармацевтически приемлемую соль гетероциклического соединения формулы 1 можно получать любым общепринятым способом получения солей, известным в данной области.
Как используют в настоящем документе, термин "фармацевтически приемлемая соль" относится к соли, полученной из фармацевтически приемлемого нетоксичного основания или кислоты, включающих неорганическое или органическое основание и неорганическую или органическую кислоту. Примеры фармацевтически приемлемой соли могут включать соли соединения 1 с неорганическим основанием, например с ионом алюминия, аммония, кальция, меди, трехвалентного железа, двухвалентного железа, лития, магния, манганата, марганца, калия, натрия или цинка. Особенно предпочтительными являются соли аммония, кальция, магния, калия и натрия. Твердая соль может иметь одну или несколько кристаллических структур, или в ином случае она может иметь форму гидрата. Примеры фармацевтически приемлемой нетоксичной органической соли могут включать соли соединения 1 с первичным, вторичным или третичным амином, замещенным амином, таким как встречающийся в природе замещенный амин, циклическим амином, или основной ионообменной смолой, такой как аргининовая, бетаиновая, кофеиновая, холиновая, N,N'-дибензилэтилендиаминовая, диэтиламиновая, 2-диэтиламиноэтаноловая, 2-диметиламиноэтаноловая, этаноламиновая, этилендиаминовая, N-этилморфолиновая, N-этилпиперидиновая, глюкаминовая, глюкозаминовая, гистидиновая, гидрабаминовая, изопропиламиновая, лизиновая, метилглюкаминовая, морфолиновая, пиперазиновая, пиперидиновая, полиаминовая смола, прокаином, пурином, теобромином, триэтиламином, триметиламином, трипропиламином и трометамином.
Когда соединение по настоящему изобретению является основанием, его соль можно получать из фармацевтически приемлемых нетоксичных кислот, включающих неорганические и органические кислоты. Примеры кислоты могут включать уксусную кислоту, бензолсульфоновую кислоту, бензойную кислоту, камфорсульфоновую кислоту, лимонную кислоту, этансульфоновую кислоту, фумаровую кислоту, глюконовую кислоту, глутаминовую кислоту, бромисто-водородную кислоту, хлористо-водородную кислоту, изетионовую кислоту, молочную кислоту, малеиновую кислоту, яблочную кислоту, миндальную кислоту, метансульфоновую кислоту, муциновую кислоту, азотную кислоту, памовую кислоту, пантотеновую кислоту, фосфорную кислоту, янтарную кислоту, серную кислоту, винно-каменную кислоту, п-толуолсульфоновую кислоту и адипиновую кислоту. Особенно предпочтительными являются уксусная, лимонная, хлористо-водородная, яблочная, фосфорная, янтарная, винно-каменная и адипиновая кислоты.
Когда в настоящем документе представлено соединение формулы 1, этот термин включает его фармацевтически приемлемую соль.
Как используют в настоящем документе, термин "гидрат" означает соединение формулы 1 или его фармацевтически приемлемую соль, которые дополнительно включают стехиометрическое или нестехиометрическое количество воды, связанной с ними посредством нековалентных межмолекулярных сил. Гидрат может содержать более 1 эквивалента воды, как правило, от 1 до 5 эквивалентов воды. Гидрат можно получать кристаллизацией соединения формулы 1 или его фармацевтически приемлемой соли в воде или содержащем воду растворителе.
Как используют в настоящем документе, термин "сольват" означает соединение формулы 1 или его соль, которые дополнительно включают стехиометрическое или нестехиометрическое количество растворителя, связанного с ними посредством нековалентных межмолекулярных сил. Предпочтительные растворители являются летучими, нетоксичными и/или приемлемыми для введения человеку. Например, могут быть упомянуты этанол, метанол, пропанол, метиленхлорид и т.д.
В соответствии с другим аспектом настоящего изобретения предусмотрен способ получения гетероциклического соединения с бета-аминогруппой, представленного формулой 1, или его фармацевтически приемлемой соли.
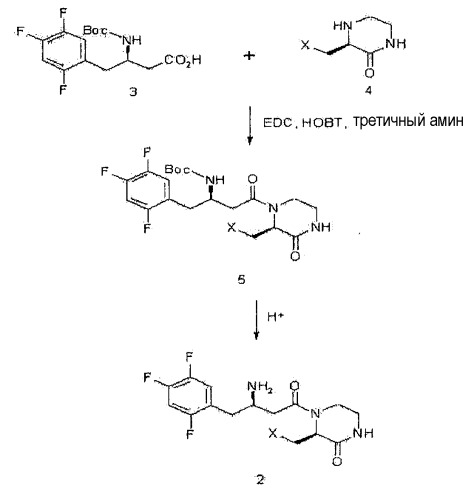
Настоящее изобретение, как показано на схеме реакции 1, ниже, включает способ получения гетероциклического соединения, представленного формулой 2, включающий: 1) реакцию соединения формулы 3, имеющего бета-аминогруппу, с замещенным гетероциклическим соединением формулы 4 в присутствии 1-гидроксибензотриазола (HOBT), 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) и третичного амина с получением, таким образом, соединения формулы 5, имеющего пептидную связь, и 2) реакцию соединения формулы 5 в присутствии кислоты с получением гетероциклического соединения формулы 2, имеющего бета-аминогруппу.
[Схема реакции 1]
где X является таким, как определено для формулы 1.
Например, промежуточное соединение формулы 5 можно получать реакцией соединения формулы 3 и соединения формулы 4 обычным путем в растворителе, таком как N,N-диметилформамид (DMF) или дихлорметан, в присутствии связывающего реагента, такого как 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC) или 1-гидроксибензотриазол (HOBT), и основания, такого как диизопропилэтиламин или триэтиламин, при температуре от 0°С до комнатной температуры в течение от 3 до 48 часов.
Для предотвращения участия соединения в пептидизации атом азота промежуточного соединения формулы 5, которое получено пептидизацией, защищают защитной группой. Требуемое гетероциклическое соединение формулы 2, имеющее бета-аминогруппу, можно получить удалением защитной группы посредством реакции снятия защитной группы. Следовательно, поскольку защитная группа представляет собой Boc, удаление защитной группы можно проводить в кислых условиях, как правило, с использованием смеси трифторуксусная кислота/дихлорметан, смеси этилацетат/хлористо-водородная кислота, смеси хлористо-водородная кислота/дихлорметан или смеси метанол/хлористо-водородная кислота, при температуре от 0°С до комнатной температуры в течение от 1 до 24 часов.
Если необходимо, соединение формулы 2, полученное реакцией пептидной связи и удалением защитной группы, можно очищать от нежелательных побочных продуктов любым общепринятым способом, таким как перекристаллизация, порошкование, препаративная тонкослойная хроматография, флэш-хроматография на силикагеле (см. W.C. Still et al., J. Org. Chem., 43, 2923 (1978)) или ВЭЖХ. Соединение, очищенное посредством ВЭЖХ, можно выделять в качестве соответствующей его соли. Соединение формулы 5 также можно очищать аналогичным образом.
В настоящем изобретении смесь стереоизомеров соединения формулы 1 получают с использованием смеси стереоизомеров в качестве исходного материала, и полученную смесь разделяют на отдельные стереоизомеры с получением, таким образом, соединения формулы 1. Кроме того, каждый стереоизомер соединения формулы 1 можно получать с использованием каждого стереоизомера в качестве исходного материала. Выделение стереоизомера можно проводить общепринятой колоночной хроматографией или перекристаллизацией.
При получении соединения формулы 2 соединение формулы 3, используемое в схеме реакции 1, является коммерчески доступным, или его можно легко получать любым способом, известным в данной области.
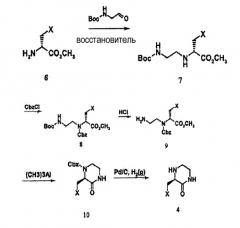
При получении соединения формулы 2 соединение формулы 4, используемое в схеме реакции 1, можно получать в соответствии с синтетическим каскадом схемы реакции 2 и схемы реакции 3.
В схеме реакции 2 соединение 6 может быть коммерчески доступным, или оно может не быть коммерчески доступным, в зависимости от заместителя X, так что соединение 6 является коммерчески доступным, или его можно легко получить любым способом, известным в данной области, например способом, представленным на схеме реакции 3, ниже.
На схеме реакции 2 соединение 4, используемое для получения соединения по настоящему изобретению, можно получать из соединения 6. Конкретно, соединение 6 подвергают реакции с N-бутилоксикарбонил-2-аминоацетальдегидом в присутствии восстановителя с получением соединения 7, из которого затем получают соединение 8, имеющее вторичный амин, защищенный бензилоксикарбонилом (Cbz), с последующим удалением защитной группы с получением, таким образом, соединения 9, где бутилоксикарбонил (Boc) удален. Затем соединение 9 подвергают циклизации с использованием триметилалюминия (или смеси диизопропилэтиламин/этанол, смеси гидрокарбонат натрия/метанол и т.д.) с получением соединения 10, за которой следует удаление защитной группы Cbz с получением соединения 4. Примеры восстановителя, который можно использовать для получения соединения 7 из соединения 6, могут включать цианоборгидрид натрия, триацетоксиборгидрид натрия, боргидрид натрия и т.п.
[Схема реакции 2]
где X является таким, как определено в формуле 1.
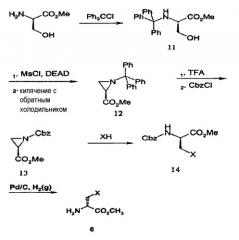
Когда соединение 6 на схеме реакции 2 не является коммерчески доступным, его можно получать аналогично схеме реакции 3, ниже. Соединение 6, имеющее множество заместителей R1 на схеме реакции 3, получают замещением метилового сложного эфира D-серина тритилхлоридом с получением соединения 11 и заменой гидроксильной группы соединения 11 мезильной группой, с последующим кипячением с обратным холодильником с получением, таким образом, соединения азиридина 12. Затем тритильную группу соединения 12 удаляют с использованием трифторуксусной кислоты, а затем защищают бензилоксикарбонилом (Cbz) с получением соединения 13. Затем соединение 13 подвергают реакции с HX, имеющим множество заместителей R1, с получением соединения 14, с последующим удалением Cbz с получением соединения 6.
[Схема реакции 3]
где X является таким, как определено в формуле 1.
Для облегчения представляющей интерес реакции или избежания образования нежелательного продукта реакции для некоторых из соединений формулы 1 по настоящему изобретению указанные выше условия реакции и последовательности реакции можно варьировать, если желательно.
Как описано выше, соединения формулы 1 по настоящему изобретению, исходные материалы и промежуточные соединения можно синтезировать различными способами, известными в данной области.
В соответствии со следующим аспектом настоящего изобретения предусмотрена фармацевтическая композиция для предупреждения и лечения диабета или ожирения, содержащая соединение формулы 1 или его фармацевтически приемлемую соль в качестве активного ингредиента.
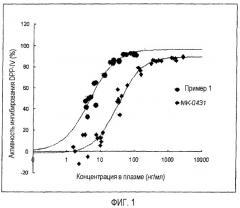
Соединение формулы 1 в соответствии с настоящим изобретением обладает превосходной ингибиторной активностью в отношении DPP-IV. Когда определяли ингибиторную способность соединения формулы 1 в отношении фермента DPP-IV, IC50, концентрация лекарственного средства, которая требуется для ингибирования ферментативной реакции DPP-IV на 50%, была практически равна диапазону от 0,5 до 20 нМ, что соответствует более высокой ингибиторной активности в отношении DPP-IV по сравнению с общепринятым ингибитором DPP-IV, для которого описана IC50 от нескольких сотен нМ до нескольких тысяч нМ или даже до нескольких десятков тысяч нМ (Jinyou Xu, et al., Bioorg. Med. Chem. Lett., 2004, 4759-4762; и Linda L. B., et al., Bioorg. Med. Chem. Lett., 2004, 4763-4766).
Кроме того, соединение формулы 1 в соответствии с настоящим изобретением обладает высокой пероральной толерантностью к глюкозе. Таким образом, в тесте пероральной толерантности к глюкозе (OGTT) было измерено, что соединение формулы 1 обладает эффектами снижения глюкозы в крови более чем на 35%, предпочтительно более чем на 50%, таким образом демонстрируя, что оно обладает более высокой биодоступностью по сравнению с общепринятыми ингибиторами DPP-IV. Кроме того, результаты экспериментов in vivo, включающие фармакокинетические/фармакодинамические корреляции, измерение длительности периода ингибиторной активности DPP-IV и эксперименты кинетики in vivo, демонстрируют, что соединение по настоящему изобретению обладает более высокой ингибиторной активностью в отношении DPP-IV и биодоступностью.
Таким образом, фармацевтическую композицию, содержащую в качестве активного ингредиента соединение формулы 1, можно эффективно использовать для лечения и предупреждения диабета и ожирения, которые являются репрезентативными заболеваниями, вызываемыми с помощью DPP-IV.
В соответствии с другим аспектом настоящего изобретения предусмотрены применение указанной выше композиции для предупреждения и лечения диабета или ожирения и способ предупреждения и лечения диабета или ожирения, включающий введение эффективного количества указанной выше композиции млекопитающему (включая человека).
Фармацевтическую композицию, содержащую в качестве активного ингредиента соединение формулы 1 или его стереоизомер, фармацевтически приемлемую соль, гидрат или сольват, можно изготавливать в виде следующих пероральных или парентеральных лекарственных форм, не ограничиваясь ими.
Примеры лекарственной формы для перорального введения могут включать таблетки, пилюли, мягкие и твердые капсулы, растворы, суспензии, эмульсии, сиропы, гранулы, эликсиры и т.п. Эти фармацевтические составы могут содержать, в дополнение к указанному выше активному ингредиенту, один или несколько общепринятых разбавителей или эксципиентов, таких как наполнители, разбавители, смачивающие вещества, дезинтегрирующие вещества, вещества, способствующие скольжению, связующие вещества и поверхностно-активные вещества. Примеры дезинтегрирующих веществ могут включать агар, крахмал, альгиновую кислоту или ее натриевую соль, безводный моногидрофосфат кальция и т.п. Примеры веществ, способствующих скольжению, могут включать диоксид кремния, тальк, стеариновую кислоту или их магниевую или кальциевую соль, полиэтиленгликоль и т.п. Примеры связующего вещества могут включать алюмосиликат магния, крахмальную пасту, желатин, трагакант, метилцеллюлозу, карбоксиметилцеллюлозу натрия, поливинилпирролидон, низкозамещенную гидроксипропилцеллюлозу и т.п. Кроме того, фармацевтический состав может содержать разбавители, например лактозу, декстрозу, сахарозу, маннит, сорбит, целлюлозу и/или глицин. Если желательно, состав может дополнительно содержать широко известные шипучие смеси, абсорбенты, красители, вкусовые добавки и подсластители.
Фармацевтическую композицию, содержащую в качестве активного ингредиента соединение формулы 1 или его фармацевтически приемлемую соль, можно вводить парентеральным путем, например посредством суппозитория, подкожной инъекции, внутривенной инъекции, внутримышечной инъекции или внутригрудной инъекции. Для приготовления композиции по настоящему изобретению в виде препарата для парентерального введения соединение формулы 1 или его фармацевтически приемлемую соль смешивают со стабилизатором или буфером в присутствии воды с получением раствора или суспензии, из которых затем изготавливают единичные лекарственные формы в виде ампул или флаконов.
Композиция может быть стерилизованной и/или она может содержать адъюванты, такие как консерванты, стабилизаторы, гидратирующие вещества, эмульгаторы, соли для контроля осмотического давления и/или буферы, и терапевтически пригодные вещества, и их можно изготавливать в соответствии с общепринятыми способами, такими как смешивание, грануляция и нанесение покрытия.
Если желательно, соединение формулы 1 или фармацевтическую композицию, содержащую его в качестве активного ингредиента, можно вводить в сочетании с другими лекарственными средствами, например противодиабетическими лекарственными средствами.
Когда соединение формулы 1 или фармацевтическую композицию, содержащую его в качестве активного ингредиента, изготавливают в виде стандартной лекарственной формы, соединение формулы 1 применяют предпочтительно в единичной дозе приблизительно от 0,1 до 1,500 мг при пересчете на активный ингредиент. Как будет очевидно специалистам в данной области, эффективную дозу активного соединения в соответствии с настоящим изобретением можно определять в соответствии с назначением врача, в зависимости от различных факторов, таких как масса тела и возраст пациентов, тип и тяжесть заболевания и т.п. Для взрослых эффективная доза активного соединения, как правило, находится в диапазоне приблизительно от 1 до 500 мг/сутки, с учетом частоты и интенсивности введения. В случае внутримышечной или внутривенной инъекции взрослым могут быть пригодными от 5 до 300 мг общей дозы, разделенной на несколько единичных доз, хотя для некоторых пациентов может потребоваться даже более высокая суточная доза.
ПРЕИМУЩЕСТВЕННЫЕ ЭФФЕКТЫ
Как конкретно проиллюстрировано в дальнейшем в данном документе, настоящее изобретение относится к гетероциклическому соединению, содержащему бета-аминогруппу и обладающему превосходными ингибиторными эффектами в отношении ферментативной активности DPP-IV. Фармацевтическая композиция, содержащая указанное соединение по настоящему изобретению в качестве активного ингредиента, обладает превосходной ингибиторной активностью в отношении DPP-IV и биодоступностью, и поэтому она может быть пригодной для профилактики или лечения различных заболеваний, считающихся вызываемыми посредством DPP-IV, таких как диабет и ожирение.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 представлена корреляция между активностью DPP-IV в плазме и дозой лекарственного средства, полученная для MK-0431 и соединения примера 1; и
на фиг.2 показаны результаты измерения и сравнения длительности ингибиторной активности DPP-IV, полученной для MK-0431, и соединения примера 1 у лабораторных крыс.
СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение описано более подробно с помощью следующих примеров. Эти примеры предоставлены только для иллюстрации настоящего изобретения, и их не следует истолковывать как ограничивающие объем и сущность настоящего изобретения.
Пример 1: получение гидрохлорида (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенилбутаноил]-3-(трет-бутоксиметил)пиперазин-2-она
Стадия 1: получение (R)-метил-1-тритилазиридин-2-карбоксилата
200 г гидрохлорида метилового сложного эфира D-серина добавляли к 1,8 л хлороформа, и реакционный раствор охлаждали до 0°С, и затем к нему медленно добавляли 448 мл триэтиламина. В реакционную смесь медленно добавляли 358,4 г тритилхлорида и затем ее перемешивали в течение 1 часа. Реакционную смесь нагревали до комнатной температуры, и к ней добавляли 1 л хлороформа, а затем промывали 2,5 л воды. Органический слой сушили над сульфатом магния и охлаждали до 0°С, а затем к нему последовательно медленно добавляли 484 мл триэтиламина и 15,7 г 4-метиламинопиридина. Реакционную смесь перемешивали в течение 5 мин и к ней медленно добавляли 139 мл сульфонилхлорида метана. Реакционную смесь нагревали до комнатной температуры, перемешивали еще в течение 4 часов, а затем кипятили с обратным холодильником в течение 12 часов. Реакционную смесь охлаждали до комнатной температуры и промывали 4 л воды, а затем 3 л рассола. Органический слой сушили над сульфатом магния и концентрировали до высушивания при пониженном давлении. К полученному осадку добавляли 3 л этанола, а затем его перемешивали. Полученные твердые вещества отфильтровывали с получением 329 г указанного в заголовке соединения.
1H ЯМР (400 МГц, CDCl3): 7,42-7,49 (м, 6H), 7,18-7,32 (м, 9H), 7,68 (с, 1H), 3,74 (с, 3H), 2,24 (м, 1H), 1,87 (м, 1H) и 1,40 (м, 1H).
Стадия 2: Получение (R)-1-бензил-2-метилазиридин-1,2-дикарбоксилата
328,4 г (R)-метил-1-тритилазиридин-2-карбоксилата растворяли в 1,4 л хлороформа и реакционный раствор охлаждали до 0°С, а затем к нему медленно добавляли 462 мл трифторуксусной кислоты. Реакционную смесь перемешивали в течение 1 часа, и затем к ней добавляли 2 л воды, и затем перемешивали в течение 10 мин и удаляли органический слой. Водный слой нейтрализовывали гидрокарбонатом натрия и использовали в последующих реакциях без дальнейшей очистки.
К водному слою добавляли 2 л диэтилового эфира и 120,5 г гидрокарбоната натрия, и реакционный раствор охлаждали до 0°С, а затем к нему медленно по каплям добавляли 165 мл бензилхлорформиата. Реакционную смесь перемешивали в течение еще 2 часов и водный слой удаляли. Органический слой сушили над сульфатом магния, концентрировали и сушили при пониженном давлении, и очищали колоночной хроматографией, с получением, таким образом, 108,5 г указанного в заголовке соединения.
1H ЯМР (400 МГц, DMSO): 7,32-7,36 (м, 5H), 5,13 (с, 2H), 3,09 (д.д. J=3,2, 5,4 Гц, 1H), 2,58 (д.д. J=1,2, 3,2 Гц, 1H) и 2,47 (д.д. J=1,2, 5,4 Гц, 1H).
Стадия 3: получение метилового сложного эфира (R)-2-амино-3-трет-бутоксипропана
1,1 г (R)-1-бензил-2-метилазиридин-1,2-дикарбоксилата растворяли в 11 мл хлороформа и затем к нему добавляли 18 мл трет-бутанола. К реакционной смеси медленно по каплям добавляли 1,2 мл BF3OEt2, а затем перемешивали в течение 12 часов. Реакцию завершали добавлением в реакционную смесь 2 л воды. Затем органический слой отделяли и сушили над сульфатом магния, концентрировали и сушили при пониженном давлении, а затем использовали в последующих реакциях без дальнейшей очистки.
Полученный осадок растворяли в 10 мл метанола, и затем к нему добавляли 740 мг смеси палладий/углерод в 2 мл этилацетата, после этого барботировали водородом в течение 1 часа при внешнем атмосферном давлении. Реакционную смесь фильтровали и сушили при пониженном давлении с получением 736 мг указанного в заголовке соединения.
1H ЯМР (400 МГц, CD3OD): 4,21 (м, 1H), 3,82 (с, 3H), 3,74-3,88 (м, 2H) и 1,20 (с, 9H)
Стадия 4: получение метилового сложного эфира (R)-3-трет-бутокси-2-(2-(трет-бутоксикарбониламино)этиламино)пропионовой кислоты
736 мг метилового сложного эфира (R)-2-амино-3-трет-бутоксипропана, полученного на стадии 3, растворяли в 14 мл дихлорметана, и к нему медленно добавляли 6335 мг N-трет-бутоксикарбонил-2-аминоацетальдегида метанола. Реакционную смесь охлаждали до 0°С, а затем постепенно добавляли 1,2 мл триэтиламина и 1,78 г триацетоксиборгидрида натрия. Реакционную смесь нагревали до комнатной температуры, а затем перемешивали в течение 12 часов. Для завершения реакции добавляли насыщенный раствор гидрокарбоната натрия и органический слой промывали 10 мл воды и рассола, концентрировали и сушили при пониженном давлении. Полученный осадок очищали колоночной хроматографией с получением, таким образом, 355 мг указанного в заголовке соединения.
1H ЯМР (400 МГц, CDCl3): 5,10 (м, 1H), 3,71 (с, 3H), 3,56 (м, 2H), 3,40 (м, 1H), 3,15-3,28 (м, 2H), 2,81 (м, 1H), 2,67 (м, 1H), 1,42 (с, 9H) и 1,13 (с, 9H)
Стадия 5: получение метилового сложного э