Гетероциклические соединения, пригодные для использования в качестве анаболических агентов скота
Иллюстрации
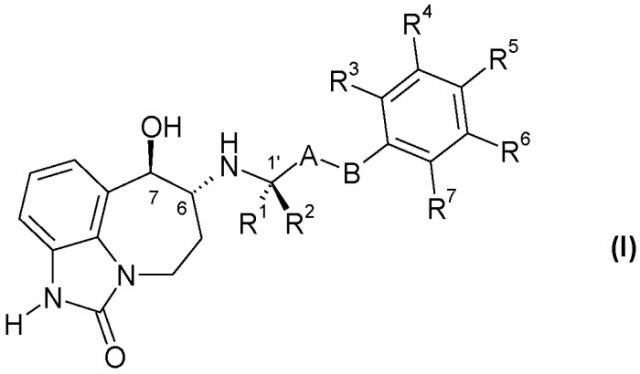
Показать всеНастоящее изобретение относится к соединению формулы (I) или его фармацевтически или ветеринарно приемлемым солям, где: А представляет собой -CH2-; и В представляет собой -СН2-, -С(СН3)2-; или -А-В- представляет собой -СН=СН-; один из R1 и R2 представляет собой СН3 и другой представляет собой Н; R3, R4, R5, R6 и R7, каждый независимо выбран из Н, R8 и R9; или R4 и R5 вместе представляют собой -O-СН2-СН2-, -СН2-СН2-O- или -O-СН2-O-, и R3, R6 и R7, каждый представляет собой Н; R8 представляет собой галоген, -CN, C1-C4 алкил, C1-C4 галогеналкил, -СН2OН, -O-(C1-C4 алкил), -O-СН2-(С3-С5)циклоалкил, -СO2Н, -CO2(C1-C4 алкил), -CONH2, -CONH(C1-C4 алкил), -CONH(C1-C4 галогеналкил), -CONH(C3-C6 циклоалкил) или NH2; и R9 представляет собой -ОН, -NHSO2(C1-C3 алкил), -NHCO(C1-C4 алкил), -NHCO(C1-C4 галогеналкил), -NHSO2(С1-С3 галогеналкил) или -NНSO2(фенил). Также изобретение относится к фармацевтической композиции на основе соединения формулы (I), которая обладает агонистической активностью в отношении коровьих и свиных адренергических бета-2-рецепторов. Технический результат: получены новые соединения, обладающие полезными биологическими свойствами. 2 н. и 10 з.п. ф-лы.
Реферат
Настоящее изобретение касается ряда 6-амино-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-онов. Более конкретно, оно касается ряда 6-(арил-1-метилалкил)амино-7-гидрокси-4,5,6,7-тетрагидро-имидазо[4,5,1-jk][1]бензазепин-2(1H)-онов. Соединения действуют как агонисты адренергических бета-2-рецепторов и могут быть использованы в качестве анаболических агентов для скота.
ПРЕДПОСЫЛКИ
Основной задачей в животноводческом производстве остается эффективность, достигаемая оптимизацией конверсии корма в нежирное мясо. Корм составляет высокую долю общих экономических вложений на финальных стадиях животноводства, и следовательно, имеется постоянная потребность в агентах, которые повышают коэффициент конверсии корма (FCR). Наиболее эффективным путем повышения FCR являются метаболические манипуляции с целью повышения потенциала животных по отложению мышечного белка, что также обеспечивает очевидные преимущества в получаемом качестве и составе мясной туши.
Один подход к получению высококачественного мяса и увеличению производства мяса включает введение агентов, которые являются бета-2-блокаторами. Примерами агентов, зарегистрированных для такого применения у скота, являются Zilmax™ (зилпатерол) и Optaflexx™ (рактопамин). Зилпатерол представляет собой (±)-транс-6-(изопропиламино)-7-гидрокси-4,5,6,7-тетрагидроимидазо[4,5,1-jk][1]бензазепин-2(1H)-он. Зилпатерол и схожие с ним аналоги впервые были раскрыты в FR 2534257 и позже обсуждалось их применение в качестве пищевых добавок животным в FR 2608046 и EP 272976. Рактопамин представляет собой (±)-4-(3-{[2-гидрокси-2-(4-гидроксифенил)этил]амино}бутил)фенол и был впервые открыт исследователями van Dijk и Moed (Recl. Trav. Chim. Pays Bas, 1973, 92, 1281-1279). Его применение в качестве пищевой добавки описано в GB 2133986. Оба вещества, зилпатерол и рактопамин, вводятся на последних стадиях жизни продуктивных животных и вызывают активацию биологического каскадного механизма, стартующего с взаимодействия по адренергическому бета-2-рецептору, который промотирует и усиливает рост мышечной массы. Недавно в US-6841563 раскрыт ряд арилоксипропаноламинов для повышения производительности животноводства.
Существует постоянная потребность в альтернативных бета-2-блокаторах для применения в качестве агентов, повышающих производство мяса у скота и, в особенности, в агонистах с улучшенными свойствами. По причинам экономии агент предпочтительно должен обеспечивать желательное повышение производства мяса при низкой дозе. Он также должен не давать каких-либо нежелательных эффектов у рассматриваемого животного. В конечном счете, продуцируемое животным мясо должно быть безопасным для употребления человеком, это предполагает, что в мясе должны быть минимизированы остаточные уровни реагента. Следовательно, идеальный агент будет иметь высокую афинность к адренергическим бета-2-рецепторам животных заданного вида и являться вполне эффективным их агонистом. Он должен иметь высокую степень селективности относительно этого рецептора и быстро выводиться из организма животного, чтобы минимизировать присутствие остатков в мясе без необходимости продолжительного периода выведения. Нулевой период выведения обеспечивает фермеру максимальное экономическое преимущество. Таким образом, целью данного изобретения является получение соединений, которые обладают высокой афинностью, селективностью, агонистической эффективностью и/или активностью к адренергическим бета-2-рецепторам животных, важных для животноводства, и/или которые быстро выводятся из организма животного метаболическим путем.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В первом аспекте настоящее изобретение касается соединения формулы (I)
или его фармацевтически приемлемой соли, где:
A представляет собой -CH2-; и
B представляет собой -CH2-, -C(CH3)2-, -O-, -CH2-CH2-, -CH2-O- или -O-CH2-; или
-A-B- представляет собой -CH=CH-;
один из R1 и R2 представляет собой CH3 и другой представляет собой H;
R3, R4, R5, R6 и R7, каждый независимо выбран из H, R8 и R9; или
R4 и R5 вместе представляют собой -O-CH2-CH2-, -CH2-CH2-O- или -O-CH2-O-, и R3, R6 и R7, каждый независимо выбран из H, R8 и R9;
R8 представляет собой галоген, -CN, C1-C4 алкил, C1-C4 галогеналкил, -CH2OH, -O-(C1-C4 алкил), -O-CH2-(C3-C5)циклоалкил, -CO2H, -CO2(C1-C4 алкил), -CONH2, -CONH(C1-C4 алкил), -CONH(C1-C4 галогеналкил), -CONH(C3-C6 циклоалкил) или NH2; и
R9 представляет собой -OH, -NHSO2(C1-C3 алкил), -NHCO(C1-C4 алкил), -NHCO(C1-C4 галогеналкил), -NHSO2(C1-C3 галогеналкил) или -NHSO2(фенил).
В другом аспекте настоящее изобретение касается пищевой добавки для сельскохозяйственного животного, содержащей соединение формулы (I) или его фармацевтически приемлемую соль.
В еще одном аспекте настоящее изобретение касается способа повышения мясной продуктивности или качества мяса у сельскохозяйственного животного, включающего введение указанному сельскохозяйственному животному эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
В еще одном аспекте настоящее изобретение касается применения соединения формулы (I) или его фармацевтически приемлемой соли в качестве лекарственного средства.
В еще одном аспекте настоящее изобретение касается фармацевтической композиции, содержащей соединение формулы (I) или его фармацевтически приемлемую соль.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для целей настоящего описания используются следующие определения.
“Алкил” означает насыщенный моновалентный углеводородный радикал CnH2n+1, который может быть линейным или разветвленным. C1-C4 алкил включает метил, этил, н-пропил, изопропил (1-метилэтил), н-бутил, втор-бутил (1-метилпропил), изобутил (2-метилпропил) и трет-бутил (1,1-диметилэтил).
“Циклоалкил” означает насыщенный моновалентный моноциклический или мостиковый или сконденсированный полициклический углеводородный радикал. C3-C5 циклоалкил включает циклопропил, циклобутил и циклопентил.
“Галоген” включает фтор, хлор, бром и йод.
“Галогеналкил” означает алкильную группу, которая определена выше, где один или более атомов водорода замещены атомами галогенов, выбранными из фтора, хлора, брома и йода. Если группа содержит более одного атома галогена, то эти атомы могут быть одинаковыми или различными. Галогеналкил включает пергалогеналкил, т.е. алкильную группу, в которой все атомы водорода замещены атомами галогенов. C1-C4 галогеналкильные группы включают фторметил, дифторметил, трифторметил, хлордифторметил, 2-бромэтил, 2,2,2-трифторэтил, 3-йодпропил и 2,2,2-трихлор-1,1-диметилэтил.
Соединения формулы (I) имеют в структурной формуле три асимметричных атома углерода (хиральных центра), помеченных 1′, 6 и 7. Некоторые варианты заместителей от R3 до R7 могут включать дополнительные хиральные центры. Если не указано по-другому, формула (I) изображает относительную стереохимию на трех центрах: C-1′, C-6 и C-7. Предполагается, что изображение формулы (I) не следует принимать как выражение абсолютной стереохимии на этих центрах. Следовательно, настоящее изобретение включает индивидуальные энантиомеры соединений формулы (I) и их смесей, включая рацематы. Если имеется дополнительный хиральный центр в заместителе, то изобретение включает диастереомерные смеси, а также индивидуальные стереоизомеры.
Соединения формулы (I), в которых -A-B- представляет собой -CH=CH-, могут существовать в виде геометрических изомеров. Если не указано по-другому, данное изображение не предполагает конкретной геометрии. Следовательно, настоящее изобретение включает такие соединения в виде цис- (Z-) или транс- (E-) конфигурации, а также смеси этих геометрических изомеров.
Некоторые соединения формулы (I) могут существовать в более чем одной таутомерной форме. Настоящее изобретение включает все такие таутомеры, а также их смеси.
Настоящее изобретение включает все фармацевтически приемлемые изотопно-меченные соединения формулы (I), в которых один или более атомов замещены атомами, имеющими те же атомные номера, но атомную массу или массовый номер, отличный от атомной массы или массового номера, преобладающего в природе.
Примеры изотопов, подходящих для включения в соединения по изобретению, включают изотопы водорода, такие как 2H и 3H, углерода, такие как 11C, 13C и 14C, хлора, такие как 36Cl, фтора, такие как 18F, йода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15O, 17O и 18O, фосфора, такие как 32P, и серы, такие как 35S.
Некоторые изотопно-меченные соединения формулы (I), например, соединения, включающие радиоактивный изотоп, полезны при исследованиях распределения лекарственных средств и/или субстрата в тканях. Радиоактивные изотопы трития, т.е. 3H, и углерод-14, т.е. 14C, являются особенно полезными для этих целей ввиду простоты их включения и состояния готовности к детекции.
Замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2H, может обеспечить некоторые терапевтические преимущества в результате большей метаболической стабильности, например, увеличенный период полураспада in vivo или требование пониженной дозы и, следовательно, может быть предпочтительным в некоторых обстоятельствах.
Замещение позитрон-излучающими изотопами, такими как 11C, 18F, 15O и 13N, может быть полезным при исследованиях методом позитронной эмиссионной топографии (PET) с целью изучения занятости рецепторов субстратом.
Изотопно-меченные соединения формулы (I) обычно можно получить по обычным методикам, известным специалистам в данной области, или способами, аналогичными способам, описанным в сопутствующих примерах и получениях, используя подходящий изотопно-меченный реагент вместо применяемого ранее немеченого реагента.
Соединения формулы (I) способны образовывать аддитивные соли с кислотами. Некоторые соединения формулы (I), которые имеют кислотную функциональную группу, способны образовывать соли с подходящими основаниями. Такие соли включены в область настоящего изобретения в той степени, в которой они приемлемы для ветеринарного или фармацевтического применения.
Подходящие аддитивные соли кислот получают из кислот, которые образуют нетоксичные соли. Примеры включают следующие соли: ацетат, адипат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камзилат, цитрат, цикламат, эдизилат, эзилат, формиат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат, хибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид, изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напсилат, никотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, пироглютамат, сахарат, стеарат, сукцинат, таннат, тартрат, тозилат, трифторацетат и ксинафоат.
Подходящие соли оснований получают из оснований, которые образуют нетоксичные соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка.
Могут также образовываться полусоли кислот и оснований, например, полусульфаты и полукальциевые соли.
Обзор подходящих солей смотрите в Handbook of Pharmaceutical Salts: Properties, Selection, and Use, Stahl and Wermuth (Wiley-VCH, 2002).
Фармацевтически приемлемые соли соединений формулы (I) можно получить одним или несколькими из следующих трех способов:
(i) взаимодействие соединения формулы (I) с заданной кислотой или основанием;
(ii) удаление кислото- или основно-лабильной защитной группы из подходящего предшественника соединения формулы (I) или открытие цикла подходящего циклического предшественника, например, лактона или лактама, с использованием заданной кислоты или основания; или
(iii) преобразование одной соли соединения формулы (I) в другую соль посредством взаимодействия с подходящей кислотой или основанием или при использовании подходящей ионообменной колонны.
Все три реакции обычно проводят в растворе. Результирующую соль можно осадить и собрать фильтрованием или можно выделить при выпаривании растворителя.
Соединения формулы (I) и их соли могут существовать в разнообразных твердых состояниях: от полностью аморфных до полностью кристаллических. Термин «аморфный» относится к состоянию, при котором материал не имеет дальнего порядка на молекулярном уровне и в зависимости от температуры может демонстрировать физические свойства твердого вещества или жидкости. Обычно такие материалы не дают характеристических картин рентгеновской дифракции и, демонстрируя свойства твердого вещества, более формально описываются как жидкости. При нагревании происходит изменение свойств от свойств твердого вещества до свойств жидкого вещества, что обычно характеризуется фазовым переходом второго рода («стеклование»). Термин «кристаллический» относится к твердой фазе, в которой материал имеет регулярную внутреннюю структуру на молекулярном уровне и дает характеристическую картину рентгеновской дифракции с определенными пиками. Такие материалы при достаточном нагревании также демонстрируют свойства жидкости, но изменение от твердого состояния к жидкому обычно характеризуется фазовым переходом первого рода («точка плавления»).
Соединения формулы (I) и их соли могут также существовать в несольватированном и сольватированном виде. Термин «сольват» используют здесь для описания молекулярного комплекса, включающего соединение по изобретению и одну или более молекул фармацевтически приемлемого растворителя, например, этанола. Термин «гидрат» применяют, если указанный растворитель является водой.
Принятая в настоящее время система классификации органических гидратов представляет собой систему, которая определяет гидраты, координированные по изолированным местам, в каналах или по иону металла - смотрите Polymorphism in Pharmaceutical Solids, K. R. Morris (Ed. H. G. Brittain, Marcel Dekker, 1995). Гидраты на изолированных местах представляют собой гидраты, в которых молекулы воды не имеют прямого контакта друг с другом и отделены находящимися между ними органическими молекулами. В гидратах в каналах молекулы воды лежат в каналах решетки, где они располагаются рядом с другими молекулами воды. В гидратах с координированными ионами металлов молекулы воды связаны с ионом металла.
Если растворитель или вода связаны прочно, комплекс будет иметь четко определяемую стехиометрию, независимо от влажности. Однако, если растворитель или вода связаны слабо, как в сольватах в каналах и гигроскопических соединениях, содержание воды/растворителя будет зависеть от влажности и условий сушки. В таких случаях нестехиометрия является нормой.
Фармацевтически приемлемые сольваты в соответствии с изобретением включают сольваты, в которых растворитель кристаллизации может быть изотопно замещенным, например, D2O, d6-ацетон, d6-ДМСО.
В область изобретения включены также многокомпонентные комплексы (отличные от солей и сольватов), в которых лекарственное средство и по меньшей мере один другой компонент присутствуют в стехиометрических или нестехиометрических количествах. Комплексы этого типа включают клатраты (комплексы включения лекарственное средство-хозяин) и сокристаллы. Последние обычно определяют как кристаллические комплексы нейтральных молекулярных компонентов, которые связаны вместе посредством нековалентных взаимодействий, но также может быть комплекс нейтральной молекулы с солью. Сокристаллы можно получить кристаллизацией расплава, перекристаллизацией из растворителей или физическим перемалыванием компонентов вместе - смотрите Chem Commun, 17, 1889-1896, O. Almarsson and M. J. Zaworotko (2004). Общий обзор многокомпонентных комплексов смотрите в J Pharm Sci, 64 (8), 1269-1288, Haleblian (август 1975 г.).
При воздействии подходящих условий соединения формулы (I) и их соли также могут существовать в мезоморфном состоянии (мезофаза или жидкий кристалл). Мезоморфное состояние является промежуточным между истинным кристаллическим состоянием и истинным жидким состоянием (расплавом или раствором). Мезоморфизм, появляющийся в результате изменения температуры, описывают как «термотропный», и мезоморфизм, появляющийся в результате добавления второго компонента, такого как вода или другой растворитель, описывают как «лиотропный». Соединения, которые имеют возможность образовывать лиотропные мезофазы, описываются как «амфифильные» и содержат молекулы, которые имеют ионную (например, -COO-Na+, -COO-K+ или -SO3 -Na+) или неионную (например, -N-N+(CH3)3) полярную головную группу. Более подробную информацию смотрите в Crystals and the Polarizing Microscope, N. H. Hartshorne и A. Stuart, 4th Edition (Edward Arnold, 1970).
Здесь далее все ссылки на соединения формулы (I) включают ссылки на их соли, сольваты, многокомпонентные комплексы и жидкие кристаллы и сольваты, многокомпонентные комплексы и жидкие кристаллы их солей.
Настоящее изобретение также включает так называемые «пролекарства» соединений формулы (I). Таким образом, некоторые производные соединений формулы (I), которые сами по себе могут иметь низкую фармакологическую активность или не обладать таковой вовсе, при введении внутрь или применении на теле могут превращаться в соединения формулы (I), обладающие желательной активностью, например, посредством гидролитического расщепления. Такие производные обозначают как «пролекарства». Дополнительную информацию по применению пролекарств можно найти в Pro-drugs as Novel Delivery Systems, Vol. 14, ACS Symposium Series (T. Higuchi и W. Stella) и Bioreversible Carriers in Drug Design, Pergamon Press, 1987 (Ed. E. B. Roche, American Pharmaceutical Association).
В соответствии с изобретением пролекарства можно получить, например, замещая подходящие функциональные возможности, присутствующие в соединении формулы I, определенными фрагментами, известными специалистам в данной области как «профрагменты», которые описаны, например, в Design of Prodrugs, H. Bundgaard (Elsevier, 1985).
Примеры пролекарств в соответствии с изобретением включают:
(i) производные C-7 гидроксильной функции, такие как сложные эфиры и ацилоксиметиловые простые эфиры, где атом водорода гидроксильной группы замещен ацильной группой, такие как (C1-C6 алкил)CO- или (необязательно замещенный арил)CO-, или ацилоксиметильной группой, такие как (C1-C6 алкил)CO2CH2-; и
(ii) производные C-6 вторичной аминной функции, такие как амиды и карбаматы, в которых атом водорода аминогруппы замещен ацильной группой, такие как (C1-C6 алкил)CO-, или алкилоксикарбонильной группой, такие как (C1-C6 алкил)OCO-.
Некоторые варианты радикалов с R3 по R7 также могут быть ответственны за образование пролекарства.
В еще одном аспекте настоящее изобретение касается способов получения соединения формулы (I) или его соли, приемлемой с точки зрения фармацевтики, ветеринарии или сельского хозяйства, или его сольвата, приемлемого с точки зрения фармацевтики, ветеринарии или сельского хозяйства (включая гидрат) любого состава, как проиллюстрировано ниже.
Специалистам в данной области понятно, что во время синтеза соединений по изобретению может потребоваться введение и снятие защиты чувствительных функциональных групп. Этого можно достичь общеизвестными способами, например, как описано в “Protective Groups in Organic Synthesis”, T.W. Greene и P.G.M. Wuts, John Wiley & Sons Inc (1999), и приведенных в ней ссылках.
Следующие способы являются иллюстрациями общих синтетических методик, которые можно принять для получения соединений по изобретению.
Если один или более из R3, R4, R5, R6 и R7 содержат реакционноспособные функциональные группы, то во время синтеза соединений формулы (I) можно обеспечить дополнительную защиту согласно стандартным методикам. В описанных ниже способах для всех синтетических предшественников, используемых при синтезе соединений формулы (I), предполагается, что определения R3, R4, R5, R6 и R7 (где R3, R4, R5, R6 и R7 являются такими, как описано для формулы (I)) необязательно включают подходящим образом защищенные варианты P3, P4, P5, P6 и P7. Такие подходящие защитные группы для этих функциональных возможностей описаны в перечисленных ниже ссылках, и как специально подразумевается, применение этих защитных групп, где необходимо, включено в область способов, описанных в настоящем изобретении для получения соединений формулы (I) и их предшественников. Если используются подходящие защитные группы, то для получения соединений формулы (I) требуется их удаление. Удаление защиты можно осуществить по стандартным методикам, включая методики, описанные в перечисленных ниже ссылках.
1. Получение соединений формулы (I)
1.1. Восстановительное аминирование
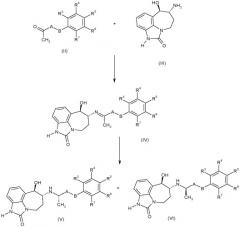
Соединения формулы (I) можно синтезировать способом восстановительного аминирования метилкетонов формулы (II), где R3, R4, R5, R6, R7, A и B имеют такие значения, которые определены для формулы (I), используя аминоспирт формулы (III), как показано на схеме A:
Схема A
где клиновидные и пунктирные связи показывают относительную стереохимию 6-амино- и 7-гидроксизаместителей. Специалисту понятно, что для реакции восстановительного аминирования можно использовать индивидуальные энантиомеры или рацемат формулы (III).
Можно использовать разнообразные реакционные условия. Вообще, взаимодействие аминоспирта (III) с кетонами формулы (II) дает имин (IV), который можно восстановить на месте с получением соединений формулы (I). Образование имина достигается стандартными методами, например, взаимодействием аминоспирта (III) с кетонами (II) в спиртовом растворителе, предпочтительно метаноле, в присутствии основания, такого как триэтиламин или гидроксид калия. Реакционные условия можно варьировать от комнатной температуры до 50°C в течение периода от 10 минут до 60 часов, необязательно в атмосфере азота и необязательно при нагревании в микроволновой печи. Затем можно получить соединения формулы (I) воосстановлением имина на месте, обычно используя боргидрид натрия или цианоборгидрид натрия при температурах от 0 до 60°C в течение 1-60 часов, обычно в течение ночи.
Восстановление имина протекает с образованием набора диастереоселективностей, хотя предсказательных тенденций пока не наблюдается.
Соединения формулы (I), где A-B представляет собой CH=CH, можно получить, используя условия, аналогичные условиям, описанным выше для восстановительного аминирования аминоспирта (III) α,β-ненасыщенными енонами формулы (VII), где R3, R4, R5, R6 и R7 имеют такие значения, которые определены для формулы (I), как показано на схеме B.
Схема B
Использование избытка боргидридного восстановителя будет также восстанавливать двойную связь, таким образом, использование енонов формулы (VII) может давать соединения формулы (I), в которых A-B представляет собой CH2-CH2 или A-B представляет собой CH=CH, т.е. соединения формулы (IX) или соединения формулы (VIII).
Соединения формулы (I), в которых A-B представляет собой CH2-CH2, можно также получить из соединений формулы (I), в которых A-B представляет собой CH=CH, используя стандартные восстановители, такие как водород, в присутствии металлического катализатора, например, катализатора Уилкинсона, палладия на угле или оксида платины, в протонном растворителе, например, метаноле, или катализаторы, описанные в «Handbook of Reagents for Organic Synthesis - Oxidising and Reducing Agents» под редакцией S.D.Burke и R.L.Danheiser.
2. Получение трициклических промежуточных продуктов
2.1 Аминоспирт (III)
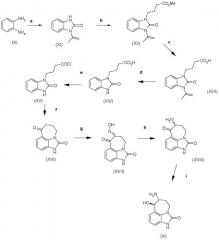
Аминоспирт формулы (III) можно получить, как показано на схеме C.
Схема C
а) этилацетоацетат, ксилены, 150°C; b) метиловый эфир 4-броммасляной кислоты, K2CO3, ацетон, кипячение с обратным холодильником; c) 15% NaOH, ТГФ, кипячение с обратным холодильником; d) концентрированная HCl, ТГФ; e) SOCl2, ДХМ; f) AlCl3, ДХМ, кипячение с обратным холодильником; g) трет-BuONO, HCl, AcOH, 40ºC; h) Pd/C, H2, MeOH, концентрированная HCl, 1,5 атм.; i) NaBH4, MeOH, 0ºC.
Получение соединений формул (XI), (XII), (XIII), (XIV), (XV) и (XVI) раскрыто в Tetrahedron Letters, 1995, 36, 9, 1387. Получение соединений формул (XVII) и (III) раскрыто в патенте США US-4585770.
Энантиомеры аминоспирта (III) можно разделить методом хиральной ВЭЖХ. N-защита облегчает разделение. Специалисту в данной области понятно, что можно использовать разнообразные N-защищенные соединения, например, трет-бутилоксикарбамат, получаемый при взаимодействии аминоспирта (III) с трет-BOC-ангидридом в подходящем растворителе, таком как метанол, в присутствии основания, такого как триэтиламин. После разделения методом хиральной ВЭЖХ, можно удалить трет-BOC-защитную группу посредством кислотного гидролиза, например, при перемешивании в смеси 4 н. HCl/диоксан при комнатной температуре в течение нескольких часов, обычно 1 часа.
Требуемый энантиомер аминоспирта (III) можно также получить путем энантиоселективного восстановления кетооксима (XVII). Специалисту в данной области понятно, что степень энантиоселективности зависит от катализатора, лиганда, растворителя и реакционной температуры. Особо подходящие условия используют водород в присутствии металлического катализатора, такого как димер хлор(норборнадиен)родия, в комплексе с таким лигандом, как 1-[(S)-ферроценил-2-(R)-этил-1-диметиламино)фенил]-(S)-фосфино-1'-дициклогексилфосфино-ферроцен (Solvias AG), в протонном растворителе, обычно водном метаноле, при повышенных температурах, обычно 80°C, в течение 10-40 часов, обычно 16 часов.
3. Получение кетонов (II)
Многие из метилкетонов формулы (II), используемых в методике восстановительного аминирования, являются коммерчески доступными. Специалисту в данной области понятно, что другие соединения можно получить по экспериментальным методикам, которые описаны в литературе.
3.1 Соединения, в которых A-B представляет собой CH=CH
Еноны формулы (VII) можно получить согласно способу, показанному на схеме D, из бензальдегидов формулы (XVII), где R3, R4, R5, R6 и R7 имеют такие значения, которые определены для формулы (I), посредством катализируемой основанием конденсации с ацетоном, обычно используя в качестве основания гидроксид натрия при 0°C.
Схема D
Замещенные бензальдегиды формулы (XIX) можно получить литиированием арилбромидов (XX), используя, например, н-бутиллитий в тетрагидрофуране, с последующим взаимодействием ариллитиевого реагента с N,N-диметилформамидом. По-другому, еноны формулы (VII) можно получить взаимодействием альдегидов формулы (XIX) с 1-трифенилфосфоранилиден-2-пропаноном при кипении с обратным холодильником в подходящем растворителе, таком как тетрагидрофуран, в течение 5-20 часов, обычно 12 часов.
3.2 Соединения, в которых A-B представляет собой CH 2 -CH 2
Кетоны формулы (II), в которых A-B представляет собой CH2-CH2, можно получить из енонов формулы (VII), в которых A-B представляет собой CH=CH, используя стандартные восстановители, такие как водород, в присутствии металлического катализатора, такого как палладий на оксиде алюминия, в подходящем растворителе, например, этилацетате, или восстановители, описанные в «Handbook of Reagents for Organic Synthesis - Oxidising and Reducing Agents» под редакцией S.D.Burke и R.L.Danheiser, как показано на схеме E.
Схема E
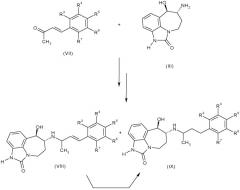
Кетоны формулы (II), в которых A-B представляет собой CH2-CH2, можно также получить реакцией сочетания Хека, сочетания йодсодержащего соединения (XXI) с бут-3-ен-2-олом, используя Pd(OAc)2 в качестве катализатора в подходящем растворителе, таком как N,N-диметилформамид, в присутствии основания, такого как триэтиламин, с необязательным добавлением неорганических солей, например, хлорида лития, как показано на схеме F. α,β-енон (VII) можно получить как побочный продукт реакции сочетания Хека.
Схема F
Соединения, в которых R3 и R7 оба представляют собой H, и R5 представляет собой OH, т.е. кетоны формулы (XXII), в которых R4 и R6 имеют такие значения, которые определены для формулы (I), можно получить взаимодействием фенолов формулы (XXIII) с метилвинилкетоном в подходящем растворителе, таком как толуол, в присутствии кислотного катализатора, обычно серной кислоты, как показано на схеме G. Предпочтительно, если добавление реагента происходит при 0°C с последующим перемешиванием реакционной смеси в течение 2-24 часов, обычно в течение ночи.
Схема G
Соединения формулы (XXVIII), в которых W представляет собой -SO2 или -CO, и R10 является таким, как определено для формулы (I), можно получить, как показано на схеме Н.
Схема H
В еноны формулы (XXIV) можно ввести защиту посредством образования этиленкеталей формулы (XXV) взаимодействием с этиленгликолем в подходящем растворителе, таком как толуол, в присутствии кислотного катализатора, такого как пара-толуолсульфоновая кислота, при нагревании до кипения с обратным холодильником в аппарате Дина-Старка в течение нескольких часов, обычно 5 часов. Амины формулы (XXVI) можно получить из соединений формулы (XXV), используя стандартные восстановители, такие как водород, в присутствии металлического катализатора, такого как 10% палладий на угле, в подходящем растворителе, например, в метаноле, используя проточный гидрогенизатор H-Cube, или восстановители, описанные в «Handbook of Reagents for Organic Synthesis - Oxidising and Reducing Agents» под редакцией S.D.Burke и R.L.Danheiser. Амины формулы (XXVI) можно ацилировать и сульфонилировать, используя стандартные описанные в литературе условия, хорошо известные специалисту в данной области. Можно удалить защиту с кеталей формулы (XXVII) посредством катализируемого кислотой гидролиза, например, при перемешивании в смеси концентрированная HCl/метанол при комнатной температуре в течение нескольких часов, обычно 2 часов.
3.3 Соединения, в которых A-B представляет собой CH 2 -C(CH 3 ) 2
Кетоны формулы (II), в которых A-B представляет собой -CH2C(CH3)2-, можно получить восстановительным арилированием 4-метилпент-3-ен-2-она (XXIX) солями бензолдиазония формулы (XXX) в подходящем апротонном растворителе, таком как N,N-диметилформамид, в присутствии кислоты Льюиса в качестве катализатора, например, тетрахлорида титана, как показано на схеме I.
Схема I
Соединения, в которых R3 представляет собой OH, т.е. метилкетоны (XXXI), можно получить, выполняя последовательность взаимодействий, показанную на схеме J.
Схема J
Хроманоны формулы (XXXIII) можно получить, перемешивая раствор соединений (XXXII) в подходящем растворителе, обычно дихлорэтане, в присутствии кислоты Льюиса, например, хлорида алюминия, в атмосфере азота в течение 5-24 часов, обычно в течение ночи. Морфолинамиды (XXXIV) получают при нагревании (XXXIII) в морфолине при повышенной температуре, обычно 85°C, в течение нескольких часов, например, 2 часов. Взаимодействие морфолинамидов (XXXIV) с метиллитием в подходящем растворителе, таком как тетрагидрофуран, при пониженной температуре, обычно -60°C, в атмосфере азота дает кетоны формулы (XXXI).
3.4 Соединения, в которых A-B представляет собой CH 2 -O
Алкилирование моногалогенацетона фенолами формулы (XXXV) или соответствующим фенолят-анионом в подходящем апротонном растворителе, таком как ацетонитрил, необязательно в присутствии основания, например, триэтиламина, дает кетоны формулы (II), в которых A-B представляет собой -CH2O-, как показано на схеме K.
Схема K
3.5 Соединения, в которых A-B представляет собой CH 2 -CH 2 -O
Кетоны формулы (II), в которых A-B представляет собой -CH2CH2O-, можно получить взаимодействием фенолов формулы (XXXV) с метилвинилкетоном, используя методики, аналогичные методикам, описанным в J. Amer. Chem. Soc., 1971, 93, 4, 985, как показано на схеме L.
Схема L
3.6 Соединения, в которых A-B представляет собой CH 2 -O-CH 2
Кетоны формулы (II), в которых A-B представляет собой -CH2OCH2-, можно получить алкилированием гидроксиацетона подходящим бензилбромидом (XXXVI) способами, аналогичными способам, описанным в US-5360819, пример 36, как показано на схеме M.
Схема M
3.7 Соединения, в которых A-B представляет собой CH 2 -CH 2 -CH 2
Кетоны формулы (II), в которых A-B представляет собой -CH2CH2CH2-, можно получить взаимодействием с участием металлорганических соединений, например, цинкорганического реагента формулы (XXXVII) с 4-хлор-2-бутаноном необязательно в присутствии медного катализатора и соли лития, как показано на схеме N. Специалисту в данной области понятно, что можно использовать другие металлорганические реагенты.
Схема N
Цинкорганические реагенты формулы (XXXVII) можно получить из соответствующих бензилбромидов, используя стандартные методики, известные в литературе.
4. Разнообразные преобразования
Понятно, что некоторые из заместителей на фенильном кольце соединений формулы (II) подлежат преобразованию посредством дополнительных химических манипуляций. Например, способы, показанные на схемах G и I, обеспечивают продукты, которые содержат фенольную гидроксильную группу. Если требуются соответствующие простые эфиры, то O-алкилирование этих фенолов можно осуществить посредством взаимодействия с подходящими органическими галогенидами, используя основание, например, карбонат калия, в подходящем растворителе, например, ацетоне. Реакционные смеси перемешивают при повышенных температурах, обычно при кипении с обратным холодильником, в течение нескольких часов, обычно в течение ночи.
Фенолы формулы (XXXVIII), в которых A и B имеют такие значения, которые определены для формулы (I), легко подвергаются воздействию стандартных реакций замещения.
Схема O
Например, соединения формулы (XXXIX) можно получить взаимодействием соединений формулы (XXXVIII) с N-бромсукцинимидом в подходящем растворителе, таком как N,N-диметилформамид, при комнатной температуре в течение 10-25 часов, обычно 18 часов, как показано на схеме O.
Амиды формулы (XLI), в которых A и B имеют такие значения, которые определены для формулы (I), можно получить из кислот формулы (XL), как показано на схеме P.
Схема P
Специалисту в данной области понятно, что можно использовать многие стандартные известные из литературы реакционные условия для осуществления процесса с образованием такого амида; некоторые из них рассмотрены в “Amid bond formation and peptide coupling” C.A.G.N.Montalbetti и V.Falque, Tetrahedron, 2005, 61, 10827-10852. Например, кислоты формулы (XL) можно преобразовать в соответствующие хлорангидриды кислот при взаимодействии с оксалилхлоридом в подходящем растворителе, таком как N,N-диметилформамид. Можно провести взаимодействие этих хлорангидридов кислот с аминами формулы R11NH2 в подходящем растворителе, таком как дихлорметан.
Специалисту в данной области также понятно, что в рамках некоторых из описанных способов порядок используемых синтетических стадий может варьировать и, среди прочего, буд