Меченные радиоактивным изотопом конъюгаты rgd-содержащих пептидов и способы их получения с помощью click-химии
Иллюстрации
Показать всеИзобретение относится к способам и реагентам мечения вектора, такого как пептид, включающим взаимодействие соединения формулы (I) с соединением формулы (II) в присутствии Cu(I) катализатора. Получающиеся в результате меченые конъюгаты полезны в качестве диагностических агентов, например, в качестве радиофармацевтических препаратов, более конкретно для применения в позитронно-эмиссионной томографии (ПЭТ) или однофотонной эмиссионной компьютерной томографии (ОЭКТ), или для радиотерапии. 4 н. и 3 з.п. ф-лы, 3 табл.
Реферат
Настоящее изобретение относится к радиодиагностическим и радиотерапевтическим агентам, включающим биологически активные векторы, меченные радионуклидами. Также оно относится к способам и реагентам мечения вектора, такого как пептид. Получающиеся в результате меченые конъюгаты полезны в качестве диагностических агентов, например в качестве радиофармацевтических препаратов, более конкретно для применения в позитронно-эмиссионной томографии (ПЭТ) или однофотонной эмиссионной компьютерной томографии (ОЭКТ), или для радиотерапии.
В медицинской радиологии увеличивается важность значения применения меченных радиоактивными изотопами биологически активных пептидов для диагностической визуализации. Биологически активные молекулы, которые избирательно взаимодействуют со специфическими типами клеток, полезны для доставки радиоактивности в ткани-мишени. Например, меченные радиоактивными изотопами пептиды обладают серьезным потенциалом для доставки радионуклидов в опухолевые, пораженные инфарктом и инфицированные ткани для диагностической визуализации и радиотерапии. 18F, имеющий период полураспада приблизительно 110 минут, представляет собой позитрон-излучающий нуклид, выбираемый для множества исследований рецепторной визуализации. Таким образом, 18F-меченые биологически активные пептиды обладают значительным клиническим потенциалом вследствие их применимости в ПЭТ для количественного обнаружения и характеристики широкого диапазона заболеваний. Другие полезные радионуклиды включают 11С, радиоактивный йод, такой как 125I, 123I, 124I, 131I и 99mTc.
До настоящего времени отсутствие быстрых и имеющих общее применение способов мечения пептидов и биологических молекул затрудняло использование пептидов и биомолекул в качестве диагностических агентов. Например, почти во всех используемых в настоящее время способах мечения пептидов и белков 18F используют активные сложные эфиры меченного фтором синтона. Поскольку пептиды и белки могут содержать множество функциональных групп, способных вступать в реакцию с активными сложными эфирами, эти используемые в настоящее время способы не являются сайт-специфическими. Например, пептид, содержащий три лизиновых остатка, имеет три аминные функциональные группы, все из которых в равной степени являются реакционноспособными в отношении меченого синтона. Таким образом, остается потребность в агентах мечения, таких как 18F-меченые простетические группы, и способах, обеспечивающих быстрое хемоселективное введение метки, такой как радионуклид, например 18F, в частности в пептиды, в мягких условиях с получением меченых продуктов с высокими радиохимическими выходом и чистотой. Дополнительно, существует потребность в таких способах, которые поддаются автоматизации с целью облечения получения диагностических агентов в клинических условиях.
В настоящем изобретении предложен способ мечения вектора, включающий взаимодействие соединения формулы (I) с соединением формулы (II):
или соединения формулы (III) с соединением формулы (IV):
в присутствии Cu (I) катализатора, где:
каждый из L1, L2, L3 и L4 представляет собой линкерную группу;
R* представляет собой репортерную группировку, содержащую радионуклид;
с получением конъюгата формулы (V) или (VI), соответственно:
,
где L1, L2, L3, L4 и R* являются такими, как определено выше.
Каждая из линкерных групп L1, L2, L3 и L4 независимо представляет собой С1-60гидрокарбильную группу, подходящим образом - C1-30гидрокарбильную группу, возможно содержащую от 1 до 30 гетероатомов, подходящим образом - от 1 до 10 гетероатомов, таких как кислород или азот. Подходящие линкерные группы включают алкильные, алкенильные, алкинильные цепи, ароматические, полиароматические и гетероароматические кольца, любое(ая) из которых может быть возможно замещено(а), например, одной или более чем одной функциональной группой простого эфира, тиоэфира, сульфонамида или амида, мономеры и полимеры, содержащие этиленгликолевые, аминокислотные или углеводные субъединицы.
Термин "гидрокарбильная группа" обозначает органический заместитель, состоящий из углерода и водорода, такие группы могут содержать насыщенные, ненасыщенные или ароматические фрагменты.
Линкерные группы L1, L2, L3 и L4 могут быть выбраны для обеспечения хорошей фармакокинетики in vivo, например благоприятных характеристик экскреции получающегося в результате соединения формулы (V) или (VI). Использование линкерных групп, обладающих различными липофильностями и/или зарядом, может значительно изменить фармакокинетику пептида in vivo с целью удовлетворения диагностических потребностей. Например, когда желательно, чтобы соединение формулы (V) или (VI) выводилось из организма путем экскреции через почки, используют гидрофильный линкер, а когда желательной для клиренса является гепатобилиарная экскреция, используют гидрофобный линкер. Обнаружено, что линкеры, содержащие полиэтиленгликолевую группировку, замедляют клиренс из крови, что в некоторых случаях является желательным.
R* представляет собой репортерную группировку, которая содержит радионуклид, например позитрон-излучающий радионуклид. Подходящие для этой задачи позитрон-излучающие радионуклиды включают 11С, 18F, 75Br, 76Br, 124I, 82Rb, 68Ga, 64Cu и 62Cu, из которых 11С и 18F являются предпочтительными. Другие полезные радионуклиды включают 123I, 125I, 131I, 211At, 99mTc и 111In. Металлические радионуклиды подходящим образом включены в хелатообразующий агент, например путем прямого включения с использованием способов, известных специалистам в данной области техники. Хелатирование металлического репортера предпочтительно осуществляют перед взаимодействием соединения формулы (I) или (IV) с соединением формулы (II) или (III), соответственно, для того, чтобы избежать хелатирования Cu(I) катализатора.
Подходящие хелатообразующие агенты, содержащиеся в R*, включают соединения формулы X
,
где:
каждый из R1A, R2A R3A и R4A независимо представляет собой группу RA;
каждая группа RA независимо представляет собой Н или С1-10алкил, С3-10алкиларил, С2-10алкоксиалкил, С1-10гидроксиалкил, С1-10алкиламин, С1-10фторалкил, или 2 или более чем 2 группы RA вместе с атомами, к которым они присоединены, образуют карбоциклическое, гетероциклическое, насыщенное или ненасыщенное кольцо,
или R* может содержать хелатообразующий агент формулы (i), (ii), (iii) или (iv)
.
Предпочтительный пример хелатообразующего агента представлен формулой (v)
.
Соединения формулы (II) или (IV), содержащие хелатообразующие агенты формулы X, могут быть мечены радиоактивным изотопом с хорошей радиохимической чистотой (РХЧ) при комнатной температуре в водных условиях при почти нейтральном значении рН.
Если специально не указано иначе, в формулах (I) и (III) и других аспектах изобретения подходящими векторами для мечения являются пептиды, которые могут включать аналоги соматостатина, такие как октреотид, бомбезин, вазоактивный интестинальный пептид, аналоги хемотаксического пептида, α-меланоцит-стимулирующий гормон, нейротензин, пептид Arg-Gly-Asp, человеческий проинсулин-связывающий пептид, инсулин, эндотелин, ангиотензин, брадикинин, эндостатин, ангиостатин, глутатион, кальцитонин, магаинин I и II, рилизинг-фактор лютеинизирующего гормона, гастрины, холецистокинин, вещество Р, вазопрессин, формил-норлейцил-лейцил-фенилаланил-норлейцил-тирозил-лизин, аналоги аннексина V, вазоактивные протеина-1 пептиды (VAP-1) и субстраты на основе пептида каспазы. Предпочтительные пептиды для мечения представляют собой пептид Arg-Gly-Asp и его аналоги, такие как описанные в WO 01/77415 и WO 03/006491, предпочтительно пептид, содержащий фрагмент:
,
более предпочтительно пептид формулы (А):
,
где X7 представляет собой или -NH2, или
,
где а представляет собой целое число от 1 до 10, предпочтительно а равно 1.
Специалисту в данной области техники понятно, что способы по изобретению также могут быть использованы для введения радиоактивной метки в другие биомолекулы, такие как белки, гормоны, полисахариды, олигонуклеотиды и фрагменты антител, клетки, бактерии, вирусы, а также небольшие молекулы, подобные лекарствам, с получением множества диагностических агентов. Если специально не указано иначе, в формулах (I) и (III) и других аспектах изобретения особенно подходящими векторами для введения радиоактивной метки являются пептиды, белки, гормоны, клетки, бактерии, вирусы и небольшие молекулы, подобные лекарствам.
Взаимодействие соединения формулы (I) с соединением формулы (II) или соединения формулы (III) с соединением формулы (IV) может быть осуществлено в подходящем растворителе, например ацетонитриле, С1-4-алкиловом спирте, диметилформамиде, тетрагидрофуране или диметилсульфоксиде, или водных смесях любого из них, или в воде и при некритической температуре от 5 до 100°С, предпочтительно при температуре окружающей среды. Cu(I) катализатор присутствует в количестве, достаточном для развития реакции, обычно или в каталитическом количестве, или в избытке, таком как от 0,02 до 1,5 мольных эквивалентов относительно соединения формулы (I) или (III).
Подходящие Cu(I) катализаторы включают соли Cu(I), такие как CuI, CuOTfC6H6 или [Cu(NCCH3)4][PF6], но преимущественно могут быть использованы соли Cu(II), такие как сульфат меди (II), в присутствии восстановителя, такого как аскорбиновая кислота или ее соль, например аскорбат натрия, гидрохинон, хинон, металлическая медь, глутатион, цистеин, Fe2+ или Со2+. Cu(I) также по существу присутствует на поверхности частиц элементарной меди, поэтому элементарная медь, например в форме порошка или гранул, также может быть использована в качестве катализатора. Было обнаружено, что использование Cu(I) катализатора, в частности элементарной меди, с контролируемым размером частиц, неожиданно приводит к улучшенным радиохимическим выходам. Таким образом, в одном из аспектов изобретения Cu(I) катализатор, в частности элементарная медь, имеет размер частиц в диапазоне от 0,001 до 1 мм, предпочтительно от 0,1 мм до 0,7 мм, более предпочтительно приблизительно 0,4 мм.
В настоящем изобретении предложен более хемоселективный подход к введению радиоактивной метки, при котором точный сайт введения метки предварительно выбран во время синтеза пептида или векторного предшественника. Реакция лигирования, протекающая в предварительно определенном сайте в векторе, позволяет получить только один возможный продукт. Таким образом, этот способ является хемоселективным и его применение рассматривается как общее для широкого диапазона пептидов, биомолекул и низкомолекулярных лекарств. Кроме того, как алкиновые, так и азидные функциональные группы стабильны в большинстве реакционных условий и являются нереакционноспособными в отношении наиболее общих пептидных функциональных групп, и, таким образом, минимизируют стадии введения и удаления защиты, требующиеся во время синтеза с введением метки. Более того, триазольное кольцо, образующееся во время реакции введения метки, не гидролизуется и высокоустойчиво к окислению и восстановлению, что означает, что меченый вектор обладает высокой стабильностью in vivo. Триазольное кольцо также сравнимо по размеру и полярности с амидом, так что меченые пептиды или белки представляют собой хорошие имитаторы своих природных аналогов.
Соединения формулы (I) и (III), где вектор представляет собой пептид или белок, могут быть получены стандартными способами пептидного синтеза, например путем твердофазного пептидного синтеза, например как описано Atherton, Е. and Sheppard, R.C. в "Solid Phase Synthesis"; IRL Press: Oxford, 1989. Включение алкиновой или азидной группы в соединение формулы (I) или (III) может быть осуществлено путем взаимодействия N- или С-конца пептида или с некоторой другой функциональной группой, содержащейся в пептидной последовательности, модификация которой не влияет на связывающие характеристики вектора. Алкиновые или азидные группы предпочтительно вводят в соединение формулы (I) или (III) путем образования стабильной амидной связи, например, образующейся путем взаимодействия пептидной аминной функциональной группы с активированной кислотой или, альтернативно, путем взаимодействия пептидной кислотной функциональной группы с аминной функциональной группой, и вводят во время или после пептидного синтеза. Способы введения алкиновой или азидной группы в такие векторы, как клетки, вирусы, бактерии, можно найти в Н.С.Kolb and K.В.Sharpless, Drug Discovery Today, Vol 8 (24), December 2003 и ссылках, описанных в этом источнике. Подходящие промежуточные соединения, полезные для введения алкиновой или азидной группы в соединение формулы (I) или (III), включают:
В еще одном аспекте настоящего изобретения предложены новые простетические группы, полезные для мечения векторов, таких как пептиды и белки, например с использованием способов, описанных выше. Соответственно, предложено соединение формулы (II) или формулы (IV):
,
где каждый из L2 и L4 представляет собой линкерную группу, как определено выше, и R* представляет собой репортерную группировку, как определено выше. В одном из воплощений этого аспекта изобретения R* представляет собой 18F, так что простетические группы имеют формулы (IIa) и (IVa):
,
где каждый из L2 и L4 представляет собой линкерную группу, как определено выше.
Предпочтительные соединения формулы (IV) включают:
.
В еще одном аспекте настоящего изобретения предложено соединение формулы (I) или (III):
,
где каждый из L1 и L3 представляет собой линкерную групу, как определено выше, и вектор является таким как определено выше. Подходящим вектором в этом аспекте изобретения является пептид или белок. Предпочтительные соединения формулы (I) и (III) представляют собой соединения, где вектор представляет собой пептид Arg-Gly-Asp или его аналог, такие как описанные в WO 01/77415 и WO 03/006491, предпочтительно пептид, содержащий фрагмент:
,
более предпочтительно пептид формулы (А):
,
где X7 представляет собой или -NH2, или
,
где а представляет собой целое число от 1 до 10, предпочтительно а равно 1.
В еще одном аспекте настоящего изобретения предложены меченые векторы формул (V) и (VI), как определено выше. Предпочтительные соединения формул (V) и (VI) представляют собой соединения, где вектор представляет собой пептид Arg-Gly-Asp или его аналог, такие как описанные в WO 01/77415 и WO 03/006491, предпочтительно пептид, содержащий фрагмент:
,
более предпочтительно пептид формулы (А)
,
где X7 представляет собой или -NH2, или
,
где а представляет собой целое число от 1 до 10, предпочтительно а равно 1.
Соединения формулы (II), где R* содержит радиоактивную метку 11С, могут быть получены, например, в соответствии со схемой:
,
где -NuH представляет собой нуклеофильный реакционный центр, такой как гидроксильная, тиольная или аминная функциональная группа.
Соединения формулы (II), где R* представляет собой 18F, могут быть получены при помощи реакций или электрофильного, или нуклеофильного фторирования, например:
Подходящие способы получения соединения формулы (II) путем радиоактивного фторирования включают взаимодействие предшественника, содержащего уходящую группу (такую как алкил- или арилсульфонатную, например мезилатную, трифлатную или тозилатную; нитро или триалкиламмониевую соль), с 18F в присутствии агента фазового переноса, такого как циклический полиэфир, например 18-краун-6 или криптофикс 2.2.2. Эта реакция может быть осуществлена в фазе раствора (с использованием апротонного растворителя, такого как ацетонитрил в качестве растворителя) в стандартных условиях, известных из уровня техники [например, из M.J.Welch and C.S.Redvanly "Handbook of Radiopharmaceuticals", опубликованной Wiley], или с использованием твердого носителя для облегчения очистки соединения формулы (II) с использованием способов, описанных в WO 03/002157.
Соединения формулы (IV) могут быть получены из подходящих ацетиленовых предшественников с использованием способов, аналогичных описанным для синтеза соединений формулы (II).
В настоящем изобретении также предложена радиофармацевтическая композиция, содержащая эффективное количество (например, количество, эффективное для применения в способе визуализации in vivo, подходящим образом - ПЭТ или ОЭКТ) соединения общей формулы (V) или (VI), как определено выше; вместе с одним или более фармацевтически приемлемыми адъювантами, эксципиентами или разбавителями. Предпочтительно, вектор в соединении формулы (V) или (VI) представляет собой пептид Arg-Gly-Asp или его аналог, как описано выше.
Еще одно воплощение изобретения относится к соединению общей формулы (V) или (VI), как определено выше, для медицинского применения и в частности для применения в визуализации in vivo (подходящим образом - ПЭТ или ОЭКТ). Предпочтительно, вектор в соединении формулы (V) или (VI) представляет собой пептид Arg-Gly-Asp или его аналог, как описано выше.
Меченые векторы формул (V) и (VI) могут быть введены пациентам для визуализации in vivo в количествах, достаточных для получения желаемого сигнала, типичные дозы радионуклида для ПЭТ- или ОЭКТ-визуализации от 0,01 до 100 мКи, предпочтительно от 0,1 до 50 мКи, обычно будут достаточны для массы организма 70 кг.
Следовательно, меченые векторы формул (V) или (VI) могут быть приготовлены для введения с использованием физиологически приемлемых носителей или эксципиентов способом, полностью известным специалисту в данной области техники. Например, соединения, возможно с добавлением фармацевтически приемлемых эксципиентов, могут быть суспендированы или растворены в водной среде, с последующей стерилизацией получающегося(ейся) в результате раствора или суспензии.
В еще одном аспекте изобретения предложено применение меченого вектора формулы (V) или (VI) для изготовления фармацевтического препарата для применения в способе визуализации in vivo, подходящим образом - ПЭТ; включая введение указанного фармацевтического препарата в организм человека или животного и получение изображения по меньшей мере части указанного организма.
В еще одном аспекте изобретения предложен способ получения изображения организма человека или животного, включающий введение фармацевтического препарата в указанный организм, например в сосудистую систему, и получение изображения по меньшей мере части указанного организма, в котором указанный фармацевтический препарат распределен, с использованием способа визуализации in vivo, такого как ПЭТ, где указанный фармацевтический препарат содержит меченый вектор формулы (V) или (VI).
В еще одном аспекте изобретения предложен способ мониторинга эффекта лечения организма человека или животного лекарственным средством для борьбы с состоянием, включающий введение в указанный организм меченого вектора формулы (V) или (VI) и детектирование захвата указанного меченого вектора, причем указанные введение и обнаружение возможно, но предпочтительно, осуществляют неоднократно, например до, во время и после лечения указанным лекарственным средством.
В еще одном воплощении настоящего изобретения предложен набор для получения радиофторированной метки, содержащий простетическую группу формулы (II) или (IV) или ее предшественник и соединение формулы (I) или (III).
При использовании наборов соединение-предшественник может быть превращено в соответствующее соединение формулы (II) или (IV) с использованием описанных выше способов. Соединения формулы (II) и (IV) могут быть использованы в неочищенной форме, но предпочтительно соединение формулы (II) и (IV) может быть отделено от отходов реакции путем пропускания реакционной смеси через картридж для твердофазной экстракции (ТФЭ), при помощи хроматографии или путем перегонки. Затем соединение формулы (II) и (IV) следует добавить к соединениям формулы (I) и (III), соответственно, которые подходящим образом могут быть растворены в подходящем растворителе, как описано здесь. После реакции при некритической температуре в течение 1-90 минут меченый пептид может быть очищен, например путем ТФЭ, и собран.
Описанная здесь химия также может быть использована для получения библиотек меченных радиоактивным изотопом векторов, подходящих для скрининга в качестве диагностических лекарственных средств или агентов визуализации in vivo. Таким образом, смесь простетических групп формулы (II) или (IV) может вступать в реакцию с одним или более чем одним соединением формулы (I) или (III), соответственно, с использованием описанных выше способов с получением библиотеки меченных радиоактивным изотопом векторов.
ПРИМЕРЫ
Изобретение проиллюстрировано при помощи примеров, в которых использованы следующие сокращения:
ВЭЖХ: высокоэффективная жидкостная хроматография
ДМФ: N,N-диметилформамид
ДМСО: диметилсульфоксид
МС-ЭРИ: масс-спектрометрия с электрораспылительной ионизацией
к.т.: комнатная температура
ВП-МС-ЭРИ: времяпролетная масс-спектрометрия с электрораспылительной ионизацией
ПФ-ИК: инфракрасная спектроскопия с Фурье-преобразованием
млн-1: миллионная доля
ТФУ: трифторуксусная кислота
АЦН: ацетонитрил.
Получение контрольных соединений
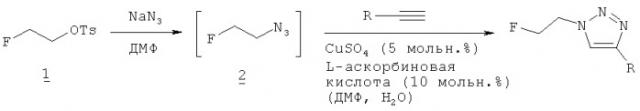
Пример 1 - Получение соединения (2) - 1-азидо-2-фторэтана
2-Фторэтиловый эфир толуол-4-сульфоновой кислоты, соединение (1), получали, как описано E.U.T.van Velzen et al. в Synthesis (1995), 989-997. Соединение (1) (128 мг, 0,586 ммоль) и азид натрия (114 мг, 1,758 ммоль) смешивали с безводным ДМФ (10 мл) и перемешивали при комнатной температуре в течение 48 часов. Реакционную смесь фильтровали, но продукт (2) не выделяли из реакционного раствора.
Пример 2 - Получение соединения (3)-1-(2-фторэтил)-4-фенил-1H-[1,2,3]триазола
Фенилацетилен (105 мкл, 0,977 ммоль) в ДМФ (1 мл) добавляли в атмосфере азота к перемешиваемому раствору пентагидрата сульфата меди (II) (12 мг, 0,0489 ммоль) и L-аскорбиновой кислоты (16 мг, 0,0977 ммоль) в воде (0,3 мл). После добавления соединения (2) (1,172 ммоль) в ДМФ (5 мл) перемешивание продолжали при комнатной температуре в течение 21 часа. Реакционную смесь разбавляли водой (5 мл) и неочищенный продукт экстрагировали дихлорметаном (3×5 мл) и промывали раствором бикарбоната натрия (10%, 3×10 мл) и рассолом (1×5 мл). После сушки над сульфатом натрия растворитель удаляли при пониженном давлении и неочищенный материал очищали с использованием флэш-хроматографии (диоксид кремния, гексан/этилацетат).
Выход: 32 мг (17%), белые кристаллы, т.пл. 83-85°С.
1Н-ЯМР (CDCl3): δ=4.70 (m, 1Н, СН2), 4.76 (m, 1Н, СН2), 4.80 (m, 1Н, СН2), 4.89 (m, 1Н, СН2), 7.35 (tt, 1.0 Гц, 7.5 Гц, 1Н, HAr), 7.44 (m, 2Н, HAr), 7.84 (m, 2Н, HAr), 7.89 (d, 1 Гц, 1Н, СН-триазол) млн-1.
Газовая хроматография/масс-спектрометрия (ГХ/МС): m/z=191.
ВП-МС-ЭРИ: обнаружено m/z=192,0935 [МН]+, рассчитано для C10H10N3F [МН]+ m/z=192,0932.
Пример 3 - Получение соединения (4) - 4-[1-(2-фторэтил)-1Н-[1,2,3]триазол-4-ил]фениламина
4-Этиниланилин (40 мг, 0,344 ммоль) в ДМФ (0,7 мл) добавляли в атмосфере азота к перемешиваемому раствору пентагидрата сульфата меди (II) (129 мг, 0,516 ммоль) и L-аскорбиновой кислоты (182 мг, 1,032 ммоль) в воде (1,2 мл). После добавления соединения (2) (0,287 ммоль) в ДМФ (2,45 мл) перемешивание продолжали при комнатной температуре в течение 4 часов. Реакционную смесь гасили раствором гидроксида натрия (1М, 5 мл). Продукт экстрагировали этилацетатом (3×5 мл), промывали водой (5 мл) и рассолом (2 мл). После сушки над сульфатом натрия растворитель удаляли при пониженном давлении, и неочищенный материал очищали с использованием флэш-хроматографии (диоксид кремния, гексан/этилацетат). Выход: 15 мг (25%), бежевые кристаллы, т.пл. 79-82°С.
1Н-ЯМР (CDCl3): δ=4.70 (m, 1Н, СН2), 4.72 (m, 1Н, СН2), 4.77 (m, 1Н, СН2), 4.88 (m, 1Н, СН2), 6.74 (m, 2Н, HAr), 7.63 (m, 2Н, HAr), 7.74 (d, 0.1 Гц, 1Н, СН-триазол) млн-1.
ВП-МС-ЭРИ: обнаружено m/z=207,1030 [МН]+, рассчитано для C10H11N4F [МН]+ m/z=207,1040.
Пример 4 - Получение соединения (5) - бензиламида 1-(2-фторэтил)-1Н-[1,2,3]триазол-4-карбоновой кислоты
Бензиламид пропионовой кислоты (50 мг, 0,314 ммоль), который получали в соответствии с протоколом G.M.Coppola and R.E.Damon в Synthetic Communications 23 (1993), 2003-2010, растворяли в ДМФ (1 мл) и добавляли в атмосфере азота к перемешиваемому раствору пентагидрата сульфата меди (II) (3,9 мг, 0,0157 ммоль) и L-аскорбиновой кислоты (11 мг, 0,0628 ммоль) в воде (0,4 мл). После добавления соединения (2) (0,377 ммоль) в ДМФ (3,2 мл) перемешивание продолжали при комнатной температуре в течение 48 часов. Реакционную смесь разбавляли бикарбонатом натрия (10%, 5 мл) и неочищенный продукт экстрагировали дихлорметаном (3×5 мл) и промывали рассолом (5 мл). После сушки над сульфатом натрия растворитель удаляли при пониженном давлении и неочищенный материал очищали путем перекристаллизации из смеси этилацетат/диэтиловый эфир. Выход: 8 мг (10%), белые кристаллы, т.пл. 165-167°С.
1Н-ЯМР (CDCl3): δ=4.70 (m, 6Н, СН2), 7.34 (m, 5Н, HAr), 7.46 (m, 1Н, NH), 8.20 (s, 1Н, СН-триазол) млн-1.
ВП-МС-ЭРИ: обнаружено m/z=249,1143 [МН]+, рассчитано для C12H13N4OF [МН]+m/z=249,1146.
Пример 5 - Получение соединения (6) - N-бензил-3-[1-(2-фторэтил)-1Н-[1,2,3]триазол-4-ил]пропионамида
Бензиламид пент-4-иновой кислоты - Это соединение синтезировали аналогичным способом, как описано G.M.Coppola and R.E.Damon (смотри пример 4) за исключением выделения N-сукцинимидильного промежуточного соединения.
Выход: 100 мг (53%), белые иглы, т.пл. 50-55°С.
1Н-ЯМР (CDCl3): δ=1.98 (m, 1Н, алкин-СН), 2.44 (m, 2Н, СН2), 2.56 (m, 2Н, СН2), 4.46 (d, 2Н, CH2N), 7.29-7.25 (m, 5Н, HAr) млн-1.
ПФ-ИК (пленка): 1651, 1629 см-1.
ВП-МС-ЭРИ: обнаружено m/z=188,1073 [МН]+, рассчитано для C12H13NO [МН]+ m/z=188,1070.
N-Бензил-3-[1-(2-фторэтил)-1Н-[1,2,3]триазол-4-ил]пропионамид - Бензиламид пент-4-иновой кислоты (50 мг, 0,267 ммоль) в метаноле (0,5 мл), соединение (2) (0,320 ммоль) в ДМФ (2,62 мл) и диизопропиламин (0,233 мл, 1,335 ммоль) добавляли в атмосфере азота к перемешиваемой суспензии йодида меди (I) (255 мг, 1,335 ммоль) в метаноле (0,8 мл). Перемешивание продолжали при комнатной температуре в течение 2 часов. Реакционную смесь гасили раствором гидрофосфата натрия (1 г) в воде (10 мл) и фильтровали через целит. Неочищенный продукт экстрагировали этилацетатом (3×20 мл) и промывали рассолом (20 мл). После сушки над сульфатом натрия растворитель удаляли при пониженном давлении и неочищенный материал очищали путем колоночной хроматографии с использованием диоксида кремния и смеси этилацетат/гексан.
Выход: 19 мг (26%), белые кристаллы, т.пл. 127-133°С.
1Н-ЯМР (CDCl3): δ=2.66 (t, 7.0 Гц, 2Н, СН2), 3.09 (t, 7.0 Гц, 2Н, СН2), 4.40 (d, 5.7 Гц, 2Н, бензил-СН2), 4.56 (m, 2Н, СН2), 4.61 (m, 2Н, СН2), 4.70 (m, 2Н, СН2), 4.80 (m, 2Н, СН2), 6.0 (s, 1Н, NH), 7.0-7.3 (m, 5Н, HAr), 7.44 (s, 1Н, СН-триазол) млн-1.
ВП-МС-ЭРИ: обнаружено m/z=277,1474 [МН]+, рассчитано для C12H13N4OF [MH]+ m/z=277,1459.
Пример 6 - Получение соединения (7) - 4-[1-(2-фторэтил)-1Н-[1,2,3]триазол-4-ил]бензойной кислоты
4-Этинилбензоат натрия (50 мг, 0,297 ммоль) в ДМФ (1,5 мл) добавляли в атмосфере азота к перемешиваемому раствору пентагидрата сульфата меди (II) (3,7 мг, 0,0149 ммоль) и L-аскорбиновой кислоты (10,5 мг, 0,0595 ммоль) в воде (0,2 мл). После добавления соединения (2) (0,356 ммоль) в ДМФ (0,76 мл) перемешивание продолжали при комнатной температуре в течение 12 часов. Реакционную смесь разбавляли HCl (20 мл, 1М). Неочищенный продукт экстрагировали этилацетатом (3×10 мл) и промывали рассолом (10 мл). После сушки над сульфатом натрия растворитель удаляли при пониженном давлении и неочищенный материал перекристаллизовывали из смеси этилацетат/гексан.
Выход: 37 мг (52%), белые кристаллы, т.пл. 236-240°С.
1Н-ЯМР (ДМСО-d6): δ=4.74 (m, 1Н, СН2), 4.80 (m, 2Н, СН2), 4.90 (m, 1Н, СН2), 8.70 (s, 1 Гц, 1Н, СН-триазол) млн-1.
ВП-МС-ЭРИ: обнаружено m/z=236,0838 [МН]+, рассчитано для C11H10N3O2F [МН]+ m/z=236,0830.
Пример 7 - Получение соединения (8) - 1-(2-фторэтил)-1Н-[1,2,3]триазол-4-карбоновой кислоты
Пропионовую кислоту (60 мкл, 0,977 ммоль) в ДМФ (0,5 мл) добавляли в атмосфере азота к перемешиваемому раствору пентагидрата сульфата меди (II) (12 мг, 0,0489 ммоль) и L-аскорбиновой кислоты (34 мг, 0,135 ммоль) в воде (0,4 мл). После добавления соединения (2) (1,172 ммоль) в ДМФ (2,5 мл) перемешивание продолжали при комнатной температуре в течение четырех часов. Реакционную смесь гасили HCl (20 мл, 1 М) и неочищенный продукт экстрагировали этилацетатом (3×20 мл). После промывки рассолом (5 мл) и сушки над сульфатом натрия растворитель удаляли при пониженном давлении и продукт очищали путем перекристаллизации из смеси этилацетат/гексан.
Выход: 16 мг (10%), белые кристаллы, т.пл. 160-165°С.
1Н-ЯМР (ДМСО-d6): δ=4.74 (m, 1Н, СН2), 4.80 (m, 2Н, СН2), 4.90 (m, 1Н, СН2), 8.71 (s, 1Н, СН-триазол) млн-1.
ВП-МС-ЭРИ: обнаружено m/z=160,0518 [МН]+, рассчитано для C5H6N3O2F [МН]+ m/z=160,0517.
Пример 8 - Получение соединения (9) - этилового эфира 2-ацетиламино-3-[1-(2-фторэтил)-1H-[1,2,3]триазол-4-ил]пропионовой кислоты
Этиловый эфир 2-ацетиламинопент-4-иновой кислоты (200 мг, 1,09 ммоль) в метаноле (1 мл) добавляли в атмосфере азота к медному порошку (200 мг, 40 меш) с последующим добавлением раствора соединения (2) (1,09 ммоль) в ДМФ (3 мл). Смесь перемешивали в течение 90 минут и затем нагревали при 80°С в течение трех часов. Соединение (9) выделяли путем флэш-хроматографии с обращенной фазой (ацетонитрил/вода).
Выход: 145 мг (49%) масла, кристаллы при хранении при 4°С, т.пл. 55-60°С.
1Н-ЯМР (CDCl3): δ=1.13 (t, 3Н, СН2СН3), 1.82 (s, 3Н, СН3), 2.97 (dd, 2J=14.9 Гц, 3J=8.5 Гц, 1Н, пропионовый-СН2), 3.07 (dd, 2J=14.9 Гц, 3J=6.0 Гц, 1Н, пропионовый-СН2), 4.05 (m, 2Н, ОСН2СН3), 4.47 (m, 1Н, СН), 4.46 (m, 1Н, СН2), 4.64 (m, 1Н, СН2), 4.70 (m, 1Н, СН2), 4.81 (m, 1Н, СН2), 7.89 (s, 1Н, триазол-СН), 8.31 (d, 1Н, NH) млн-1.
ВП-МС-ЭРИ: обнаружено m/z=273,1372 [МН]+, рассчитано для C11H17N4O3F [МН]+ m/z=273,1357.
Радиохимия
Пример 9 - Получение соединения (11) - [18F]1-азидо-2-фторэтана
18F-Фторид получали при помощи циклотрона с использованием 18O(p,n)18F ядерной реакции с протонным излучением 19 MeV и обогащенной [18O]Н2О мишенью. После излучения к 18F-воде (1 мл) добавляли смесь Kryptofix® (5 мг), карбоната калия (1 мг) и ацетонитрила (1 мл). Растворитель удаляли путем нагревания при 80°С в потоке азота (100 мл/мин). После этого добавляли ацетонитрил (0,5 мл) и упаривали при нагревании и потоке азота. Эту операцию повторяли дважды. После охлаждения до комнатной температуры добавляли раствор соединения (10) [1,5 мкл; приготовленный в соответствии со способом Z.P.Demko and К.B.Sharpless, Org. Lett. 3 (2001), 4091] в безводном ацетонитриле (0,2 мл). Реакционную смесь перемешивали в течение 30 мин при 80°С. Соединение (11) выделяли путем перегонки с радиохимическим выходом, скорректированным на распад (decay-corrected), 40±14% (n=7) [эффективность: 76±8% (n=7)].
Пример 10 - Получение соединений (12)-(16) - [18F][1-(2-фторэтил)-1H-[1,2,3]триазолов
| Соединение | R | Радиохимический выход (РХВ)* |
| 12 | 39%** | |
| 13 | 7% | |
| 14 | меньше 1% | |
| 15 | 69% | |
| 16 | больше 99% | |
| * в соответствии с ВЭЖХ, ** выделено, реакция в одном реакторе |
Раствор алкинового реагента (0,015 ммоль) в ДМФ (0,1 мл) добавляли к смеси сульфата меди (II) (5 эквивалентов) и L-аскорбиновой кислоты (20 эквивалентов) в атмосфере азота. Добавляли раствор соединения (11) в ацетонитриле (0,2 мл). После перемешивания в течение 30 мин при 80°С реакционную смесь анализировали путем ВЭЖХ.
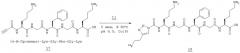
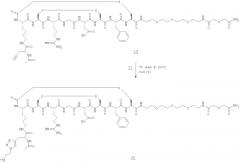
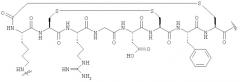
Пример 11 - Получение соединения (18) - [18F](S)-6-амино-2-(2-{(S)-2-[2-((S)-6-амино-2-{[4-(2-фторэтил)-[1,2,3]триазол-1-карбонил]-амино}-гексаноиламино}-ацетиламино]-3-фенилпропиониламино}-ацетиламино)-гексановой кислоты
Соединение (17) (1 мг, 1,7 мкмоль) растворяли в буфере фосфате натрия (рН 6,0, 0.25 М, 0,05 мл). Добавляли соединение (11) (175 мкКи, 6,5 МБк) в ацетонитриле (0,05 мл), а затем гранулированную медь (400 м