Гидрозоль для формирования покрытий электрохимических пероксидчувствительных сенсоров и биосенсоров, способ его получения, электрохимический сенсор и биосенсор, способы их получения и применения
Иллюстрации
Показать всеНастоящее изобретение относится к области аналитической химии, электрохимии и медицинской диагностики и касается гидрозоля диоксида марганца для электрохимической детекции пероксида водорода, способа его получения, изготовления пероксид-чувствительного сенсора и биосенсоров на его основе, способов их получения и применения. Техническим результатом является разработка простого способа изготовления высокочувствительных пероксид-чувствительных электрохимических сенсоров и биосенсоров на основе стабильного водного золя медиатора диоксида марганца. Способ получения гидрозоля на основе коллоидных наночастиц диоксида марганца для формирования покрытия электрохимических пероксичувствительных сенсоров осуществляют по реакции сопропорционирования перманганат ионов МnO4 - и ионов Mn2+ в водном растворе, в которой противоионы и концентрации солей подбирают таким образом, чтобы в результате образовался стабильный золь коллоидных наночастиц МnO2, что предусматривает смешивание равных объемов водного раствора перманганата калия или натрия и водного раствора ацетата или дигидрофосфата марганца при стехиометрическом соотношении концентраций и комнатной температуре. 7 н. и 5 з.п. ф-лы, 4 ил.
Реферат
Настоящее изобретение относится к области аналитической химии, электрохимии и медицинской диагностики и может быть использовано для анализа пероксида водорода, холина, определения активности холинэстераз и концентрации ингибиторов холинэстераз.
Концентрация пероксида водорода является важным показателем при изучении различных технологических и биохимических процессов. Так, например, скорость расхода или наработки Н2О2 является показателем активности многих ферментов класса оксидоредуктаз: оксидаз, каталаз и пероксидаз и супероксиддисмутаз. Для эффективного высокочувствительного анализа Н2O2 необходимо сформировать на поверхности электрохимического датчика пероксид-чувствительный медиаторный слой, обеспечивающий быстрое окисление или восстановление Н2O2 в электрохимической цепочке на поверхности электрода. Современные тенденции в разработке сенсорных элементов предполагают адаптацию метода формирования медиаторных слоев для высокопроизводительных технологий, таких как струйная печать, для этого необходимо получить стабильный коллоидный раствор медиатора на водной основе.
В работах группы Хонг-Юан Чена [1], [2], [3] процедуру получения частиц диоксида марганца проводили, постепенно добавляя 40 мл 0,1 М-го водного раствора КМnO4 к 4 мл 1,5 М-го водного раствора ацетата марганца (II) при 25°С и одновременном воздействии ультразвука на реакционную смесь. После этого раствор центрифугировали, осадок, состоящий из наночастиц МnO2, многократно промывали водой до нейтральной реакции, затем диспергировали в воде в концентрации 20 мг/мл при помощи ультразвука и хранили препарат при +4°С. Полученные частицы были охарактеризованные как аморфные, имеющие размеры около 20 нм и существующие в водном растворе в виде конгломератов.
Недостатками данного метода является необходимость использования обработки ультразвуком для стабилизации образующейся суспензии.
В работах группы Шала [4] для формирования пероксид-чувствительного слоя на поверхности электрода применялась методика электрохимического осаждения МnO2 в щелочной среде. Формирование пероксид-чувствительного слоя МnO2 в аммиачном буфере (рН=9,5), содержащем Мn2+ в концентрации 10 мг/л. Модификация электродов осуществлялась при постоянном потенциале +600 мВ относительно Ag/AgCl электрода сравнения в течение 15 минут. Далее электроды выдерживались при t=60°С в течение одного часа. Модифицированные электроды хранились при комнатной температуре.
Вышеописанная методика обладает следующими недостатками: электрохимическое осаждение МnO2 на поверхность электрода не позволяет наладить широкомасштабное производство электродов, т.к. для соблюдения условий воспроизводимого формирования пероксид-чувствительного слоя требуется соблюдение определенной геометрической ориентации модифицируемого электрода и электрода сравнения, что может быть достигнуто только либо последовательным проведением процедуры для каждого электрода (и соответственно привести к очень высоким временным затратам), либо увеличением площади электрода сравнения и расхода реагентов.
Более перспективными в этом отношении представляются методы формирования сенсорных покрытий, связанные со струйно-капельным нанесением на поверхность малых объемов жидкости. Современные технологии позволяют дозировать с высокой точностью микро- и нанолитровые объемы растворов, содержащих необходимые компоненты для формирования чувствительных слоев. При этом существуют автоматизированные системы дозирования, позволяющие сделать процесс изготовления аналитических элементов высокопроизводительным. В этой связи особое внимание привлекает разработка процедур формирования медиаторных слоев без использования электрохимического осаждения.
В работе [5] предпринята попытка создания пероксид-чувствительного элемента без применения электрохимического осаждения на основе наночастиц диоксида марганца, стабилизированных коллоидным раствором монтмориллонита.
В работе [6] описана детекция пероксида водорода на стеклоуглеродном электроде, модифицированном наночастицами диоксида марганца, диспергированных в растворе дигексадецил фосфата.
Для получения суспензии МnO2 авторами данной группы работ использовалась следующая методика: в раствор, содержащий стабилизатор, добавляли твердый диокисд марганца в таком количестве, чтобы конечная концентрация его в суспензии составила 1 мг/мл, и диспергировали при помощи ультразвука в течение 2-х часов. Для изготовления пероксид-чувствительного электрода полученную суспензию наносили на поверхность стеклоуглеродного электрода и высушивали при комнатной температуре.
Недостатками обоих методов является: необходимость использования дополнительных стабилизаторов, труднодоступных из-за специфичности рецептуры получения, использование длительной процедуры ресуспендирования в стабилизаторе при помощи ультразвука; а также недостаточная чувствительность электрода.
В работе [7] описан планарный холиноксидазный электрод на основе другого известного пероксид-чувствительного медиатора - берлинской лазури. Для создания пероксид-чувствительного слоя на поверхность планарного графитового электрода наносили 40 мкл смеси, состоящей из 20 мкл 0,1 М-го раствора K3[Fe(CN)6] в 10 мМ НСl и 20 мкл 0,1 М-го раствора FeCl3 в 10 мМ НСl, электроды осторожно встряхивали на круговом шейкере в течение 10 минут, промывали 10 мМ НСl, а затем высушивали 1 час при 100°С, хранили при комнатной температуре темноте. Иммобилизацию холиноксидазы на графитовый планарный электрод, покрытый медиаторным слоем берлинской лазури, осуществляли в пленке с бычьим сывороточным альбумином и нафионом при помощи сшивки глутаровым альдегидом. Для приготовления 150 мкл смеси, наносимой на электрод, смешивали 20 мкл 2,5%-го водного раствора глутрового альдегида, 30 мкл 5%-го раствора Nafion® в этаноле и 100 мкл 0.05М фосфатного буферного раствор, рН 7.4, содержащего 0,1 М КСl, 40 мг/мл бычьего сывороточного альбумина и 10 мг/мл холиноксидазы. 7 мкл полученной смеси наносили на поверхность электрода, высушивали 45 минут при комнатной температуре, затем в течение 30 минут промывали 0.1 М модным раствором глицина.
Недостатками описанной процедуры изготовления ферментативного пероксид-чувствительного амперометрического сенсора является необходимость проведения реакции синтеза медиатора на электроде, процедура требует контроля времени контакта реагентов, которые вначале смешиваются, после чего смесь наносится на электрод, далее необходимо организовать дополнительное аккуратное перемешивание, в результате процедура усложняется, и создаются трудности для воспроизводимого получения большого количества электродов.
Таким образом, задачами изобретения являются: разработка способа получения устойчивого водного золя медиатора диоксида марганца, не предполагающего использования каких-либо дополнительных процедур для стабилизации образующегося гидрозоля. Разработка на его основе простого и экономичного способа получения высокочувствительных пероксид-чувствительного электрохимического сенсора и пероксид-чувствительного ферментативного биосенсора.
В соответствии с изобретением описывается гидрозоль на основе коллоидных наночастиц диоксида марганца для формирования покрытия электрохимических пероксидчувствительных сенсоров и электрохимических пероксидчувствительных биосенсоров, характеризующийся гидродинамическим радиусом коллоидных частиц диоксида марганца 60±15 нм, значением дзета-потенциала (-30)±10 мВ и имеющий максимум поглощения света при длине волны в диапазоне 620 - 640 нм, полученный по реакции сопропорционирования перманганат ионов и ионов Мn2+ путем смешения равных объемов 1·10-4-3·10-4 М водного раствора перманганата калия или натрия и 1,5·10-4-4,8·10-4 М водного раствора ацетата или дигидрофосфата марганца при стехиометрическом соотношении концентраций и комнатной температуре или путем смешения равных объемов 1·10-4-3·10-4 М водного раствора перманганата калия или натрия и смеси, содержащей хлорид марганца и ацетат или гидрокарбонат или дигидрофосфат натрия или калия в мольном соотношении 1:2-1:10 при стехиометрическом соотношении перманганат ионов и ионов Мn2+.
Также описывается способ получения гидрозоля на основе коллоидных наночастиц диоксида марганца для формирования покрытия электрохимических пероксидчувствительных сенсоров и электрохимических пероксидчувствительных биосенсоров по реакции сопропорционирования перманганат ионов и ионов Мn2+, заключающийся в том, что реакцию сопропорционирования проводят путем смешения равных объемов 1·10-4-3·10-4 М водного раствора перманганата калия или натрия и 1,5·10-4-4,8·10-4 М водного раствора ацетата или дигидрофосфата марганца при стехиометрическом соотношении концентраций и комнатной температуре или путем смешения равных объемов 1·10-4-3·10-4 М водного раствора перманганата калия или натрия и смеси, содержащей хлорид марганца и ацетат или гидрокарбонат или дигидрофосфат натрия или калия в мольном соотношении 1:2-1:10 при стехиометрическом соотношении перманганат ионов и ионов Мn2+ и комнатной температуре.
Описывается электрохимический пероксид-чувствительный сенсор, представляющий собой сенсорный электрод, покрытый медиаторным слоем коллоидных частиц диоксида марганца, полученный путем нанесения на поверхность графитового электрода струйно-капельным методом указанного выше гидрозоля коллоидных частиц диоксида марганца, способ его получения, путем нанесения гидрозоля коллоидных частиц диоксида марганца с последующей сушкой, осуществляемой в две стадии, сначала при комнатной температуре с последующей промывкой водой и затем при 55-65°С и промывкой водой.
Описывается также электрохимический пероксидчувствительный биосенсор, представляющий собой электрохимический пероксидчувствительный сенсор с последовательно нанесенными на него чередующимися адгезивным(и) слоем(ями) и слоем(ями) оксидо-редуктазного фермента и/или антител заданной специфичности, где адгезивный(ые) слой(и) состоит(ят) из 1-12 чередующихся слоев катионного и анионного полиэлектролита или 1-12 чередующихся слоев катионного или анионного полиэлектролита и углеродных, кремниевых, белковых или пептидных нанотрубок, или фуллеренов, или наночастиц металлов или их оксидов, или молекул белков, или молекул нуклеиновых кислот, или рекомбинантных вирусных частиц и слой(и) оксидо-редуктазного фермента состоит(ят) из глюкозоксидазы, холиноксидазы, лактатоксидазы, алкогольоксидазы или лактатоксидазы либо осуществляют последовательное нанесение чередующихся 1-12 адгезивных слоев и 1-10 слоев оксидо-редуктазного фермента и/или антител заданной специфичности.
Способ получения электрохимического пероксидчувствительного биосенсора, заключается в том, что на поверхность электрохимического пероксидчувствительного сенсора наносят чередующиеся адгезивный(е) слой(и) путем адсорбции его (их) из водных растворов с последующей промывкой водой и слой(и) оксидо-редуктазного фермента и/или антител заданной специфичности путем адсорбции его (их) из водных буферных растворов с последующей промывкой водой, где в качестве адгезивного(ых) слоя(ев) наносят 1-12 чередующихся слоев катионного и анионного полиэлектролита или 1-12 чередующихся слоев катионного или анионного полиэлектролита и углеродных, кремниевых, белковых или пептидных нанотрубок, или фуллеренов, или наночастиц металлов или их оксидов, или молекул белков, или молекул нуклеиновых кислот, или рекомбинантных вирусных частиц и в качестве слоя(ев) оксидо-редуктазного фермента наносят глюкозоксидазу, холиноксидазу, лактатоксидазу, алкогольоксидазу или лактатоксидазу либо осуществляют последовательное нанесение чередующихся 1-12 адгезивных слоев и 1-10 слоев оксидо-редуктазного фермента и/или антител заданной специфичности.
Описывается также применение указанного выше электрохимического пероксидчувствительного биосенсора для определения активности холинэстераз и концентрации ингибиторов холинэстераз в биологических и небиологических жидкостях или в качестве метки для иммуноферментного анализа.
Гидрозоль диоксида марганца получали, проводя реакцию сопропорционирования между ионами Мn2+ и МnO4 - в водном растворе, подбирая противоионы и концентрации солей таким образом, чтобы в результате образовался стабильный золь МnO2. Роль стабилизатора в этом случае выполняли отрицательно заряженные противоионы (например, ацетат ионы), которые, адсорбируясь на поверхности образующихся частиц МnO2, придавали им одноименный заряд и препятствовали агломерации.
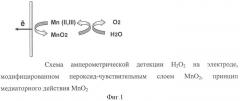
Каплю полученного золя наносили на поверхность планарного графитового электрода, где МnO2 работал как медиатор. Принцип работы медиатора на поверхности полученного таким образом пероксид-чувствительного сенсора состоит в том, что пероксид водорода, окисляясь на поверхности электрода, восстанавливает МnO2 до оксидов Mn (II) и (III), которые при потенциале +250 - +500 мВ тут же электрохимически окисляются на электроде до МnO2. На фиг.1 представлена схема амперометрической детекции Н2O2 на электроде, модифицированном пероксид-чувствительным слоем МnO2.
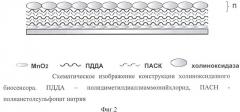
Для получения ферментативного пероксид-чувствительного биосенсора на поверхность пероксид-чувствительного сенсора наносили фермент холиноксидазу, предварительно модифицировав поверхность адгезивными слоями полиэлектролитов. На фиг.2 представлено схематическое изображение конструкции холиноксидазного биосенсора.
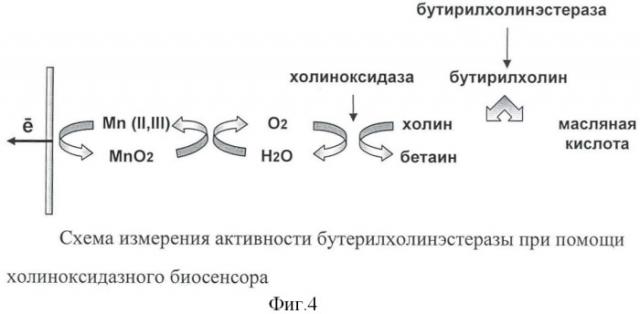
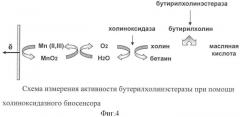
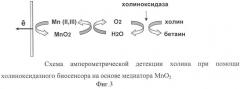
На фиг.3 представлена схема амперометрической детекции холина при помощи холиноксидазного биосенсора на основе медиатора МnO2. Холин окисляется кислородом воздуха при участии фермента холиноксидазы на поверхности электрода, при этом образуется пероксид водорода, который электрохимически регистрируется пероксид-чувствительным слоем сенсора.
Одним из возможных применений холиноксидазного биосенсора является измерение активности хлинэстераз. На фиг.4 представлена схема измерения активности бутирилхолинэстеразы при помощи холиноксидазного биосенсора. Ферменты холинэстеразы, играющие ключевую роль в работе центральной и переферической нервной системы организма, расщепляют холиновые эфиры, генерируя холин, который может быть зарегестрирован при помощи холиноксидазного биосенсора. Таким образом, разработанный холиноксидазный биосенсор может быть использован как для непосредственного определения активности холинэстераз в крови или в имуноаналитических системах, так и для анализа токсичных веществ - ингибиторов холинэстераз.
Коллоидный раствор диоксида марганца получали по реакции сопропорционирования ацетата марганца (II) с перманганатом калия:
3(СН3СОО)2Мn·4Н2O+2КМnO4→5МnO2+2СН3СООК+4СН3СООН+2Н2O
Исходные растворы реагентов готовили в воде в следующих концентрациях: ацетата марганца в концентрации 2,4·10-4-4,5·10-4 М, перманганата калия в концентрации 1,6·10-4-3,0·10-4 М. Концентрации реагентов в исходных растворах подбирали таким образом, чтобы они соответствовали стехиометрическим коэффициентам в приведенном выше уравнении реакции. Равные объемы растворов реагентов смешивали и интенсивно встряхивали в течение 5 минут. Полученные коллоидные растворы МnO2 оставались гомогенными в течение 10-30 дней при комнатной температуре.
Пероксид-чувствительный электрод изготовляли, модифицируя полученным гидрозолем диоксида марганца поверхность планарных графитовых электродов. На поверхность графитового планарного электрода наносили каплю гидрозоля диоксида марганца, электрод высушивали на воздухе при комнатной температуре, промывали водой и прогревали электроды 1 час при 60°С в термостате и хранили при комнатной температуре.
Для изготовления планарных холиноксидазных биосенсоров использовались планарные графитовые электроды, покрытые пероксид-чувствительным слоем МnO2. На него путем адсорбции из водных буферных растворов последовательно наносили полиэлектролиты и холиноксидазу, чередуя слои. После адсорбции каждого слоя электрод промывали водой, излишки воды удаляли, после чего наносили следующий слой.
Пример 1. Получение гидрозоля диоксида марганца.
500 мкл раствора перманганата калия с концентрацией 2,5·10-4 М добавляли к 500 мкл 3,75·10-4 М-го раствора ацетата марганца (II) и интенсивно встряхивали в течение 5 минут. Полученные коллоидные растворы МnО2 оставались гомогенными в течение 20 дней при комнатной температуре. Полученные частицы имели следующие характеристики: гидродинамический радиус, определенный при помощи метода динамического квазиупругого светорассеяния 64±1 нм, величину определенного ζ-потенциала (-30)±5 мВ, максимум поглощения света 366±2 нм.
Пример 2. Изготовление пероксид-чувствительного сенсора.
Пероксид-чувствительный слой формировали на поверхности планарных графитовых электродов. Планарные электроды были изготовлены с использованием аппарата для полуавтоматической печати Winon модели WSC160B, трафаретной сетки (Mesh count=200 нитей/см), и проводящих графитовых чернил (Coates Screen, Германия) на подложке из поливинилхлорида толщиной 0.2 мм. Каждый планарный графитовый электрод состоял из круглой рабочей поверхности диаметром 3 мм, проводящей полоски (30 · 1.5 mm2) и контактной площадки (3·7 mm2).
На поверхность графитового планарного электрода наносили каплю свежеприготовленного раствора диоксида марганца объемом 5 мкл, электрод высушивали на воздухе при комнатной температуре около 40 минут до полного высыхания капли, затем промывали бидистиллированной водой, излишки воды удаляли и снова высушивали электрод. После этого электроды прогревали 1 час при 60°С в термостате и хранили при комнатной температуре.
Пример 3. Построение калибровочного графика для определения концентрации пероксида водорода.
Амперометрические измерения проводили в электрохимической ячейке объемом 1 мл, установленной на магнитной мешалке. Ячейка содержала Ag/AgCl электрод сравнения, относительно которого поддерживался заданный потенциал (480 мВ) и рабочий пероксид-чувствительный электрод. Растворы пероксида водорода готовили ежедневно путем последовательного разведения исходного 30%-го раствора пероксида водорода бидистиллированной водой до нужной концентрации. В электрохимическую ячейку помещали 990 мкл буферного раствора 50 мМ на основе N-[2-гидроксиэтил]пиперазин-N'-[2-этансульфоновой кислоты] (Hepes), содержащий 30 мМ КСl, рН от 7.5 и после выхода базовой линии вводили в ячейку 10 мкл раствора пероксида водорода и фиксировали изменение тока. За изменениями величины тока следили при помощи управляемого компьютером потенциостат-гальваностата IPC-2000 (производства Института Физической Химии РАН).
Зависимость величины аналитического сигнала от концентрации пероксида водорода была исследована в диапазоне 2.5·10-8-5·10-4 М. Из градуировочной зависимости были получены следующие аналитические характеристики: предел обнаружения по пероксиду водорода, рассчитанный по уравнению у=36.1·х+0.1 при уровне шума 0,3 нА составил 2.2·10-8 М (3σ), линейный диапазон 2.2·10-8-1.0·10-4 М, чувствительность сенсора 515±3 мА/(М·см2).
Пример 4. Изготовление холиноксидазного сенсора.
Для изготовления планарных холиноксидазных биосенсоров использовались планарные графитовые электроды, покрытые пероксид-чувствительным слоем на основе водного коллоидного раствора МnO2. Площадь рабочей поверхности пероксид-чувствительных электродов ограничивалась до 5 мм2 для предотвращения растекания капель наносимых растворов и улучшения воспроизводимости. Раствор холиноксидазы готовили в 50 мМ буфере Hepes, содержащем 30 мМ КС1, рН 7.5. Полиэлектролиты: полидиметилдиаллиаммонийхлорид (ПДДА) и полианетолсульфонат натрия (ПАСН), растворяли в бидистиллированной воде в концентрации 5 мг/мл. Для изготовления холиноксидазных электродов, покрытых пленкой (ПДДА/ПАСН2/ПДДА/ХО на рабочую поверхность электрода наносили 5 мкл раствора ПДДА, адсорбировали 10 минут, затем промывали электрод бидистиллированной водой 1-2 минуты, высушивали, затем наносили 5 мкл раствора ПАСН, адсорбировали 10 минут, затем промывали электрод бидистиллированной водой 1-2 минуты и т.д. Последней наносили наносили каплю раствора холиноксидазы объемом 5 мкл, снова выдерживали 10 минут, затем промывали водой и высушивали. Аналогичную процедуру использовали для формирования пленок состава (ПДДА/ПАСН)2/(ПДДА/ХО)3.
Пример 5. Построение калибровочного графика для определения концентрации холина.
Амперометрические измерения проводили в электрохимической ячейке объемом 1 мл, установленной на магнитной мешалке. Ячейка содержала Ag/AgCl электрод сравнения, относительно которого поддерживался заданный потенциал (450 мВ) и рабочий холиноксидазный электрод. Растворы холина готовили ежедневно путем растворения сухого холина в бидистиллированной воде и последовательного разведения до нужной концентрации. В электрохимическую ячейку помещали 990 мкл буферного раствора 50 мМ Hepes, содержащий 30 мМ КСl, рН 7.5 и после выхода базовой линии вводили в ячейку 10 мкл раствора холина и фиксировали изменение тока. За изменениями величины тока следили при помощи управляемого компьютером потенциостат-гальваностата IPC-2000 (производства Института Физической Химии РАН).
Для электродов конструкции (ПДДА/ПАСН)2/ПДДА/ХО градуировочная зависимость величины аналитического сигнала от концентрации холина была исследована в диапазоне концентраций 7.5·10-7-1·10-3 М. Анализ этой зависимости позволил вычислить следующие аналитические характеристики сенсора: предел обнаружения по холину, рассчитанный по уравнению у=2.9·х+3.5 при уровне шума 0.3 нА, составил 3.0·10-7 М (3σ), линейный диапазон 3.0·10-7-1.0·10-4 М, чувствительность составила 59±3 мА/(М·см2).
Для электродов конструкции (ПДДА/ПАСН)2/(ПДДА/ХО)3 градуировочная зависимость величины аналитического сигнала от концентрации холина была исследована в диапазоне концентраций 2.0·10-7-2·10-2М. Анализ этой зависимости дал следующие аналитические характеристики сенсора: предел обнаружения по холину, рассчитанный по уравнению у=5,146·х при уровне шума 0.3 нА, составил 1.3.0·10-7М (3σ), линейный диапазон 1.3.0·10-7-1.0·10-4 М, чувствительность составила 103±3 мА/(М·см2).
Пример 6. Электрохимическое определение активности бутирилхолинэстеразы.
Для определения активности бутирилхолинэстеразы раствор фермента готовили в концентрации 2·10-3 мг/мл в буфере Hepes 50 мМ рН 7.5, содержащим 30 мМ КСl и 1 мг/мл БСА. Необходимую концентрацию фермента в электрохимической ячейке получали добавлением различных объемов исходного раствора. Все измерения проводились в буфере Hepes 50 мМ рН 7.5, содержащим 1 мг/мл BSA. После выхода базовой линии в ячейку добавляли раствор бутирилхолина в воде 90 мМ, конечная концентрация бутирилхолина в ячейке составляла 3 мМ, около 2-х минут прописывали спонтанный гидролиз субстрата, а затем добавляли раствор фермента и измеряли суммарную скорость спонтанного и ферментативного гидролиза.
Градуировочная зависимость начальной скорости ферментативного гидролиза бутирилхолина от концентрации фермента бутирилхолинэстеразы была получена для диапазона концентраций 5·10-12-1·10-10 М. Из измеренной градуировочной зависимости получены следующие аналитические характеристики: предел обнаружения фермента бутирилхолинэстеразы, рассчитанный из этой зависимости по уравнению у=93.6·х составил 10-12 М, чувствительность метода составила 93.6 мкМ·с.
Пример 7. Электрохимический анализ ингибиторов активности холинэстераз на примере хлорпирифоса.
Для проведения электрохимического анализа ингибиторов активности холинэстераз использовали планарные холиноксидазные электроды конструкции: ПДДА/ПАСК)2/(ПДДА/ХО)3. Вначале для каждого электрода измеряли отклик на стандартную концентрацию холина (10-5М) в в буфере Hepes 50 мМ рН 7.5, содержащим 30 мМ КСl. Затем в электрохимическую ячейку помещали 680 мкл в буфера Hepes 50 мМ рН 7.5, содержащим 30 мМ КСl и 1 мг/мл БСА и 20 мкл водного раствора бутирилхолина с концентрацией 19 мг/мл и прописывали спонтанный гидролиз. После этого добавляли в ячейку 300 мкл раствора, содержащего фермент, проинкубированный с ингибитором, и измеряли суммарную скорость спонтанного и ферментативного гидролиза. Данные фиксировали в виде отношения тангенса ферментативного гидролиза к измеренному отклику на стандартную концентрацию холина.
Растворы ингибитора готовили последовательным разведением 0.01 молярного раствора в изопропаноле 50 мМ буфером Hepes рН 7.5, содержащим 30 мМ КС1. Ингибитор предварительно активировали для перевода в оксонную форму, окисляя бромной водой. Для приготовления бромной воды к 0.5 М водному раствору бромида калия добавляли жидкий бром из расчета 8 мкл брома на 25 мл раствора КВr, смесь интенсивно встряхивали до получения гомогенного раствора. Для окисления использовали растворы ингибиторов в буфере Hepes, которые смешивали с бромной водой в соотношении 1:1, встряхивали и выдерживали 3 минуты, затем разбавляли в 1000 раз буфером Hepes.
Инкубационные смеси готовили, смешивая 300 мкл раствора ингибитора необходимой концентрации с 30 мкл раствора бутирилхолинэстеразы в Hepes 50 мМ рН 7.5, содержащим 30 мМ КСl, 10 мг/мл БСА и 1 нМ фермента. Таким образом, концентрация фермента в инкубационной смеси составляла 0.1 нМ, в измерительной ячейке 3·10-11 М. Ингибирование проводили при комнатной температуре в течение 10 минут.
За определяемый диапазон хлорпирифоса принимали такие его концентрации, которые вызывали ингибирование фермента в пределах от 10% до 90%. Определяемый диапазон концентраций по хлорпирифосу составил 7.5·10-11-4.9·10-10 М.
Таким образом, техническим результатом настоящего изобретения являются:
- разработка способа получения устойчивого водного золя медиатора диоксида марганца простым способом, без использования каких-либо дополнительных процедур для стабилизации образующегося гидрозоля благодаря подбору концентраций реагентов и состава реакционной смеси, с низкими затратами времени на процедуру получения;
- разработка способа получения пероксид-чувствительного электрохимического сенсора на основе данного медиатора, характеризующегося высокой чувствительностью (предел обнаружения по Н2O2 составил 2.2·10-8 М (3σ) по сравнению с описанными в работах [4] (6.6·10-8 М), [5] (1.5·10-7 М) и [6] (8·10-8 М));
- разработка простого и экономичного способа получения ферментативного холиноксидазного пероксид-чувствительного биосенсора с более низкими затратами фермента (2,5-7,5 мкг на 1 электрод) в сравнении со способом из работы [7] (47 мкг на 1 электрод). Также достигнута высокая чувствительность: предел обнаружения по холину составил 1.3·10-7 М (3σ), в то время как один из лучших на сегодняшний день, описанный в работе [7], датчик дает предел обнаружения по холину 5·10-7 М. Показана возможность использования разработанного биосенсора для определения активности ферментов холинэстераз и анализа ингибиторов холинэстераз. Достигнуты пределы обнаружения: 10-12 М для фермента бутирилхолинэстеразы, 7.5·10-11 М для ингибитора холинэстераз, инсектицида хлорпирифоса.
Список литературы
1. Xi-Liang Luo, Jing-Juan Xu, Wei Zhao, Hong-Yuan Chen. Ascorbic acid sensor based on ion-sensitive field-effect transistor modified with MnО2 nanoparticles. Analytica Chimica Acta 512 (2004) 57-61.
2. Xi-Liang Luo, Jing-Juan Xu, Wei Zhao, Hong-Yuan Chen. A novel glucose ENFET based on the special reactivity of MnО2 nanoparticles. Biosensors and Bioelectronics 19 (2004) 1295-1300.
3. Jing-Juan Xu, Wei Zhao, Xi-Liang Luo and Hong-Yuan Chen. A sensitive biosensor for lactate based on layer-by-layer assembling MnО2 nanoparticles and lactate oxidase on ion-sensitive field-effect transistors. Chem. Commun., 2005, 792-794.
4. Schachl K., Alemu H., Kalcher K., Moderegger H., Svancara I., Vytras K. Amperometric determination of hydrogen peroxide with a manganese dioxide film-modified screen printed electrode. Fresenius J. Anal. Chem. 1998, V.362, №2, P. 194-200.
5. Yao Sh., Yuan Sh., Xu Yu., Wang Yi., Luo J., Hu Sh. A hydrogen peroxide sensor based on colloidal MnО2/Na-montmorillonite. Applied Clay Science. 2006, V.33, №l, P.35-42.
6. Shaojun Yao, Junhui Xu, Ying Wang, Xiaoxia Chen, Yanxia Xu, Shengshui Hu. A highly sensitive hydrogen peroxide amperometric sensor based on MnО2 nanoparticles and dihexadecyl hydrogen phosphate composite film. Analytica Chimica Acta 557,(2006), 78-84.
7. F. Ricci, A. Amine, G. Palleschi, D. Moscone. Prussian Blue based screen printed biosensors with improved characteristics of long-term lifetime and pH stability. Biosensors and Bioelectronics 18, (2003), 165-174.
1. Гидрозоль на основе коллоидных наночастиц диоксида марганца для формирования покрытия электрохимических пероксидчувствительных сенсоров и электрохимических пероксидчувствительных биосенсоров, характеризующийся гидродинамическим радиусом коллоидных частиц диоксида марганца 60±15 нм, значением дзета-потенциала (-30)±10 мв и имеющий максимум поглощения света при длине волны в диапазоне 620-640 нм, полученный по реакции сопропорционирования перманганат-ионов и ионов Мn2+ путем смешения равных объемов 1·10-4-3·10-4 М водного раствора перманганата калия или натрия и 1,5·10-4-4,8·10-4 M водного раствора ацетата или дигидрофосфата марганца при стехиометрическом соотношении концентраций и комнатной температуре или путем смешения равных объемов 1·10-4-3·10-4 М водного раствора перманганата калия или натрия и смеси, содержащей хлорид марганца и ацетат или гидрокарбонат или дигидрофосфат натрия или калия в мольном соотношении 1:2-1:10 при стехиометрическом соотношении перманганат-ионов и ионов Мn2+.
2. Способ получения гидрозоля на основе коллоидных наночастиц диоксида марганца для формирования покрытия электрохимических пероксидчувствительных сенсоров и электрохимических пероксидчувствительных биосенсоров по реакции сопропорционирования перманганат-ионов и ионов Мn2+, заключающийся в том, что реакцию сопропорционирования проводят путем смешения равных объемов 1·10-4-3·10-4 М водного раствора перманганата калия или натрия и 1,5·10-4-4,8·10-4 М водного раствора ацетата или дигидрофосфата марганца при стехиометрическом соотношении концентраций и комнатной температуре или путем смешения равных объемов 1·10-4-3·10-4 М водного раствора перманганата калия или натрия и смеси, содержащей хлорид марганца и ацетат или гидрокарбонат или дигидрофосфат натрия или калия в мольном соотношении 1:2-1:10 при стехиометрическом соотношении перманганат-ионов и ионов Мn2+ и комнатной температуре.
3. Электрохимический пероксидчувствительный сенсор, представляющий собой сенсорный электрод, покрытый медиаторным слоем коллоидных частиц диоксида марганца, полученный путем нанесения на поверхность сенсорного электрода струйно-капельным методом гидрозоля коллоидных частиц диоксида марганца по п.1 с последующей сушкой и промывкой водой.
4. Способ получения электрохимического пероксидчувствительного сенсора, заключающийся в том, что на поверхность сенсорного электрода струйно-капельным методом наносят гидрозоль коллоидных частиц диоксида марганца по п.1 с последующей сушкой и промывкой водой.
5. Способ по п.4, где сушку осуществляют в две стадии, сначала при комнатной температуре с последующей промывкой водой и затем при 55-65°С.
6. Электрохимический пероксидчувствительный биосенсор, представляющий собой электрохимический пероксидчувствительный сенсор по п.3 с последовательно нанесенными на него чередующимися адгезивным(и) слоем(ями) и слоем(ями) оксидо-редуктазного фермента и/или антител заданной специфичности.
7. Электрохимический пероксидчувствительный биосенсор по п.6, где адгезивный(ые) слой(и) состоит(ят) из 1-12 чередующихся слоев катионного и анионного полиэлектролита или 1-12 чередующихся слоев катионного или анионного полиэлектролита и углеродных, кремниевых, белковых или пептидных нанотрубок, или фуллеренов, или наночастиц металлов или их оксидов, или молекул белков, или молекул нуклеиновых кислот, или рекомбинантных вирусных частиц и слой(и) оксидо-редуктазного фермента состоит(ят) из глюкозоксидазы, холиноксидазы, лактатоксидазы, алкогольоксидазы или лактатоксидазы.
8. Электрохимический биосенсор по пп.6, 7, содержащий чередующиеся 1-12 адгезивных слоев и 1-10 слоев оксидоредуктазного фермента и/или антител заданной специфичности.
9. Способ получения электрохимического пероксидчувствительного биосенсора, заключающийся в том, что на поверхность электрохимического пероксидчувствительного сенсора по п.3 наносят чередующиеся адгезивный(е) слой(и) путем адсорбции его (их) из водных растворов с последующей промывкой водой и слой(и) оксидоредуктазного фермента и/или антител заданной специфичности путем адсорбции его (их) из водных буферных растворов с последующей промывкой водой.
10. Способ по п.9, где в качестве адгезивного(ых) слоя(ев) наносят 1-12 чередующихся слоев катионного и анионного полиэлектролита или 1-12 чередующихся слоев катионного или анионного полиэлектролита и углеродных, кремниевых, белковых или пептидных нанотрубок, или фуллеренов, или наночастиц металлов или их оксидов, или молекул белков, или молекул нуклеиновых кислот, или рекомбинантных вирусных частиц и в качестве слоя(ев) оксидоредуктазного фермента наносят глюкозоксидазу, холиноксидазу, лактатоксидазу, алкогольоксидазу или лактатоксидазу.
11. Способ по пп.9, 10, где осуществляют последовательное нанесение чередующихся 1-12 адгезивных слоев и 1-10 слоев оксидоредуктазного фермента и/или антител заданной специфичности.
12. Применение электрохимического пероксидчувствительного биосенсора по пп.6-8 для определения активности холинэстераз и концентрации ингибиторов холинэстераз в биологических и небиологических жидкостях или в качестве метки для иммуноферментного анализа.