Способ диагностики патологии щитовидной железы и тимуса у телят
Иллюстрации
Показать всеИзобретение относится к ветеринарной медицине, в частности к эндокринологии, и может быть использовано для постановки более точных диагнозов при обследовании телят. Техническим результатом является разработка безопасного и анатомически корректного способа отбора проб биоматериала для прижизненных гистологических исследований у телят. Способ диагностики патологии щитовидной железы и тимуса у телят включает проведение под местной анестезией у животного биопсии долей щитовидной железы, шейных парных и грудной непарной долей тимуса. Отбор биоматериала проводят путем использования иглы для режущей биопсии различных органов, вводимой через предварительно введенный троакар. Троакар вводят путем прокола по сагиттальной линии при использовании инфильтрационной анестезии при фиксации животного в положении стоя с незначительным поворотом головы в сторону и вверх - дорсо-латерально. 1 з.п. ф-лы, 4 ил.
Реферат
Изобретение относится к ветеринарной медицине, в частности к эндокринологии, и может быть использовано для постановки более точных диагнозов при обследовании телят, особенно в йод-недостаточных и техногенных промышленных областях, в которых ведется животноводство.
Интенсивное развитие промышленности привело к увеличению техногенной нагрузки на сельскохозяйственные зоны, в которых выращивается поголовье скота. В этих условиях довольно часто возникают эндокринные нарушения, в частности, идет значительная нагрузка на тиреоидную и иммунную системы организма, особенно у телят (см. Клинико-морфологическая диагностика незаразных болезней животных в условиях экологического неблагополучия. / Под ред. д.в.н., проф., засл. деятеля науки РФ Л.И.Дроздовой, д.в.н. И.А.Шкуратовой, к.б.н. М.И.Барашкина. - Екатеринбург: УрГСХА, 2002 г. - 116 с.).
Вилочковая и щитовидная железы играют важнейшую роль в регуляции процессов роста и развития, активизации иммунного ответа организма на негативные воздействия экологических факторов окружающей среды. Методы прижизненной диагностики патологических изменений, происходящих в щитовидной и вилочковой железах, в настоящее время сводятся в основном к проведению гематологического и биохимического исследования крови животных (см. Практикум по внутренним болезням животных. / Под общей редакцией засл. деятеля науки РФ, проф. Г.Г.Щербакова и проф. А.В.Коробова. - СПб.: Издательство «Лань», 2003. - С.307-323, 417-421). Но, для определения характера поражения, они недостаточно информативны, а отбор материала для более точного гистологического исследования производят обычно посмертно, что приводит к потерям в животноводстве и повышает стоимость полученной продукции (см. Фисенко С.П. Морфологическая характеристика щитовидной железы и тимуса молодняка крупного рогатого скота черно-пестрой породы: автореф. дис. канд. биол. наук. / Ивановская ГСХА - Саранск - 2009).
Широкий спектр диагностических методов исследования эндокринных органов у человека не нашел применения в ветеринарной практике из-за специфики производства на фермах и анатомо-физиологических особенностей животных (наличие грубой кожи и шерстного покрова). Отсутствие комплексного диагностического подхода в вопросах возможной тканевой реакции изучаемого органа, а также характера послеоперационных осложнений явилось сдерживающим фактором в вопросе биопсии для прижизненной диагностики эндокринных органов у животных.
Задачей изобретения в данных условиях является разработка безопасного и анатомически корректного способа отбора проб биоматериала для прижизненных гистологических исследований, что позволило бы с большей точностью и направленностью проводить диагностику, прогноз и профилактику заболеваний эндокринной системы, в частности, у телят. Способ должен практически осуществляться в условиях ветеринарного пункта животноводческих ферм при минимальном использовании специальной аппаратуры, приборов и медикаментозных препаратов силами штатных ветеринарных специалистов.
Задача решается тем, что у животного под местной анестезией прижизненно проводят биопсию долей щитовидной железы, шейных (парных) и грудной (непарной) долей тимуса, причем отбор биоматериала проводят путем использования иглы для режущей биопсии различных органов, вводимой через предварительно введенный троакар, а троакар вводят путем прокола по сагиттальной линии при использовании инфильтрационной анестезии при фиксации животного в положении стоя с незначительным поворотом головы в сторону и вверх (дорсо-латерально), при этом используют автоматическую иглу диаметром 2 мм для режущей биопсии различных органов типа ИБРА «Уникон» (ИБРА 10), причем местную инфильтрационную анестезию проводят 0,5% раствором новокаина, а биоптат отбирают длиной 10-15 мм и для гистологических исследований фиксируют 10% водным раствором формальдегида.
Способ осуществляют следующим образом. Заболевшего теленка с внешними признаками заболевания переводят в санитарный блок (изолятор), где у животного производят забор крови для гематологического и биохимического исследования. А для уточнения диагноза и назначения более эффективного лечения проводят пункционную биопсию его эндокринных органов для гистологических исследований, используя по новому назначению автоматическую иглу для режущей биопсии различных органов ИБРА-3 «Уникон» с диаметром иглы 2 мм, вводимую через троакар.
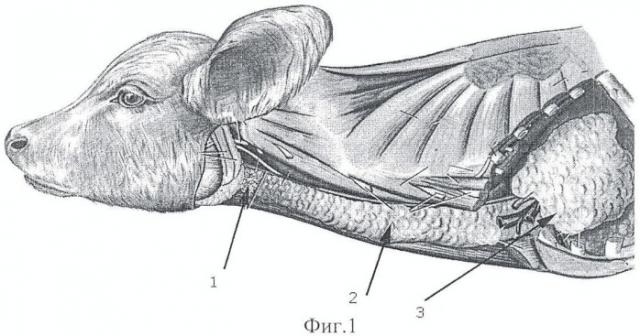
На фиг.1 представлена схема точек вкола троакара и направление введения иглы для взятия у телят биопроб, где:
1. Точка вкола и направление введения иглы для пункции щитовидной железы;
2. Для парных долей тимуса;
3. Для грудной доли тимуса.
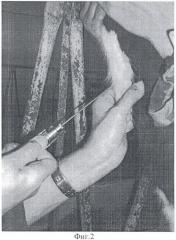
На фиг.2 представлен снимок взятия биопробы щитовидной железы.
На фиг.3 представлен снимок взятия биопробы тимуса в условиях фермы.
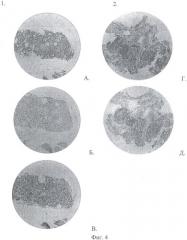
На фиг.4 представлены снимки гистологического просмотра зафиксированных биопроб:
1. Щитовидная железа;
А. Окраска гематоксилином и эозином;
Б. Окраска по методу Ван-Гизона;
В. Окраска по методу Маллори;
2. Тимус;
Г. Окраска гематоксилином и эозином;
Д. Окраска по методу Ван-Гизона.
Для пункции боковой доли щитовидной железы у теленка, проведя анестезию, необходимо зафиксировать гортань. Пропальпировать задний край гортани и первые два кольца трахеи. На уровне первого кольца трахеи, по сагиттальной линии шеи, путем прокола ввести направляющую иглу (троакар) (фиг.2) по касательной к трахее на глубину 2 см до контакта с латеральной поверхностью первого кольца трахеи. После чего через канал троакара подводим биопсийную иглу к точке отбора пробы, выдвигаем стилет на необходимую длину, производим отбор биоматериала путем спуска автоматического механизма иглы и извлечение биоматериала для гистологического исследования.
Для пункции парных долей тимуса (фиг.3) ориентиром является передняя граница задней трети шеи и ее сагиттальная плоскость (при смещенной в сторону трахее). Передняя граница задней трети шеи находится на расстоянии 8-12 см (в зависимости от возраста) от рукоятки грудной кости. Направляющую иглу-троакар вводим по сагиттальной линии до упора в трахею, смещаем трахею латерально (в сторону). Игла проходит по касательной к трахее, на глубину 3-4 см. Ориентируем выемку стилета в направлении от трахеи, производим отбор биоматериала путем спуска автоматического механизма иглы и извлечение биоматериала для гистологического исследования.
Точку введения направляющей иглы-троакара и иглы для взятия материала из грудной (непарной) доли тимуса определяем по пересечению сагиттальной линии шеи и переднему краю рукоятки грудной кости. Направляющую иглу вводим по касательной к боковой части трахеи, под углом 15° в каудальном направлении, на глубину 4-5 см. Ориентируем выемку стилета в направлении от трахеи, производим отбор материала путем спуска автоматического механизма иглы.
Предварительные исследования, проведенные на трупном материале, показали, что такой доступ к структурам щитовидной железы и тимуса является практически безопасным, так как введение троакара и иглы для режущей биопсии проводим минуя крупные кровеносные сосуды, что не вызывает кровотечения, при этом не повреждаются нервные стволы. Это обстоятельство дает основание для разработки прижизненной гистологической оценки состояния щитовидной железы и тимуса по отобранному биоматериалу, без излишнего травмирования животного.
Отработка способа на живых телятах осуществлялась с применением местной инфильтрационной анестезии 0,5% раствором новокаина. Животных фиксировали в положении стоя, с незначительным поворотом головы в сторону и вверх (дорсо-латерально) (фиг.2 и 3).
Полученный биоптат, который имеет вид столбика ткани длиной от 5 до 15 мм и диаметром 1-2 мм, фиксируют 10%-ным водным раствором формальдегида.
По морфологическим критериям пунктаты ткани щитовидной железы имеют более четкие структуры, чем фрагменты железы, взятые посмертно. Участки поврежденных фолликулов располагаются лишь по линии отсечения пунктата, тканевые структуры на остальной площади не деформированы.
Использование трех окрасок при гистологическом исследовании полученных образцов позволяют судить о морфофункциональных особенностях изучаемых структур и оперативно назначать необходимое лечение. Окраска гематоксилином и эозином является основной, фоновой. Окраска по методу Ван-Гизона дает возможность выявить активность соединительнотканных компонентов щитовидной железы. Окраска по методу Маллори выявляет функциональную активность щитовидной железы и насыщение коллоида йодом (фиг.4).
Гистологическое исследование показало, что при окраске А - гематоксилином и эозином: щитовидная железа находится в состоянии активного фолликулогенеза и имеет четко выраженное фолликулярное строение. В поле зрения микроскопа LEICA DM1000 при увеличении: объектив ×4, окуляр ×10 попадает значительная часть исследуемой нами ткани железы. Фолликулы в основном мелкие, заполнены гемогенным коллоидом. Увеличение окуляр ×20, объектив ×10. Эпителий мелких фолликулов имеет кубическую, реже цилиндрическую форму, с базально расположенным ядром. Кроме тиреоцитов, в эпителии обнаруживаются клетки Ашкинази-Гюртля, выступающие в просвет фолликула и имеющие более крупный размер, центрально расположенное ядро. Фолликулярный эпителий в большинстве фолликулов располагается в 1 ряд. На препарате так же отчетливо видны крупные фолликулы, стенка которых представлена тиреоцитами, располагающимися в 2-3 ряда. В полости фолликулов резорбционных вакуолей не обнаружно. Кровеносные сосуды запустевшие.
При окраске Б - по Ван-Гизону: межфолликулярная соединительная ткань отечна, представлена тонкими коллагеновыми волокнами.
Особым диагностическим тестом является окраска щитовидной железы по методу Маллори (В). Она позволяет выявить недостаточность поступающего в организм йода, особенно в условиях природного йод-дефицита территории - показателем чего и является щитовидная железа. На препарате большинство мелких фолликулов - слабо активны. В крупных фолликулах только в пристеночной области обнаруживается наличие коллоида, содержащего йод. Более 30% фолликулов не содержат йода в коллоиде.
На основании комплекса данных, полученных при гистологическом исследовании, можем говорить о йод-дефицитном состоянии, развившемся в организме теленка.
Тимус - увеличение ×100 фиг.4 - 2Г.Д. Дольки тимуса разделены широкими соединительнотканными тяжами. В препарате отчетливо видна застойная гиперемия как микроциркулярного русла, так и сосудов более крупного калибра, с выпадением зерен гемосидерина. Коллагеновые волокна располагаются рыхло. В дольках тимуса граница коркового и мозгового слоев сглажена, а клеточность - резко снижена. Клетки, заселяющие дольки, представлены, в основном, малыми и большими лимфоцитами, лимфобластами, плазматическими клетками, макрофагами. Тельца Гассаля присутствуют на препарате в незначительном количестве, в виде как скоплений эпителиоидных клеток, так и в виде еденичных клеток с явлениями распада. Комплекс патологических изменений, обнаруженный при гистологическом исследовании, характерен иммунодифицитному состоянию железы, с признаками йодной недостаточности.
Неочевидные преимущества при использовании предлагаемого способа заключаются в отсутствии необходимости сложного инструментального контроля положения, режущего инструмента (УЗИ, рентген и т.п.), и практически полном отсутствии кровотечения при отборе биообразцов у телят при получении качественного биоматериала для исследований.
Первичные испытания по апробации способа проводили на трупном материале в количестве 5 голов. Отработку разработанного способа осуществляли на телятах в возрасте 2, 3, 4 месяцев - в количестве 10 голов.
Количество опытных животных
| Трупный материал | 5 голов |
| Телята в возрасте | |
| 2-4 месяца | 10 голов |
Инструментарий: - автоматическая игла для режущей биопсии различных органов ИБРА «УНИКОН» (ИБРА 10) ТУ 9432-001-36926687-98. Изготовитель: ООО Научно - производственное предприятие «УНИКОН»,
- направляющая игла (троакар) ТрИБ - 6 - «УНИКОН».
Выбор инструмента для прижизненного взятия биопроб при диагностике патологических процессов в эндокринных органах у телят осуществлен и обоснован после всестороннего изучения производимого инструментария (отечественного и зарубежного) и его практической проверки.
Практически подобранный и используемый в способе инструмент применяется по новому назначению и новой схеме, позволяет осуществлять отбор образцов биоматериала из эндокринных органов телят путем только прокола грубой кожи животного, без разреза (как требует инструкция на ИБРА). Причем взятие биообразцов эндокринных органов телят проводят с минимальными затратами времени и средств, не создавая особых стрессовых ситуаций для животных, а только используя четкое знание анатомии телят и их физиологических особенностей с учетом расположения крупных кровеносных сосудов и нервных стволов у животного. Снимки на фиг.2 и 3 визуально подтверждают спокойное состояние животных при взятии биопроб.
Предложенный способ диагностики патологических изменений эндокринных органов у телят практически применен в трех хозяйствах Свердловской области, показал его техническую осуществимость штатным составом ветеринарных специалистов после обучения и инструктажа и может быть рекомендован к применению в животноводческих хозяйствах, расположенных в экологически неблагоприятных зонах и зонах йодной недостаточности, где производится выращивание телят.
1. Способ диагностики патологии щитовидной железы и тимуса у телят, включающий забор и исследования проб биоматериала животного, отличающийся тем, что у животного под местной анестезией прижизненно проводят биопсию долей щитовидной железы, шейных парных и грудной непарной долей тимуса, причем отбор биоматериала проводят путем использования иглы для режущей биопсии различных органов, вводимой через предварительно введенный троакар, а троакар вводят путем прокола по сагиттальной линии при использовании инфильтрационной анестезии при фиксации животного в положении стоя с незначительным поворотом головы в сторону и вверх - дорсо-латерально.
2. Способ по п.1, отличающийся тем, что используют автоматическую иглу диаметром 2 мм для режущей биопсии различных органов типа ИБРА «Уникон», предпочтительно ИБРА 10, причем местную инфильтрационную анестезию проводят 0,5% раствором новокаина, а биоптат отбирают длиной 10-15 мм и для гистологических исследований фиксируют 10% водным раствором формальдегида.