Композиции, аппликаторы, наборы с конъюгированным эстрогеном и способы их получения и применения
Иллюстрации
Показать всеПредложены монофазная фармацевтическая композиция, содержащая конъюгированный эстроген и гидрофильный или липофильный эксципиент, где конъюгированный эстроген включает эстронсульфат натрия, эквилинсульфат натрия, 17α-дигидроэквилинсульфат натрия, 17β-дигидроэквилинсульфат натрия, 17α-эстрадиолсульфат натрия, 17β-эстрадиолсульфат натрия, эквиленинсульфат натрия, 17α-дигидроэквиленинсульфат натрия и 17β-дигидроэквиленинсульфат натрия, где вязкость композиции составляет более чем приблизительно 1 Пуаз и менее чем приблизительно 30000 Пуаз, содержащий единичную дозу упомянутой композиции аппликатор, набор аппликаторов и соответствующий способ лечения состояний при менопаузе. Показано, что диффузия и растекаемость эстрогенов из заявленных фармацевтических композиций была намного выше, чем из крема премарин. 4 н. и 47 з.п. ф-лы, 10 ил., 8 табл.
Реферат
Область изобретения
Настоящее изобретение относится к монофазным фармацевтическим композициям, содержащим конъюгированный эстроген и гидрофильный или липофильный эксципиент. Настоящее изобретение также относится к наборам и аппликаторам, содержащим эти фармацевтические композиции. Изобретение также относится к способам лечения состояний при менопаузе у субъектов женского пола, включающим введение фармацевтических композиций.
Предпосылки изобретения
Уменьшение циркулирующих уровней эстрадиола происходит при старении яичников и сниженном развитии фолликулов и вызывает характерные для менопаузы симптомы (Bachmann, G.A. and Nevadunsky, N.S., Am. Fam. Phys. 67:3090-3096 (2000); Beers, M.R. and Berkow, R., eds., "Gynecology and Abstetrics", в The Merck Manual of Diagnosis and Therapy, 17th Edition, Merck Research Laboratories, Whitehouse Station, NJ, 1942-1944 (1999)). Общие симптомы включают приливы, нерегулярность менструаций, ночную потливость, озноб, бессонницу, парестезии, учащенное сердцебиение, тахикардию, холодные руки и подошвы, головную боль, тревожность, головокружения, повышенную возбудимость, депрессию, раздражительность, ослабленную когнитивную функцию, сниженное либидо, утомляемость, желудочно-кишечные симптомы и атрофический вагинит (Bachmann, G.A. and Nevadunsky, N.S., Am. Fam. Phys. 67:3090-3096 (2000); Beers, M.R. and Berkow, R., eds., "Gynecology and Abstetrics", в The Merck Manual of Diagnosis and Therapy, 17th Edition, Merck Research Laboratories, Whitehouse Station, NJ, 1942-1944 (1999); Semmens, J.P. and Wagner, G., J. Am. Med. Assoc. 248:445-448 (1982); Bachmann, G.A., Maturitas 22 (Suppl.):S1-S5 (1995); Greendale, G.A. and Judd, H.L., J. Am. Geriatr. Soc. 41:426-436 (1993); Nilsson, K., et al, Maturitas 21:51-56 (1995)). Симптомы часто являются достаточно тяжелыми, чтобы заставить женщину искать способ лечения, и они могут продолжаться в течение нескольких лет в течение перименопаузы и/или постменопаузы.
Недостаточность эстрогена вызывает глубокие изменения в мочеполовом тракте, и до 40% женщин после менопаузы имеют симптомы, ассоциированные с этими изменениями (Greendale, G.A. and Judd, H.L., J. Am. Geriatr. Soc. 41:426-436 (1993)). Отсутствие влагалищной смазки и частые вагинальные инфекции присутствуют более чем у 50% женщин после менопаузы (Rosen, R., et al, J. Sex & Marital Therapy iP:171-188 (1993); Bachmann, G.A., Maturitas 22 (Suppl.):S1-S5 (1995)). Слизистая влагалища и кожа половых органов истончается, малые половые губы разглаживаются и уменьшаются, и клитор, матка и яичники уменьшаются в размере (Beers, M.R. and Berkow, R., eds., "Gynecology and Abstetrics", в The Merck Manual of Diagnosis and Therapy, 17th Edition, Merck Research Laboratories, Whitehouse Station, NJ (1999), pp. 1942-1944). pH влагалища увеличивается от нормальных 3,5-4,0 (что благоприятствует лактобациллам) до 6,0-8,0 (что благоприятствует патогенным организмам) (Pandit, L. and Ouslander, J.G., Am. J. Med. Set 3/4:228-231 (1997); Semmens, J.P. and Wagner, G., J. Am. Med. Assoc. 248:445-448 (1982)). Снижение тонуса тазовых мышц приводит к изменению частоты, неотложности мочеиспускания и недержанию (Bachmann, G.A., Maturitas 22 (Suppl.):S1-S5 (1995)). Эндоцервикальная железистая ткань становится менее активной и снижается секреция слизи (Bachmann, G.A., Maturitas 22 (Suppl.):S1-S5 (1995)). Вагинальный эпителий становится сухим и атрофичным, что вызывает воспаление, дискомфорт, зуд и диспареунию. Влагалище становится менее растяжимым и эластичным и легко травмируется (Bachmann, G.A. and Nevadunsky, N.S., Am. Fam. Phys. 61:3090-3096 (2000)). Цитологическое исследование слизистой влагалища показывает увеличенную долю парабазальных клеток и уменьшенную долю поверхностных клеток; например, рассчитанный показатель индекса созревания <55 (Pandit, L. and Ouslander, J.G., Am. J. Med. Sci. 314:228-231 (1997); Bachmann, G.A. and Nevadunsky, N.S., Am. Fam. Phys. 61:3090-3096 (2000); Nilsson, K., et al., Maturitas 21:51-56 (1995)). Влагалищное ультразвуковое исследование слизистой оболочки матки, как правило, демонстрирует истончение эндометрия до ≤5 мм, что означает уменьшенную стимуляцию эстрогеном (Osmers, R., et al., Lancet 335:1569-1571 (1990)).
Терапия эстрогеном (ET) или гормональная терапия (HT), если она не противопоказана, представляет собой лечение выбора для женщин после менопаузы с атрофией мочеполового тракта (Willhite, L.A. and O'Connell, M.B., Pharmacotherapy 21:464-480 (2001); Rigg., L.A., Int. J. Fertil. 31:29-34 (1986)). Показано, что различные формы HT эффективно справляются с признаками и симптомами менопаузы, включая признаки и симптомы, ассоциированные с атрофией влагалища (Cardozo, I., et al., Obstet. Gynocol. 92:122-121 (1988); Beers, M.R. and Berkow, R., eds., "Gynecology and Abstetrics", в The Merck Manual of Diagnosis and Therapy, 17th Edition, Merck Research Laboratories, Whitehouse Station, NJ, 1942-1944 (1999); Greendale, G.A. and Judd, H.L., J. Am. Geriatr. Soc. 41:426-436 (1993); Semmens, J.P. and Wagner, G., J. Am. Med. Assoc. 245:445-448 (1982); Bachmann, G.A., Maturitas 22 (Suppl.):S1-S5 (1995); Bachmann, G.A. and Nevadunsky, N.S., Am. Fam. Phys. 67:3090-3096 (2000); Nilsson, K., et al, Maturitas 21:51-56 (1995); Osmers, R., et al., Lancet 335:1569-1571 (1990); Rigg., L.A., Int. J. Fertil. 31:29-34 (1986); Marx, P., et al., Maturitas 47:47-54 (2004)). Терапия эстрогеном снижает pH влагалища (Bachmann, G.A. and Nevadunsky, N.S., Am. Fam. Phys. 67:3090-3096 (2000)), утолщает и реваскуляризирует вагинальный эпителий (Bachmann, G.A. and Nevadunsky, N.S., Am. Fam. Phys. 67:3090-3096 (2000)), увеличивает количество поверхностных клеток (тем самым увеличивая индекс созревания) (Pandit, L. and Ouslander, J.G., Am. J. Med. Sci. 314:228-231 (1997)) и быстро обращает атрофию влагалища (Bachmann, G.A. and Nevadunsky, N.S., Am. Fam. Phys. 61:3090-3096 (2000)).
Известен ряд схем лечения для заместительной терапии эстрогеном, хотя многие из этих схем включают пероральное или трансдермальное введение эстрогенов. Например, показано, что введение конъюгированных эстрогенов лошади, эстрадиола и вагинальных кремов с эстриолом восстанавливает цитологические характеристики влагалища до предклимактерического состояния и улучшают состояние атрофии мочеполового тракта (Willhite, L.A. and O'Connell, M.B., Pharmacotherapy 21:464-480 (2001)). Предложено циклическое введение конъюгированных эстрогенов ежедневно в течение трех недель с последующей неделей без введения (вкладыш в упаковку вагинального крема "Премарин" (Premarin), проверенный 28 апреля 2004 года, Wyeth Pharmaceuticals, Inc., Philadelphia, PA). Однако результаты исследования Women's Health Initiative (WHI) привели к рекомендациям FDA, чтобы проходящих терапию эстрогеном женщин подвергали воздействию меньшей эффективной дозы в течение более короткого лечения (Hulley and Grady, J. Am. Med. Assoc. 291:1769-71 (2004)). Таким образом, применение режима с менее частым дозированием для проводимой локально заместительной терапии эстрогеном представляет конкретный интерес.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к аппликатору, содержащему единичную однократную дозу монофазной фармацевтической композиции, содержащей конъюгированный эстроген и гидрофильный или липофильный эксципиент, где вязкость композиции составляет больше чем приблизительно 1 Пуаз и менее чем приблизительно 30000 Пуаз.
В некоторых вариантах осуществления конъюгированный эстроген включает два или более конъюгированных эстрогена.
В некоторых вариантах осуществления конъюгированный эстроген включает эстронсульфат натрия, эквилинсульфат натрия, 17α-дигидроэквилинсульфат натрия, 17β-дигидроэквилинсульфат натрия, 17α-эстрадиолсульфат натрия, 17β-эстрадиолсульфат натрия, эквиленинсульфат натрия, 17α-дигидроэквиленинсульфат натрия, 17β-дигидроэквиленинсульфат натрия или их сочетание.
В некоторых вариантах осуществления конъюгированный эстроген включает эстронсульфат натрия, эквилинсульфат натрия, 17α-дигидроэквилинсульфат натрия, 17β-дигидроэквилинсульфат натрия, 17α-эстрадиолсульфат натрия, 17β-эстрадиолсульфат натрия, эквиленинсульфат натрия, 17α-дигидроэквиленинсульфат натрия, 17β-дигидроэквиленинсульфат натрия, Δ8,9-дегидроэстронсульфат натрия или их сочетание.
В некоторых вариантах осуществления конъюгированный эстроген состоит из сочетания эстронсульфата натрия, эквилинсульфата натрия, 17α-дигидроэквилинсульфата натрия, 17β-дигидроэквилинсульфата натрия, 17α-эстрадиолсульфата натрия, 17β-эстрадиолсульфата натрия, эквиленинсульфата натрия, 17α-дигидроэквиленинсульфата натрия и 17β-дигидроэквиленинсульфата натрия.
В некоторых вариантах осуществления конъюгированный эстроген состоит из сочетания эстронсульфата натрия, эквилинсульфата натрия, 17α-дигидроэквилинсульфата натрия, 17β-дигидроэквилинсульфата натрия, 17α-эстрадиолсульфата натрия, 17β-эстрадиолсульфата натрия, эквиленинсульфата натрия, 17α-дигидроэквиленинсульфата натрия, 17β-дигидроэквиленинсульфата натрия и Δ8,9-дегидроэстронсульфата натрия.
В некоторых вариантах осуществления композиция содержит гидрофильную фазу. В дополнительных вариантах осуществления композиция содержит фармацевтически приемлемый гидрофильный эксципиент, выбранный из группы, состоящей из воды, глицерина, пропиленгликоля, полиэтиленгликоля, полиола, спирта и их сочетание.
В некоторых вариантах осуществления композиция содержит липофильную фазу. В дополнительных вариантах осуществления композиция содержит фармацевтически приемлемый липофильный эксципиент, выбранный из группы, состоящей из сложных эфиров глицерина и жирных кислот, моноглицеридов, диглицеридов, триглицеридов и их сочетаний. В некоторых вариантах осуществления композиция содержит сложные эфиры глицерина и жирных кислот с длиной углеродной цепи от 4 до 24 атомов и их сочетания. В некоторых вариантах осуществления композиция содержит фармацевтически приемлемый липофильный эксципиент, выбранный из группы, состоящей из лауриновой кислоты, пальмитиновой кислоты, олеиновой кислоты, линолевой кислоты, линоленовой кислоты, стеариновой кислоты, миристиновой кислоты и их сочетаний.
В некоторых вариантах осуществления композиция содержит фармацевтически приемлемый эксципиент, выбранный из группы, состоящей из щелочного средства, стабилизатора, связывающего средства, растворителя, поверхностно-активного вещества, увлажнителя, буферного средства и их сочетаний.
В некоторых вариантах осуществления композиция содержит фармацевтически приемлемый эксципиент, где эксципиент представляет собой щелочное средство. Щелочное средство может представлять собой неорганическое основание, выбранное из группы, состоящей из гидроксидов и оксидов щелочных металлов, щелочноземельных металлов и их сочетаний. Щелочное средство может представлять собой органическое основание, содержащее амин.
В некоторых вариантах осуществления композиция содержит фармацевтически приемлемый эксципиент, где эксципиент представляет собой стабилизатор. Стабилизатор можно выбирать из группы, состоящей из метилпарабена, пропилпарабена, трет-бутилгидрохинона, бутилированного гидроксианизола, бутилированного гидрокситолуола, аскорбиновой кислоты и ее сложных эфиров, витамина E и его сложных эфиров, бисульфита натрия, метабисульфита натрия, 3-дегидрошикимовой кислоты, токоферолов и их сложных эфиров, алкилгаллатов, хелатирующих средств, ЭДТА, динатриевой соли этилендиаминтетрауксусной кислоты, лимонной кислоты, бензилового спирта и их сочетаний.
В некоторых вариантах осуществления композиция содержит фармацевтически приемлемый эксципиент, где эксципиент представляет собой связывающее средство. Связывающее средство можно выбирать из группы, состоящей из гидрогенизированного растительного масла, полиэтиленгликоля, цетилового спирта, воска из сложных цетиловых эфиров, микрокристаллического воска, парафина, этилового спирта, стеарилового спирта, лаурилового спирта, миристилового спирта, цетостеарилового спирта, белого воска, желтого воска, пчелиного воска, канделильского воска, хлопкового воска, карнаубского воска, воска гвоздичного перца, воска из рисовых отрубей, карбомера, гидроксипропилметилцеллюлозы, гипромеллозы, крахмала, метилцеллюлозы, микрокристаллической целлюлозы и их сочетаний.
В некоторых вариантах осуществления композиция содержит фармацевтически приемлемый эксципиент, где эксципиент представляет собой растворитель. Растворитель можно выбирать из группы, состоящей из воды, глицерина, абсолютного спирта, сложных эфиров глицерина и жирных кислот, лаурилмакроглицеридов, сложных эфиров полиоксиэтиленалкилов и их сочетаний.
В некоторых вариантах осуществления композиция содержит фармацевтически приемлемый эксципиент, где эксципиент представляет собой поверхностно-активное вещество. Поверхностно-активное вещество можно выбирать из группы, состоящей из лаурилсульфата натрия, полисорбата 80, полоксамера, лаурилмакроголглицеридов, эфиров полиоксиэтиленалкилов и их сочетаний.
В некоторых вариантах осуществления композиция содержит фармацевтически приемлемый эксципиент, где эксципиент представляет собой увлажнитель. Увлажнитель можно выбирать из группы, состоящей из полиэтиленгликоля, пропиленгликоля, глицерина, полиола, производных полиолов и их сочетаний.
В некоторых вариантах осуществления композиция содержит фармацевтически приемлемый эксципиент, где эксципиент представляет собой буферное средство. Буферное средство можно выбирать из группы, состоящей из буферов Tris, Tris-ЭДТА, Tris-ацетата, Tris-фосфата, Tris-глицина, фосфатных буферов, фосфата натрия, двухосновного фосфата натрия, фосфат калия, бикарбонатных буферов, ацетатных буферов, аммонийных буферов, цитратных буферов, буферов на основе органических кислот, цвиттер-ионных буферов и их производных и сочетаний.
В некоторых вариантах осуществления композиция по существу не содержит этанола.
В некоторых вариантах осуществления композиция содержит конъюгированный эстроген в единичной однократной дозе, где конъюгированный эстроген находится в количестве приблизительно от 0,1 мг до приблизительно 10 мг. В некоторых вариантах осуществления композиция представляет собой единичную однократную дозу в количестве приблизительно от 100 мг до приблизительно 5 г. В некоторых вариантах осуществления композиция содержит конъюгированный эстроген в единичной однократной дозе, где конъюгированный эстроген находится в количестве приблизительно от 0,1 мг до приблизительно 10 мг, где общая масса композиции составляет приблизительно от 100 мг до приблизительно 5 г.
В некоторых вариантах осуществления композиция содержит конъюгированный эстроген в концентрированной единичной стандартной лекарственной форме, где конъюгированный эстроген находится в количестве приблизительно от 0,02% до приблизительно 5% от общей массы композиции.
В некоторых вариантах осуществления композиция содержит конъюгированный эстроген в концентрированной единичной стандартной лекарственной форме, где конъюгированный эстроген находится в количестве приблизительно от 1 мг до приблизительно 10 мг от общей композиции. В некоторых вариантах осуществления композиция представляет собой единичную однократную дозу в количестве приблизительно от 100 мг до приблизительно 2 г. В некоторых вариантах осуществления композиция содержит конъюгированный эстроген в концентрированной единичной стандартной лекарственной форме, где конъюгированный эстроген находится в количестве приблизительно от 1 мг до приблизительно 10 мг от общей композиции, где общая масса композиции составляет приблизительно от 100 мг до приблизительно 2 г.
Настоящее изобретение дополнительно относится к монофазной фармацевтической композиции, содержащей конъюгированный эстроген и липофильный или гидрофильный эксципиент, где вязкость композиции составляет больше чем приблизительно 1 Пуаз и меньше чем приблизительно 30000 Пуаз и где композиция способна покрывать приблизительно до 90% от рассчитанной площади поверхности влагалища человека.
Настоящее изобретение дополнительно относится к монофазной фармацевтической композиции, содержащей конъюгированный эстроген и липофильный или гидрофильный эксципиент, где вязкость композиции составляет больше чем приблизительно 1 Пуаз и меньше чем приблизительно 30000 Пуаз и где диффузия эстрона или эквилина из композиции через целлюлозоацетатную мембрану составляет приблизительно от 60% до приблизительно 90% за 6 часов.
Настоящее изобретение дополнительно относится к монофазной фармацевтической композиции, содержащей конъюгированный эстроген и липофильный или гидрофильный эксципиент, где вязкость композиции составляет больше чем приблизительно 1 Пуаз и меньше чем приблизительно 30000 Пуаз и где диффузия эстрона или эквилина из композиции через ткань влагалища человека составляет приблизительно от 30% до приблизительно 90% за 24 часа.
Настоящее изобретение дополнительно относится к набору, содержащему один или несколько аппликаторов, где каждый аппликатор содержит единичную однократную дозу монофазной фармацевтической композиции, содержащей конъюгированный эстроген и липофильный или гидрофильный эксципиент, где вязкость композиции составляет больше чем приблизительно 1 Пуаз и меньше чем приблизительно 30000 Пуаз.
В некоторых вариантах осуществления набор содержит вагинальный аппликатор.
В некоторых вариантах осуществления набор содержит пероральный аппликатор.
В некоторых вариантах осуществления набор дополнительно содержит инструкцию по применению набора.
Настоящее изобретение дополнительно относится к вагинальному аппликатору, содержащему единичную однократную дозу монофазной фармацевтической композиции, содержащей конъюгированный эстроген и липофильный или гидрофильный эксципиент, где вязкость композиции составляет больше чем приблизительно 1 Пуаз и меньше чем приблизительно 30000 Пуаз.
Настоящее изобретение дополнительно относится к пероральному аппликатору, содержащему единичную однократную дозу монофазной фармацевтической композиции, содержащей конъюгированный эстроген и липофильный или гидрофильный эксципиент, где вязкость композиции составляет больше чем приблизительно 1 Пуаз и меньше чем приблизительно 30000 Пуаз. В дополнительных вариантах осуществления пероральный аппликатор наносит композицию в виде спрея.
Настоящее изобретение дополнительно относится к способу лечения патологического состояния при менопаузе у нуждающихся в этом субъектов женского пола, где способ включает введение субъекту женского пола единичной однократной дозы монофазной фармацевтической композиции, содержащей конъюгированный эстроген и липофильный или гидрофильный эксципиент, где вязкость композиции составляет больше чем приблизительно 1 Пуаз и меньше чем приблизительно 30000 Пуаз.
В некоторых вариантах осуществления способ дополнительно включает введение через слизистые.
В некоторых вариантах осуществления композицию вводят, по меньшей мере, один раз в сутки в течение, по меньшей мере, 2 последующих дней.
В некоторых вариантах осуществления композицию вводят, по меньшей мере, один раз в сутки в течение, по меньшей мере, 7 последующих дней.
В некоторых вариантах осуществления композицию вводят, по меньшей мере, дважды в неделю в течение, по меньшей мере, 1 недели.
В некоторых вариантах осуществления композицию вводят, по меньшей мере, дважды в неделю в течение, по меньшей мере, 2 недель.
В некоторых вариантах осуществления композицию вводят (a), по меньшей мере, один раз в сутки в течение, по меньшей мере, 7 последующих дней, а затем (b), по меньшей мере, дважды в неделю в течение, по меньшей мере, 2 недель.
В некоторых вариантах осуществления композицию вводят (a), по меньшей мере, один раз в сутки в течение срока от 2 до 13 последующих дней, а затем (b), по меньшей мере, дважды в неделю в течение, по меньшей мере, 2 недель.
В некоторых вариантах осуществления патологическое состояние при менопаузе выбрано из группы, состоящей из сухости влагалища, боли при половом контакте, увеличенного риска инфекций, неспособности контролировать мочеиспускание (недержание), увеличенной частоты инфекций мочевых путей, атрофии влагалища, крауроза наружных половых органов, приливов и ночной потливости, утомляемости, эмоциональных изменений (перепадов настроения и изменений в половом влечении), нарушений сна (бессонницы), сухости кожи и волос, увеличенного роста волос на лице и теле, ломоты и боли в суставах, головных болей, учащенного сердцебиения (быстрых нерегулярных сердечных сокращений), влагалищного зуда, остеопороза и общего зуда.
В некоторых вариантах осуществления способ обеспечивает системное лечение патологического состояния при менопаузе.
Настоящее изобретение дополнительно относится к способу доставки нуждающемуся в этом субъекту женского пола аппликатора, содержащего единичную одноразовую дозу монофазной фармацевтической композиции, содержащей конъюгированный эстроген и липофильный или гидрофильный эксципиент, где вязкость композиции составляет больше чем приблизительно 1 Пуаз и меньше чем приблизительно 30000 Пуаз, где способ включает: (a) регистрацию в читаемом компьютером носителе информации удостоверения доктора, допущенного к выписке аппликатора; (b) предоставление женщине консультативной информации относительно риска связанного с аппликатором; (c) получение информированного согласия женщины на получение композиции, несмотря на риск; (d) регистрацию женщины в читаемом компьютером носителе после получения информированного согласия и (e) разрешение женщине допуска к аппликатору.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
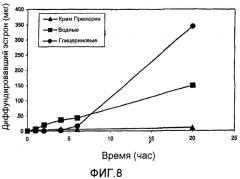
На фиг. 1 показаны профили стабильности эстрона (фиг. 1A) и эквилина (фиг. 1B) в течение четырех недель при 60°C в водных (▲), глицериновых (■) и основанных на Gelucire® (●) препаратах, содержащие конъюгированные эстрогены, USP (тип DE, 525 мг/г).
На фиг. 2 показаны профили стабильности суммы эстрона + эквилина + 17α-дигидроэквилина (фиг. 2A) и эквиленина (фиг. 2B) в течение четырех недель при 60°C в водных (▲), глицериновых (■) и основанных на Gelucire® (●) препаратах, содержащих конъюгированные эстрогены, USP (тип DE, 525 мг/г).
На фиг. 3 показаны профили стабильности эстрона (фиг. 3A) и эквилина (фиг. 3B) в течение четырех недель при 60°C в водных (▲), глицериновых (■) и основанных на Gelucire® (●) препаратах, содержащих конъюгированные эстрогены (37,5 мг/г).
На фиг. 4 показаны профили стабильности суммы эстрона + эквилина + 17α-дигидроэквилина (фиг. 4A) и эквиленина (фиг. 4B) в течение четырех недель при 60°C в водных (▲), глицериновых (■) и основанных на Gelucire® (●) препаратах, содержащих конъюгированные эстрогены (37,5 мг/г).
На фиг. 5 показана диффузия эстрона (фиг. 5 A) и эквилина (фиг. 5B) in vitro через целлюлозоацетатные мембраны для водных (♦) и глицериновых (■) препаратов, содержащих конъюгированные эстрогены (37,5 мг/г).
На фиг. 6 представлена диаграмма способа измерения диффузии препаратов конъюгированных эстрогенов in vitro через нормальную вагинальную эктоцервикальную ткань человека.
На фиг. 7 показана диффузия эстрона in vitro через нормальную вагинальную эктоцервикальную ткань человека глицериновых (♦) препаратов, содержащих конъюгированные эстрогены (37,5 мг/г), по сравнению с кремом премарин (Premarin®) (▲).
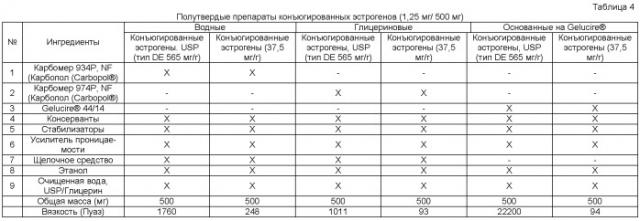
На фиг. 8 показана диффузия эстрона in vitro через нормальную вагинальную эктоцервикальную ткань человека водных (■) и глицериновых (●) препаратов, содержащих конъюгированные эстрогены, USP (тип DE, 525 мг/г), по сравнению с кремом премарин (Premarin®) (▲).
На фиг. 9 представлена блок-схема способа получения водных, глицериновых и основанных на Gelucire® препаратов конъюгированных эстрогенов, полученных из конъюгированных эстрогенов, USP (тип DE, 525 мг/г).
На фиг. 10 показана диффузия эстрона in vitro через нормальную вагинальную эктоцервикальную ткань человека водных (▲), глицериновых (●) и основанных на Gelucire® (X) не содержащих этанол препаратов, полученных из конъюгированных эстрогенов, USP (тип DE, 525 мг/г) по сравнению с глицериновым (□) содержащим этанол препаратом, полученным из конъюгированных эстрогенов, USP (тип DE, 525 мг/г), стандартным раствором эстрона (●) и кремом премарин (Premarin®) (■).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Фармацевтические композиции
Настоящее изобретение относится к аппликаторам, монофазным фармацевтическим композициям и наборам, содержащим конъюгированный эстроген и гидрофильный или липофильный эксципиент, и способам их применения. Описанные варианты осуществления и определения предназначены для иллюстрации изобретения и не предназначены для ограничения объема изобретения. В некоторых вариантах осуществления настоящее изобретение относится к монофазным фармацевтическим композициям, содержащим два или более конъюгированных эстрогена и липофильный или гидрофильный эксципиент. В некоторых вариантах осуществления, по меньшей мере, часть, по меньшей мере, одного конъюгированного эстрогена находится в композиции в молекулярной дисперсии.
Как описано в настоящем документе, "монофазные" композиции представляют собой композиции, полученные из одной жидкой фазы. Специалист в данной области легко поймет, что композицию можно получать из жидкой фазы с ограничением подвижности жидкой фазы компонентами, увеличивающими вязкость или густоту композиции. В некоторых вариантах осуществления единственная жидкая фаза содержит одну или несколько жидкостей, которые являются липофильными. В некоторых вариантах осуществления единственная жидкая фаза содержит одну или несколько жидкостей, которые являются гидрофильными. В некоторых вариантах осуществления единственная жидкая фаза содержит одну или несколько жидкостей, которые являются амфифильными. В некоторых вариантах осуществления единственная жидкая фаза содержит одну или несколько жидкостей, которые являются сочетанием гидрофильных, липофильных и амфифильных жидкостей, которые дают единственную жидкую фазу. Кремы (например, премарин (Premarin®), вагинальный крем с конъюгированными эстрогенами лошади), содержащие, по меньшей мере, две отдельных жидких фазы, такие как масляная фаза и водная фаза, не являются "монофазными", как указано в настоящем документе. Точнее, такие кремы представляют собой двухфазные системы, в которых лекарственное средство диспергировано в одной фазе (как правило, в водной фазе), а эксципиенты диспергированы в другой фазе (как правило, в масляной фазе). Это требует получения двух раздельных фаз и использования эмульгаторов для смешивания несмешивающихся фаз в одну композицию (эмульсию). Фазы в эмульсии, которая часто нестабильна при изменении температуры или других физических параметров, остаются физически и химически обособленными. В отличие от эмульсий, монофазные системы содержат совместимые компоненты в одной фазе. Как применяют в настоящем документе, термин "монофазный" также охватывает растворы или суспензии, в которых компоненты диспергированы в пределах единственной жидкой фазы. В некоторых вариантах осуществления монофазные композиции, описываемые в настоящем документе, могут содержать молекулярную дисперсию (истинный раствор) одного или нескольких компонентов. В некоторых вариантах осуществления монофазные композиции, описываемые в настоящем документе, могут содержать молекулярную дисперсию, по меньшей мере, части одного или нескольких компонентов. Таким образом, в молекулярной дисперсии может находиться часть, а не все количество конкретного компонента. В некоторых вариантах осуществления монофазные композиции, описываемые в настоящем документе, содержат молекулярную дисперсию, по меньшей мере, части, по меньшей мере, одного конъюгированного эстрогена. В некоторых вариантах осуществления монофазные композиции, описываемые в настоящем документе, могут содержать одну или несколько коллоидных дисперсий или грубых дисперсий, в зависимости от размера частиц диспергированных компонентов, как понятно специалисту в данной области. В некоторых вариантах осуществления монофазные композиции, описываемые в настоящем документе, могут содержать любое сочетание молекулярных, коллоидных и грубых дисперсий. В некоторых вариантах осуществления монофазные композиции, описываемые в настоящем документе, могут содержать в виде любого сочетания молекулярных, коллоидных и грубых дисперсий конкретный компонент. Компоненты, диспергированные в монофазной композиции, могут быть липофильными, гидрофильными, амфифильными или их сочетанием.
В некоторых вариантах осуществления для улучшения удержания композиций в участках применения можно регулировать вязкость композиций. Вязкость можно регулировать известными в данной области эксципиентами, включая связывающие средства, как описано в настоящем документе. В некоторых вариантах осуществления вязкость может быть большей, чем приблизительно 1,0 Пуаз (пЗ), и меньшей, чем приблизительно 30000 пЗ. В некоторых вариантах осуществления вязкость композиции в участках применения может быть большей, чем приблизительно 1,0, и меньшей, чем приблизительно 20000 пЗ. В некоторых вариантах осуществления вязкость композиции в участках применения может быть большей, чем приблизительно 2,5, и меньшей, чем приблизительно 10000 пз. В некоторых вариантах осуществления вязкость композиции в участках применения может быть большей, чем приблизительно 10, и меньшей, чем приблизительно 5000 пз. В некоторых вариантах осуществления вязкость композиции в участках применения может быть большей, чем приблизительно 50, и меньшей, чем приблизительно 30000 пз. В некоторых вариантах осуществления вязкость композиции в участках применения может быть большей, чем приблизительно 50, и меньшей, чем приблизительно 2500 пз. В некоторых вариантах осуществления вязкость композиции в участках применения может быть большей, чем приблизительно 50, и меньшей, чем приблизительно 2000 пз. В некоторых вариантах осуществления вязкость композиции в участках применения может быть большей, чем приблизительно 90, и меньшей, чем приблизительно 30000 пз. В некоторых вариантах осуществления вязкость композиции в участках применения может быть большей, чем приблизительно 90, и меньшей, чем приблизительно 2500 пз. В некоторых вариантах осуществления вязкость композиции в участках применения может быть большей, чем приблизительно 90, и меньшей, чем приблизительно 2000 пз. В некоторых вариантах осуществления вязкость композиции в участках применения может быть большей, чем приблизительно 25,0, и меньшей, чем приблизительно 2000 пз. В некоторых вариантах осуществления вязкость композиции в участках применения может быть большей, чем приблизительно 500, и меньшей, чем приблизительно 2000 пз.
В некоторых вариантах осуществления композиции по настоящему изобретению являются биоадгезивными с продленным удержанием в участке применения. В некоторых вариантах осуществления композиции являются биоадгезивными, с продленным удержанием при вагинальном применении. В дополнительных вариантах осуществления композиции применяют вагинально с большей легкостью, с меньшим просачиванием. В некоторых вариантах осуществления композиции применяют вагинально, и они сопровождаются большим комфортом вследствие меньшего просачивания. В некоторых вариантах осуществления композиции сопровождаются большим комфортом вследствие успокаивающего и смягчающего эффекта. В некоторых вариантах осуществления композиции позволяют лучшее соблюдение пациентом схемы лечения при предписанных процедурах введения вследствие большего комфорта.
В некоторых вариантах осуществления композиции демонстрируют улучшенную растекаемость по сравнению с существующими препаратами. В некоторых вариантах осуществления растекаемость измеряют как процент области распределения по поверхности (% распределения) композиций по сравнению с площадью поверхности участка введения. В некоторых вариантах осуществления растекаемость измеряют посредством % распределения композиций по сравнению с рассчитанной площадью поверхности влагалища человека. В некоторых вариантах осуществления композиции способны к % растекания приблизительно до 90% рассчитанной площади поверхности влагалища человека. В некоторых вариантах осуществления композиции способны к % распределения по поверхности приблизительно до 80% рассчитанной площади поверхности влагалища человека. В некоторых вариантах осуществления композиции способны к % распределения приблизительно до 70%, 71% или 72% рассчитанной площади поверхности влагалища человека. В некоторых вариантах осуществления продленное удерживание, биоадгезивность, увеличенный комфорт и сочетания этих характеристик связаны с % распределения композиций.
В некоторых вариантах осуществления композиции демонстрируют физическую стабильность, определяемую характеристиками, включающими в качестве неограничивающих примеров, внешний вид, pH и вязкость при повышенной температуре и/или повышенной влажности в течение длительных периодов времени. В некоторых вариантах осуществления композиции демонстрируют химическую стабильность, определяемую характеристиками, включающими в качестве неограничивающих примеров химическую стабильность конъюгированных эстрогенов при повышенной температуре и/или повышенной влажности. В некоторых вариантах осуществления химическую стабильность конъюгированных эстрогенов в композициях определяют отношением эквилина к эстрону. В некоторых вариантах осуществления отношение эквилина к эстрону в композициях остается по существу постоянным при повышенной температуре и/или повышенной влажности. В некоторых вариантах осуществления физическая стабильность и/или химическая стабильность композиций при повышенной температуре и/или повышенной влажности показана в течение периода времени, большего, чем один год. В некоторых вариантах осуществления физическая стабильность и/или химическая стабильность композиций при повышенной температуре и/или повышенной влажности показана в течение периода времени длительностью один год. В некоторых вариантах осуществления физическая стабильность и/или химическая стабильность композиций при повышенной температуре и/или повышенной влажности показана в течение периода времени длительностью 6 месяцев. В некоторых вариантах осуществления физическая стабильность и/или химическая стабильность композиций при повышенной температуре и/или повышенной влажности показана в течение периода времени длительностью 3 месяца. В некоторых вариантах осуществления физическая стабильность и/или химическая стабильность композиций при повышенной температуре и/или повышенной влажности показана в течение периода времени длительностью один месяц. В некоторых вариантах осуществления физическая стабильность и/или химическая стабильность композиций при повышенной температуре и/или повышенной влажности показана в течение периода времени одной, двух, трех или четырех недель. В некоторых вариантах осуществления физическую стабильность и/или химическую стабильность композиций измеряют при 60°C. В некоторых вариантах осуществления физическую стабильность и/или химическую стабильность композиций измеряют при 40°C и 75% относительной влажности.
В диапазоне композиций, описываемых в настоящем документе, можно использовать различные конъюгированные эстрогены. Эстроген представляет собой любой из различных природных стероидов или синтетических стероидов, который стимулирует развитие вторичных женских половых признаков и стимулирует рост и поддержание женской репродуктивной системы; или любое другое соединение, имитирующее физиологическое действие природных эстрогенов. Примеры эстрогенов приведены в патентах США №5908638, 6855703 и 6660726, которые в общем переданы правопреемнику настоящего изобретения, описания которых полностью включены в настоящий документ в качестве ссылки. Подходящие эстрогены включают эстрон, 17α-эстрадиол, 17β-эстрадиол, эквилин, 17α-дигидроэквилин, 17β-дигидроэквилин, эквиленин, 17α-дигидроэквиленин, 17β-дигидроэквиленин, Δ8,9-дегидроэстрон, 17α-Δ8,9-дегидроэстрадиол, 17β-Δ8,9-дегидроэстрадиол, этинилэстрадиол, валерат эстрадиола, 6-OH-эквиленин, 6-OH-17α-дигидроэквиленин, 6-OH-17β-дигидроэквиленин и их смеси и соли и кетоны эстрогенов и их соответствующие 17α- и 17β-гидрокси производные. Как описано в настоящем документе, термин "конъюгированный" относится к различным конъюгатам, известным специалистам в данной области, включая в качестве неограничивающих примеров, сложные сульфатные эфиры, сложные глюкуронидные эфиры или смешанные сульфатные глюкуронидные сложные эфиры эстрогена. В некоторых вариантах осуществления эстрогены присутствуют в виде солей конъюгатов эстрогенов. Фармацевтически пригодные соли могут представлять собой различные соли, известные специалистам в данной области, включая в качестве неограничивающих примеров натриевые соли, кальциевые соли, магниевые соли, литиевые соли, пиперазиновые соли и 2-амино-2-(гидроксиметил)-1,3-пропандиоловые (Tris) соли.
В некоторых вариантах осуществления композиция по настоящему изобретению содержит конъюгированный эстроген, в качестве неограничивающих примеров, такой как эстронсульфат натрия, эквилинсульфат натрия, 17α-дигидроэквилинсульфат натрия, 17β-дигидроэквилинсульфат натрия, 17α-эстрадиолсульфат натрия, 17β-эстрадиолсуль