Применение ингибирующих tgf-бета1 пептидов для приготовления модулирующего иммунный ответ агента
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой применение пептида с SEQ ID NO:1 или SEQ ID NO:2 или их фрагментов, включая фрагменты с амидированием в положении р11 и фрагменты с ацетилированием в положении р1 и амидированием в положении р11, для приготовления фармацевтической композиции для лечения рака. Кроме того, данные пептиды применяются после иммунизации для защиты против роста опухоли. Также пептиды применяются в смеси для иммунизации с агентом для ингибирования гуморального иммунного ответа, для стимуляции антигенпрезентирующих клеток, а также в качестве адъюванта при вакцинации. 5 н. и 1 з.п. ф-лы, 16 ил., 3 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение включено в область приготовления модулирующих иммунный ответ агентов.
УРОВЕНЬ ТЕХНИКИ
TGF-β1 (трансформирующий фактор роста β1) является сильным иммуномодулятором, присутствующим на всех стадиях иммунного ответа, производящего различные эффекты. В настоящее время он известен в качестве сильного регулятора клеток иммунной системы, в том числе лимфоцитов, макрофагов и дендритных клеток (Letterio J.J., 1998).
Биологическая активность TGF-β1 сильно варьирует в зависимости от типа и стадии клеточной дифференциации, а также присутствия других цитокинов, что говорит о том, что изменение баланса этого набора цитокинов может также оказывать влияние на TGF-β1 и вносить вклад в развитие патологий, связанных с нарушением функции иммунной системы. TGF-β1 регулирует иммунный ответ сложным контекстнозависимым образом, выявленным с помощью использования экспериментальных моделей различных заболеваний, а также анализа генетически модифицированных мышей в отношении экспрессии TGF-β1, его рецепторов или регулирующих белков. TGF-β1 регулирует функцию и взаимодействие клеток иммунной системы при формировании гуморального, цитотоксического ответа и иммунологической толерантности и патологическое возникновение многих инфекционных и аутоиммунных заболеваний.
Т-лимфоциты, по-видимому, регулируются TGF-β1 на всех стадиях их развития (Fontana A. et al., 1992). Эффект TGF-β1 варьирует в соответствии со стадией дифференциации лимфоцита и типом сигнала активации, который он получил. В первых исследованиях эффекта TGF-β1 на лимфоциты человека обнаружена способность таких лимфоцитов продуцировать и секретировать TGF-β1 в качестве ингибитора зависимой от IL-2 пролиферации и цитолитической функции (Pardoux C. et al., 1997).
Дендритные клетки представляют собой популяцию лейкоцитов, дифференцирующихся, по-видимому, благодаря их функционированию в качестве антигенпрезентирующих клеток при активации ответов Т-лимфоцитов. Они являются высокоспециализированной клеточной популяцией, включающей эпидермальные клетки Лангерганса и фолликулярные дендритные клетки лимфатических узлов, причем TGF-β1 регулирует как их дифференциацию, так и их активность (Strobl H. Knapp W., 1999).
Установлено, что TGF-β1 усиливают in vitro функциональную дифференциацию дендритных клеток из предшественников CD34+, индуцированную присутствием других цитокинов (TNF-α, SCF и GM-CSF). TGF-β1 также увеличивает жизнеспособность дендритных клеток в культуре. С другой стороны, роль TGF-β1 для этого типа клеток также, по-видимому, связана с регуляторным механизмом, с помощью которого ингибируются ответы низкой специфичности для исключения аутоиммунных процессов.
При дифференциации, пролиферации В-клеток и продукции ими Ig (иммуноглобинов) TGF-β1 играет регуляторную роль через ингибирование уровней определенных поверхностных молекул, в том числе главного комплекса гистосовместимости типа II (MCH-II) как пре-В-лимфоцитов, так и зрелых В-клеток. С другой стороны, TGF-β1 ингибирует секрецию Ig в общем, но отчетливо индуцирует продукцию IgА, поэтому он выполняет важную роль в иммунном ответе, связанном с секретирующими слизь мембранами. Большинство исследований действия TGF-β1 в качестве ингибитора продукции всех типов Ig проводилось in vitro. Однако также была описана необходимость в культуре лимфоцитов определенных уровней TGF-β1, которые действуют на аутокринном уровне, для эффективной продукции IgG и IgE. Таким образом, функция TGF-β1 в индукции антител, как и во многих других процессах, является двойственной и противоположной в соответствии с контекстом иммунного ответа (Lebman D. A., Edmiston J.S., 1999).
В случае макрофагов действие TGF-β1 на тканевом уровне является, как правило, супрессивным и вносит вклад в окончательное формирование воспалительного ответа.
Вероятно, наиболее релевантное действие TGF-β1 на инактивацию макрофагов обусловлено его способностью ограничивать продукцию клетками, активированными IFN-γ или LPS, реагирующих с кислородом частиц и промежуточных продуктов метаболизма азота. Ферментом, ответственным за продукцию NO (оксида азота) активированными макрофагами, является индуцибельная форма фермента синтазы оксида азота (iNOS). Регуляция активности этого фермента различными цитокинами, в том числе TGF-β1, позволяет регулировать иммунный ответ в общем и, в частности, реакцию макрофагов на микроорганизмы и опухолевые клетки. TGF-β1 ингибирует фермент iNOS как на уровне транскрипции, уменьшая уровни мРНК, так и подавляя активность белка. TGF-β1 также ингибирует продукцию промежуточных реагирующих с кислородом частиц и окислительную цитотоксичность посредством инактивации макрофагов и контролирования моноцитов периферической крови (Ashcroft G.S., 1999).
Кроме того, активация или продукция TGF-β1, а также изменение его пути передачи сигнала описаны при многих заболеваниях, вызванных инфекцией различных микроорганизмов, в том числе Leishmania, Trypanosoma cruzi, вируса иммунодефицита человека, вируса гепатита С, …
Наиболее близкими к настоящему изобретению документами предшествующего уровня техники являются патент ES 2146552 и заявка на патент ES200302020. Первый документ относится к применению антагонистических в отношении соединения TGF-β1 с его рецепторами в организме пептидов, характеризующихся тем, что они имеют частичные аминокислотные последовательности, идентичные или схожие с последовательностями TGF-β1 и/или его рецепторов; а также к их применению для приготовления композиции, применимой при заболеваниях печени, в частности фиброзе печени. Этим документом защищен пептид р144 (SEQ ID NO:1), а также его упомянутое выше применение, хотя в нем нет упоминания о его применении для приготовления модулирующего иммунный ответ агента, являющегося целью настоящего изобретения.
Заявкой на патент ES200302020 защищаются ингибирующие биологическую активность TGF-β1-пептиды, полученные из библиотеки фагов, и их применение для лечения заболеваний, прогрессирующих при нарушении регуляции экспрессии TGF-β1, в частности фиброзных изменений. Этим документом защищен пептид р17 (SEQ ID NO:2) и указанное применение, но снова он не относится к его применению для приготовления имуномодулирующего агента.
Иммуномодулирующий иммунную систему эффект очень важен, поскольку он позволяет стимулировать или ингибировать различные аспекты иммунного ответа в соответствии с требованиями, и он даже может найти применение в качестве адъюванта при вакцинации.
Другим релевантным документом является заявка на патент WO 2005/059133A2, относящаяся к фармацевтической композиции, которая содержит по крайней мере один стимулятор функции иммунных клеток и по крайней мере одно вещество, ингибирующее пролиферацию клеток и/или индуцирующее гибель клеток. Антагонист TGF-β1, выбираемый из олигонуклеотидов, гибридизующихся с мРНК или ДНК, кодирующей TGF-β1, ингибирующих TGF-β1 белков и пептидов с молекулярной массой ниже 100 кДа, которые ингибируют TGF-β1, используется в качестве стимулятора функции иммунной системы. Кроме того, этот документ относится к применению указанной фармацевтической композиции для лечения опухолей. Тем не менее, в этом документе не применяется какой-либо пептид в качестве ингибитора TGF-β1 вместо олигонуклеотида, хотя и можно сделать вывод, что пептид с такими характеристиками будет иметь, в принципе, схожий эффект. Это невозможно подтвердить без значительного экспериментирования.
Ниже представлен список цитируемой в настоящей заявке литературы.
Ashcroft GS. (1999). Bidirectional regulation of macrophage function by TGF-beta. Microbes Infect. Dec; 1 (15): 1275-82.
Fontana A, Constam DB, Frei K, Malipiero U, Pfister HW. Modulation of the immune response by transforming growth factor beta. (1992) Int Arch Allergy Immunol.; 99(1): 1-7.
Lai M.Z., Ross D.T., Guillet J.G., Briner T.G., Gefter M.L., Smith J.A. (1987). T lymphocyte response to bacteriophage lambda repressor cl protein. Recognition of the same peptide present by la molecules of different haplotypes. J. Immunol 139, 3973-80.
Letterio J.J., Roberts A.B. (1998). Regulation of immune responses by TGF-beta. Annu Rev Immunol 16, 137-761.
Lebman DA, Edmiston JS. (1999). The role of TGF-beta in growth, differentiation and maturation of В lymphocytes. Microbes Infect. Dec; 1 (15): 1297-304.
Pardoux, C, Ma, X., Gobert, S., Pellegrini, S., Mayeux, P., Gay, F., Trinchieri, G., Chouaib, S. (1999). Downregulation of interleukin-12 (IL-12) responsiveness in human T cells by transforming growth factor-beta: relationship with IL-12 signaling. Blood 93, 1448-55.
Schini V.B., Durante W., Elizondo E., Scott-Burden Т., Junquero D.C., Schafer A.I., Vanhouette P.M. (1992). The induction of nitric oxide synthase activity is prohibited by TGF-beta 1, PDGFAB and PDGFBB in vascular smooth muscle cells. Eur J Pharmacol 216, 379-83.
Strobl H, Knapp W. (1999). TGF-beta1 regulation of dendritic cells. Microbes infect. Dec; 1 (15):1283-90.
Teicher B.A. (2001). Malignant cells, directors of the malignant process: Role of transforming: Role of transforming growth factor-beta. Cancer and Metastasis Reviews 20, 133-143.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для облегчения понимания текста настоящей заявки отмечается, что термин «пептид р144» относится к ингибирующему TGF-β1 пептиду, который отличается тем, что его аминокислотная последовательность соответствует последовательности, определенной в SEQ ID NO:1. Подобным образом термин «пептид р17» относится к ингибирующему активность TGF-β1 пептиду, который отличается тем, что его аминокислотная последовательность соответствует последовательности, определенной в SEQ ID NO:2.
«Неполный адъювант Фрейнда» относится к композиции, очень хорошо известной квалифицированному в данной области техники специалисту, которая характеризуется тем, что она состоит из эмульсии типа вода в масле, которая действует в качестве адъюванта, замедляющего высвобождение антигена.
Настоящее изобретение относится к модулирующему иммунный ответ агенту, отличающемуся тем, что он включает ингибирующий TGF-β1 пептид, выбираемый из пептида р144, последовательность которого соответствует SEQ ID NO:1, пептида р17, последовательность которого соответствует SEQ ID NO:2, пептида, гомологичного вышеуказанным пептидам на по крайней мере 90%, и их фрагментов. В конкретном варианте осуществления настоящего изобретения указанный фрагмент ингибирующего TGF-β1 пептида выбирают из фрагмента р17(1-11), определенного в последовательности SEQ ID NO:3, фрагмента р17(1-11)am, который соответствует SEQ ID NO:4, и фрагмента Acp17(1-11)am, определенного последовательностью SEQ ID NO:5.
С другой стороны, настоящее изобретение также относится к применению указанного модулирующего агента для регуляции гуморального или клеточного иммунных ответов или обоих ответов. В предпочтительном варианте осуществления настоящее изобретение относится к применению модулирующего агента в качестве адъюванта при вакцинации. В конкретном варианте осуществления настоящего изобретения модулирующий иммунный ответ агент отличается тем, что он дополнительно содержит неполный адъювант Фрейнда.
В предпочтительном варианте осуществления настоящее изобретение относится к применению указанного модулирующего агента для приготовления фармацевтической композиции для лечения патологий, выбираемых из патологий, связанных с микроорганизмами, которые индуцируют опосредуемую TGF-β1 иммуносупрессию, и рака. Предпочтительно указанные микроорганизмы выбраны из Leishmania, Trypanosoma cruzi, вируса иммунодефицита человека, вируса гриппа и вируса простого герпеса. Подобным образом в конкретном варианте осуществления настоящего изобретения упомянутая выше композиция предназначена для лечения рака, выбираемого из рака молочной железы, рака предстательной железы, карциномы толстой кишки, рака поджелудочной железы, рака кожи, гепатокарциномы, множественной миеломы и рака желудка.
Настоящее изобретение относится к применению ингибирующего TGF-β1 пептида, выбираемого из пептида р144, последовательность которого соответствует SEQ ID NO:1, пептида р17, последовательность которого соответствует SEQ ID NO:2, пептида, гомологичного вышеуказанным пептидам на по крайней мере 90%, и их фрагментов, для приготовления модулирующего иммунный ответ агента.
Кроме того, настоящее изобретение относится к способу применения ингибирующего TGF-β1 пептида, выбираемого из пептида р144, последовательность которого соответствует SEQ ID NO:1, пептида р17, последовательность которого соответствует SEQ ID NO:2, пептида, гомологичного вышеуказанным пептидам на по крайней мере 90%, или их фрагментам для приготовления модулирующего иммунный ответ агента.
Кроме того, настоящее изобретение относится к применению фрагмента ингибирующего TGF-β1 пептида, полученного из пептида р17, выбираемого из фрагмента р17(1-11), определенного в последовательности SEQ ID NO:3, фрагмента р17(1-11)am, который соответствует SEQ ID NO:4, и фрагмента Acp17(1-11)am, определенного последовательностью SEQ ID NO:5. Для облегчения понимания текста настоящей заявки отмечается, что пептид р17(1-11)am соответствует фрагменту, соответствующему аминокислотам 1-11 пептида р17, причем аминокислота в положении 11 (триптофан) является амидированной; Acp17(1-11)am соответствует раннее указанному фрагменту, который дополнительно имеет ацетилированную аминокислоту в положении 1 (лизин).
Настоящее изобретение также относится к пептидам, которые гомологичны указанным пептидам на по крайней мере 70% и предпочтительно на 80% при условии, что они сохраняют способность ингибировать биологическую активность TGF-β1, а также к любому фрагменту вышеуказанных пептидов, который сохраняет способность ингибировать биологическую активность TGF-β1.
В предпочтительном варианте осуществления настоящее изобретение относится к применению упомянутого выше ингибирующего TGF-β1 пептида, отличающемуся тем, что упомянутый выше модулирующий агент регулирует гуморальный или клеточный иммунные ответы или оба этих ответа. В конкретном варианте осуществления настоящего изобретения указанный модулирующий агент оказывает стимулирующий эффект на иммунный ответ, предпочтительно в качестве адъюванта при вакцинации.
С другой стороны, предпочтительный вариант осуществления настоящего изобретения характеризуется тем, что указанный модулирующий агент оказывает ингибирующий эффект на иммунный ответ.
Кроме того, настоящее изобретение относится к применению последовательности ДНК, кодирующей ингибирующий TGF-β1 пептид, выбираемый из пептида р144, последовательность которого соответствует SEQ ID NO:1, пептида р17, последовательность которого соответствует SEQ ID NO:2, пептида, гомологичного вышеуказанным пептидам на по крайней мере 90%, и их фрагментов, для приготовления модулирующего иммунный ответ агента. Изобретение, кроме того, относится к применению рекомбинантной экспрессирующей системы, кодирующей пептид р144, пептид p17, пептид, гомологичный вышеуказанным пептидам на по крайней мере 90%, или их фрагменты, для приготовления модулирующего иммунный ответ агента. В предпочтительном варианте осуществления настоящего изобретения указанный модулирующий иммунный ответ агент оказывает эффект, выбираемый из стимулирующего и ингибирующего иммунный ответ эффектов.
С другой стороны, настоящее изобретение относится к применению ингибирующего TGF-β1 пептида, последовательность которого соответствует SEQ ID NO:1, пептида, гомологичного вышеуказанному пептиду на по крайней мере 90%, или фрагментов одного из вышеуказанных пептидов для приготовления композиции для лечения патологий, выбираемых из патологий, связанных с микроорганизмами, которые индуцируют опосредуемую TGF-β1 иммуносупрессию, и рака. В конкретном варианте осуществления настоящего изобретения указанные микроорганизмы выбраны из Leishmania, Trypanosoma cruzi, вируса иммунодефицита человека, вируса гриппа и вируса простого герпеса.
Конкретный вариант осуществления настоящего изобретения характеризуется тем, что указанная композиция будет вызывать эффект индукции иммунных ответов на укоренившиеся опухоли, ингибируя иммуносупрессивный эффект, связанный с продукцией и/или активацией TGF-β1 в различных типах опухолей (Teicher B.A., 2001): раке молочной железы, раке предстательной железы, карциноме толстой кишки, раке поджелудочной железы, раке кожи, гепатокарциноме, множественной миеломе и раке желудка.
Модулирующий агент, являющийся целью настоящего изобретения, можно использовать для любого вида млекопитающих, в том числе грызунов и приматов, и в предпочтительном варианте осуществления для людей.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
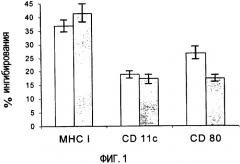
Фиг. 1. Ингибирование экспрессии различных маркеров во время созревания дендритных клеток после инкубации с р144 (заполненные прямоугольники) или антителами, нейтрализующими TGF-β1 (пустые прямоугольники). Экспрессию маркеров клеточной поверхности определяли с помощью проточной цитометрии.
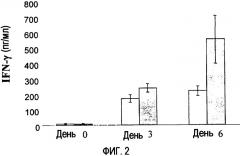
Фиг. 2. Эффект введения р144 и/или RАd-IL-12 мышам BALB/c на уровни IFN-γ в сыворотке в дни 0, 3 и 6. Внутрибрюшинно вводили 108 бляшкообразующих единиц RАd-IL-12 (пустые прямоугольники) или RАd-IL-12 + р144 (заполненные прямоугольники).
Фиг. 3. Уровни NO (мкМ) в сыворотке в дни 0 и 6 после внутрибрюшинного введения 108 бляшкообразующих единиц RАd-IL-12 вместе с р144 (заполненные прямоугольники) или без него (пустые прямоугольники).
Фиг. 4. Гуморальный ответ, индуцированный RAd-LacZ, на 15-й день у мышей BALB/c после подкожной иммунизации (в FIA) RAd-LacZinact в присутствии или в отсутствие р144.
Фиг. 5. Гуморальный ответ, индуцированный RAd-LacZ, на 15-й день у мышей BALB/c после второй подкожной иммунизации (в FIA) RAd-LacZinact в присутствии или в отсутствие р144.
Фиг. 6. Гуморальный ответ, индуцированный у мышей на фиг. 5, на седьмой день после инфицирования с помощью внутривенного введения 4×108 бляшкообразующих единиц RAd-LacZact. Контрольная группа соответствует мышам, которым вводили внутривенно только 4×108 бляшкообразующих единиц RAd-LacZact.
Фиг. 7. Окрашивание красителем X-gal гистологических срезов образцов печени от мышей на фиг. 6 через 7 дней после внутривенного введения 4×108 бляшкообразующих единиц RAd-LacZact.
Фиг. 8. Эффект включения р144 в смеси для иммунизации с FIS на уровни IL-2 (А) и IFN-γ (В) в супернатантах культур лимфоцитов, происходящих из лимфатических узлов мышей, иммунизированных только FIS или FIS + р144. Продукцию цитокинов определяли in vitro после повторной стимуляции культур 6 мкМ (пустые прямоугольники) или 30 мкМ (заполненные прямоугольники) FIS или р144.
Фиг. 9. Выживание мышей BALB/c, которым внутривенно вводили 5×105 клеток СТ26 и которых подвергали различным обработкам (i)-(iv). За исключением контрольной группы, которая получила только 5×105 клеток СТ26 на 10-й день, три оставшиеся группы, кроме того, иммунизировали с помощью подкожного введения 50 мкг AH1 в FIA в день 0. Группы (iii) и (iv) дополнительно получали 50 мкг р144 с помощью внутрибрюшинного введения через день между днями 4-20 и 10-20 соответственно.
Фиг. 10. Добавление ингибирующего TGF-β1 пептида р17 в культуральную среду NK-клеток мыши ингибирует их пролиферацию в ответ на высокие концентрации IL-2. Во всех случаях сравнивали лимфоциты «природные киллеры», установленные точно одним и тем же способом, с и без пептида р17. А) Число клеток в указанные моменты времени в культуре спленоцитов в целом мыши RAG-/-. Представленное значение соответствует среднему подсчета в лунках диаметром 2×3,5 см, в каждом случае - абсолютное число. В) Число клеток в указанные моменты времени в культуре клеток DX5+, магнитно-очищенных из спленоцитов мыши RAG-/-, среди которых отсутствуют Т- и В-лимфоциты, представленное в виде среднего подсчета в лунках диаметром 2×0,4 см в каждом случае. С) Пролиферация клеток микрокультуры, сходных с представленными в В) клетками и в те же моменты времени, измеренная в виде включения меченного тритием тимидина в анализе через 6 часов.
Фиг. 11. Пептид р17 уменьшает уровни экспрессии в мембране маркеров активации CD25 и CD69 в NK-клетках мыши. Гистограммы демонстрируют определяемый с помощью проточной цитометрии уровень экспрессии этих маркеров в клетках, культивируемых с и без пептида и активированных IL-2. Внутри каждой гистограммы указана средняя интенсивность флуоресценции (MFI) каждого маркера.
Фиг. 12. Пептид р17 увеличивает цитотоксичность NK-клеток мыши, активированных IL-2 против различных линий опухолевых клеток. Графики демонстрируют проценты лизиса клеточных линий с различной чувствительностью к цитотоксичности, проявляемой NK. Эффекторные клетки поддерживались в культуре с или без пептида в течение 6 дней, и во время анализа высвобождения хрома отмечались разы превышения над клетками-мишенями - соотношения между эффекторными лимфоцитами и клетками-мишенями.
Фиг. 13. Графики демонстрируют пролиферацию клеток, измеренную по включению меченного тритием тимидина, в соответствии с количеством дендритных клеток (DC), присутствующих на лунку, в отсутствие или в присутствии различных предшествующих стимулов и в отсутствие или в присутствии пептида р17 (150 мкг/мл). Пептид р17 увеличивает пролиферацию лимфоцитов в анализах ответа смеси лимфоцитов (MCR) с использованием CD, не стимулированных или простимулированных LPS или pIC.
Фиг.14. Популяция CD25 оказывает супрессивный эффект на пролиферацию спленоцитов, активированных антителами против CD3 (0,5 мкл/лунка) (ромбы), клетки CD25- (квадраты) не способны оказывать такой эффект, что делает возможной пролиферацию клеток, сопоставимую с основной пролиферацией спленоцитов в отсутствие пролиферативных стимулов (треугольники).
Фиг.15. Ингибирующие TGF-β1 пептиды (усеченные и модифицированные формы р17) в сокультуре регуляторных Т-клеток и активированных спленоцитов мыши ингибируют супрессивное действие, проявляемое регуляторными Т-лимфоцитами на пролиферацию клеток. Можно наблюдать зависимый от дозы эффект пептидов p17(1-11)am и Acp17(1-11)am на ингибиторное действие регуляторных Т-лимфоцитов. Проявляемое ингибирование зависит от дозы, p17(1-11) в концентрации 50 мкМ способен ингибировать супрессивный эффект на 20%, в концентрации 25 мкМ p17(1-11)am - на 128% и Acp17(1-11)am - на 148%.
Фиг.16. Ингибирующие TGF-β1 пептиды, р144 и р17(1-11)am, введенные внутрибрюшинно между днями 6 и 10 (50 мкг/мышь/48 часов), задерживают рост опухоли при подкожной инокуляции 50000 клеток СТ26 в день 0 у животных, иммунизированных 10 днями ранее АН1.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Ниже представлены некоторые примеры функционирования изобретения с иллюстративной целью и в той степени, которая никоим образом не ограничивает его объем.
ПРИМЕР 1
В этом примере исследуется эффект пептида р144 в системе, в которой в качестве индуктора дифференциации популяции спленоцитов в направлении дендритных клеток используется TGF-β1.
Выделение и культивирование дендритных клеток
После умерщвления 8-недельного самца мыши С58 его селезенку извлекали в стерильных условиях и гомогенизировали в чашке с использованием чистой среды с получением клеточной суспензии. Клетки центрифугировали в течение 5 минут при 1000 об/мин и полученный клеточный осадок ресуспендировали с использованием 1 мл/селезенка раствора для лизиса АСК (0,15 М NH4Cl, 1 мМ KHCO3, 0,1 М раствор EDTA-натриевая соль, рН 7,2-7,4) в течение 1 минуты при 37°С. Затем клетки центрифугировали и промывали с использованием 10 мл холодной среды R10 (RPMI-1640, 10% FBS, глютамин, 2×10-5 M 2-меркаптоэтанол) с повторенными один раз центрифугированием и промывкой. Наконец, клетки ресуспендировали в 50 мл среды R10. Были приготовлены 6-луночные планшеты (Costar #3471) путем обработки их 1 мл на лунку среды R10 для дифференциации спленоцитов в направлении дендритных клеток [R10 + 10 нг/мл GM-CSF мыши (Peprotec, EC LTD, London, Соединенное Королевство) + 1 нг/мл TGF-β1 (RD Systems, Minneapolis, США)] в течение 15 минут при комнатной температуре. Затем в каждую лунку добавляли 2 мл клеточной суспензии и планшеты инкубировали при 37°С и 5% СО2. В течение первых недель среду меняли дважды путем удаления 1 мл супернатанта и добавления 1 мл свежей среды (R10 + GM-CSF + TGF-β1) для дендритных клеток. Спустя две недели среду отделяли. В планшеты добавляли по 1 мл на лунку среды для диссоциации в BPS без ферментов (GIBCO BRL), среду инкубировали при 37°С, затем ее удаляли и добавляли 2 мл умеренно теплой среды (R10 + GM-CSF + TGF-β1). Затем клетки собирали с помощью медленного отбора пипеткой и собранные клетки центрифугировали при 1000 об/мин, и их ресуспендировали в свежей среде (R10 + GM-CSF + TGF-β1). Полученные таким образом клетки можно реамплифицировать с помощью засева в планшет, повторяя первоначальный процесс.
Обработка дендритных клеток
Следующие обработки выполняли в течение 72 часов на 18-й неделе культивирования дендритных клеток, происходящих из спленоцитов.
Контрольная группа: клетки, обработанные средой для дендритных клеток (GM-CSF + TGF-β1) с 0,25% DMSO.
Антитело против TGF-β1: клетки, обработанные средой для дендритных клеток (GM-CSF + TGF-β1) с 0,25% DMSO, в которую добавляли нейтрализующее антитело против TGF-β1 (Pharmingen) в концентрации 20 мкг/мл.
Пептид р144: клетки, обработанные средой для дендритных клеток (GM-CSF + TGF-β1), в которую добавляли пептид р144 в растворе с DMSO до конечной концентрации пептида в растворе 50 мкг/мл при 25% DMSO.
Среды, соответствующие каждой обработке, заменяли новыми через 48 часов и в конце обработки клетки собирали с помощью отбора пипеткой после обработки средой для диссоциации (GIBCO BRL).
Анализ поверхностных маркеров с помощью проточной цитометрии
Определение поверхностных маркеров спленоцитов, прокультивированных при различных обработках, проводили с использованием проточной цитометрии (FACScalibur, Becton-Dickinson, San Jose, CA, США). Клетки промывали с использованием 2 мл физиологического раствора на лунку и затем добавляли 1 мл среды для диссоциации в РВS без ферментов (GIBCO BRL) и инкубировали в течение 10 минут при 37°С. Затем среду удаляли и добавляли 2 мл РВS. Клетки собирали с помощью медленного отбора пипеткой и собранные клетки центрифугировали при 1000 об/мин и ресуспендировали до концентрации 2×106 клетка/мл в PBS. 100 мкл/лунка полученной клеточной суспензии инкубировали с 1 мкл из флакончиков, содержащих мышиные моноклональные антитела против CD80, CD11c и MHC I (Becton-Dickinson, Pharmingen), конъюгированные с FITC (1 мг/мл), в 96-луночных планшетах в течение 30 минут при 4°С и в темноте. Затем клетки промывали 3 раза PBS с помощью центрифугирования планшета при 1500 об/мин (Centrifuge 5810R, Eppendorf) в течение 5 минут, удаления супернатанта и ресуспендирования клеток в 100 мкл PBS. В качестве отрицательного контроля использовали нереактивное моноклональное антитело, конъюгированное с FITC (Becton-Dickinson, Pharmingen).
Во время созревания спленоцитов in vitro присутствие определенных факторов и цитокинов в среде может привести к дифференциации клеток в направлении различных фенотипов лейкоцитов. В этом случае TGF-β1 описан в качестве фактора, необходимого in vitro для экспрессии определенными типами клеток на поверхности маркеров, связанных с дендритными клетками. При исследовании авторами настоящего изобретения эффекта инкубации дендритных клеток в течение 72 часов в присутствии р144 на маркеры этих клеток наблюдали, что р144 оказывал отрицательный эффект на экспрессию MHC I, CD11c и CD80. Этот эффект будет иметь то же значение и схожую величину, что и эффект, вызванный инкубацией клеток в присутствии антител против TGF-β1. Действительно, как видно на фиг. 1, уровни флуоресценции, связанные с каждым маркером, уменьшаются схожим образом при обработке р144 или антителом против TGF-β1. Эти результаты показывают важность TGF-β1 для созревания дендритных клеток и говорят о том, что применение ингибиторов этого цитокина в протоколах иммунизации может оказывать значительный эффект на гуморальный и клеточный ответы.
ПРИМЕР 2
In vivo активность рекомбинантного аденовируса, экспрессирующего IL-12 мыши
В этом примере исследуется эффект пептида р144 в in vivo системе, в которой TGF-β1 действует в качестве предполагаемого антагониста цитокинов, индуцированных в этой модели. Продукция IL-12 мыши при экспрессии трансгена, включенного в рекомбинантный аденовирус, индуцирует воспалительное состояние через индукцию каскада факторов, в том числе IFN-γ и оксида азота. TGF-β1 был описан как ингибитор продукции и биологического действия IL-12, IFN-γ и NO (Pardoux C. et al., 1999; Schini V.B. et al., 1992). В этой модели 1×108 бляшкообразующих единиц RАd-IL-12 мыши в 500 мкл физиологического раствора вводили внутрибрюшинно группам из 3 мышей BALB/c возрастом 4-8 недель (Harlan), распределяя животных по следующим группам:
- RАd-IL-12: эти животные получали 1×108 бляшкообразующих единиц RАd-IL-12 мыши в день 0.
- RАd-IL-12 + р144: эти животные подвергались такой же обработке, что и предшествующая группа, но им после введения аденовируса вводили пептид в течение 5 дней в ежедневной дозе 100 мкг пептида в PS, содержащей 0,66% DMSO.
Образцы крови брали у обеих групп в дни 6 и 9 после иммунизации для последующего количественного определения уровней IFN-γ и NO в сыворотке.
Определение уровней IFN-γ
Количество IFN-γ определяли с помощью коммерчески доступной ELISA (Mouse IFN-γ Duoset ELISA Development System, Genzyme, Cambridge и OPTEIA Mouse IFN-γ Set, Pharmingen, San Diego, США) в соответствии с инструкциями изготовителя. Результаты выражали в пг/мл IFN-γ с использованием стандартной кривой известных количеств IFN-γ.
Определение уровней оксида азота
Уровни продукции NO определяют в виде непрямых измерений уровней нитритов и нитратов в сыворотке. Эти измерения проводили с помощью хемилюминесцентного анализа с использованием детектора оксида азота Sievers NOA 280, следуя рекомендованному производителем методу (Sievers Instruments Inc. 1996).
Используемый метод позволяет измерять нитраты или нитраты + нитриты в зависимости от используемого процесса восстановления до NO. Присутствующие в образцах нитриты восстанавливали до NO путем инкубации с 350 мМ NaI в ледяной уксусной кислоте в соответствии со следующей реакцией:
I- + NO2 - + 2 H+ → NO + I2 + H2O
При измерении нитритов и нитратов их восстанавливали до NO путем инкубации с 50 мМ VCl3 в 1 н HCl при 90°С в соответствии со следующей реакцией:
2 NO3 - + 3 V+3 + 2 H2O → 2 NO + 3 VO2 + 4 H+
Восстановление до NO происходит в резервуаре с детектором. Получаемый в результате NO любой из этих двух предшествующих реакций перемещается в детектор с помощью вакуумного насоса. В детекторе происходит хемилюминесцентная реакция между NO и озоном:
NO + O3 → O2 + NO2 ∗ → NO2 + h•
Эмиссия NO2 ∗ находится в красной и инфракрасной области оптического спектра и обнаруживается с помощью фотоэлектронного умножителя, чувствительного к красной области оптического спектра. Определяют величину этого сигнала и полученные данные собирают и обрабатывают с помощью компьютера.
Введение мышам рекомбинантного аденовируса (RAd), экспрессирующего IL-12 мыши, вызывает каскад реакций, среди которых выступает значительное увеличение уровней в сыворотке IFN-γ и NO. Поскольку на процессы индукции IFN-γ и NO оказывает влияние TGF-β1 (Schini V.B. et al., 1992), авторы настоящего изобретения также исследовали эффект введения р144 на указанные уровни. На фиг. 2 и 3 соответственно показаны уровни IFN-γ и NO в сыворотке мышей, которым ввели дозу 1×108 бляшкообразующих единиц рекомбинантного аденовируса, экспрессирующего IL-12 мыши, (RАd-IL-12) с р144 или без него. На фиг. 2 демонстрируется, что введение пептида р144 вместе с RАd-IL-12 приводит к увеличению уровней индуцированного IFN-γ относительно уровней, достигаемых после введения только RАd-IL-12.
На фиг. 3 демонстрируется эффект введения RАd-IL-12 с р144 или без него на уровни NO в сыворотке. Совместное введение RАd-IL-12 и р144 приводит к достижению более высокого уровня NO в день 6 относительно уровня, достигаемого при введении только RАd-IL-12.
Эффект р144 в этой модели индукции провоспалительных цитокинов можно объяснить на основе действия TGF-β1 на регуляцию, экспрессию и активность IL-12 и процессы активации этого цитокина. Действительно, описано, что TGF-β1 проявляет антагонистическое в отношении экспрессии и активности IL-12 и IFN-γ действие. Следовательно, если р144 нейтрализует TGF-β1, он устраняет антагонистическое действие этого цитокина в отношении экспрессии и активности IL-12 и IFN-γ, и в результате происходит повышение уровней IFN-γ в сыворотке (фиг. 2). В итоге в этой модели TGF-β1 действует путем контролирования как экспрессии IL-12, так и (сопутствующим образом) экспрессии IFN-γ. В результате ингибирование TGF-β1 с помощью р144 приводит к увеличению экспрессии IFN-γ.
Что касается эффекта р144, выражающегося в увеличении NO, авторы настоящего изобретения полагают, что он может также быть объяснен ингибированием TGF-β1 с помощью р144. Действительно, поскольку TGF-β1 ингибирует экспрессию и активацию фермента iNOS, ответственного за продукцию NO, логично заключить, что при исключении цитокина уровни NO будут стремиться к увеличению, что наблюдается на фиг. 3 в день 6.
Поскольку IFN-γ индуцирует экспрессию и активность iNOS, результаты, представленные на фиг. 2 и 3, являются согласующимися, так как в день 6 наблюдают, что введение р144 соответственно приводит к увеличению уровней IFN-γ и NO.
ПРИМЕР 3
Индукция антител
Для анализа иммуномодулирующего эффекта пептида р144 на гуморальный ответ использовали самок мышей BALB/c (Harlan, Barcelona) возрастом 6-8 недель. Для индукции специфических антител инокулировали рекомбинантный аденовирус (RAd-LacZ), инактивированный нагреванием в бане при 100°С в течение 10 минут.
Группы животных и обработки
Иммунизировали трех мышей на группу путем внутрибрюшинного введения 200 мкл смеси, содержащей 1×108 бляшкообразующих единиц инактивированного аденовируса RАd-LacZ, физиологическую сыворотку (PS) или 50 мкг пептида р144, эмульгированных в полном адъюванте Фрейнда (FCA) в объемном соотношении 1:1, как указано в таблице 1. Спустя 30 дней после первой иммунизации животных повторно иммунизировали той же самой смесью, но эмульгированной в неполном адъюванте Фрейнда (FIA). Образцы крови брали из ретроорбитального венозного сплетения в дни 15 и 45 для количественного определения антител против аденовируса, образованных в каждом животном.
Для исследования возможного индуцирования аллергии на антиген у мышей, обработанных р144, на 50-й день после первой инъекции инокулировали внутривенно 4×108 бляшкообразующих единиц активного RАd-LacZ в 100 мкл RPMI-1640 мышам, включающим новую группу мышей (контроль внутривенно), которая только получала внутривенную дозу активного аденовируса LacZ. У всех групп образцы крови брали через 7 дней. Затем животных умерщвляли для получения образцов печени в OCT® (Tissue-Tek®, SAKURA, Нидерланды) для последующей оценки экспрессии LacZ в печени.
| Таблица 1Композиция смесей для иммунизации различных групп инактивированным нагреванием аденовирусом | ||||
| Группы | RAd-LacZ | P144 | FCA/FIA | PS |
| RAd-LacZ | 50 мкл (1×108 бляшкообразующих единиц) | - | 100 мкл | 50 мкл |
| RAd-LacZ + p144 | 50 мкл (1×108 бляшкообразующих единиц) | 50 мкл (50 мкг) | 100 мкл | - |
Количественное определение антител против RАd-LacZ в сыворотке
Для определения антител против RАd-LacZ в сыворотке выполняли анализ ELISA с использованием планшетов с 96 плоскодонными лунками Maxisorp® (Nunc, Roskilde, Дания), основанный на системе стрептавидин-биотин с использованием 2,2'-азино-бис-3-этилбензтиазолин-6-сульфокислоты (ABTS) в качестве проявителя. Планшеты инкубировали на протяжении ночи при 4°C с 50 мкл на лунку раствора 75 мкл 1010 бляшкообразующих единиц RАd-LacZ/мл в 10 мл 0,1 М Na2CO3 (pH 10,5). Затем осуществляли 3 промывки 200 мкл на лунку буфера для промывок PBST (pH 6 солевой фосфатный буфер с 0,1% Tween 20). Неспецифические связи блокировали инкубированием планшетов в течение одного часа при комнатной температуре с 400 мкл на лунку PBST с 1% порошкообразного молока (PLT). Планшеты опустошали и осуществляли три промывки PBST. Добавляли 4 мкл сыворотки в 100 мкл PLT, получая 8 двойных серийных разведений, и планшеты инкубировали в термостате в течение 1 часа при 37°С. Их промывали три раза PBST и инкубировали в течение 1 часа при 37°C с 50 мкл на лунку 1/1000 разведения биотинилированного антитела против IgG мыши, полученного из козы, (Amersham) в PBST. После инкубации в течение 1 часа выполняли три промывки PBST и планшеты проявляли. В качестве субстрата для проявления реакции использовали ABTS, дающий зеленое окрашивание в присутствии перекиси водорода и фермента пероксидазы. Готовили раствор с использованием 10 мл 0,6% уксусной кислоты (рН 4,6), 7,5 мкл 33% H2O2 (объем/объем) и 100 мкл 40 мМ ABTS. Добавляли 100 мкл на лунку и через час планшеты считывали при 405 нм в считывающем устройстве Multiskan Plus MKII (Labsystem, Helsinki, Финляндия).
In situ окрашивание на экспрессию трансгена (краситель X-gal)
Полученные с использованием криостата срезы (6 мкм) препаратов образцов печени, помещаемых в соединение для оптимальной для получения срезов температуры, сушили при комнатной температуре. Затем их фиксировали с использованием 0,5% глютальдегида в течение 10 минут, добавляя 200 мкл на препарат. Затем осуществляли 3 промывки в PBS и затем добавляли 200 мкл