Вакцина на основе в-клеток, нагруженных лигандом т-клеток-природных киллеров и антигеном
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описана иммунотерапевтическая или профилактическая вакцина, применяемая при/против вирусного инфекционного заболевания, бактериального инфекционного заболевания или рака, содержащая фармацевтически эффективное количество В-клеток, выбранных из группы, состоящей из В-клеток, полученных путем нагрузки их лигандом Т-клеток-природных киллеров и сенсибилизирующим антигеном, и В-клеток, полученных путем нагрузки их лигандом Т-клеток-природных киллеров и переноса гена, кодирующего пептидный антиген или белковый антиген, посредством которого В-клетки экспрессируют антиген, и фармацевтически приемлемый носитель. Предложен способ индукции цитотоксического ответа у нуждающегося в лечении пациента, предусматривающий введение этому пациенту описанной вакцины. Изобретение расширяет арсенал средств иммунотерапии или профилактики вирусного инфекционного заболевания, бактериального инфекционного заболевания или рака. 2 н. и 9 з.п. ф-лы, 36 ил.
Реферат
ОПИСАНИЕ
Область техники
Настоящее изобретение относится к вакцине на основе В-клеток, нагруженной лигандом Т-клеток-природных киллеров и антигеном для профилактики и лечения инфекционных заболеваний и злокачественных заболеваний, более конкретно к иммунотерапевтической и профилактической вакцине, действие которой опосредовано В-клетками, нагруженными α-галактозилцерамидом, разновидностью гликолипида, который вместе с антигеном может стимулировать Т-клетки-природные киллеры.
Предшествующий уровень техники
В основном опухолевые антигены не могут быть эффективно представлены антиген-представляющими клетками, то есть иммунный ответ не может быть эффективно индуцирован. Противоопухолевая вакцина представляет собой новую терапевтическую вакцину, которая характеризуется активацией опухолеспецифической иммунной системы (например, введение опухолевых антигенов в антиген-представляющие клетки) для индукции мощного иммунного ответа для разрушения злокачественных клеток.
Из доступных подходов к вакцинации известно, что клеточные вакцины с использованием антиген-представляющих клеток (АПК), таких как дендритные клетки (ДК), являются надежными для выработки эффективного Т-клеточного иммунитета (Rosenberg, S. A. et al., Nat. Med., 10, 909-915, 2004). Поскольку было показано, в частности, что вакцины на основе ДК эффективно индуцируют Aг-специфические эффекторные Т-клетки и Т-клетки памяти, они были предложены для противоопухолевой иммунотерапии в ряде клинических испытаний (Rosenberg, S. A. et al., Nat. Med., 10, 909-915, 2004). Дендритные клетки являются идеальными антиген-представляющими клетками (АПК) для иммунотерапии, поскольку они могут захватывать Аг, а затем мигрировать в лимфоидные органы, где они представляют этот Аг соответствующим Т-клеткам. Более важно то, что они обеспечивают мощную ко-стимуляцию Т-клеток (Figdor, C. G. et al., Nat. Med., 10, 475-480, 2004; и Banchereau, J. et al., Cell, 106, 271-274, 2001). Идея ДК-вакцины является традиционной как для экспериментальных, так и для клинических исследований. Однако ДК сравнительно редки в крови и лимфоидных тканях и увеличить их численность ex vivo из моноцитов крови затруднительно, и то и другое являются основными препятствиями для их широкого применения в вакцинах (Schultze, J. L. et al., Trends Immunol., 25, 659-664, 2004).
В-клетки представляются перспективным альтернативным источником для клеточных вакцин в силу их изобилия в лимфоидных тканях и крови и легкого способа размножения ex vivo (Schultze, J. L. et al., Trends Immunol., 25, 659-664, 2004; von Bergwelt-Baildon, M.S. et al., Blood, 99, 3319-3325, 2002; и Schultze, J. L. et al., J. Clin. Invest., 100, 2757-2757, 1997), а также в силу того, что они собираются в лимфоидных органах после их паретнерального введения.
Несмотря на эти преимущества, В-клетки игнорируются в качестве источника клеточных вакцин, поскольку они слабо иммуногенны. Действительно, накопленные доказательства показывают, что они непосредственно индуцируют иммунологическую толерантность и у CD4 и у CD8 Т-клеток, вероятно, вследствие отсутствия ко-стимуляции (Bennett, S. R. et al., J. Exp. Med., 188, 1977-1983, 1998; и Eynon, E. E. et al., J. Exp. Med., 175, 131-138, 1992). Однако «активированные» В-клетки могут примировать как CD4, так и CD8 Т-клетки (von Bergwelt-Baildon, M. S. et al., Blood, 99, 3319-3325, 2002; Schultze, J. L. et al., J. Clin. Invest., 100, 2757-2765, 1997; Lapointe, R. et al., Cancer Res., 63, 2836-2843, 2003; и Heit, A. et al., J. Immunol., 172, 1501-1507, 2004), давая возможность предположить, что при активизации соответствующими стимулами В-клетки могут действовать как иммуногенные АПК, способные индуцировать Аг-специфический Т-клеточный иммунитет.
Точно установлено, что iNKТ-клетки играют ключевую роль в разнообразии иммунных ответов и в иммунопатологии в целом. Хотя они представляют менее 1% лимфоцитов у мышей, iNKТ-клетки направляют ответ на собственные и экзогенные Аг и определяют индукцию толерантности или иммунитета (Kronenberg, M., Annu. Rev. Immunol., 23, 877-900, 2005; и Park, S. H. & Bendelac, A., Nature, 406, 788-792, 2000). Они действуют как суппрессоры иммунитета при опухолях, диабете и в иммунологически привилегированном участке (Sonoda, K. H., et al., J. Exp. Med., 190, 1215-1226, 1999).
Напротив, опосредованная лигандом активация iNKТ-клеток приводит к активации T-, B- и NK-клеток, а также ДК. Инъекция αGalCer, лиганда iNKT генерирует противоопухолевый иммунитет посредством NK- и Т-клеток (Moodycliffe, A. M., et al., Nat. Immunol., 1, 521-525, 2000).
Альфа-галактозилцерамид (αGalCer) представляет собой разновидность гликолипида, экстрагированного из морской губки, который является лигандом Т-клеток-природных киллеров, имеющих Т-клеточный рецептор (TCR) Vα14+, и представленный как CD1d на антиген-представляющей клетке (АПК) (Kawano et al., Science, 278: 1626, 1997). Активация Т-клеток-природных киллеров приводит к масс-продукции IFN-γ и IL-4, которые могут контролировать иммунные ответы либо на инфекционное заболевание либо на злокачественное заболевание (Chen et al., J. Immunol., 159: 2240, 1997; Wilson et al., Proc. Natl. Acad. Sci. U.S.A., 100: 10913, 2003).
У мышей, которым совместно вводили белковый Аг и αGalCer, развивается гуморальный и клеточно-опосредованный иммунитет, в том числе цитотоксические Т-клеточные ответы (Hermans, I. F., et al., J. Immunol, 171, 5140-5147, 2003; и Stober, D. et al., J. Immunol., 170, 2540-2548, 2003). Более того, недавнее исследование показало, что ДК, нагруженные αGalCer, генерируют более продолжительные iNKТ-клеточные ответы, чем свободная форма αGalCer, что позволяет предположить, что адъювантность iNKT-лигандов могла бы быть усилена, если ее направить на специальные АПК.
Авторы настоящего изобретения подтвердили, что представление iNKT-лиганда на В-клетках могло бы перевести их из толерогенных в иммуногенные, тем самым генерируя мощный иммунитет против Аг, представленного на молекулах MHC В-клеток. Для верификации этого подтверждения и таким образом для осуществления этого изобретения авторы настоящего изобретения дополнительно подтвердили эффективность αGalCer-нагруженных, сенсибилизированных пептидом В-клеток и В-клеток, нагруженных αGalCer, трансдуцированных аденовирусом, в выработке антиген-специфического иммунитета и противоопухолевой активности.
Техническая задача
Задачей настоящего изобретения является предоставление иммунотерапевтической/профилактической вакцины и противоопухолевой вакцины, способной индуцировать опосредованные антиген-представляющими В-клетками антиген-специфические иммунные реакции. Т-клетки-природные киллеры, стимулированные αGalCer на молекуле CD1d нагруженных антигеном В-клеток, переводят толерогенные В-клетки в иммуногенные антиген-представляющие клетки.
Техническое решение
Настоящее изобретение относится к иммунотерапевтической/профилактической вакцине и противоопухолевой вакцине, действие которой опосредовано В-клетками, нагруженными лигандом Т-клеток-природных киллеров и антигеном.
Настоящее изобретение относится также к противоопухолевой вакцине, действие которой опосредовано В-клетками, нагруженными лигандом Т-клеток-природных киллеров и экспрессирующими опухолевый антиген.
Настоящее изобретение дополнительно относится к активатору Т-клеток-природных киллеров, опосредованному В-клетками, нагруженными αGalCer.
Кроме того, настоящее изобретение относится к индуктору цитотоксического ответа, опосредуемого В-клетками, экспрессирующими опухолевый антиген.
Далее настоящее изобретение описывается подробно.
Настоящее изобретение относится к иммунотерапевтической/профилактической вакцине и противоопухолевой вакцине, содержащей фармацевтически эффективное количество В-клеток, выбранных из группы, состоящей из a) CD19+ В-клеток, полученных нагрузкой их лигандом Т-клеток-природных киллеров, b) CD19+ В-клеток, полученных путем их нагрузки лигандом и сенсибилизации антигеном, и c) CD19+ В-клеток, полученных путем их нагрузки лигандом и переносом гена, кодирующего пептидный антиген, посредством чего CD19+ В-клетки экспрессируют антиген, и фармацевтически приемлемый носитель.
Лиганд Т-клеток-природных киллеров включает в себя альфа-галактуронозилцерамид и альфа-глюкуронозилцерамид, происходящие из Sphingomonas spp. (Mattner, J. et al. Nature 434:525, 2005, Kinjo, Y. et al. Nature 434:520, 2005), фосфатидилинозитолтетраманнозид, происходящий из M. tuberculosis (Fischer, K. et al. PNAS 101:10685, 2004), аутоантигены изоглоботригексозилцерамид (Zhou, D. et al. Science 306:1786, 2004) и ганглиозид GD3 (Wu, D. Y. et al. J. Exp. Med. 198:173, 2003), фосфатидилхолин (J. Immunol. 175:977, 2005), бета-галактозилцерамид (β GalCer, Ortaldo JR et al. J. Immunol. 172:943), липофосфогликан и гликоинозитол фосфолипиды гликозидной связи на поверхности лейшманий (J. Exp. Med. 200:895, 2004), αGalCer производные бета-аномерного GalCer и альфа-аномерного GalCer (J. Immunol. 173:3693, 2004), варианты αGalCer (J. Am. Chem. Soc. 126:13602, 2004) и бактериальный липидный антиген, такой как мономиколят глюкозы, происходящий из Nocardia falcinica (Moody, D. B. et al. J. Exp. Med. 192:965, 2000).
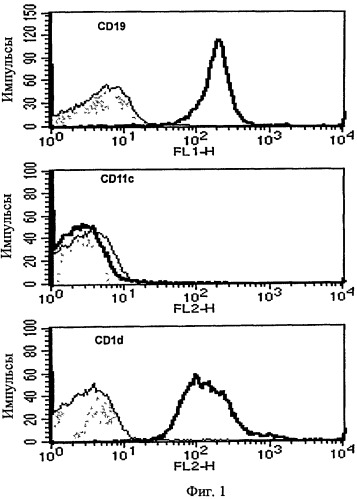
Поскольку уже точно установлено, что ДК, нагруженные αGalCer, активируют iNKТ-клетки (van der Vliet HJ, et al., J Immunol Methods., 247(1-2): 61-72, 2001), авторы настоящего изобретения исследовали вопрос о том, будут ли В-клетки, нагруженные αGalCer, оказывать подобное воздействие.
ДК и CD19+ В-клетки (Фиг. 1) выделяли у мыши. Каждую клетку сенсибилизировали различными концентрациями αGalCer, затем совместно культивировали с NKT гибридомой. Затем измеряли уровень IL-2 в культуральном супернатанте. В результате и В-клетки, нагруженные αGalCer (B/αGalCer), и ДК, нагруженные αGalCer (ДК/αGalCer), стимулировали продукцию IL-2 NKT гибридомой (см. Фиг. 30). Следовательно, это подтверждает, что и B/αGalCer, и ДК/αGalCer могут активировать iNKТ-клетки ex vivo.
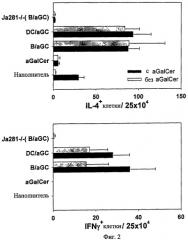
Для изучения того, могут ли B/αGalCer и ДК/αGalCer, введенные in vivo, активировать иммунные клетки или нет, авторы настоящего изобретения вводили B/αGalCer или ДК/αGalCer от мышей C57BL/6 внутривенно сингенным мышам и измеряли уровень клеток, продуцирующих IL-4 и IFN-γ, c помощью ELISPOT. В частности, мышам C57BL/6 дикого типа или Jα281-/- внутривенно вводили носитель, αGalCer, В-клетки, нагруженные αGalCer, или ДК, нагруженные αGalCer. Неделю спустя клетки селезенки отделяли для получения отдельных клеток, которые помещали на планшет ELISPOT. Носитель или αGalCer добавляли к планшету, с последующим культивированием в течение 6 часов для стимуляции. Исследование ELISPOT проводили для определения клеток, секретирующих IL-4 и IFN-γ, в соответствии с инструкциями производителя (набор IL-4 ELISPOT, набор IFN-γ ELISPOT; R&D system).
В результате инъекция и B/αGalCer и ДК/αGalCer индуцировала высокие количества клеток, продуцирующих IL-4 и IFN-γ (Фиг. 2). Однако следует отметить, что значительное число этих цитокин-продуцирующих клеток выявлялось даже при отсутствии повторной стимуляции αGalCer. Тем не менее, авторы настоящего изобретения полагают, что индукция клеток, продуцирующих IL-4 и IFN-γ, зависит от iNKТ-клеток, поскольку этого не происходило у мышей Jα281-/-, котороые лишены популяции iNKT (см. Фиг. 2).
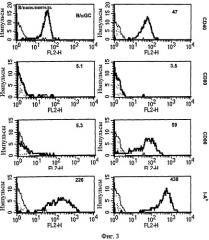
Авторы настоящего изобретения внутривенно вводили B/αGalCer, меченные CFSE (сложным эфиром сукцинимидила и карбоксифлуоресцеина) нативным мышам, а через 24 или 48 часов после введения анализировали молекулы ко-стимуляции на клетках CFSE+ методом проточной цитометрии для определения того, какие изменения, если они есть, были индуцированы в В-клетках, нагруженных αGalCer, после введения. В результате высокие уровни экспрессии CD86, а не CD80 были индуцированы в течение 24 часов (Фиг. 3). CD40 и MHC II также слегка активировались. В заключение in vivo введение B/αGalCer индуцировало активацию В-клеток в течение 24 или 48 часов.
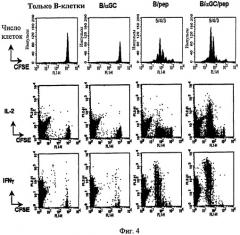
Далее, авторы настоящего изобретения изучили то, может ли совместная сенсибилизация αGalCer и MHC I-рестриктированного пептида на В-клетках примировать пептид-специфические CD8+ Т-клетки. С этой целью авторы изобретения впервые осуществили адоптивный перенос CFSE-меченых OVA-специфических CD8+ Т-клеток мышам, затем ввели сенсибилизированные наполнителем В-клетки (одни B), αGalCer-сенсибилизированные В-клетки (B/αGalCer), наполнитель + В-клетки, сенсибилизированные пептидом (B/pep), или αGalCer + В-клетки, сенсибилизированные пептидом (B/αGalCer/pep). Затем были получены лимфоциты из селезенки и лимфатических узлов, с последующим измерением CD8+ Т-клеточного ответа у мышей, с перенесенными В-клетками. В результате небольшое деление OVA-специфических CD8+ Т-клеток было индуцировано у мышей, получавших только В; однако слабое деление OVA-специфичных CD8+ Т-клеток, возможно, Аг-неспецифического происхождения, было отмечено в группе B/αGalCer. Введение B/pep индуцировало значительное деление OVA-специфических CD8+ Т-клеток. А у мышей, получивших B/αGalCer/pep, было показано усиленное деление CD8+ Т-клеток, с более чем 40% полученных в результате клеток, продуцирующих IL-2, и наиболее неожиданно более чем 90% полученных в результате клеток, продуцирующих IFN-γ на значительно более высоких уровнях, чем группа B/pep (см. Фиг. 4). Эти результаты дают возможность предположить, что значительно большая скорость CD8+ Т-клеточной активации могла быть достигнута посредством нагрузки αGalCer на B/pep.
Авторы настоящего изобретения исследовали вопрос о том, мог ли подход к вакцинам на основе В-клеток индуцировать цитотоксический иммунитет. В частности, авторы изобретения вводили внутривенно группам мышей C57BL/6 одни B, B/αGalCer, B/pep или B/αGalCer/pep, а затем определяли in vivo активность CTL. В результате только B/αGalCer/pep полностью лизировали сенсибилизированные пептидом мишени (Фиг. 5). А в группе, обработанной B/αGalCer/pep, было показано значительное увеличение числа IFN-γ-продуцирующих CD8+ Т-клеток в отношении этого пептида (Фиг. 6, слева). При проведении последующей иммунизации с использованием OVA-покрытых сингенных спленоцитов для определения реактивности CTL мыши, которым вводили одни B или B/αGalCer, реагировали нормально на прайминг и генерировали значительное количество пептид-специфических IFN-γ-продуцирующих CD8+ Т-клеток (Фиг. 6, справа). Однако когда спленоциты от мышей, иммунизированных B/pep, повторно стимулировали родственным пептидом in vitro, число IFN-γ-продуцирующих CD8+ Т-клеток снижалось по сравнению с мышами, которым вводили одни В, что дает возможность предположить, что те мыши были толерантны к этому пептиду. Напротив, у мышей, вакцинированных B/αGalCer/pep, обнаруживалось гораздо большее число пептид-реактивных CD8+ Т-клеток, чем обнаруживалось либо в группе, получающей B/αGalCer или одни B, что предполагает, что это вторичный иммунный ответ.
Авторы изобретения сравнили эффективность стратегии вакцин на основе В-клеток в генерировании цитотоксичности с ДК-вакцинами. С этой целью определяли минимальное число клеток, необходимое для достижения полного лизиса клеток-мишеней in vivo. Принимая во внимание то, что площадь поверхности ДК гораздо больше, чем площадь поверхности В-клеток, можно сделать заключение, что B/αGalCer/pep были столь же эффективны, как и ДК/αGalCer/pep, в генерировании цитотоксичности. В то же время профиль in vivo цитотоксичности группы, обработанной ДК/pep, был очень похож на таковой группы, обработанной ДК/αGalCer/pep, что указывает на то, что нагрузка αGalCer на ДК дополнительно не усиливала вакцинную эффективность ДК/pep.
Авторы изобретения далее изучали, какие типы иммунных клеток вовлечены в выработку CTL-ответа. С этой целью мышам вводили элиминирующие антитела за 4 дня до или 4 дня после их вакцинации B/αGalCer/pep, а затем проводили исследование CTL in vivo. В результате выработки активности CTL не препятствовали ни элиминация CD4+, ни элиминация NK1.1+ клеток, независимо от сроков проведения элиминации. С другой стороны, элиминация CD8 полностью блокировала уничножение клеток-мишеней (Фиг. 9).
Можно было бы утверждать, что сенсибилизированные пептидом В-клетки действуют не как АПК, а как резервуары пептида, из которого ДК хозяина извлекают пептиды для индукции CTL-ответов. Для исследования этой возможности использовали мышей bm-1. Клетки этих мышей могут нести OVA-пептид на их молекулах MHC класса I, но полученный в результате комплекс не распознается когнитивными CD8+ Т-клетками вследствие мутации в области H-2K. В-клетки этой линии экспрессировали CD1d нормально и стимулировали активацию iNKT в ответ на αGalCer, что указывает на то, что взаимодействие между B и iNKT было интактным. Еще раз, когда B/αGalCer/pep получали с использованием В-клеток мышей дикого типа, а затем их вводили мышам недикого типа, генерировалась полная in vivo OVA-специфическая цитотоксичность. Однако когда B/αGalCer/pep, полученный из В-клеток мышей bm-1, вводили мышам недикого типа, генерировать OVA-специфическую цитолитическую активность не удавалось, что дает возможность предположить, что ДК или другие специфические АПК у мышей реципиентов не отвечают за выработку CTL (Фиг. 11).
Авторы изобретения далее изучали возможность генерирования CTL в тех случаях, когда αGalCer и пептид были сенсибилизированы по отдельности, а затем введены вместе. В результате у мышей, вакцинированных с использованием 'B/αGalCer плюс B/pep', не вырабатывалась in vivo цитотоксичность (Фиг. 12). Этот результат демонстрирует, что пептид и αGalCer должны быть представлены на той же В-клетке для генерирования OVA-специфической цитотоксичности.
Авторы изобретения исследовали также то, будет ли вакцинация с использованием B/αGalCer/pep генерировать противоопухолевый иммунитет. Для тестирования профилактической противоопухолевой активности группы мышей вакцинировали однократно, используя одних только B, B/αGalCer, B/pep, B/αGalCer/pep, ДК/pep или ДК/αGalCer/pep до подкожной трансплантации им меланомы, трансфицированной OVA. В результате наблюдался слегка замедленный профиль опухолевого роста у мышей, вакцинированных B/αGalCer, хотя в конце концов у всех мышей развивались опухоли. Напротив, у мышей, получавших B/αGalCer/pep, ДК/pep или ДК/αGalCer/pep, опухоли не развивались (см. Фиг. 13). Для изучения того, установилась ли у этих мышей длительная противоопухолевая активность, повторно заражали выживших мышей без опухоли теми же опухолевыми клетками через 70 дней после первого заражения опухолью. Авторы изобретения не наблюдали опухолевый рост у тех мышей, демонстрируя, что вакцинация с использованием B/αGalCer/pep создавала противоопухолевый иммунитет памяти (см. Фиг. 14).
Далее, авторы изобретения изучали вопрос о том, будет ли вакцинация с использованием B/αGalCer/pep уничтожать уже существующие опухоли. В результате опухолевый рост полностью подавлялся у мышей, вакцинированных с использованием ДК/pep, ДК/αGalCer/pep или B/αGalCer/pep (см. Фиг. 15 и Фиг. 16).
Для определения того, может ли эта схема введения вакцины на основе В-клеток применяться для конкретного опухолевого Аг, авторы изобретения выбрали модель Her-2/neu. Они наблюдали значительный уровень цитотоксичности, специфичной в отношении Her-2/neu in vivo у мышей, которым вводили нагруженные αGalCer, Her-2/neu 63-71-сенсибилизированные В-клетки (см. Фиг. 17). Для проверки терапевтической противоопухолевой активности в этой модели авторы изобретения вводили опухолевые клетки, экспрессирующие Her-2/neu, мышам до вакцинации их αGalCer-нагруженных, Her-2/neu 63-71-сенсибилизированных В-клеток. После инокуляции опухоли выживаемость была несколько лучше у тех мышей, которых вакцинировали B/αGalCer или B/pep, чем у мышей, вакцинированных только B (см. Фиг. 18). Напротив, все мыши, вакцинированные с использованием B/αGalCer/pep выжили на протяжении всего эксперимента. В модели солидной опухоли мышей с трансплантированными опухолями вакцинировали вакциной на основе В-клеток или вакциной на основе ДК. В результате рост опухолевых клеток ингибировался у мышей, вакцинированных αGalCer-нагруженными, Her-2/neu 63-71-сенсибилизированными В-клетками, также как и у мышей, вакцинированных ДК-вакциной (см. Фиг. 19).
Следовательно, доказано, что вакцина на основе В-клеток согласно изобретению является такой же эффективной, как и вакцины на основе ДК в выработке как профилактического, так и терапевтического противоопухолевого иммунитета.
Настоящее изобретение относится также к иммунотерапевтической/профилактической вакцине и противоопухолевой вакцине, действие которой опосредовано В-клетками, нагруженными лигандом Т-клеток-природных киллеров, и экспрессирующих антиген.
В отличие сенсибилизированных пептидом клеточных вакцин клеточная вакцина, трансдуцированная вирусным вектором для экспрессии целого антигена, может применяться ко всем, без ограничения, в гаплотипах главного комплекса гистосовместимости и может идуцировать различные эпитоп-специфические иммунные ответы, в частности как гуморальный иммунный ответ, так и опосредованный клетками иммунный ответ, одновременно В-клетки трансдуцировали аденовирусом (AdHM), имеющим ген, кодирующий внеклеточный и трансмембранный домен Her-2/neu антигена, ассоциированного с опухолью. В результате на αGalCer презентацию В-клеток не влияла трансдукция AdHM (см. Фиг. 21). Через неделю после иммунизации лизис клеток-мишеней не наблюдался у мышей, иммунизированных В-клетками и B/αGalCer. Напротив, мощный цитотоксический Т-клеточный иммунный ответ наблюдался у мышей, иммунизированных B/AdHM и B/AdHM/αGalCer (см. Фиг. 22 и Фиг. 24).
Цитотоксический T-лимфоцитарный ответ, опосредованный нагруженными αGalCer, трансдуцированными аденовирусом В-клетками (B/AdHM/αGalCer), продолжался выше и дольше, чем ответ, опосредованный В-клетками, трансдуцированными аденовирусом (B/AdHM), хотя различие не было значительным. Эти результаты указывают на то, что нагрузка αGalCer В-клеток в отличие от пептидной сенсибилизации не влияет на стимуляцию цитотоксического Т-клеточного ответа. Однако когда В-клеточную вакцину, нагруженную αGalCer, вводили мышам, NKТ-клетки стимулировались, и тем самым NK-клетки активировались по меньшей мере in vivo, в отличие от мышей, которым вводили В-клеточную вакцину, трансдуцированную аденовирусом (см. Фиг. 25).
Для определения эффективности стратегии вакцин на основе В-клеток в выработке цитотоксического Т-лимфоцитарного ответа авторы изобретения исследовали лизис клеток-мишеней путем вакцинации мышей субоптимальной дозой, которая была недостаточной для индукции полных цитотоксических Т-лимфоцитарных реакций. В результате В-клетки, трансдуцированные аденовирусом для экспрессии антигена, могли индуцировать антиген-специфический Т-лимфоцитарный ответ эффективно, даже несмотря на то, что требовалось большое количество В-клеток по сравнению с сенсибилизированной пептидом В-клеточной вакциной. Поскольку приблизительно 20% всех В-клеток, трансдуцированных аденовирусом, фактически экспрессировали Her-2/neu, эффективность В-клеток, трансдуцированных аденовирусом, была принудительно занижена. В случае переноса небольшого количества В-клеток NKТ-клеточная активация, индуцированная В-клетками, нагруженными αGalCer, была полезна для лизиса клеток-мишеней, индуцированного В-клетками, трансдуцированными аденовирусом.
Вирус, который инфицирует В-клетки для экспрессии опухолевого антигена, может быть проиллюстрирован аденовирусом, ретровирусом, вирусом коровьей оспы, вирусом оспы и вирусом синдбис, но не всегда ими ограничен. Помимо использования вирусного вектора для переноса гена, кодирующего антиген, могут быть использованы следующие способы: 1) связывание ДНК с липосомой для защиты ДНК от разрушения ферментом или абсорбции в эндосому; 2) связывание ДНК с молекулярным конъюгатом или синтетическим лигандом для повышения эффективности трансфекции (например, асиалогликопротеином, трансферрином и полимерным IgA); 3) конструирование новой системы трансдукции ДНК с использованием PTD (домен белковой трансдукции) для повышения эффективности трансдукции гена, кодирующего антиген (например: Mph-1); и 4) введение пептида или белка в В-клетки для презентации антигена.
Настоящее изобретение дополнительно относится к активатору Т-клеток-природных киллеров, опосредованному В-клетками, нагруженными αGalCer. Как объяснялось выше, В-клетки согласно изобретению, нагруженные αGalCer, как дендритные клетки, нагруженные αGalCer, стимулируют гибридому Т-клеток-природных киллеров in vitro и таким образом индуцируют секрецию IL-2 (см. Фиг. 30) и эффективно активируют iNKТ-клетки, которые могли индуцировать активацию различных иммунных клеток in vivo (см. Фиг. 2). Следовательно, В-клетки согласно изобретению, нагруженные αGalCer, могут быть использованы в качестве активатора Т-клеток-природных киллеров как дендритные клетки, нагруженные αGalCer.
Настоящее изобретение также относится к индуктору цитотоксического ответа, опосредованного В-клетками, экспрессирующими опухолевый антиген.
В отличие от В-клеточной вакцины, сенсибилизированной пептидом для индукции опосредованного клетками иммунного ответа, В-клеточная вакцина, трансдуцированная аденовирусом, может индуцировать как опосредованный клетками иммунный ответ, так и гуморальный иммунный ответ одновременно. Для подтверждения, могла ли В-клеточная вакцина, трансдуцированная AdHM индуцировать антитело, специфичное к Her-2/neu, мышей иммунизировали B/AdHM и B/AdHM/αGalCer соответственно, а затем измеряли титр анти-Her-2/neu антител в сыворотке. В результате титр анти-Her-2/neu антитела удерживался на высоком уровне в течение длительного времени в обеих группах, иммунизированных B/AdHM и B/AdHM/αGalCer (см. Фиг. 27). В отличие от групп, иммунизированных только В-клетками (B) и B/αGalCer, гуморальный иммунный ответ генерировался в обеих группах, иммунизированных B/AdHM и B/AdHM/αGalCer (см. Фиг. 28).
Через одну неделю после иммунизации вакциной на основе В-клеток авторы настоящего изобретения выполнили внутривенную инъекцию мышиных/крысиных опухолевых клеток, экспрессирующих Her-2/neu (TAUF), с последующим изучением выживаемости. В результате мыши, которым вводили либо В-клетки, нагруженные αGalCer (B/αGalCer), либо В-клетки, трансдуцированные AdHM (B/AdHM), выживали дольше, чем те, которым вводили только В-клетки. Более того, противоопухолевый эффект у мышей, которым вводили В-клетки, трансдуцированные аденовирусом, экспрессируют Her-2/neu и нагруженные αGalCer был более значительным, чем у мышей, иммунизированных B/AdHM (см. Фиг. 29). Следовательно, было подтверждено, что В-клеточная вакцина, нагруженная αGalCer и трансдуцированная аденовирусом, может эффективно индуцировать иммунные реакции для профилактики опухолей.
Для подтверждения терапевтического эффекта В-клеточной вакцины мышей BALB/c иммунизировали B, B/αGalCer, B/AdHM и B/AdHM/αGalCer соответственно, с последующим внутривенным введением TAUF в хвостовую вену для приживления рака легких. В результате самое короткое время выживания наблюдалось в группе мышей, обработанных только В-клетками, а результат в группе, обработанной B/αGalCer вакциной, был сходно коротким. В то же время период выживания был более или менее пролонгированным в группе мышей, обработанной вакциной B/AdHM, по сравнению с группами, обработанными В или B/αGalCer, но образование опухоли не было полностью подавлено. Но период выживания был гораздо длиннее в группе, обработанной B/AdHM/αGalCer, по сравнению со всеми остальными группами, и, следовательно, противоопухолевый эффект в группе B/AdHM/αGalCer был больше, чем в любых других иммунизированных группах (см. Фиг. 29).
Вакцина согласно изобретению может дополнительно к лиганду Т-клеток-природных киллеров и В-клеткам содержать один или несколько эффективных ингредиентов, обладающих тем же или сходным эффектом. Вакцина также может включать в себя в дополнение к упомянутым выше эффективным ингредиентам один или несколько фармацевтически приемлемых носителей для введения. Фармацевтически приемлемый носитель может быть выбран или получен перемешиванием нескольких ингредиентов, выбранных из группы, состоящей из солевого раствора, стерильной воды, раствора Рингера, забуференного солевого раствора, раствора декстрозы, раствора мальтодекстрозы, глицерина и этанола. Можно добавлять другие общие добавки, такие как антиокислитель, буферный раствор, бактериостатический агент и т.д. для получения инъекционных растворов, таких как водный раствор, суспензия и эмульсия, разбавители, диспергирующие агенты, поверхностно-активные вещества, связующие и смазывающие вещества можно дополнительно добавлять. Вакцина согласно изобретению в дальнейшем может быть получена в подходящих формах для каждого заболевания или в соответствии с ингредиентами по способу, представленному у Remington's Pharmaceutical Science (в последней редакции), Mack Publishing Company, Easton PA.
Вакцину согласно изобретению можно вводить парентерально и такое парентеральное введение включает в себя подкожную инъекцию, внутривенную инъекцию, внутримышечную инъекцию и внутригрудную инъекцию. Для получения вакцины в виде состава для парентерального введения В-клетки, нагруженные лигандом Т-клеток-природных киллеров, В-клетки, нагруженные лигандом Т-клеток-природных киллеров и пептидом, или В-клетки, трансдуцированные вирусом, экспрессирующим опухолевый антиген, смешивают со стабилизатором или буферным агентом для получения раствора или суспензии, которые потом предоставляли в виде ампул или флаконов (см. стандарт для получения вирусного вектора, используемого для трансдукции дендритных клеток).
Вакцину можно вводить эффективной дозой для индукции иммунного ответа у пациента. Например, вакцину можно вводить людям однократно или несколько раз в день дозировкой 1·103~1·109 клеток/кг, и более предпочтительно 1·104 клеток/кг ~ 1·108 клеток/кг. Для получения В-клеточной вакцины, нагруженной αGalCer, среда должна быть дополнена αGalCer в концентрации 1-2 мкг/мл на 1·106-1·107 В-клеток/мл. Для получения В-клеточной вакцины, сенсибилизированной совместно αGalCer и пептидом, среда должна быть дополнена αGalCer в концентрации 1-2 мкг/мл на 1·106~1·107 В-клеток/мл и пептидом в концентрации 1-10 мкг/мл на 1·106~1·107 В-клеток/мл.
По-видимому, αGalCer не индуцирует токсичность у грызунов и обезьян (Nakata et al., Cancer Res., 58: 1202-1207, 1998). При введении мышам 2200 мкг/кг побочных эффектов не отмечалось (Giaccone et al., Clin. Cancer Res., 8: 3702, 2002). В результате клинического испытания отмечалась слабая головная боль как побочный эффект в соответствии с системным введением αGalCer (Mie Nieda et al., Blood, 103: 383-389, 2004, Giaccone et al., Clin. Cancer Res., 8: 3702, 2002), которую можно предотвратить приемом парацетамола. Это небольшая, если вообще есть, возможность показать небольшой системный побочный эффект (Giaccone et al., Clin. Cancer Res., 8: 3702, 2002). В настоящем изобретении αGalCer не вызывал дозо-зависимой токсичности (50-4800 мкг/м2) и продемонстрировал резистентность на протяжении всего исследования с повышением дозы, что указывает на то, что αGalCer является весьма безопасным веществом.
Настоящее изобретение включает в себя антигенные пептиды вирусного, бактериального, грибкового, паразитарного и опухолевого происхождения и введенный антиген в В-клетки, опосредованный вирусным вектором, включает в себя антиген вирусного, бактериального, грибкового, паразитарного и опухолевого происхождения.
«Антиген» означает любое вещество (например, белок, пептид, опухолевые клетки, гликопротеин, гликолипид, живой вирус, убитый вирус, ДНК и т.д.), которое способно индуцировать иммунный ответ при распознавании его иммунной системой, когда оно проникает в хозяина. Антиген может быть получен в очищенном или неочищенном виде, но очищенная форма является предпочтительной. Антиген согласно изобретению включает в себя патогенный белок, рекомбинантный белок, пептид, полисахарид, гликопротеин, липополисахарид и молекулу ДНК (полинуклеотид), опухолевые клетки, живые вирусы и убитые вирусы.
Антигены, представленные в приведенном ниже перечне антигенов, могут быть предоставлены в качестве инструмента для индукции иммунного ответа вместо ассоциированного с опухолью антигена в Примерах изобретения, но не всегда ограничены этим перечнем. Перечень включает в себя антиген вируса гриппа (гемагглютинин и нейраминидазный антигены), антиген Bordetella pertussis (коклюшевый токсин, нитевидный гемагглютинин и пертактин), антиген вируса папилломы человека (HPV) (гликопротеин), антиген Helicobacterpylori (капсульные полисахариды серогруппы A, B, C, Y и W-135), столбнячный токсоид, дифтерийный антиген (дифтерийный токсоид), пневмококковый антиген (капсульный полисахарид Streptococcus pnemoniae 3 типа, туберкулезный антиген, антиген вируса иммунодефицита человека (HIV) (GP-120, GP-160, p18, Tat, Gag, Pol и Env), холерный антиген (В субъединица холерного токсина), антиген стафилококка (стафилококковый энтеротоксин B), антиген шигеллы (полисахариды шигеллы), антиген вируса везикулярного стоматита (гликопротеин вируса везикулярного стоматита), антиген цитомегаловируса (CMV), антиген гепатита (антигены гепатита A(HAV), B(HBV), C(HCV), D(HDV) и G(HGV)) (коровый антиген и поверхностные антигены), антиген респираторно-синцитиального вируса (RSV), антигены простого герпеса или их сочетания (например, дифтерии, коклюша и столбняка, DPT), антиген Borrelia sp. (например, антигены OspA, OspB и OspC), антиген Candida albicans (например, MP65) и антиген плазмодия (например, белок CS).
Опухолевый антиген образуется путем соматической мутации гена дикого типа. Злокачественный антиген включает в себя антиген, специфичный к опухоли, придающий генетическую нестабильность опухолевой клетке, и ассоциированный с опухолью антиген, эндогенный аутоантиген, который экспрессируется больше в опухолевых клетках и временно экспрессируется на стадии развития опухоли или экспрессируется в специфической ткани ограниченно. Примером специфичного к опухоли антигена может служить HPV E6/E7, который представляет собой антиген злокачественного вируса, а ассоциированный с опухолью антиген может быть проиллюстрирован gp100, тирозиназой, TRP-1 (родственный тирозиназе белок-1), TRP-2 (родственный тирозиназе белок-2), MAGE, MUC-1, CEA (карнцероэмбриональный антиген), p53, альфа-фетопротеин и Her-2/neu, и т.д. (Rosenberg SA., Nature, 17; 411 (6835): 380-4, 2001).
Описание чертежей
Применение предпочтительных вариантов осуществления изобретения лучше всего понятно со ссылкой на сопровождающие чертежи, на которых:
на Фиг. 1 - Фиг. 3 представлены графики, иллюстрирующие реципрокную активацию между iNKТ-клетками и В-клетками, нагруженными αGalCer;
на Фиг. 1 представлена серия графиков, иллюстрирующих, что В-клетки очищали из селезенки после истощения CD11c+ клеток с последующим измерением экспрессии CD19, CD11c и CD1d с помощью проточной цитометрии;
на Фиг. 2 представлена серия графиков, иллюстрирующих, что мышам C57BL/6 дикого типа или мышам Jα281-/- вводили только наполнитель, свободную форму αGalCer, или В-клетки, нагруженные αGalCer (B/αGalCer) или ДК (ДК/αGalCer), а затем получали спленоциты от мышей-реципиентов и анализировали клетки, продуцирующие IL-4 и IFN-γ, анализировали с помощью анализа ELISPOT;
на Фиг. 3 представлена серия графиков, иллюстрирующих, что В-клетки, нагруженные наполнителем или αGalCer, окрашивали CFSE и вводили мышам C57BL/6. Анализировали CFSE+ клетки из спленоцитов;
на Фиг. 4 - Фиг. 6 представлены графики, демонстрирующие, что В-клетки, сенсибилизированные совместно αGalCer и пептидом (OVA257-264), активируют пептид-специфические CD8+ Т-клетки;
на Фиг. 4 представлена серия графиков, иллюстрирующих, что CD8+ Т-клетки, специфичные к OVA257-264, меченные CFSE (OT-I Т-клетки), переносили мышам C57BL/6, которым вводили B/наполнитель, B/αGalCer, B/pep или B/αGalCer/pep соответственно. Затем исследовали пролиферацию OT-1 Т-клеток и секрецию цитокинов с помощью проточной цитометрии;
на Фиг. 5 представлена серия графиков, иллюстрирующих, что мышей C57BL/6 вакцинировали указанными формами В-клеток (только B, B/αGalCer, B/pep или B/αGalCer/pep). Одну, три или пять недель спустя проводили in vivo исследование CTL путем введения сингенных мишеней, меченных CFSE;
CFSEhigh: сенсибилизированная пептидом мишень;
CFSElow: несенсибилизированный пептидом контроль;
на Фиг. 6 представлена серия графиков, иллюстрирующих, что ответ CD8+ Т-клеток, продуцирующих IFN-γ, на повторную стимуляцию OVA257-264 in vitro рассчитывали 7 дней спустя после введения вакцин на основе В-клеток (слева) или 7 дней после дополнительного прайминга CTL с использованием сингенных спленоцитов, нагруженных OVA257-264 (справа);
на Фиг. 7 и Фиг. 8 представлены графики сравнения эффективности выработки цитотоксических Т-лимфоцитов между клеточной вакциной на основе В-клеток и на основе ДК;
на Фиг. 7 представлена серия графиков, иллюстрирующих, что B/αGalCer/pep и ДК/αGalCer/pep, сенсибилизированные пептидом OVA257-264, серийно разводили, затем вводили мышам, а затем измеряли цитотоксичность in vivo в отношении OVA257-264;
на Фиг. 8 представлена серия графиков, иллюстрирующих, что B/наполнитель/pep и ДК/наполнитель/pep, сенсибилизированные OVA257-264, вводили аналогичным образом, как описано на Фиг. 7, а затем измеряли цитотоксичность in vivo в отношении OVA257-264;
на Фиг. 9 и Фиг. 10 представлены графики, показывающие типы клеток, вовлеченных в CTL-ответ, индуцированный вакциной, на основе В-клеток;
на Фиг. 9 представлена серия графиков, иллюстрирующих, что В-клетки, совместно сенсибилизированные αGalCer и OVA257-264, вводили мышам. Мыши-реципиенты получ