Слитые белки связывающий домен-иммуноглобулин
Иллюстрации
Показать всеНастоящее изобретение относится к иммунологии и биотехнологии. Предложен слитый белок, содержащий от аминоконца к карбоксильному концу: полипептид связывающего домена, который связывается с биологической молекулой-мишенью; пептид шарнирной области IgG1 человека с одним цистеином; полипептид константной области СН2 тяжелой цепи иммуноглобулина и полипептид константной области СН3 тяжелой цепи иммуноглобулина. Слитый белок представляет собой смесь мономеров и димеров, имеет ADCC, CDC или оба вида цитотоксичности. Описаны также фармкомпозиция и способ лечения В-клеточного расстройства с использованием слитого белка. Использование изобретения может найти дальнейшее применение в медицине при лечении В-клеточных расстройств. 3 н. и 23 з.п. ф-лы, 27 ил.
Реферат
ПРЕДПОСЫЛКА ИЗОБРЕТЕНИЯ
Данное изобретение, в общем, относится к иммунологически активным рекомбинантным связывающим белкам и, в частности, к сконструированным молекулам слитых белков связывающий домен-иммуноглобулин, включая слитые белки одноцепочечный Fv-иммуноглобулин. Данное изобретение также относится к композициям и способам лечения злокачественных состояний и В-клеточных нарушений, включая заболевания, для которых характерна продукция аутоантител.
Молекула иммуноглобулина состоит из двух идентичных легких цепей и двух идентичных тяжелых цепей, которые связаны в макромолекулярный комплекс межцепочечными дисульфидными связями. Внутрицепочечные дисульфидные связи связывают различные области одной и той же полипептидной цепи, и это приводит к образованию петель, которые вместе с расположенными рядом аминокислотами образуют домены иммуноглобулина. Каждая легкая цепь и каждая тяжелая цепь имеет одну вариабельную область, которая проявляет значительную изменчивость аминокислотного состава от антитела к антителу. Вариабельная область легкой цепи, VL, связана с вариабельной областью тяжелой цепи, VH, образуя антигенсвязывающий сайт иммуноглобулина, Fv. Легкие цепи имеют один домен константной области, а тяжелые цепи имеют несколько доменов константной области. Классы IgG, IgA и IgE имеют три домена константной области, которые обозначены CH1, CH2 и CH3, а классы IgM и IgE имеют четыре домена константной области.
Тяжелые цепи иммуноглобулинов можно разделить на три функциональные области: Fd, шарнир и Fc. Область Fd содержит домены VH и CH1 и вместе с легкой цепью образует Fab. Обычно считают, что фрагмент Fc отвечает за эффекторные функции иммуноглобулина, такие как фиксация комплемента и связывание с Fc-рецепторами. Шарнирная область, выявленная в классах IgG, IgA и IgD, действует как гибкий спейсер, позволяя Fab-части свободно перемещаться в пространстве. В отличие от константных областей шарнирные домены разнообразны по структуре, и варьируют как по последовательности, так и по длине среди классов и подклассов иммуноглобулинов. Например, три подкласса IgG человека, IgG1, IgG2 и IgG4, имеют шарнирные области из 12-15 аминокислот, тогда как IgG3 содержит примерно 62 аминокислоты, включая 21 остаток пролина и 11 остатков цистеина. Согласно кристаллографическим исследованиям шарнир, кроме того, можно функционально подразделить на три области: верхний шарнир, центральная часть и нижний шарнир (Shin et al., Immunological Reviews 130: 87 (1992)). Верхний шарнир включает в себя аминокислоты от карбоксильного конца CH1 до первого остатка в шарнире, который ограничивает движение, как правило, до первого остатка цистеина, который образует межцепочечную дисульфидную связь между двумя тяжелыми цепями. Длина верхней шарнирной области коррелирует с гибкостью участков антитела. Центральная шарнирная область содержит дисульфидные мостики внутри тяжелых цепей, и нижняя шарнирная область связана с аминоконцом домена CH2 и включает в себя остатки в CH2 (там же). Центральная шарнирная область IgG1 человека содержит последовательность Cys-Pro-Pro-Cys, которая при образовании дисульфидных связей дает циклический октапептид, предположительно действующий как точка поворота, придавая таким образом гибкость. Шарнирная область также может содержать сайты присоединения углеводов. Например, IgA1 содержит пять сайтов для углеводов в пределах участка шарнирной области из 17 аминокислот, придавая шарниру исключительную устойчивость к протеазам кишечника, что считается свойством, дающим преимущество секретируемому иммуноглобулину.
Конформационные изменения, допускаемые структурой и гибкостью шарнирной области, могут влиять на эффекторные функции Fc-части антитела. Три основных категории эффекторных функций, связанных с Fc-областью, включают (1) активацию классического каскада комплемента, (2) взаимодействие с эффекторными клетками и (3) компартментализацию иммуноглобулинов. Различные подклассы IgG человека варьируют по своей относительной эффективности в активации и усилении стадий каскада комплемента. В общем, IgG1 и IgG3 наиболее эффективно фиксируют комплемент, IgG2 менее эффективен и IgG4 не активирует комплемент. Активация комплемента инициируется связыванием C1q, субъединицы первого компонента C1 в каскаде, с комплексом антиген-антитело. Хотя сайт связывания C1q локализован в CH2-домене антитела, шарнирная область влияет на способность антитела активировать каскад. Например, рекомбинантные иммуноглобулины, в которых отсутствует шарнирная область, не способны активировать комплемент (там же). В отсутствии гибкости, придаваемой шарнирной областью, Fab-часть антитела, связанная с антигеном, не способна принимать конформацию, необходимую для того, чтобы дать возможность C1q связаться с CH2 (смотри там же). Исследования показали, что длина шарнира и гибкость участков коррелирует с активацией комплемента; однако корреляция не является абсолютной. Молекулы IgG3 человека с измененными шарнирными областями, которые являются такими же негибкими, как IgG4, все еще эффективно активируют каскад.
Отсутствие шарнирной области также влияет на способность IgG-иммуноглобулинов человека связываться с рецепторами Fc на иммунных эффекторных клетках. Связывание иммуноглобулина с рецептором Fc способствует зависимой от антител клеточной цитотоксичности (ADCC), которая предположительно является важным способом элиминации опухолевых клеток. Семейство рецепторов Fc IgG человека делится на три группы, FcγRI (CD64), который способен с высокой аффинностью связывать IgG, FcγRII (CD32) и FcγRIII (CD16), которые оба являются низкоаффинными рецепторами. Молекулярное взаимодействие между каждым из трех рецепторов и иммуноглобулином точно не установлено, но эксперименты свидетельствуют о том, что остатки в проксимальной по отношению к шарниру области домена CH2 имеют важное значение для специфичности взаимодействия между антителом и рецептором Fc. Кроме того, белки IgG1 миеломы и рекомбинантные химерные IgG3-антитела, в которых отсутствует шарнирная область, не способны связывать FcγRI, вероятно, вследствие того, что снижена доступность к CH2 (Shin et al., Intern. Rev. Immunol. 10: 177, 178-79 (1993)).
Технология моноклональных антител и генно-инженерные способы привели к быстрой разработке молекул иммуноглобулинов для диагностики и лечения заболеваний человека. Конструирование белков применяли для повышения аффинности антитела по отношению к узнаваемому им антигену, чтобы уменьшить проблемы, связанные с иммуногенностью, и чтобы изменить эффекторные функции антитела. Доменная структура иммуноглобулинов поддается конструированию, при котором можно произвести обмен антигенсвязывающими доменами и доменами, придающими эффекторные функции, между классами и подклассами иммуноглобулинов.
Кроме того, сконструированы меньшие по размеру молекулы иммуноглобулинов, чтобы преодолеть проблемы, связанные с терапией на основе целых иммуноглобулинов. Одноцепочечные Fv (scFv) содержат вариабельный домен тяжелой цепи, связанный посредством короткого линкерного пептида с вариабельным доменом легкой цепи (Huston et al. Proc. Natl. Acad. Sci. USA, 85: 5879-83, 1988). Вследствие небольшого размера молекул scFv наблюдается очень быстрый клиренс их из плазмы и тканей и более эффективное проникновение в ткани, чем целого иммуноглобулина. Антиопухолевые scFv показали более быстрое проникновение в опухоль и более равномерное распределение в массе опухоли, чем соответствующее химерное антитело (Yokota et al., Cancer Res. 52, 3402-08 (1992)). Слияние scFv с другой молекулой, такой как токсин, обладает преимуществом специфичной антигенсвязывающей активности и небольшого размера scFv для доставки токсина в ткань-мишень (Chaudary et al., Nature 339: 394 (1989); Batra et al., Mol. Cell. Biol. 11: 2200 (1991)).
Несмотря на преимущества, которые приносят молекулы scFv для серотерапии, существует несколько недостатков данного терапевтического подхода. Хотя быстрый клиренс scFv может снижать токсические эффекты в нормальных клетках, такой быстрый клиренс может препятствовать доставке минимальной эффективной дозы в ткань-мишень. Производство адекватных количеств scFv для введения пациентам явилось сложной задачей вследствие трудностей, связанных с экспрессией и выделением scFv, которые неблагоприятно влияют на выход. Во время экспрессии молекулы scFv нестабильны и часто агрегируют в результате спаривания вариабельных областей из разных молекул. Кроме того, уровни продукции молекул scFv в экспрессирующих системах млекопитающих низкие, что ограничивает возможность эффективного производства молекул scFv для терапии (Davis et al., J. Biol. Chem. 265: 10410-18 (1990); Traunecker et al., EMBO J. 10: 3655-59 (1991)). Выявлены методики повышения продукции, включающие добавление сайтов гликозилирования к вариабельным областям (Jost, C. R. Патент США №5888773, Jost et al., J. Biol. Chem. 269: 26267-73 (1994)).
Конъюгирование или слияние токсинов с scFv дает очень эффективную молекулу, но дозирование ограничено токсичностью, обусловленной молекулой токсина. Токсические воздействия включают повышение уровней ферментов печени и синдром заменения проницаемости сосудов. Кроме того, иммунотоксины являются высоко иммуногенными и антитела хозяина, вырабатываемые против токсина, ограничивают возможность повторного лечения.
Дополнительным недостатком использования scFv для терапии является отсутствие эффекторной функции. scFv при отсутствии цитолитических функций, ADCC и зависимой от комплемента цитотоксичности (CDC), связанных с константной областью иммуноглобулина, могут быть неэффективными при лечении заболевания. Хотя разработка методики scFv начата 12 лет назад, в настоящее время нет scFv-продуктов, одобренных для терапии.
Преимущество эффекторных функций, связанных с константной областью антитела, для лечения заболевания побудило к разработке слитых белков, в которых неиммуноглобулиновые последовательности заменяют вариабельной областью антитела. Например, CD4, поверхностный белок T-клеток, распознаваемый HIV, рекомбинантным способом сливали с эффекторным доменом Fc иммуноглобулина (Смотри Sensel et al., Chem. Immunol. 65: 129-158 (1997)). Биологическая активность такой молекулы отчасти будет зависеть от класса и подкласса выбранной константной области. Слитый белок IL-2-IgG1 влиял на опосредованный комплементом лизис клеток, несущих рецептор IL-2 (Смотри там же). Применение константных областей иммуноглобулинов для конструирования указанных и других слитых белков также может придавать улучшенные фармакокинетические свойства.
Заболевания и расстройства, которые, как считают, поддаются некоторым типам иммуноглобулиновой терапии, включают рак и расстройства иммунной системы. Рак включает широкий круг заболеваний, поражающих примерно одного из четырех людей во всем мире. Быстрая и неконтролируемая пролиферация злокачественных клеток является признаком многих типов злокачественных опухолей, включая гематологические злокачественные образования. Наибольшую пользу достижения в области терапии злокачественных опухолей в последние два десятилетия принесли пациентам с гематологическим злокачественным состоянием (Multani et al., J. Clin. Oncology 16: 3691-3710, 1998). Хотя возросла доля ремиссий, у большинства пациентов еще возникают рецидивы и они умирают из-за болезни. Препятствия для лечения цитотоксическими лекарственными средствами включают резистентность опухолевых клеток и высокую токсичность химиотерапии, которые мешают оптимальному дозированию для многих пациентов. Новые способы лечения, основанные на том, чтобы направлять к мишени молекулы, которые специфично связываются со злокачественной клеткой, включая моноклональные антитела (мАт), которые повышают эффективность, не увеличивая токсичность.
С тех пор как в 1975 году впервые были описаны мАт (Kohler et al., Nature 256: 495-97 (1975)), многие пациенты подверглись лечению мАт к антигенам, экспрессируемым на опухолевых клетках. Указанные исследования принесли важный опыт, касающийся выбора антигенных мишеней, подходящих для терапии. Во-первых, и наиболее важно, антигенная мишень не должна экспрессироваться важными нормальными тканями. К счастью злокачественные клетки крови экспрессируют много антигенов, которые не экспрессируются стволовыми клетками или другими жизненно важными клетками. Лечение гематологического злокачественного состояния, которое истощает популяции как нормальных, так и злокачественных клеток гематологического происхождения, приемлемо, так как после окончания терапии происходит регенерация нормальных клеток из предшественников. Во-вторых, антигенная мишень должна экспрессироваться на всех клоногенных популяциях опухолевых клеток, и экспрессия должна продолжаться, несмотря на избирательное давление иммуноглобулиновой терапии. Таким образом, выбор поверхностного идиотипа для терапии В-клеточной злокачественности ограничен ростом вариантов опухолевых клеток с измененной экспрессией поверхностных идиотипов, даже если антиген проявляет высокую степень избирательности по отношению к опухоли (Meeker et al., N. Engl. J. Med. 312: 1658-65 (1985)). В-третьих, выбранный антиген должен правильным образом перемещаться после связывания с ним иммуноглобулина. Сброс или интернализация антигенной мишени после того, как иммуноглобулин связывается с антигеном, может давать опухолевым клеткам возможность избежать разрушения, ограничивая таким образом эффективность серотерапии. В-четвертых, результатом связывания иммуноглобулина с антигенными мишенями, которые передают сигналы активации, могут быть усиленные функциональные ответы в опухолевых клетках, которые приводят к остановке роста и апоптозу. Хотя важны все указанные свойства, запуск апоптоза после связывания иммуноглобулина с антигеном может быть критическим фактором достижения успешной серотерапии.
Антигены, которые были тестированы в качестве мишеней для серотерапии B- и T-клеточных злокачественных опухолей, включают идиотип Ig (Brown et al., Blood 73: 651-61 (1989)), CD19 (Hekman et al., Cancer Immunol. Immunother. 32: 364-72 (1991); Vlasveld et al., Cancer Immunol. Immunother. 40: 37-47 (1995)), CD20 (Press et al., Blood 69: 584-91 (1987); Maloney et al., J. Clin. Oncol. 15: 3266-74, (1997)), CD21 (Scheinberg et. al., J. Clin. Oncol. 8: 792-803, (1990)), CD5 (Dillman et al., J. Biol. Respn. Mod. 5: 394-410 (1986)) и CD52 (CAMPATH) (Pawson et al., J. Clin. Oncol. 15: 2667-72, (1997)). Из них наибольшего успеха достигли с использованием CD20 в качестве мишени для терапии B-клеточных лимфом. Каждая из других мишеней была ограничена биологическими свойствами антигена. Например, поверхностный идиотип может быть изменен соматической мутацией, обеспечивающей спасение опухолевой клетки. CD5, CD21 и CD19 быстро интернализуются после связывания мАт, позволяя опухолевым клеткам избежать разрушения, если мАт не конъюгированы с токсичными молекулами. CD22 экспрессируется только на подгруппе В-клеточных лимфом, тогда как CD52 экспрессируется как на T-клетках, так и на B-клетках и вызывает иммуносупрессию из-за истощения популяции Т-клеток.
CD20 удовлетворяет описанным выше критериям для выбора подходящей антигенной мишени для терапии B-клеточного злокачественного состояния. Лечение пациентов с В-клеточной лимфомой низкой степени злокачественности или фолликулярной В-клеточной лимфомой с использованием химерного CD20-мАт индуцирует частичные или полные реакции у многих пациентов (McLaughlin et al., Blood 88: 90a (abstract, suppl. 1) (1996); Maloney et al., Blood 90: 2188-95 (1997)). Однако обычно происходит рецидив опухоли в течение периода времени от шести месяцев до одного года. Таким образом, необходимы дальнейшие усовершенствования серотерапии, чтобы индуцировать более продолжительные реакции при B-клеточной лимфоме низкой степени злокачественности и обеспечить возможность эффективного лечения лимфомы высокой степени злокачественности и других В-клеточных заболеваний.
Одним из подходов к улучшению серотерапии CD20 была целенаправленная доставка радиоизотопов к B-клеточным лимфомам с использованием мАт, специфичных по отношению к CD20. Хотя увеличивается эффективность терапии, также увеличивается связанная с этим токсичность из-за длительного периода полужизни радиоактивного антитела in vivo, иногда требующая того, чтобы подвергнуть пациента процедуре спасения стволовых клеток (Press et al., N. Eng. J. Med. 329: 1219-1224, 1993; Kaminski et al., N. Eng. J. Med. 329: 459-65 (1993)). мАт к CD20 расщепляли протеазами, получая фрагменты F(ab')2 или Fab до связывания с радиоизотопом. Это повышало проникновение радиоизотопного конъюгата в опухоль и укорачивало время полужизни in vivo, уменьшая таким образом токсичность по отношению к нормальным тканям. Однако теряются преимущества эффекторных функций, включая фиксацию комплемента и ADCC, которые обеспечивает Fc-область CD20-мАт.Таким образом, для улучшенной доставки радиоизотопов необходима методика получения производного CD20-мАт, которое сохраняет Fc-зависимые эффекторные функции, но меньше по размеру, тем самым усиливая проникновение в опухоль и укорачивая время полужизни мАт.
CD20 была первой поверхностной молекулой человека, специфичной для B-клеточной линии, идентифицированной с помощью моноклонального антитела, но функция CD20 в биологии B-клеток еще не полностью выяснена. CD20 является негликозилированным гидрофобным фосфопротеином с М.м. 35 кД, амино- и карбоксильный концы которого расположены в цитоплазме (Einfeld et al., EMBO J. 7: 711-17 (1988)). Природные лиганды CD20 идентифицированы не были. CD20 экспрессируется всеми нормальными зрелыми B-клетками, но не экспрессируется предшественниками B-клеток.
CD20-мАт доставляют сигналы к нормальным B-клеткам, которые влияют на жизнеспособность и рост (Clark et al., Proc. Natl. Acad. Sci. USA 83: 4494-98 (1986)). Недавние данные показали, что обширное сшивание CD20 могут индуцировать апоптоз линий клеток В-клеточной лимфомы (Shan et al., Blood 91: 1644-52 (1998)). Сшивание CD20 на поверхности клеток увеличивает значение и кинетику сигнальной трансдукции, которые регистрировали измерением фосфорилирования клеточных субстратов по остаткам тирозина (Deans et al., J. Immunol. 146: 846-53 (1993)). Важно, что апоптоз B-клеток лимфомы Рамоса так же индуцировался сшиванием CD20-мАт при добавлении клеток, позитивных в отношении Fc-рецептора (Shan et al., Blood 91: 1644-52 (1998)). Таким образом, кроме истощения популяции клеток посредством механизмов на основе комплемента и ADCC связывание Fc-рецептора CD20-мАт in vivo может стимулировать апоптоз злокачественных B-клеток посредством сшивания CD20. Данная теория согласуется с экспериментами, показывающими, что эффективность терапии с помощью CD20 человеческой лимфомы в модели на мышах SCID зависела от связывания Fc-рецептора мАт к CD20 (Funakoshi et al., J. Immunotherapy 19: 93-101 (1996)).
Полипептид CD20 содержит четыре трансмембранных домена (Einfeld et al., EMBO J. 7: 711-17, (1988); Stamenkovic et al., J. Exp.Med. 167: 1975-80 (1988); Tedder et al., J. Immunol. 141: 4388-4394 (1988)). Множественные домены, проходящие в мембране, предотвращают интернализацию CD20 после связывания с антителом. Указанное качество CD20 признано важным свойством для эффективной терапии В-клеточных злокачественных опухолей, когда мышиные CD20-мАт, 1F5, инъецировали пациентам с B-клеточной лимфомой, что приводило к значительному истощению популяции злокачественных клеток и частичным клиническим ответам (Press et al., Blood 69: 584-91 (1987)).
Поскольку нормальные зрелые B-клетки так же экспрессируют CD20, популяция нормальных B-клеток истощается во время терапии CD20-антителом (Reff M. E. et al., Blood 83: 435-445, 1994). Однако после завершения лечения нормальные B-клетки восстанавливаются из CD20-негативных предшественников B-клеток; таким образом, пациенты, которых лечили с помощью анти-CD20-терапии, не испытывают значительной иммуносупрессии. Истощение популяции нормальных B-клеток может быть полезным при заболеваниях, в которые вовлечена несвойственная продукция аутоантител, или других заболеваниях, в которых могут играть роль B-клетки. Химерное мАт, специфичное по отношению к CD20, состоящее из вариабельных областей тяжелой и легкой цепей мышиного происхождения, слитых с константными областями тяжелой цепи IgG1 человека и легкой каппа-цепи человека, сохраняют способность связываться с CD20 и опосредовать ADCC и фиксировать комплемент (Liu et al., J. Immunol. 139: 3521-26 (1987); Robinson et al., патент США No. 5500362). Указанная работа привела к разработке химерного CD20-мАт, ритуксимаба (RituximabTM), недавно одобренного Управлением по пищевым продуктам и медикаментам США (FDA) для лечения B-клеточных лимфом. Хотя после лечения ритуксимабом клинические ответы наблюдаются с высокой частотой, у пациентов часто возникают рецидивы примерно через 6-12 месяцев.
Для внутривенной инфузии требуются высокие дозы ритуксимаба, поскольку молекула является крупной, примерно 150 кД, и диффузия в лимфоидные ткани, где находится много опухолевых клеток, ограничена. Считают, что механизм противоопухолевой активности ритуксимаба заключается в комбинировании нескольких активностей, включая ADCC, фиксацию комплемента и запускание сигналов в злокачественных B-клетках, которые стимулируют апоптоз. Большой размер ритуксимаба препятствует оптимальной диффузии молекулы в лимфоидные ткани, которые содержат злокачественные B-клетки, тем самым ограничивая указанные противоопухолевые активности. Как обсуждалось выше, расщепление CD20-мАт протеазами на Fab- или F(ab')2-фрагменты делает их меньшего размера и позволяет лучше проникать в лимфоидные ткани, но эффекторные функции, важные для противоопухолевой активности, теряются. Хотя фрагменты CD20-мАт могут быть более эффективными для доставки радиоизотопов, чем интактное антитело, желательным было бы конструирование производного CD20-мАт, которое сохраняет эффекторные функции Fc-части, но меньше по размеру, способствуя лучшему проникновению в опухоли и характеризуясь более коротким временем полужизни.
CD20 экспрессируется злокачественными клетками B-клеточной природы, включая B-клеточную лимфому и хронический лимфоцитарный лейкоз (CLL). CD20 не экспрессируется злокачественными опухолями пре-B-клеток, такими как острый лимфобластный лейкоз. Таким образом, CD20 является хорошей мишенью для терапии B-клеточной лимфомы, CLL и других заболеваний, при которых B-клетки вовлечены в активность заболевания. Другие B-клеточные расстройства включают аутоиммунные заболевания, при которых продуцируются аутоантитела во время дифференцировки B-клеток в плазматические клетки. Примеры B-клеточных расстройств включают аутоиммунное заболевание щитовидной железы, включая болезнь Грейвса и тиреоидит Хашимото, ревматоидный артрит, системную красную волчанку (СКВ), синдром Шегрена, иммунную тромбоцитопеническую пурпуру (ITP), рассеянный склероз (MS), миастению (MG), псориаз, склеродерму и воспалительное заболевание кишечника, включая болезнь Крона и язвенный колит.
Из сказанного выше очевидна явная необходимость усовершенствования композиций и способов лечения злокачественных состояний и B-клеточных расстройств. Композиции и способы согласно данному изобретению преодолевают ограничения предшествующего уровня техники, предоставляя слитый белок связывающий домен-иммуноглобулин, содержащий полипептид связывающего домена, который слит с полипептидом шарнирной области иммуноглобулина, который слит с полипептидом константной области CH2 тяжелой цепи иммуноглобулина, слитым с полипептидом константной области CH3 тяжелой цепи иммуноглобулина, при этом слитый белок связывающий домен-иммуноглобулин способен опосредовать ADCC или фиксацию комплемента. Кроме того, композиции и способы обеспечивают другие связанные преимущества.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Аспектом данного изобретения является получение слитого белка связывающий домен-иммуноглобулин, содержащего (a) полипептид связывающего домена, который слит с полипептидом шарнирной области иммуноглобулина, где указанный полипептид шарнирной области выбран из группы, состоящей из (i) мутантного полипептида шарнирной области, который не содержит остатков цистеина и который получен из полипептида шарнирной области иммуноглобулина дикого типа, имеющего один или более остатков цистеина, (ii) мутантного полипептида шарнирной области, который содержит один остаток цистеина и который получен из полипептида шарнирной области иммуноглобулина дикого типа, имеющего два или более остатков цистеина, (iii) полипептида шарнирной области IgA дикого типа человека, (iv) мутантного полипептида шарнирной области IgA человека, который не содержит остатков цистеина и который получен из полипептида области IgA дикого типа человека, и (v) мутантного полипептида шарнирной области IgA человека, который содержит один остаток цистеина и который получен из полипептида области IgA дикого типа человека; (b) полипептид константной области CH2 тяжелой цепи иммуноглобулина, который слит с полипептидом шарнирной области; и (c) полипептид константной области CH3 тяжелой цепи иммуноглобулина, который слит с полипептидом константной области CH2, где: (1) слитый белок связывающий домен-иммуноглобулин способен проявлять, по меньшей мере, одну иммунологическую активность, выбранную из группы, состоящей из антителозависимой опосредованной клетками цитотоксичности и фиксации комплемента, и (2) полипептид связывающего домена способен специфично связываться с антигеном. В одном варианте полипептид шарнирной области иммуноглобулина является мутантным полипептидом шарнирной области и проявляет пониженную способность димеризоваться по сравнению с полипептидом шарнирной области человеческого иммуноглобулина G дикого типа. В другом варианте полипептид связывающего домена содержит, по меньшей мере, один полипептид вариабельной области иммуноглобулина, который является полипептидом вариабельной области легкой цепи иммуноглобулина или полипептидом вариабельной области тяжелой цепи иммуноглобулина. В следующем варианте полипептид вариабельной области иммуноглобулина получен из иммуноглобулина человека.
В другом варианте полипептид связывающего домена слитого белка связывающий домен Fv-иммуноглобулин содержит (a) по меньшей мере, один полипептид вариабельной области легкой цепи иммуноглобулина; (b) по меньшей мере, один полипептид вариабельной области тяжелой цепи иммуноглобулина и (c) по меньшей мере, один линкерный пептид, который слит с полипептидом (a) и с полипептидом (b). В следующем варианте полипептиды вариабельной области легкой цепи иммуноглобулина и вариабельной области тяжелой цепи иммуноглобулина получены из иммуноглобулинов человека.
В другом варианте, по меньшей мере, один из полипептидов - полипептид константной области CH2 тяжелой цепи иммуноглобулина и полипептид константной области CH3 тяжелой цепи иммуноглобулина, получен из тяжелой цепи иммуноглобулина человека. В другом варианте полипептиды константных областей CH2 и CH3 тяжелой цепи иммуноглобулина относятся к изотипу, выбранному из IgG человека и IgA человека. В другом варианте антиген выбран из группы, состоящей из CD19, CD20, CD37, CD40 и L6. В некоторых следующих вариантах описанного выше слитого белка линкерный полипептид содержит, по меньшей мере, один полипептид, имеющий аминокислотную последовательность Gly-Gly-Gly-Gly-Ser [SEQ ID NO: 21], и в некоторых других вариантах линкерный полипептид содержит, по меньшей мере, три повтора полипептида, имеющего аминокислотную последовательность Gly-Gly-Gly-Gly-Ser [SEQ ID NO: 21]. В некоторых вариантах полипептид шарнирной области иммуноглобулина содержит полипептид шарнирной области IgA человека. В некоторых вариантах полипептид связывающего домена содержит внеклеточный домен CD154. В некоторых вариантах полипептид связывающего домена содержит внеклеточный домен CD154 и, по меньшей мере, один полипептид вариабельной области иммуноглобулина.
В других вариантах изобретение относится к выделенному полинуклеотиду, кодирующему любой из описанных выше слитых белков связывающий домен-иммуноглобулин, и в связанных вариантах изобретение относится к рекомбинантной экспрессирующей конструкции, содержащей такой полинуклеотид, и в некоторых следующих вариантах изобретение относится к клетке-хозяину, трансформированной или трансфицированной такой рекомбинантной экспрессирующей конструкцией. В другом варианте изобретение относится к способу получения слитого белка связывающий домен-иммуноглобулин, включающему стадии (a) культивирования раскрытой здесь клетки-хозяина, в условиях, которые обеспечивают экспрессию слитого белка связывающий домен-иммуноглобулин; и (b) выделения слитого белка связывающий домен-иммуноглобулин из культуры клеток-хозяев.
Данное изобретение также относится к некоторым вариантам фармацевтической композиции, содержащей слитый белок связывающий домен-иммуноглобулин, который описан выше, в комбинации с физиологически приемлемым носителем. В другом варианте представлен способ лечения субъекта, у которого имеется или предположительно имеется злокачественное состояние или В-клеточное расстройство, включающий введение пациенту терапевтически эффективного количества описанного выше слитого белка связывающий домен-иммуноглобулин. В некоторых следующих вариантах злокачественным состоянием или В-клеточным расстройством является В-клеточная лимфома или заболевание, которое характеризуется продукцией аутоантител, и в некоторых других вариантах злокачественным состоянием или В-клеточным расстройством является ревматоидный артрит, миастения, болезнь Грейвса, сахарный диабет типа I, рассеянный склероз или аутоиммунное заболевание.
Указанные и другие аспекты данного изобретения станут более понятными при обращении к следующему подробному описанию и прилагаемым чертежам. Все указанные источники информации включены в данное описание в виде ссылки в полном объеме, так же как были бы включены по отдельности.
Краткое описание чертежей
На фигуре 1 показана последовательность DNA и расшифрованная аминокислотная последовательность [SEQ ID NO: 15] 2H7scFv-Ig, слитого белка связывающий домен-иммуноглобулин, способного специфично связывать CD20.
На фигуре 2 показаны уровни продукции 2Н7 scFv-Ig трансфицированными стабильными линиями СНО и получение стандартной кривой с помощью связывания очищенного 2Н7 scFv-Ig с клетками СНО, экспрессирующими CD20.
На фигуре 3 показан анализ в SDS-ПААГ различных препаратов выделенного белка 2H7scFv-Ig.
На фигуре 4 показана фиксация комплемента (фиг.4А) и опосредование антителозависимой клеточной цитотоксичности (ADCC, фиг.4В)) посредством 2H7scFv-Ig.
На фигуре 5 показано влияние одновременного лигирования CD20 и CD40 на рост нормальных В-клеток.
На фигуре 6 показано влияние одновременного лигирования CD20 и CD40 на экспрессию CD95 и индукцию апоптоза в лимфобластоидной В-клеточной линии.
На фигуре 7 показана последовательность DNA и расшифрованная аминокислотная последовательность слитых белков связывающий домен-иммуноглобулин 2H7scFv-CD154 L2 (фиг.7А, SEQ ID NO:21 и 33) и 2H7scFv-CD154 34 (фиг.7 В, SEQ ID NO:22 и 34), способных специфично связывать CD20 и CD40.
На фигуре 8 показано связывание слитых белков связывающий домен-иммуноглобулин 2H7scFv-CD154 с СНО-клетками CD20+с помощью проточной иммуноцитофлуорометрии.
На фигуре 9 показано связывание аннексина V с линиями В-клеток Ramos, ВJAB и Т51 после связывания с клетками слитого белка связывающий домен-иммуноглобулин 2H7scFv-CD154.
На фигуре 10 показано влияние на пролиферацию В-клеточной линии Т51 после связывания слитого белка связывающий домен-иммуноглобулин 2H7scFv-CD154.
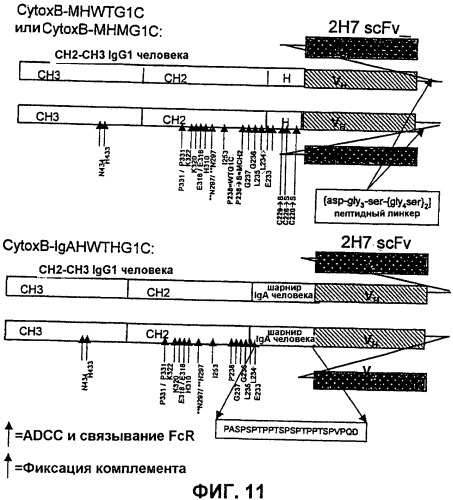
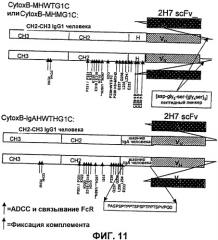
На фигуре 11 изображено схематичное представление структур слитых белков, 2H7ScFv-Ig [SEQ ID NO:16, 17 и 18], называемых производными CytoxB или CytoxB: CytoxB-MHWTG1C (2H7-ScFv, мутантный шарнир, Fc-домен человеческого IgG1 дикого типа), CytoxB-MHMG1C (2H7-ScFv, мутантный шарнир, мутантный Fc-домен IgG1 человека) и CytoxB-IgAHWTHG1C (2H7-ScFv, шарнир, полученный из IgA человека, соответственно, Fc-домен IgG1 дикого типа человека). Стрелками указаны номера положений аминокислотных остатков, которые предположительно участвуют в связывании FcR и в активности ADCC (темные стрелки), и в фиксации комплемента (светлые стрелки). Межцепочечные дисульфидные связи не указаны.
На фигуре 12 показан анализ в SDS-ПААГ выделенных слитых белков связывающий домен-иммуноглобулин CytoxB и 2H7scFv-CD154.
На фигуре 13 показана антителозависимая опосредованная клетками цитотоксическая (ADCC) активность производных CytoxB.
На фигуре 14 показана комплемент-зависимая цитотоксичность (CDC) производных CytoxB.
На фигуре 15 показаны определения времени полужизни в сыворотке CytoxB-MHWTG1C в образцах крови макак.
На фигуре 16 показано влияние CytoxB-MHWTG1C на уровни циркулирующих В-клеток CD40+в образцах крови макак.
На фигуре 17 показаны уровни продукции HD37 (CD19-специфичного)-ScFv-Ig трансфицированными линиями клеток млекопитающих и получение стандартной кривой с помощью связывания очищенного HD37-ScFv-Ig с клетками, экспрессирующими CD19.
На фигуре 18 показаны уровни L6 (антиген карциномы)-ScFv-Ig трансфицированными стабильными линиями CHO и получение стандартной кривой с помощью связывания очищенного L6-ScFv-Ig с клетками, экспрессирующими антиген L6.
На фигуре 19 показана ADCC-активность слитых белков связывающий домен-иммуноглобулин 2H7-ScFv-Ig, HD37-ScFv-Ig и G28-1 (CD37-специфичного)-ScFv-Ig.
На фигуре 20 показана ADCC-активность слитых белков L6-ScFv-Ig.
На фигуре 21 показан анализ в SDS-ПААГ слитых белков L6-ScFv-Ig и 2H7-ScFv-Ig.
На фигуре 22 показан анализ в SDS-ПААГ слитых белков G28-1-ScFv-Ig и HD37-ScFv-Ig.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение направлено на слитые белки связывающий домен-иммуноглобулин и родственные композиции и способы, которые будут использованы в иммунотерапевтических и иммунодиагностических применениях и которые дают определенные преимущества по сравнению с антиген-специфичными полипептидами предшествующего уровня техники. Слитые белки согласно данному изобретению предпочтительно представляют собой одиночные полипептидные цепи, которые содержат в существенной части следующие слитые домены: полипептид связывающего домена, полипептид шарнирной области иммуноглобулина, полипептид константной области CH2 тяжелой цепи иммуноглобулина и полипептид константной области CH3 тяжелой цепи иммуноглобулина. В особенно предпочтительных вариантах полипептидные домены, из которых состоит слитый белок связывающий домен-иммуноглобулин, являются или получены из полипептидов, которые представляют собой продукты генных последовательностей человека, но изобретение не следует ограничивать таким образом, и в действительности оно может относиться к слитым белкам связывающий домен-иммуноглобулин, которые представлены в данном описании, которые получены из любого природного или искусственного источника, включая генетически сконструированные и/или мутантные полипептиды.
Данное изобретение частично относится к неожиданному наблюдению того, что приведенные в данном описании слитые белки связывающий домен-иммуноглобулин способны проявлять иммунологическую активность. Более конкретно указанные белки сохраняют способность принимать участие в хорошо известных иммунологических эффекторных активностях, включая антителозависимую опосредованную клетками цитотоксичность (ADCC, например, происходящее после связывания антигена на поверхности клеток контактирование и индукцию цитотоксических эффекторных клеток, несущих соответствующие Fc-рецепторы, таких как природные клетки-киллеры (NK), несущие FcRγIII, в соответствующих условиях) и/или фиксацию комплемента в случае комплемент-зависимой цитотоксичности (CDC, например, происходящее после связывания антигена на поверхности клеток, рекрутмент и активация цитолитических белков, которые являются компонентами каскада комплемента крови), несмотря на наличие структур, для которых не ожидали, что они способны стимулировать такие эффекторные активности. Как описано более подробно ниже, ADCC и CDC являются неожиданными функциями для мономерных белков, содержащих области тяжелой цепи иммуноглобулина, которые предпочтительны благодаря структурам, выбранным для рассматриваемых слитых белков, и, в частности, благодаря выбору полипептидов шарнирной области, в которых нарушена способность образовывать межцепочечные, дисульфидные связи гомодимеров.
Другим преимуществом, предоставляемым данным изобретением, является слитый полипептид связывающий домен-иммуноглобулин, который можно получить в значительных количествах, как правило, больших, чем обычно достигаемые количества в случае конструкций одноцепочечного антитела предшествующего уровня техники. В предпочтительных вариантах слитые полипептиды связывающий домен-иммуноглобулин согласно данному изобретению рекомбинантно экспрессируют в экспрессирующих системах млекопитающих, которые дают преимущество,