Способ конструирования штаммов дрожжей saccharomyces cerevisiae - стабильных продуцентов соматотропина человека, штамм дрожжей saccharomyces cerevisiae - стабильный продуцент соматотропина человека (варианты)
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии. Предлагается способ конструирования штаммов дрожжей - стабильных продуцентов гормона роста человека (соматотропина). Кроме того, предлагаются два штамма ВКПМ Y-3506 и ВКПМ Y-3507 - стабильных продуцента соматотропина человека. Штаммы-продуценты были получены путем последовательной интеграции в геном реципиентного штамма экспрессионных плазмид. Каждая плазмида несет в своем составе ген соматотропина (GH1), слитый с лидерной последовательностью, под контролем промотора GAL1, а также один из генов URA3, LEU2, TRP1 и HIS3, комплементирующих ауксотрофные мутации штамма-реципиента. Продуктивность полученных штаммов составляет 100-130 мг соматотропина на 1 л среды. 3 н.п. ф-лы, 7 ил.
Реферат
Изобретение относится к области биотехнологии и касается дрожжей вида Saccharomyces cerevisiae (S. cerevisiae), продуцирующих соматотропин (гормон роста) человека - рекомбинантный белок медицинского назначения.
Соматотропин человека (соматотропин) относится к группе анаболических гормонов. Недостаточность его в организме человека приводит к тяжелым последствиям - карликовости, сопровождаемой в большинстве случаев дегенеративными изменениями скелета и мышц, бесплодием, а иногда и задержкой умственного развития. Физиологический эффект соматотропина включает в себя увеличение роста и силы мышц, стимуляцию формирования костной и хрящевой тканей, повышение распада жира, улучшение сердечной деятельности (Hedge G.A, Colby H.D., Goodman R.L. Clinical endocrine physiology. W.B. Saunders company, 1987).
Гормон роста также обладает выраженным антиатерогенным эффектом (повышает уровень содержания липопротеинов высокой плотности [ЛПВП] и снижает уровень содержания липопротеинов низкой плотности [ЛПНП]). Показано, что люди с дефицитом гормона роста имеют повышенный риск кардиоваскулярной смертности (Материалы III Всероссийской научно-практической конференции «Актуальные проблемы нейроэндокринологии», Москва, 6-7 октября, 2003 г.). Существенным недостатком, препятствующим широкому применению соматотропина, является его высокая стоимость. Существующая технология производства рекомбинантного соматотропина с использованием штаммов Escherichia coli (E.coli) такова, что существенное снижение его себестоимости не представляется возможным.
Продуценты на основе E.coli синтезируют рекомбинантный соматотропин в двух видах - цитоплазматическом и секреторном. В промышленном производстве используется преимущественно цитоплазматический вид продукции как дающий наибольший выход целевого белка. Цитоплазматическая форма, тем не менее, имеет ряд серьезных недостатков. Так, в цитоплазме E.coli соматотропин аккумулируется в виде нерастворимых белковых агрегатов (телец включения), восстановление его нативной конформации и корректное замыкание дисульфидных связей требует проведения стадии рефолдинга белка с применением высоких концентраций хаотропных реагентов. При этом потери целевого белка составляют около 50%.
Дополнительные сложности вызывают удаление из состава белка N-концевого остатка метионина, придающего молекуле соматотропина иммуногенность (Sonoda H., Sugimura A. Biosci Biotechnol Biochem. 2008 72:2675-80; Singh S.M., Eshwari A.N., Garg L.C., Panda A.K. Methods Mol Biol. 2005, 308:163-76; Patra A.K., Mukhopadhyay R., Mukhija R., Krishnan A., Garg L.C., Panda A.K. Protein Expr Purif. 2000, 18:182-92; Pitukcheewanont P., Schwarzbach L., Kaufman F.R. J Pediatr Endocrinol Metab. 2002, 15:653-7).
С помощью эукариотических экспрессионных систем синтезируют секретируемую форму соматотропина, не содержащего N-концевого метионина, что существенно упрощает процесс его выделения и очистки. При этом рекомбинантный соматотропин, секретируемый, например, дрожжами Pichia pastoris, по своей структуре и биологической активности полностью соответствует нативному белку (Ascacio-Martinez J.A., Barrera-Saldana Н.А. Gene 2004; 340: 261-266). Дрожжи S. cerevisiae также секретируют полностью биологически активный соматотропин без N-концевого метионина. Продуктивность первых рекомбинантных штаммов S. cerevisiae в отношении гормона роста составляла не более 100 мкг/л (Tsiomenko A.B., Lupashin V.V., Morzunov S.A., Karpychev I.V., El'darov M.A., Bezhelarskaia S.N., Rubtsov P.M., Skriabin K.G., Kulaev I.S. Mol Biol (Mosk). 1990; 24: 1126-1133). Позже на основе S. cerevisiae был сконструирован штамм-продуцент KCTC 0331 ВР (US 6391585), секретировавший рекомбинантный соматотропин человека GH1 в количестве до 1,3 г/л. Однако обычно у дрожжевых штаммов, содержащих ген целевого белка на репликативной плазмиде Yep (к ним относится и штамм КСТС 0331 ВР), через 15-20 поколений значительная часть (до 30%) клеток утрачивает указанную плазмиду («Векторные системы молекулярного клонирования», М., 1991).
Низкая митотическая стабильность экспрессионных векторов в клетках штаммов-продуцентов рекомбинантного соматотропина создает трудности при использовании их в промышленности. Это делает актуальным конструирование стабильных продуцентов, способных сохранять свои свойства в ходе многократных последовательных пассажей.
Способы конструирования стабильных дрожжевых продуцентов рекомбинантного соматотропина человека известны. В качестве ближайшего аналога рассмотрим способ конструировния штамма и штамм дрожжей Hansenula polymorpha DLl/рНРальфаН - продуцент гормона роста человека hGH (GH1) (ДАН СССР, 1991, 391(2):390-393). Клоны этого штамма обладают 100% митотической стабильностью по маркеру LEU2, сцепленному с геном соматотропина, после 48 часов роста в неселективных условиях. Продуктивность штамма составляет 10-20 мг/л культуральной среды. В клетках рекомбинантного штамма H.polymorpha DLl/рНРальфаН ген GH1 находится под контролем промоторной и терминаторной областей гена метанолоксидазы МОХ H.polymorpha, секреция белка направляется лидерной областью α-фактора дрожжей S. cerevisiae.
Задача заявляемой группы изобретений - расширение арсенала способов конструирования штаммов S.cerevisiae - стабильных продуцентов соматотропина человека и конструирование штамма Saccharomyces cerevisiae - стабильного продуцента соматотропина человека.
Задача решена путем разработки способа конструирования штаммов дрожей Saccharomyces cerevisiae - стабильных продуцентов соматотропина человека и конструирования штаммов дрожжей Saccharomyces cerevisiae SCR-H1 и SCR-H2 - стабильных продуцентов соматотропина человека
Способ конструирования штаммов S. cerevisiae SCR-H1 и SCR-H2 - стабильных продуцентов секретируемого рекомбинантного соматотропина человека - осуществляют следующим образом: при конструировании ген соматотропина вводят в клетки реципиентного штамма дрожжей с использованием интегративных векторов, обеспечивших его стабильную хромосомную локализацию. В составе этих векторов ген соматотропина человека GH1 находится под контролем промотора GAL1 S. cerevisiae, секреция белка направляется либо исключительно лидерной пре-про-областью α-фактора дрожжей (в клетках штамма SCR-H1) либо в составе части векторов гибридной лидерной областью, содержащей модифицированный сигнальный пептид α-фактора дрожжей и про-область белка HSP150 S.cerevisiae (в клетках штамма SCR-H2).
Конструирование штаммов SCR-H1 и SCR-H2 осуществляют путем последовательного увеличения дозы гена соматотропина в геноме реципиентного штамма, которым служит лабораторный штамм S.cerevisiae GIL (MATα ura3 leu2 his3 trp1 gal80::leu2Δ), мутантный по гену репрессора gal80 и маркированный четырьмя ауксотрофными мутациями. Для этого в геном реципиентного штамма последовательно интегрируют сконструированные интегративные плазмиды р91-4, р91-9, р-91-13 (оба штамма), а также р91-14 (штамм SCR-H1) или р91-16 (штамм SCR-H2).
В состав каждой плазмиды вводят ген, комплементировавший одну из ауксотрофных мутаций штамма-реципиента, и экспрессионная кассета заключает промотор GAL1 S. cerevisiae, а также:
в плазмидах р91-4, р91-9, р-91-13 и р91-14 - ген соматотропина человека GH1, прецизионно (т.е. непосредственно друг за другом) слитый с последовательностью ДНК, кодирующей лидерную пре-про-область α-фактора дрожжей S. cerevisiae (Brake A.J., Merryweather J.P., Coit D.G., Heberlein U.A. Proc Natl Acad Sci USA. 1984, 81: 4642-4646);
в плазмиде р91-16 - ген соматотропина человека GH1, прецизионно слитый с последовательностью ДНК, кодирующей гибридную лидерную область, состоящую из модифицированного сигнального пептида α-фактора дрожжей и про-области белка HSP150 S. cerevisiae (Simonen M., Jämsä E., Makarow M. J Biol Chem. 1994, 269: 13887-92).
Лидерные области, использованные при конструировании штаммов-продуцентов SCR-H1 и SCR-H2, обеспечивают секрецию соматотропина в среду культивирования дрожжей.
Штаммы S. cerevisiae SCR-H1 и SCR-H2 - продуценты секретируемого рекомбинантного соматотропина человека депонированы во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) как S. cerevisiae ВКПМ Y-3506 и S. cerevisiae ВКПМ Y-3507 соответственно.
Характеристика заявляемых штаммов
Морфологическая
Клетки штаммов S. cerevisiae SCR-H1 и S. cerevisiae SCR-H2 при выращивании при температуре 28°C в течение 48 ч на агаризованной среде YPD следующего состава (в мас.%): пептон-2, дрожжевой экстракт - 1, глюкоза - 2, агар - 2, вода - остальное имеют сферическую форму, 2-5 мкм в диаметре. Клетки почкуются. Почкование истинное, многостороннее. Истинного мицелия не образуют.
Физиологическая
Клетки штаммов S. cerevisiae SCR-H1 и S. cerevisiae SCR-H2 активно сбраживают сахара: из моносахаридов - глюкозу, фруктозу, галактозу; из дисахаридов - сахарозу, мальтозу. Не сбраживают лактозу, инулин, ксилозу, арабинозу.
Хранение
Штаммы хранят при температуре -70°С в 20%-ном водном растворе глицерина.
Стабильность
Стабильность заявляемых штаммов сохраняется при 20 последовательных пересевах на агаризованной среде YPD при температуре 28°С.
Продукция соматотропина человека
При выращивании в колбах в жидкой неселективной среде YPD в течение 48 ч при температуре 28°С клетки штамма S. cerevisiae SCR-H1 продуцирует соматотропин человека в количестве до 100 мг/л среды, а клетки штамма SCR-H2 - в количестве до 150 мг/л среды.
Заявляемое изобретение проиллюстрировано следующими фигурами:
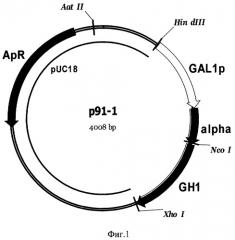
Фиг 1. Карта плазмиды р91-1. Обозначены: GAL1p - промотор гена GAL1 S. cerevisiae, alpha - последовательность, кодирующая лидерную пре-про-область α-фактора S. cerevisiae, GH1 - последовательность, кодирующая зрелый соматотропин человека, pUC18 - последовательность ДНК бактериальной плазмиды pUC18, ApR - ген бета-лактамазы.
Фиг 2. Карта экспрессионной плазмиды р91-4. Обозначены: URA3 - фрагмент хромосомной ДНК дрожжей, содержащей структурный ген URA3 S. cerevisiae, GAL1p -промотор гена GAL1 S. cerevisiae, alpha - последовательность, кодирующая лидерную пре-про-область α-фактора S. cerevisiae, GH1 - последовательность, кодирующая зрелый соматотропин человека, PGK1-5' и PGK1-3' - последовательности 5'- и 3'-области терминации транскрипции гена PGK1 S. cerevisiae, pUC18 - последовательность ДНК бактериальной плазмиды pUC18, ApR - ген бета-лактамазы. Перед трансформацией плазмида р91-4 была расщеплена по сайтам рестрикции XhoI для удаления бактериальной части из состава интегрируемого фрагмента ДНК и для направления его интеграции в геном дрожжей в область терминации транскрипции гена PGK1.
Фиг 3. Карта экспрессионной плазмиды р91-9. Обозначены: LEU2 - фрагмент хромосомной ДНК дрожжей, содержащей структурный ген LEU2 S. cerevisiae, GAL1p - промотор гена GAL1 S. cerevisiae, alpha - последовательность, кодирующая лидерную пре-про-область α-фактора S. cerevisiae, GH1 - последовательность, кодирующая зрелый соматотропин человека, sec1T - терминатор гена SEC1 S. cerevisiae, ty6-5' и ty6-3' -последовательности структурного гена TyA ретротранспозона Ty1 S. cerevisiae, pUC18 - последовательность ДНК бактериальной плазмиды pUC18, ApR - ген бета-лактамазы. Перед трансформацией плазмида р91-9 была расщеплена по сайтам рестрикции MluI для удаления бактериальной части из состава интегрируемого фрагмента ДНК и для направления его интеграции в геном дрожжей в область структурного гена ТуА ретротранспозона Ту1.
Фиг 4. Карта экспрессионной плазмиды р91-13. Обозначены: TRP1 - фрагмент хромосомной ДНК дрожжей, содержащей структурный ген TRP1 S. cerevisiae, GAL1p - промотор гена GAL1 S. cerevisiae, alpha - последовательность, кодирующая лидерную пре-про-область α-фактора S. cerevisiae, GH1 - последовательность, кодирующая зрелый соматотропин человека, аох1Т - область терминации транскрипции гена алкоголь-оксидазы АОХ1 Pichia pastoris, pUC18 - последовательность ДНК бактериальной плазмиды pUC18, ApR - ген бета-лактамазы. Перед трансформацией плазмида р91-13 была расщеплена по уникальному сайту рестрикции EcoRV для направления интеграции в геном дрожжей в область структурного гена TRP1.
Фиг 5. Карта экспрессионной плазмиды р91-14. Обозначены: HIS3 - фрагмент хромосомной ДНК дрожжей, содержащей структурный ген HIS3 S. cerevisiae, GAL1p - промотор гена GAL1 S. cerevisiae, alpha - последовательность, кодирующая лидерную пре-про-область α-фактора S. cerevisiae, GH1 - последовательность, кодирующая зрелый соматотропин человека, аох1Т - область терминации транскрипции гена алкоголь-оксидазы АОХ1 Pichia pastoris, pUC18 - последовательность ДНК бактериальной плазмиды pUC18, ApR - ген бета-лактамазы. Перед трансформацией плазмида р91-14 была расщеплена по уникальному сайту рестрикции KpnI для направления интеграции в геном дрожжей в область структурного гена HIS3.
Фиг 6. Карта плазмиды р91-16. Обозначены: HIS3 - фрагмент хромосомной ДНК дрожжей, содержащей структурный ген HIS3 S. cerevisiae, GAL1p - промотор гена GAL1 S. cerevisiae, hsp150 - последовательность, кодирующая гибридную лидерную область, содержащую про-область белка HSP150 S. cerevisiae, GH1 - последовательность, кодирующая зрелый соматотропин человека, аох1Т - область терминации транскрипции гена алкоголь-оксидазы АОХ1 Pichia pastoris, pUC18 - последовательность ДНК бактериальной плазмиды pUC18, ApR - ген бета-лактамазы. Перед трансформацией плазмида р91-16 была расщеплена по уникальному сайту рестрикции KpnI для направления интеграции в геном дрожжей в область структурного гена HIS3.
Фиг 7. Электрофореграмма образцов культуральной жидкости штамма-продуцента соматотропина S. cerevisiae SCR-H2. На дорожки нанесен белок, сконцентрированный из 50 мкл культуральной жидкости. В качестве стандарта наносили 5 мкг рекомбинантного соматотропина (препарат РАСТАН). Приведенные слева цифры - значения молекулярного веса белковых маркеров (в кДа).
Прилагаемые перечни последовательностей:
SEQ ID NO 1. Последовательность структурного гена рекомбинантного соматотропина человека GH1, слитого с лидерной пре-про-областью α-фактора S. cerevisiae.
SEQ ID NO 2. Последовательность структурного гена рекомбинантного соматотропина человека GH1, слитого с гибридной лидерной областью, содержащей модифицированный сигнальный пептид α-фактора S. cerevisiae, слитый с про-областью белка HSP150 S. cerevisiae.
Пример 1. Конструирование экспрессионных плазмид
Этап 1. ПЦР-амплификация гена соматотропина человека GH1
В качестве матрицы для ПЦР-амплификации фрагмента ДНК, заключающего ген соматотропина человека GH1, используют плазмиду pPSTH-18 (предоставлена П.М.Рубцовым, Институт Молекулярной Биологии РАН). Для амплификации используют следующие праймеры:
5'-atatccatggaaaagagattcccaaccattcccttatc-3' (прямой праймер, подчеркнут сайт NcoI);
5'-atgcctсogagggcagctagaagccacagc-3' (обратный праймер, подчеркнут сайт XhoI).
ПЦР проведена с использованием набора для амплификации производства «Fermentas» на амплификаторе «Терцик» (НПО «ДНК-биотехнология», Москва). Условия амплификации фрагмента ДНК: 94°С/4 мин - 1-й цикл; 94°С/40 сек, 55°С/40 сек, 72°С/1 мин - 7 циклов; 94°С/40 сек, 60°С/40 сек, 72°С/1 мин - 28 циклов; 72°С/10 мин - последний цикл.
В результате амплификации получают фрагмент ДНК, заключающий ген соматотропина человека GH1.
Этап 2. Клонирование и секвенирование гена соматотропина человека GH1
Амплифицированный фрагмент ДНК, заключающий ген GH1, обрабатывают рестриктазами NcoI и XhoI и клонируют в плазмиде pUC18x-GAL1p, расщепленной по тем же сайтам. В результате получают плазмидe р91-1 (Фиг.1), в составе которой ген GH1 корректно секвенируют по стандартной методике (Zimmermann J., Voss H., Schwager С., Stegemann J., Ansorge W. FEBS Lett. 1988; 233: 432-436). Плазмида р91-1 несет под контролем промотора GAL1 ген белка соматотропина, слитого с лидерной пре-про-областью α-фактора S. cerevisiae (SEQ ID NO 1).
Этап 3. Конструирование плазмиды р91-4
Экспрессионную кассету в составе HindIII/XhoI фрагмента ДНК плазмиды р91-1, содержащего ген GH1 соматотропина, слитого с лидерной пре-про-областью α-фактора S. cerevisiae (SEQ ID NO 1), под контролем промотора GAL1 клонируют в лабораторный интегративный вектор р91-3, расщепленный по сайтам рестрикции HindIII и SalI. В результате получают интегративную плазмиду р91-4 (Фиг.2), несущую экспрессионную кассету с геном соматотропина и геном URA3, способным комплементировать мутацию ura3 в клетках штамма-реципиента G1L.
Этап 4. Конструирование плазмиды р91-9
HindIII/XhoI фрагмент ДНК плазмиды р91-1, содержащий экспрессионную кассету, кодирующую ген GH1 соматотропина, слитый с лидерной пре-про-областью α-фактора S. cerevisiae (SEQ ID NO 1), под контролем промотора GAL1, клонируют в лабораторный интегративный вектор р69-51, расщепленный по сайтам рестрикции HindIII и XhoI. В результате получают интегративную плазмиду р91-9 (Фиг.3), несущую экспрессионную кассету с геном соматотропина и геном LEU2, способным комплементировать мутацию leu2 в клетках штамма-реципиента G1L.
Этап 5. Конструирование плазмиды р91 -13
AatII/XhoI фрагмент ДНК плазмиды 91-1, содержащий экспрессионную кассету, кодирующую ген GH1 соматотропина, слитый с лидерной пре-про-областью α-фактора S. cerevisiae (SEQ ID NO 1), под контролем промотора GAL1, клонируют в лабораторный вектор р68-6, расщепленный по сайтам рестрикции AatII и XhoI. В результате получают плазмиду р91-13 (Фиг.4), несущую экспрессионную кассету с геном соматотропина и геном TRP1, способным комплементировать мутацию trp1 в клетках штамма-реципиента G1L.
Этап 6. Конструирование плазмиды р91-14
AatII/XhoI фрагмент ДНК плазмиды 91-1, содержащий экспрессионную кассету, кодирующую ген GH1 соматотропина, слитый с лидерной пре-про-областью α-фактора S. cerevisiae (SEQ ID NO 1), под контролем промотора GAL1, клонируют в лабораторный вектор р68-4, расщепленный по сайтам рестрикции AatII и XhoI. В результате получена плазмида р91-14 (Фиг.5), несущая экспрессионную кассету с геном соматотропина и геном HIS3, способным комплементировать мутацию his3 в клетках штамма-реципиента G1L.
Этап 7. Конструирование плазмиды р91 -16
HindIII/NcoI фрагмент ДНК лабораторной плазмиды р71-22, содержащий промотор GAL1 и структурный ген гибридной лидерной области, кодирующий модифицированный сигнальный пептид α-фактора S. cerevisiae, слитый с про-областью белка HSP150 S. cerevisiae (SEQ ID NO 2), клонируют в вектор р91-1, расщепленный по сайтам рестрикции HindIII и NcoI. В результате получена плазмида р91-15, в составе которой ген соматотропина слит с фрагментом ДНК, кодирующим гибридную лидерную область. Затем AatIII/XhoI фрагмент ДНК плазмиды р91-15, содержащий промотор GAL1 и последовательность гена соматотропина, слитого с гибридной лидерной областью, клонируют по сайтам рестрикции AatII и XhoI в интегративный вектор р68-4, несущий селективный маркер HIS3. В результате получена интегративная экспрессионная плазмида р91-16 (Фиг.6), несущая в своем составе селективный маркер HIS3 и ген соматотропина человека, слитый с гибридной лидерной областью, состоящей из последовательности модифицированного сигнального пептида α-фактора дрожжей и про-области белка HSP150 S. cerevisiae (SEQ ID NO 2).
Пример 2. Культивирование и трансформация клеток дрожжей
Для выращивания реципиентных штаммов дрожжей используют комплексную жидкую или агаризованную среду YPD. Дрожжи культивируют на агаризованной среде в термостате или в жидкой среде на роторной качалке (250 об/мин) при температуре 28°С.
Трансформацию дрожжей проводят по методу Ито с соавт.(Ito H., Fukuda Y., Murata K., Kimura A. 1983. J Bacteriol., 153: 163-168). Для отбора трансформантов используют синтетическую среду с добавлением аминокислот или оснований, соответствующих ауксотрофным мутациям конструируемого штамма до конечной концентрации 30 мкг/л. Состав синтетической среды (в мас.%): KH2PO4 - 0,1, MgSO4 - 0,05, NaCl - 0,01, CaCl2 - 0,01, (NH4)2SO4 - 0,35, глюкоза - 2, тиамин (витамина В1) - 0,02, рибофлавин (витамина В2) - 0,02, никотиновая кислота (витамина РР) - 0,02, п-аминобензойная кислота - 0,02, пантотенат кальция - 0,02, биотин - 0,0002, пиридоксин (витамина В6) - 0,02, инозит - 1, фолиевая кислота - 0,02, вода - остальное.
Для определения уровня секреции рекомбинантного соматотропина клетки трансформантов выращивают в пробирках на комплексной среде YPD, содержащей дополнительно 0.1% Твин-20, в течение 44 часов при 28°С на роторной качалке (250 об/мин).
Пример 3. Оценка уровня секреции соматотропина у заявляемых штаммов методом электрофореза в ПААГ
Электрофорез белков культуральной жидкости проводят в 15% ПААГ в денатурирующих редуцирующих условиях (Laemmli U.K., 1970, Nature 227: 680-685). Для этого белки культуральной жидкости штаммов S. cerevisiae SCR-H1 или S. cerevisiae SCR-H2 концентрируют следующим образом: клетки дрожжей, выращенных как описано в примере 2, осаждают центрифугированием в течение 1 мин при 12000g. К 1 объему культуральной жидкости добавляют равный объем метанола и 1/4 объема хлороформа. Содержимое пробирок тщательно перемешивают и разделяют путем центрифугирования в течение 5 мин при 12000g. Из пробирок аккуратно удаляют верхнюю фазу. Оставшуюся в пробирках хлороформную фазу и интерфазу смешивают с 1 объемом свежего метанола и осаждают белок центрифугированием в течение 2 мин при 12000g. Надосадочную жидкость удаляют. Белковый осадок каждой пробирки растворяют в буфере (Laemmli U.K., 1970, Nature 227: 680-685) и анализируют (Фиг.7). Уровень секреции соматотропина у штаммов S. cerevisiae SCR-H1 и S. cerevisiae SCR-H2 составлял не менее 100 мг/л среды. Отрицательным контролем служил реципиентный штамм G1L.
Пример 4. Определение уровня секреции соматотропина у заявляемых штаммов методом твердофазного иммуноферментного анализа (ИФА)
Для ИФА-анализа (Engvall E., Perlmann P.; 1971, Immunochemistry, 8: 871-874) образцов культуральной жидкости, полученной при культивировании штаммов S. cerevisiae SCR-H1 или S. cerevisiae SCR-H2, выращенных как описано в примере 2, используют следующий протокол. В лунки 96-луночного планшета вносят по 100 мкл раствора подложечных антител XGH7 (3.14 мг/мл, Хема, Москва) в боратно-солевом буфере (BBS) в разведении 1:600 и инкубируют при комнатной температуре в течение 12-16 ч. Затем раствор из лунок удаляют, в каждую лунку вносят по 150 мкл 1% раствора бычьего сывороточного альбумина (BSA) в буфере BBST (буфер BBS с добавлением Твин-20 до конечной концентрации 0.05%) и инкубируют при постоянном перемешивании (на шейкере) в течение 1 ч. После удаления раствора лунки трижды промывают буфером, внося в них при каждой промывке по 180 мкл BBST. Затем в каждую лунку вносят по 100 мкл раствора культуральной жидкости штаммов S. cerevisiae SCR-H1 или S. cerevisiae SCR-H2, разведенной в буфере BBST (использовали разведение до 1:20000). Для построения калибровочной кривой используют различные концентрации (от 1 мкг/л до 20 мкг/л) раствора препарата РАСТАН фирмы «Фармстандарт». Инкубируют при постоянном перемешивании в течение 1 ч. Удаляют раствор из лунок, трижды промывают лунки буфером BBST. В каждую лунку вносят по 100 мкл раствора проявочных антител XGH6-HRP, конъюгированных с пероксидазой хрена (0.38 мг/мл, Хема, Москва), в буфере BBST в разведении 1:3000. Инкубируют при постоянном перемешивании в течение 1 ч. Удаляют раствор из лунок, производят 5-кратную промывку лунок буфером BBST. Вносят в каждую лунку по 100 мкл раствора ортофенилендиамина в концентрации 2-3 мг/мл в 10 мМ NaAc буфере рН 5.0 с добавлением перекиси водорода до конечной концентрации 0.03%. Инкубируют при комнатной температуре в течение 5-10 мин до появления желтой окраски. Реакцию останавливают добавлением в каждую лунку по 100 мкл 10%-ного водного раствора серной кислоты. Оптическую плотность содержимого лунок измеряют при длине волны 492 нм.
Уровень секреции соматотропина штамма S. cerevisiae SCR-H1 составил 100 мг/л среды, а штамма S. cerevisiae SCR-H2 - 130 мг/л среды. Отрицательным контролем служил реципиентный штамм G1L.
Пример 5. Конструирование штаммов S. cerevisiae SCR-H1 и SCR-H2 - продуцентов рекомбинантного соматотропина человека
В качестве основного метода конструирования штаммов-продуцентов с улучшенными секреторными свойствами используют метод последовательного увеличения дозы гена соматотропина. С этой целью клетки дрожжей реципиентного штамма S. cerevisiae_G1L, маркированного четырьмя ауксотрофными мутациями, последовательно трансформируют сконструированными экспрессионными плазмидами р91-4 (Фиг.2), р91-9 (Фиг.3) и р91-13 (Фиг.4), несущими ген соматотропина и один из селективных маркеров URA3 (U), LEU2 (L), TRP1 (W). Для направления интеграции в соответствующие хромосомные локусы реципиентных штаммов дрожжей эти плазмиды перед трансформацией расщепляют по сайтам XhoI, MluI и EcoRV соответственно. Среди клонов, полученных после трансформации, отбирают наиболее продуктивный клон, который используют в качестве реципиентного штамма для трансформации следующей экспрессионной плазмидой. В результате серии этих трансформаций получен промежуточный штамм S. cerevisiae G1L-ULW, исходные ауксотрофные мутации которого (ura3, leu2, trp1) скомпенсированы.
Для получения заявляемых штаммов SCR-H1 и SCR-H2 клетки промежуточного штамма G1L-ULW трансформируют в первом случае плазмидой р91-14, а во втором - р91-16. В каждом случае для направления интеграции в геном дрожжей экспрессионные плазмиды перед трансформацией расщепляют по уникальному сайту KpnI. В результате скрининга трансформантов по уровню секреции соматотропина отобраны штаммы-продуценты SCR-H1 и SCR-H2 соответственно.
По результатам ПААГ-анализа (Фиг.7) и ИФА-анализа продуктивность штаммов S. cerevisiae SCR-H1 и SCR-H2 - продуцентов рекомбинантного соматотропина человека - составила 100 и 130 мг соматотропина в 1 л среды.
Пример 6. Стабильность заявляемых штаммов S. cerevisiae SCR-H1 и SCR-H2
Стабильность штаммов S. cerevisiae SCR-H1 и SCR-H2 определяют путем 20 последовательных пересевов этих культур на агаризованной среде YPD.
Проведенный анализ показал идентичность уровней секреции соматотропина пассированными и исходными культурами.
Таким образом, сконструированные штаммы-продуценты соматотропина S. cerevisiae SCR-H1 и SCR-H2 имеют стабильность, соответствующую ближайшему аналогу, но в 5-7 раз превосходят его по продуктивности.
1. Способ конструирования штаммов дрожжей - стабильных продуцентов соматотропина человека, отличающийся тем, что в качестве реципиента используют штамм дрожжей Saccharomyces cerevisiae, несущий ауксотрофные мутации в генах URA3, LEU2, TRP1 и HIS3 и имеющий делецию в гене gal80, в геном которого последовательно интегрируют экспрессионные плазмиды, несущие в своем составе под контролем промотора GAL1 Saccharomyces cerevisiae ген, кодирующий соматотропин человека GH1, слитый с лидерной пре-про-областью α-фактора дрожжей или с гибридной лидерной последовательностью, состоящей из модифицированного сигнального пептида α-фактора дрожжей и про-области белка HSP150 Saccharomyces cerevisiae, а также один из генов URA3, LEU2, TRP1 и HIS3, комплементирующих ауксотрофные мутации штамма-реципиента Saccharomyces cerevisiae, имеющего делецию в гене gal80.
2. Штамм дрожжей Saccharomyces cerevisiae ВКПМ Y-3506 - стабильный продуцент соматотропина человека, полученный способом по п.1.
3. Штамм дрожжей Saccharomyces cerevisiae ВКПМ Y-3507 - стабильный продуцент соматотропина человека, полученный способом по п.1.