Условно дефектная частица вируса гриппа и способы ее получения (варианты)
Иллюстрации
Показать всеИзобретение относится к области вирусологии и биотехнологии. Раскрыта условно дефектная частица вируса гриппа с отсутствием сегмента нуклеиновой кислоты вируса гриппа, выбранного из группы сегментов, в основном кодирующих кислую полимеразу (РА), основную полимеразу 1 (РВ1) и основную полимеразу 2 (РВ2). Условно дефектная частица вируса гриппа используется для индукции иммунной защиты против вируса гриппа. Также описан способ получения таких частиц, фармацевтическая композиция, содержащая такие частицы, ее применение и способ индукции иммунной защиты против вируса гриппа. Изобретение может быть использовано в медицине. 16 н. и 33 з.п. ф-лы, 4 ил., 4 табл.
Реферат
Изобретение относится к области вируса гриппа и вакцинации против гриппа.
Вирусы гриппа (Orthomyxoviridae) представляют собой оболочечные РНК-содержащие вирусы с отрицательной цепью с сегментированным геномом (Taubenberger and Layne, Molecular Diagnosis Vol. 6 No. 4 2001). Их разделяют на два рода на основе значительных антигенных различий между их нуклеопротеинами и матриксными белками: один включает в себя грипп A и B, а другой состоит из гриппа C. Три типа вирусов также различаются по патогенности и организации генома. Тип A выявлен у широкого спектра теплокровных животных, а типы B и C преимущественно представляют собой возбудители заболеваний человека. Вирусы гриппа A дополнительно разделяют в зависимости от антигенной характеристики гемагглютинина (HA) и поверхностных гликопротеинов NA, которые экспонированы на поверхности вириона. В настоящее время существует 15 подтипов HA и девять подтипов NA. Вирусы гриппа A инфицируют широкий спектр животных, включая птиц, свиней, лошадей, людей и других млекопитающих. Водоплавающая птица служит природным резервуаром для всех известных подтипов гриппа A и, возможно, служит источником генетического материала для штаммов пандемического гриппа человека.
В отличие от родственных парамиксовирусов вирусы гриппа обладают сегментированным геномом РНК. Вирусы гриппа A и B обладают сходной структурой, тогда как грипп C отличается сильнее. Тогда как каждый из вирусов типа A и B содержит восемь дискретных генных сегментов, кодирующих, по меньшей мере, один белок каждый, тип C содержит семь дискретных сегментов, с объединением сегментов 4 и 6 типов A и B. Вирусы гриппа A и B являются покрытыми с экспозицией трех белков: HA, NA и матриксный белок 2 (M2). Вирус гриппа C несет только один поверхностный гликопротеин. Каждый сегмент РНК вируса гриппа заключен в капсид из нуклеопротеинов (NP) с формированием рибонуклеопротеиновых (RNP) комплексов. С одним из концов RNP-комплекса ассоциированы три белка полимеразы. RNP окружены мембраной с матриксным белком (матриксный белок 1) в качестве неотъемлемой части. Фосфолипидная часть оболочки происходит из клеточной мембраны хозяина. Также в вирусной частице находится неструктурный белок 2 (NS2).
Правила номенклатуры вирусов гриппа Всемирной организации здравоохранения (ВОЗ) предусматривают следующее. Во-первых, указывают тип вируса (A, B или C), затем - хозяина (если хозяином не является человек), место выделения, номер штамма и год выделения (разделенные наклонными чертами). Для гриппа A подтипы HA и NA указывают в круглых скобках. Например, штаммы, включенные в современную трехвалентную вакцину для сезонов с 2000 по 2001 год, представляют собой: A/Panama/2007/99 (H3N2), A/New Caledonia/20/99 (H1N1), и B/Yamanashi/16/98. С 1977 года у людей совместно циркулируют два подтипа гриппа A: H1N1 и H3N2.
Вирусы гриппа при репликации накапливают точковые мутации, так как их РНК-полимеразный комплекс не обладает корректирующей активностью. Мутации, приводящие к изменению аминокислот в антигенных частях поверхностных гликопротеинов, могут давать селективные преимущества для вирусного штамма, позволяя ему ускользать от существующего иммунитета. Молекула HA инициирует инфекцию посредством связывания с рецепторами на определенных клетках-хозяевах. Антитела к белку HA предотвращают связывание рецептора и очень эффективны для предотвращения повторного инфицирования тем же штаммом. HA могут ускользать от ранее приобретенного иммунитета либо посредством антигенного дрейфа, при котором мутации циркулирующего на данный момент гена HA нарушают связывание антитела, либо антигенного сдвига, при котором вирус приобретает HA нового подтипа. Давление антигенного дрейфа неравномерно распределено по молекуле HA, с положительно отбираемыми изменениями, преимущественно происходящими в глобулярной головке белка HA. Эти изменения также накапливаются в большей степени в HA, чем в NA. Изменения в других белках вируса гриппа происходят медленнее. Подобным образом давление антигенного дрейфа является наивысшим у адаптированных к человеку штаммов вируса гриппа, средним у штаммов, адаптированных к свиньям и лошадям, и наименьшим у адаптированных к птицам штаммов.
Так как вирусы гриппа обладают сегментированным геномом, совместная инфекция двумя различными штаммами одного и того же хозяина может приводить к образованию новых перегруппированных штаммов вируса гриппа, содержащих разные сочетания родительских генных сегментов. Известно, что у диких птиц существует пятнадцать подтипов HA, и они обеспечивают источник HA, которые являются новыми для людей. Появление у человека штамма вируса гриппа с новым подтипом вследствие антигенного сдвига явилось причиной последних двух пандемий гриппа в 1957 и 1968 годах и, наиболее вероятно, было причиной пандемии гриппа в 1918 году. Чтобы согласовываться со всем, что известно о появлении пандемических вирусов гриппа, пандемический штамм должен обладать антигенностью HA, отличной от антигенности, преобладающей в настоящее время; этот HA не мог циркулировать среди людей в течение промежутка от 60 до 70 годов; и вирус должен передаваться от человека к человеку. Как в 1957, так и в 1968 году пандемия происходила вследствие сдвига в HA, и в обоих случаях HA пандемических штаммов были близкородственными со штаммами птиц. Хотя одним из безусловных требований для пандемии является то, что HA должен изменяться, степень, до которой остаток вируса может или должен меняться, неизвестна. Для прямого исследования доступны только пандемические вирусы 1957 и 1968 годов, а пандемический вирус гриппа 1918 года характеризуют с применением молекулярной археологии. В 1957 году генами, подобными генам вирусов птиц, были замещены три гена: HA, NA и субъединица полимеразного комплекса (PB1). В 1968 году замещенными были только HA и PB1.
Конкретный диагноз инфекции гриппа можно сделать посредством выделения вируса, теста ингибирования гемагглютинации (HI), детекции антигенов иммуноанализом, серологических тестов, выявления активности NA в выделениях или молекулярных анализах. Образцы можно собирать в виде мокроты, носоглоточных мазков или носоглоточных смывов, полученных посредством полоскания забуференного физиологического раствора. Стандартном для диагностики гриппа является иммунологическая характеристика после культивирования. Серологический анализ предоставляет точный, но ретроспективный способ для инфекции гриппа, так как он требует сбора сыворотки и в острой фазе, и в фазе выздоровления.
Вирусы гриппа можно растить в куриных яйцах с зародышем или ряде систем тканевых культур. Добавление трипсина (для активации расщепления HA) позволяет вирусу гриппа размножаться в клетках почки собаки Madin-Darby (MDCK) и других линиях. Основным способом получения вакцины по прежнему остается культивирование вирусов гриппа в яйцах. Культивирование в клеточных линиях обычно используют для первичного выделения вирусов гриппа человека (A и B типов). Многие вирусы гриппа человека можно культивировать непосредственно в аллантоисной полости яиц с зародышем. Некоторые вирусы гриппа A и B нуждаются в начальном культивировании в амниотической полости и последующей адаптации к аллантоисной полости. После выделения культуры многие изоляты вируса гриппа окончательно идентифицируют с применением иммуноанализа или иммунофлуоресценции. Молекулы HA вирусов гриппа для усиления проникновения вируса связывают остатки сиаловых кислот на поверхности дыхательных клеток.
Штаммы вируса гриппа можно характеризовать антигенно, учитывая способность вирусов гриппа вызывать агглютинацию эритроцитов in vitro. Антитела к HA могут ингибировать агглютинацию. Таким образом, анализ ингибирования гемагглютинации (HI) представляет собой один из стандартных способов для характеристики штаммов вируса гриппа. Анализы HI используют для определения того, являются ли образцовые штаммы иммунологически родственными (т.е. перекрестно-реактивными) с новейшими вакцинными штаммами. Типирующие сыворотки, как правило, полученные у хорьков, добавляют в лунки в серии двукратных разведений, и сотрудники лабораторий оценивают анализируемые лунки посредством определения суспендированных красных кровяных клеток в сравнении со слипшимися. В большинстве случаев панель сывороток используют для подбора образцовых штаммов к вакцинным или эталонным штаммам и, в течение любого данного сезона гриппа, посредством анализов HI успешно подбирают абсолютное большинство образцовых штаммов.
ВОЗ направляет рекомендации, а центры сотрудничества с ВОЗ предоставляют руководство по идентификации антигенных характеристик конкретных вирусных штаммов. Образцовые штаммы классифицированы в зависимости от иммунологической родословной, например, A/Moscow/10/99 (H3N2), подобные A/New Caledonia 20/99 (H1N1) и подобные B/Beijing/184/93 вирусы. Образцовые штаммы, для которых не удалось получить характеристику при анализе HI, сотрудники лабораторий должны инокулировать хорькам для получения специфичной для штамма антисыворотки. Когда новая антисыворотка получена, снова проводят анализ HI, как описано. Если новая сыворотка демонстрирует значительные пропуски в перекрестной специфичности (обычно определяемые как четырехкратная разница между штаммом образца и вакцинным штаммом), ее встраивают в регулярную лабораторную панель и используют для поиска новых эпидемических штаммов. Таким образом, анализ HI является крайне важным в работе по наблюдению за вирусом гриппа для выбора вакцинного штамма и наиболее часто используемым способом для оценки антигенного дрейфа.
Штаммы вируса гриппа можно характеризовать генетически посредством сравнения последовательностей конкретных генных сегментов, и вновь указания ВОЗ и центры сотрудничества с ВОЗ предоставляют руководство по идентификации индивидуальных особенностей сегментов РНК, входящих в геном вируса гриппа; сегменты нуклеиновой кислоты вируса гриппа A и B, кодирующие нуклеопротеин (NP), основную полимеразу 1 (PB1), основную полимеразу 2 (PB2), кислую полимеразу (PA), гемагглютинин (HA), нейраминидазу (NA), матриксные белки (M1 и M2) и неструктурный белок (NS1 и NS2), и сегменты нуклеиновой кислоты вируса гриппа C, кодирующие нуклеопротеин (NP), основную полимеразу 1 (PB1), основную полимеразу 2 (PB2), гемагглютининнейраминидазоподобный гликопротеин (HN), матриксные белки (M1 и M2) и неструктурный белок (NS1 и NS2). Запросы на эталонные штаммы для антигенного анализа для сравнения последовательностей нуклеиновых кислот и для идентификации вакцинных вирусов можно направить в WHO Collaborating Centre for Reference and Research on Influenza, 45 Poplar Road, Parkville, Victoria 3052, Australia (fax: +61 3 9389 1881, веб-сайт: http://www.influenzacentre.org); WHO Collaborating Centre for Reference and Research on Influenza, National Institute of Infectious Diseases, Gakuen 4-7-1, Musashi-Murayama, Tokyo 208-0011, Japan (факс: +81 42 5610812 или +81 42 5652498); WHO Collaborating Center for Surveillance, Epidemiology and Control of Influenza, Centers for Disease Control and Prevention, 1600 Clifton Road, Mail stop G16, Atlanta, GA 30333, United States of America (факс: +1 404 639 23 34) или WHO Collaborating Centre for Reference and Research on Influenza, National Institute for Medical Research, The Ridgeway, Mill Hill, London NW7 1AA, England (факс: +44 208 906 4477). Обновленная эпидемиологическая информация доступна на веб-сайте ВОЗ http://www.who.int/influenza и географической информационной системы, FluNet, http://www.who.int/fluent.
Осознание последствий гриппа и пользы для здоровья и экономики от его предотвращения увеличивается и в последнее десятилетие наблюдается значительное увеличение применения и эффективности вакцинации и ряда противогриппозных лекарственных средств. Как результат большей длительности жизни во многих странах, значительно больше людей подвергаются риску осложнений, более широко признается нагрузка на системы медицинского обслуживания во время эпидемий гриппа, а более частые международный туризм создает благоприятные возможности для распространения вируса, несмотря на то, что внедрение новых продуктов создают более широкие возможности для профилактики и лечения заболевания. Более чем в 50 странах существуют финансируемые правительствами национальные программы иммунизации против гриппа, а во многих других доступна вакцина. Конкретные рекомендации по применению вакцины различаются, но, как правило, они включают в себя ежегодную иммунизацию индивидуумов пожилого возраста и индивидуумов старше 6 месяцев с повышенным риском тяжелого заболевания, вследствие предсуществующего хронического медицинского показания. В некоторых странах вакцину применяют для уменьшения распространенности гриппа у лиц с увеличенным медицинским риском. Странам-участникам необходимо рассматривать выгоду от действий по профилактике гриппа в контексте их общих приоритетов общественного здравоохранения. Инактивированные вакцины классифицируют по нескольким типам в зависимости от того, содержат ли они целые вирусные частицы, частично разрушенные вирусные частицы (раздробленные вакцины) или очищенные антигены оболочки (субъединичные вакцины). Некоторые субъединичные вакцины комбинируют с адъювантом или системой доставки.
В некоторых странах лицензирована живая аттенуированная вакцина против гриппа для некоторых целевых групп. В Российской Федерации используют два различных состава 1 вакцины для здоровых взрослых и детей, а другие живые вакцины интенсивно тестировали. Однако пока живые аттенуированные вакцины не достаточно широко доступны, как правило, их не рекомендуют для профилактики гриппа.
Для профилактики и лечения гриппа разработаны два класса антивирусных средств. Ингибиторы M2, амантадин и римантадин ограничиваются лечением вирусов гриппа A, а также сообщалось, что они эффективны для профилактики инфекции. Хотя оба продукта вызывают некоторые побочные эффекты, для амантадина более частыми являются значительные неврологические побочные эффекты. В ряде стран для лечения гриппа типов A и B недавно лицензированы ингибиторы нейраминидазы, такие как занамивир и оселтамивир, и сообщалось, что они эффективны для профилактики. У пациентов, принимающих оба класса антивирусных средств, выявлены устойчивые мутанты. Хотя в настоящее время этот факт не считают важной проблемой здравоохранения, ситуация может измениться, если эти лекарственные средства использовать в самом широком масштабе.
ВОЗ поддерживает всемирную международную программу по контролю, действующую при кооперации 110 национальных центров гриппа, расположенных в 82 странах, и 4 центра сотрудничества с ВОЗ по рекомендациям и исследованию гриппа, расположенные в Атланте (Соединенные Штаты Америки), Лондоне (Великобритания), Мельбурне (Австралия) и Токио (Япония). Эти центры обеспечивают систему раннего оповещения для развивающихся штаммов с эпидемическим потенциалом. Эта система важна потому, что эффективность вакцин от гриппа, если они не содержат циркулирующих в настоящее время штаммов, снижается. ВОЗ публикует рекомендации по составу вакцин, как можно найти в Weekly Epidemiological Record (например, смотри выпуск 9, 2004 год, 79, страница 88 или http://www.who.int/wer), публикуемый Всемирной Организацией Здравоохранения в феврале для вакцин, используемых в северном полушарии, и в сентября для вакцин, используемых в южном полушарии. Так как грипп имеет менее определенные сезонные особенности в экваториальных областях, на то какие из этих рекомендаций (февраль или сентябрь) подходят для вакцин для применения в экваториальных странах, будут влиять эпидемиологические факторы.
Центры сотрудничества проводят антигенный и генетический анализ изолятов гриппа, предоставленных национальными центрами. Там, где обнаруживают признаки антигенной вариабельности, их сопоставляют с эпидемиологическими данными для определения эпидемиологической значимости вариантов. Репрезентативные изоляты сравнивают со штаммами применяемых на данный момент вакцин с использованием панелей сывороток человека, собранных до и после вакцинации, для оценки того, можно ли ожидать, что применяемые на данный момент вакцины защищают от этих вирусов. После публикации ежегодных рекомендаций ВОЗ по вакцинам выращивают быстрорастущие штаммы и предоставляют их производителям в качестве эталонных вирусов, содействуя в получении вирусов-потомков для производства вакцины. Тесты по безопасности и эффективности вакцин от гриппа включают в себя инактивацию вируса, микробиологическую стерильность, количественное определение химических веществ, используемых для разрушения вируса, и подтверждение концентрации рекомендуемых антигенов. Рекомендовано, что вакцины должны соответствовать требованиям ВОЗ, однако конкретные вакцинные вирусы, применяемые в каждой стране, должны одобрять национальные контрольные органы. За рекомендации по применению вакцины ответственны национальные органы здравоохранения. Также ВОЗ опубликовала рекомендации по профилактике гриппа (смотри WER № 35, 2002, стр. 281-288).
Уже показано, что применяемые в настоящее время вакцины против гриппа не защищают не подвергнутых воздействию индивидуумов, факт, который приобретает непосредственное значение в случае пандемической вспышки гриппа, когда в таком случае под угрозой находится большинство не сталкивавшихся до этого с инфекцией гриппа индивидуумов. Как правило, вирусы начинают свой жизненный цикл посредством взаимодействия с поверхностными рецепторами клетки-хозяина, вхождения в клетки и высвобождения своей вирусной нуклеиновой кислоты с последующей репликацией вирусного генома. После синтеза новых копий вирусных белков и генов эти компоненты собираются в вирионы-потомки, которые затем выходят из клетки. Во время стадии сборки вирус-потомок должен эффективно выбирать свою геномную нуклеиновую кислоту из большого пула вирусных и клеточных нуклеиновых кислот, находящихся в цитоплазме. Упаковка вирусных геномов в вирионы, как правило, включает в себя узнавание вирусными компонентами цис-действующей последовательности в вирусной нуклеиновой кислоте, так называемого "сигнала упаковки". Определение таких сигналов важно для понимания жизненного цикла вирусов и обеспечивает нас информацией, которую можно использовать для конструирования вирусных векторов для экспрессии чужеродных белков. Действительно, пригодность ретровирусов в качестве носителей для доставляющих гены векторов для экспрессии чужеродных белков можно в большой степени объяснить хорошо обоснованным знанием процесса упаковки их вРНК в вирионы-потомки.
Геномные сигналы упаковки других РНК-содержащих вирусов изучены недостаточно, что препятствует их использованию в качестве векторов для экспрессии и доставки чужеродных генов. Например, вирус гриппа A представляет собой оболочечный РНК-содержащий вирус с отрицательной цепью, сегментированный геном которого обладает потенциалом к кодированию нуклеопротеина (NP), основной полимеразы 1 (PB1), основной полимеразы 2 (PB2), кислой полимеразы (PA), гемагглютинина (HA), нейраминидазы (NA), матриксных белков (M1 и M2) и неструктурного белка (NS1 и NS2).
В этом вирусе на оболочке присутствуют два пересекающих мембрану гликопротеина, гемагглютинин (HA) и нейраминидаза (NA). Белок HA связывается с содержащими сиаловые кислоты рецепторами на поверхности клетки-хозяина и опосредует слияние оболочки вируса с эндосомальной мембраной после опосредованного рецепторами эндоцитоза. В отличие от этого белок NA играет ключевую роль на конечной стадии инфицирования, удаляя сиаловую кислоту из сиалоолигосахаридов, таким образом высвобождая вновь собранные вирионы из клеточной поверхности и предотвращая аутоагрегацию вирусных частиц. В оболочке вирусный геном, содержащий восемь различных сегментов вирусной РНК (вРНК), прочно связывается с нуклеопротеином (NP) и белками полимераз (PA, PB1 и PB2), формируя рибонуклеопротеиновые комплексы. Все восемь (или, в случае вируса типа C, все семь) функциональных генных сегментов необходимы для получения инфекционного вируса. Описаны различные мутации в генах полимераз (WO2004/094466, WO2003/091401, US 5578473, Fodor et al, J. Virol. 77, 5017-5020, 2003), которые изменяют активность полимеразы или иным образом изменяют полимеразу, но не способствуют потере ей функциональности в отношении синтеза вирусной РНК, с получением содержащего такие мутированные полимеразы вируса, неспособного к репликации. В WO2004/094466 получали инфекционные вирусы с мутированным геном PA, таким образом демонстрируя преимущества системы селекции, позволяющие получать и восстанавливать инфекционный вирус с мутированными генами. В WO2003/091401 показано, как получать инфекционный вирус с мутациями в генах полимераз, для обеспечения получения и восстановления вируса гриппа с желательными свойствами, подходящими для получения аттенуированного вакцинного вируса, такими как температурная чувствительность или другие типы аттенуации. В US 55788473 предложены сегменты генов полимераз, возможно изменяющие специфичность и снижающие активность различных полимераз. Однако их не использовали для восстановления вируса, не считая восстановления вируса, у которого полностью потеряна активность его полимераз. Кроме того, ни в одной из указанных выше заявок не получали дефектные частицы, потерявшие способность к репликации. Хорошо известно, что когда вирусы гриппа A пересевают при высокой множественности инфицирования, образуются дефектные вирусные частицы, в которых отсутствуют один или несколько функциональных генных сегментов. В таких вирусных частицах один или несколько функциональных генов замещены дефектными интерферирующими (DI) генными сегментами, вследствие ошибок, совершаемых полимеразой вируса гриппа. Вследствие высокой множественности инфекции и, следовательно, инфекции клеток более чем 1 вирусной частицей дефекты вирусов, содержащих DI РНК, комплементируются вирусами, содержащими неповрежденные копии утраченных функциональных генов. Недавно показано, что определенные мутации в гене кислой полимеразы могут увеличивать эффективность размножения вирусных частиц с дефектными генами (Fodor 2003). Важно отметить, что размножение дефектных вирусных частиц в этих экспериментах и комплементация происходили в таких экспериментах случайным образом. Этот случайный процесс ограничивает применение DI РНК и условно дефектных вирусных частиц для практического применения. Кроме того, когда дефектные вирусные частицы получают с применением этих опубликованных способов, в дополнение к желательным условно дефектным вирусам образуются способные к репликации вирусы дикого типа. Такие способные к репликации вирусы могут быть или полностью вирусами дикого типа (вирус-помощник), или рекомбинантами, полученными в результате генетического смешения вируса-помощника с дефектным вирусом. Как происходит процесс упаковки генных сегментов вируса гриппа, случайным образом или посредством специфического механизма, обсуждается в течение многих лет. Описаны экспериментальные доказательства для обоих вариантов. Доказательством случайной упаковки является то, что агрегированные вирусные частицы обладают большей инфективностью, чем неагрегированные вирусные частицы, и то, что когда клеточную культуру инфицируют при низкой множественности инфицирования (MOI), в некоторых инфицированных клетках отсутствует экспрессия одного из сегментов, что вместе указывает на то, что существуют вирионы, не содержащие целого генома вируса гриппа. Дополнительным доказательством случайной упаковки является то, что экспериментально получены вирусы гриппа, содержащие девять сегментов.
Одним из аргументов за процесс специфической упаковки является то, что хотя все генные сегменты в биомассе вируса находятся в равных количествах, в продуцирующих клетках они находятся в разных количествах. Кроме того, когда образуются дефектные интерферирующие (DI) частицы, DI вРНК замещает тот сегмент, из которого она получена (Дефектная интерферирующая частица представляет собой вирусную частицу, в которой в одном из генных сегментов присутствует большая внутренняя делеция. Эти частицы образуются, когда вирус пересевают при высокой MOI). Наконец эффективность образования вириона увеличивается при увеличении количества генных сегментов.
Сущность изобретения
Дефектные частицы вируса гриппа (например, Mena I. et al., J. Virol. 70:5016-24 (1996); Neumann G. et al., J. Virol. 74:547-51 (2000)) можно применять в качестве кандидатов для создания вакцины, так как они кроме HA и NA индуцируют антитела к другим вирусным белкам и если они способны проникать в клетку хозяина, так как они кроме гуморального ответа способны индуцировать клеточный иммунный ответ против вируса (например, хелперные Т-клетки, цитотоксические Т-клетки). До настоящего времени получения дефектных частиц вируса гриппа добивались посредством трансфекции (Mena I. et al., J. Virol. 70:5016-24 (1996); Neumann G. et al., J. Virol. 74:547-51 (2000)), снижая возможности получения больших количеств таких частиц. Альтернативой этому подходу может быть получение вирусных частиц, которые являются условно дефектными, позволяя им реплицироваться в определенной продуцирующей системе, но не в нормальных клетках или продуцирующих системах. С этой целью клетки продуцирующей системы можно модифицировать для создания возможности образования одного или нескольких генов или продуктов генов вируса гриппа, обеспечивая транскомплементацию дефектных частиц вируса гриппа. В настоящем изобретении первый раз описана определенная транскомплементация дефектных частиц вируса гриппа. В лаборатории транскомплементацию частиц вируса гриппа наблюдают, когда дефектные интерферирующие вирусы гриппа комплементируют в тех же клетках с вирусами, несущими версию дикого типа дефектного интерферирующего генного сегмента. Эта "природная система" транскомплементации непригодна для получения определенных условно дефектных частиц вируса гриппа. Во-первых, в этой системе необходима комплементация одного (частично) дефектного вируса, по меньшей мере, с одним (частично) способным к репликации вирусом, что может привести к нежелательному образованию полностью инфекционного вируса. Во-вторых, так как образование дефектных интерферирующих частиц происходит случайным образом для различных генных сегментов, невозможно получить определенные условно дефектные вирусные частицы.
Условно дефектные частицы вируса гриппа теоретически можно получать на основе удаления целых генных сегментов или их частей. Возможность получения определенных условно дефектных вирусных частиц посредством удаления целых генных сегментов (и получения кодируемого продукта(ов) гена в трансположении) может быть ограничена, если упаковка генома вируса гриппа основана на присутствии всех 8 сегментов, что является предметом большой дискуссии (смотри в другом месте в данном описании). Если процесс упаковки требует присутствия всех 8 генных сегментов, неизвестно все ли генные сегменты должны присутствовать в полноразмерной форме, что даже дополнительно осложняет получение условно дефектных вирусных частиц. Настоящее изобретение решает эти трудности.
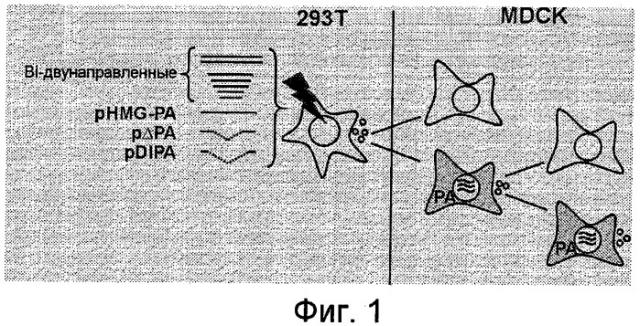
Изобретение относится к способу получения условно дефектной частицы вируса гриппа, включающему в себя первую стадию трансфекции подходящей первой клетки или клеток, такой как клетка 293T, генной конструкцией с внутренними делециями, такой как pΔPB2, pΔPB1, pΔPA или pDIPA, как предусмотрено в настоящем документе, полученной посредством внутреннего удаления нуклеиновой кислоты, кодирующей полимеразу гриппа, в результате чего указанная генная конструкция неспособна к образованию функциональной полимеразы, способной к копированию или синтезу вирусной РНК, и комплементирующими сегментами нуклеиновой кислоты вируса гриппа, кодирующими вирус гриппа, такими как семь комплементирующих конструкций, кодирующих A/WSN/33 (HW181-188, Hoffmann et al., 2000), и экспрессирующей плазмидой, способной к экспрессии указанной полимеразы в указанных клетках, такой как одна из HMG-PB2, HMG-PB1, HMG-PA, как предусмотрено в настоящем документе, и получение, по меньшей мере, одной вирусной частицы из супернатанта указанной первой клетки или клеток, в подходящий момент времени, такой как в пределах от 10 до 50, предпочтительно приблизительно от 20 до 30 часов после трансфекции; и вторую стадию трансфекции подходящей второй клетки или клеток, такой как клетка MDCK, экспрессирующей плазмидой, способной экспрессировать указанную полимеразу в указанной клетке; и третью стадию трансфекции указанной второй клетки или клеток супернатантом, содержащим, по меньшей мере, одну вирусную частицу, полученную из указанной первой клетки; и четвертую стадию, включающую получение, по меньшей мере, одной (теперь условно дефектной вследствие того, что в полученных вирусах отсутствует генный сегмент, экспрессирующий функциональную полимеразу, способную к копированию или синтезу вирусной РНК, так как в них упакован генный сегмент с внутренней делецией) вирусной частицы из супернатанта указанной первой клетки или клеток в подходящий момент времени, такой как от 24 до 96, предпочтительно от 48 до 72 часов после трансфекции.
Предпочтительны внутренние делеции, делающие генный сегмент неспособным к получению функционального белка, но не такие большие, чтобы препятствовать упаковке генных сегментов вируса в вирусные частицы. Предпочтительно эти делеции отсчитывают, соответственно, от 5' и 3' некодирующих областей. Для гриппа A такие предпочтительные делеции, например, начинаются от 5'-нуклеотида, расположенного между нуклеотидами 58 и 75, но не включая их, и оканчиваются на 3'-нуклеотиде, расположенном между нуклеотидами 27 и 50, но не включая их, для белка PA, начинаются от 5'-нуклеотида, расположенного между нуклеотидами 43 и 75, но не включая их, и оканчиваются на 3'-нуклеотиде, расположенном между нуклеотидами 24 и 50, но не включая их, для белка PB1, начинаются от 5'-нуклеотида, расположенного между нуклеотидами 34 и 50, но не включая их, и оканчиваются на 3'-нуклеотиде, расположенном между нуклеотидами 27 и 50, но не включая их, для белка PB2. Более предпочтительно эти делеции: начинаются от 5'-нуклеотида, расположенного между нуклеотидами 58 и 100, но не включая их, и оканчиваются на 3'-нуклеотиде, расположенном между нуклеотидами 27 и 100, но не включая их, для белка PA, начинаются от 5'-нуклеотида, расположенного между нуклеотидами 43 и 100, но не включая их, и оканчиваются на 3'-нуклеотиде, расположенном между нуклеотидами 24 и 100, но не включая их, для белка PB1, начинаются от 5'-нуклеотида, расположенного между нуклеотидами 34 и 100, но не включая их, и оканчиваются на 3'-нуклеотиде, расположенном между нуклеотидами 27 и 100, но не включая их, для белка PB2. Даже более предпочтительно эти делеции: начинаются от 5'-нуклеотида, расположенного между нуклеотидами 58 и 150, но не включая их, и оканчиваются на 3'-нуклеотиде, расположенном между нуклеотидами 27 и 150, но не включая их, для белка PA, начинаются от 5'-нуклеотида, расположенного между нуклеотидами 43 и 150, но не включая их, и оканчиваются на 3'-нуклеотиде, расположенном между нуклеотидами 24 и 150, но не включая их, для белка PB1, начинаются от 5'-нуклеотида, расположенного между нуклеотидами 34 и 150, но не включая их, и оканчиваются на 3'-нуклеотиде, расположенном между нуклеотидами 27 и 150, но не включая их, для белка PB2. Еще более предпочтительно эти делеции: начинаются от 5'-нуклеотида, расположенного между нуклеотидами 58 и 175, но не включая их, и оканчиваются на 3'-нуклеотиде, расположенном между нуклеотидами 27 и 175, но не включая их, для белка PA, начинаются от 5'-нуклеотида, расположенного между нуклеотидами 43 и 175, но не включая их, и оканчиваются на 3'-нуклеотиде, расположенном между нуклеотидами 24 и 175, но не включая их, для белка PB1, начинаются от 5'-нуклеотида, расположенного между нуклеотидами 34 и 175, но не включая их, и оканчиваются на 3'-нуклеотиде, расположенном между нуклеотидами 27 и 175, но не включая их, для белка PB2. Наиболее предпочтительно эти делеции: начинаются от 5'-нуклеотида, расположенного между нуклеотидами 58 и 207, но не включая их, и оканчиваются на 3'-нуклеотиде, расположенном между нуклеотидами 27 и 194, но не включая их, для белка PA, начинаются от 5'-нуклеотида, расположенного между нуклеотидами 43 и 246, но не включая их, и оканчиваются на 3'-нуклеотиде, расположенном между нуклеотидами 24 и 197, но не включая их, для белка PB1, начинаются от 5'-нуклеотида, расположенного между нуклеотидами 34 и 234, но не включая их, и оканчиваются на 3'-нуклеотиде, расположенном между нуклеотидами 27 и 209, но не включая их, для белка PB2.
В настоящем документе комплементирующие сегменты определены как сегменты, приводящие к полному набору из восьми генных сегментов, например, вируса гриппа A. Таким образом, если сегмент 1 уже использовали для получения дефектного сегмента, комплементирующие (недефектные) сегменты представляют собой сегмент 2, 3, 4, 5, 6, 7 и 8. Если дефектным является 2, комплементирующие сегменты представляют собой сегмент 1, 3, 4, 5, 6, 7 и 8. И так далее. Преимущественно в изобретении предоставлен способ, при котором не требуется или не присутствует вирус-помощник.
Изобретение относится к выделенной и условно дефектной частице вируса гриппа с отсутствием функционального сегмента нуклеиновой кислоты вируса гриппа (в настоящем документе также называемой условно дефектная частица вируса гриппа), кодирующего полимеразу, выбранную из группы кислой полимеразы (PA), основной полимеразы 1 (PB1) и основной полимеразы 2 (PB2), где указанная частица
неспособна к синтезу полимеразы или служить в качестве источника для синтеза полимеразы для копирования или синтеза вирусной РНК, таким образом только и условно позволяя образование репликационных вирусных частиц в клетках, транскомплементированных функциональной полимеразой. Кроме того, изобретение относится к способу получения условно дефектной частицы вируса гриппа, включающему в себя получение клетки посредством транскомплементации с функциональной полимеразой вируса гриппа.
В предпочтительном варианте осуществления частица по изобретению реплицируется в клетке, комплементированной аналогичным сегментом нуклеиновой кислоты, который отсутствует в самой частице, например частица с отсутствием сегмента функциональной нуклеиновой кислоты вируса гриппа PA реплицируется в клетке, которая обеспечена, по меньшей мере, сегментом функциональной нуклеиновой кислоты вируса гриппа PA, частица с отсутствием сегмента функциональной нуклеиновой кислоты вируса гриппа PB1 реплицируется в клетке, которая обеспечена, по меньшей мере, сегментом функциональной нуклеиновой кислоты вируса гриппа PB1, частица с отсутствием сегмента функциональной нуклеиновой кислоты вируса гриппа PB2 реплицируется в клетке, которая обеспечена, по меньшей мере, сегментом функциональной нуклеиновой кислоты вируса гриппа PB, соответственно. В предпочтительном варианте осуществления изобретение относится к частице по изобретению с сегментами нуклеиновой кислоты вируса гриппа, кодирующими вирусные гликопротеины, более предпочтительно с сегментами нуклеиновой кислоты вируса гриппа, кодирующими нуклеопротеин (NP), гемагглютинин (HA), нейраминидазу (NA), матриксные белки (M1 и M2) и неструктурный белок (NS1 и NS2). В одном из вариантов осуществления предоставлена частица по изобретению с сегментами нуклеиновой кислоты вируса гриппа, полученными из вируса гриппа A. Также предоставлена частица по изобретению, которая содержит нуклеиновую кислоту, не кодирующую пептид гриппа. Также изобретение относится к выделенной клетке, содержащей частицу по изобретению, где в указанной клетке отсутствует вирус гриппа дикого типа или вирус-помощник, но предпочтительно содержит полимеразу вируса гриппа или кодирующий ее генный сегмент или комплементирована ими. В предпочтительном варианте осуществления такая клетка представляет собой транскомплементированную клетку 293T или MDCK. В одном из вариантов осуществления изобретение относится к выделенной клетке, содержащей частицу с отсутствием сегмента функциональной нуклеиновой кислоты вируса гриппа PA, где в указанной клетке отсутствует вирус гриппа дикого типа или вирус-помощник, но клетка снабжена или комплементирована, по меньшей мере, сегментом функциональной нуклеиновой кислоты вируса гриппа PA или функциональной PA. В другом варианте осуществления изобретение относится к выделенной клетке, содержащей частицу с отсутствием сегмента функциональной нуклеиновой кислоты вируса гриппа PB1, где в указанной клетке отсутствует вирус гриппа дикого типа или вирус-помощник, но клетка снабжена или комплементирована, по меньшей мере, сегментом функциональной нуклеиновой