Лентивирусная репортерная векторная система для измерения активности ключевых транскрипционных факторов, отражающих функциональное состояние сигнальных путей клетки
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Может быть использовано для определения функционального состояния основных сигнальных путей клетки. Сущностью изобретения являются лентивирусные репортерные векторные конструкции, содержащие маркерные репортерные гены. Техническим результатом является создание лентивирусной репортерной векторной конструкции, оптимальной для определения активности транскрипционных факторов, отражающих функциональное состояние сигнальных путей клетки. Изобретение позволяет прогнозировать чувствительность опухоли к терапевтическим воздействиям и разрабатывать индивидуальную стратегию лечения. 6 н.п. ф-лы, 16 ил.
Реферат
Изобретение относится к области молекулярной биологии, в частности к лентивирусным репортерным векторным системам для анализа активности транскрипционных факторов р53 и NFkB, HIF1α, HSF, FOXO3A и β-катенин для определения функционального состояния клеток злокачественных новообразований, и может быть использовано для прогнозирования чувствительности опухоли к терапевтическим воздействиям и разработке персонифицированной стратегии лечения.
Предпосылки к созданию изобретения
Многолетние исследования природы злокачественного роста свидетельствуют, что возникновение опухолей обычно связано с последовательным приобретением мутаций в нескольких генах, причем число генов, нарушение функции которых может потенциально влиять на процесс канцерогенеза, исчисляется сотнями. Каждый случай злокачественного заболевания сугубо индивидуален, поскольку в его основе лежит практически уникальная комбинация генных нарушений. Высокая вариабельность форм опухолей проявляется также в различиях реакции опухолей на терапевтические воздействия. В настоящее время для лечения рака применяется достаточно стандартный набор средств, воздействующих относительно неспецифично на опухоли самого разного происхождения. При таком подходе отмечаются значительные вариации в терапевтической эффективности при высоком уровне побочных эффектов, связанных с повреждением нормальных клеток тканей и органов.
Медицина будущего, в том числе и противораковая терапия, будет основываться на новых подходах, при которых применяемое лечение направлено против индивидуальной болезни конкретного пациента. При таком подходе, на основании всестороннего знания профиля генных повреждений у конкретного пациента, будут применяться высокоспецифичные средства, эффективные в отношении данной формы патологии, и минимально влияющие на физиологию нормальных клеток.
Выбор эффективных средств лечения невозможен без выявления конкретных повреждений сигнальных путей клеток злокачественных опухолей.
На активность основных внутриклеточных сигнальных путей, влияющих на прогрессию заболевания и определяющих чувствительность к терапевтическим воздействиям, влияет слаженная работа сочетания многих сотен генов. Поэтому для ускоренного выбора оптимальной схемы лечения важно знание функционального состояния сигнальных систем опухолевой клетки, которое определяется активностью ключевых транскрипционных факторов.
Среди транскрипционных факторов, активность которых кардинально влияет на основные параметры опухолевой клетки, прогноз развития заболевания и чувствительность к терапевтическим воздействиям, можно отметить р53, NFkB, E2F1, TCF, STAT3, HIF1α, FOXO3A и некоторые другие.
Активность транскрипционных факторов можно количественно измерить с помощью транскрипционных репортерных конструкций. Такие репортерные системы представляют собой генетические конструкции, в которых репортерный ген находится под контролем модельного промотора, активность которого максимально зависит от того или иного транскрипционного фактора. Репортерным геном может быть любой ген, продукт которого легко поддается количественному измерению, и который сам по себе не влияет на физиологию клетки. Последовательность ДНК, придающая минимальному промотору способность активироваться под действием специфического транскрипционного фактора, представляет собой участок, обладающий способностью связывать и активировать транскрипционный фактор. Такие последовательности вводят в непосредственной близости от минимального промотора. При исследованиях физиологии клетки репортерные системы применяются в основном в культуре клеток. Для этого в клетки вводится с помощью процедуры трансфекции репортерная конструкция, которая начинает экспрессироваться в зависимости от активности соответствующего транскрипционного фактора. Чаще всего применяется процедура транзиторной трансфекции, при которой репортерная конструкция вводится в клетку непосредственно перед измерением активности транскрипционного фактора. Обычно в трансфицированной клетке присутствует множество копий репортерной конструкции, в не интегрированном состоянии, что само по себе может вносить погрешность в виде артефактной активации стрессорных сигнальных путей. Таким образом, для применения репортерного подхода в диагностике требуется создание нового поколения репортерных векторов, позволяющих проводить их высокоэффективное и быстрое введение в опухолевые клетки, а также высокочувствительное измерение активности репортерных генов в условиях самой опухоли, а не культуры эксплантируемых клеток.
Этим требованиям должны удовлетворять векторы, созданные на основе сложных ретровирусов (лентивирусов), которые способны эффективно и быстро встраиваться в состав генома клеток и поддерживать однородную экспрессию введенных в них репортерных кассет в зависимости от активности транскрипционного фактора, специфичного для данной конструкции. Для достоверного определения состояния сигнального пути требуется локальное введение лентивирусной конструкции в опухоль с последующей биопсией материала и измерения активности введенного репортерного маркера.
Для каждого из 5-7 ключевых транскрипционных факторов должен быть создан высокочувствительный репортерный вектор (репортерная конструкция), позволяющий количественно измерять активность в опухолевой клетке. Применение различных репортерных белков (например, флуоресцентных белков) должно позволить одновременно определять функциональную активность нескольких сигнальных систем клетки. Репортерные конструкции должны высокоэффективно входить в опухолевые клетки при локальной аппликации в опухоль, позволяя получать функциональный профиль путем последующей биопсии материала и анализа экспрессии, например с использованием проточного флуориметра.
Разработка и применение этой технологии позволит не только определять стратегию терапии, но и осуществлять контроль над ее эффективностью, в том числе регистрировать возможные изменения поведения клеток, связанные с генетическим отбором в ходе терапевтического воздействия.
Уровень техники
За последние 10 лет векторы на основе лентивирусов нашли широкое применение как в фундаментальных молекулярно-биологических, так и биомедицинских исследованиях in vitro и in vivo, являясь высокоэффективным средством для доставки чужеродной ДНК в различные типы клеток. В частности, перенос генов с использованием лентивирусных векторных конструкций описан в международных публикациях WO 02/49677 (27.06.2002), WO 2006/089001 (24.08.2006), а также в опубликованной заявке US 2003148522 (A1) (07.08.2003), в непатентной литературе, например, в статьях и обзорах: Romano G. Current development of lentiviral-mediated gene transfer. Drug News Perspect. 2005 Mar; 18(2): 128-34; Vigna E, Naldini L. Lentiviral vectors: excellent tools for experimental gene transfer and promising candidates for gene therapy, J Gene Med. 2000 Sep-Oct; 2(5):308-16; новые лентивирусные векторы для сайт-специфической вставки генов описаны, например, в US 2008200663 (A1) (21.08.2008), лентивирусные векторные композиции и их применения описаны, например, в международной публикации WO 2007133674 (А2) (22.11.2007), лентивирусные векторные системы описаны, например, в опубликованной заявке US 2006019393 (A1) (26.01.2006), в международной публикации WO 0192506 (A1) (06.12.2001), также описание лентивирусных векторов различной структуры можно найти, например, в следующих публикациях: WO 2005123930 (A1) (29.12.2005), US 6498033 (B1) (24.12.2002), WO 9904026 (A2) (28.01.1999), GB 2331522 (A) (26.05.1999).
Лентивирусные репортерные конструкции для изучения сигнальных путей в клетке описаны, например, в статье Christina H.Stuelten, Anil К. Kamaraju, Lalage M. Wakefield, Anita B. Roberts «Lentiviral reporter constructs for fluorescence tracking of the temporospatial pattern of Smad3 signaling» BioTechniques, Vol.43, No. 3, September 2007, pp.289-294.
Однако для создания оптимальной репортерной генной конструкции следует учитывать следующие требования.
При введении в клетки контрольная конструкция, не содержащая вблизи минимального промотора специфических участков связывания транскрипционного фактора должна давать минимальный уровень активности.
Уровень экспрессии репортерного гена должен быть пропорционален активности транскрипционного фактора.
Система должна быть максимально чувствительной и регистрировать даже низкие уровни активности транскрипционного фактора.
Генетическая конструкция должна адекватно встраиваться в геном клетки, причем окружающие интегрированную конструкцию участки клеточной ДНК не должны оказывать влияния на активность репортера.
Введение генетической конструкции не должно сопровождаться активацией стрессорных сигнальных путей, чтобы не оказывать артефактного влияния на измерения.
После введения генетической конструкции должна существовать возможность проведения отбора трансдуцированных репортерных клеток от клеток, не содержащих лентивирусные репортерные конструкции.
В предлагаемом изобретении для создания репортерной конструкции, удовлетворяющей всем перечисленным требованиям, был использован лентивирусный вектор. После интеграции в геномную ДНК клетки-мишени исходный лентивирусный вектор транскрипционно неактивен, и экспрессия заключенных в нем последовательностей возможна только при введении в состав вектора промотерных участков. Репортерный лентивирусный вектор содержит минимальный промотор цитомегаловируса человека (CMV), активность которого целиком зависит от соседства с ДНК-элементами, способными связывать транскрипционный фактор. Было введено несколько ДНК-связывающих участков из генов, регулируемых каждым из выбранных транскрипционных факторов. Эти участки введены в непосредственной близости от CMV промотора. В качестве репортерных генов использовали либо ген LacZ, кодирующий фермент бета-галактозидазу, либо один из цветных флуоресцентных белков. В последнем случае анализ экспрессии возможен с применением проточного цитофлуориметра. Наконец, конструкция содержит дополнительную экспрессионную кассету, в которой под контролем конститутивного промотора экспрессируется ген устойчивости к антибиотикам (использован набор селективных маркеров - гены puro, neo, hygro и bleo).
Краткое описание изобретения
В качестве основы для создания репортерных векторных систем могут быть использованы рекомбинантные лентивирусные векторы, которые позволяют вводить в клетки экспрессирующиеся кассеты даже в том случае, если клетки не способны к делениям. Каждая лентивирусная репортерная конструкция будет нести репортерную кассету, реагирующую на активность одного ключевого транскрипционного фактора. Кассета состоит из энхансера, то есть сегмента ДНК, специфически связывающего транскрипционный фактор, помещенного в непосредственной близости от минимального промотора, активность которого полностью зависит от энхансера. Экспрессия репортерного гена, которым является ген одного из цветных флуоресцентных белков, находится под контролем такого респонсивного промотора. По интенсивности флуоресценции клеток, несущих репортерную конструкцию, можно судить об активности данного транскрипционного фактора, а следовательно, и об активности сигнального пути. Это определение проводится на проточном цитофлуориметре. Одновременное введение нескольких репортерных конструкций, экспрессирующих разные флуоресцентные белки, позволяет проводить одновременную оценку активности сразу нескольких сигнальных путей.
Краткое описание чертежей
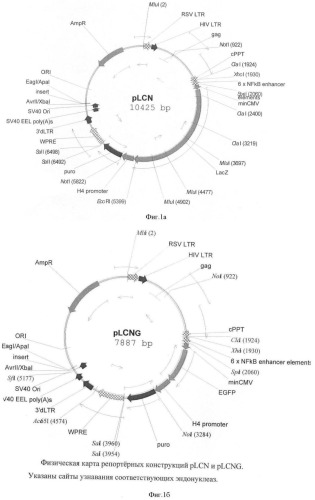
На фигуре 1(а, б) приведены схемы репортерных конструкций pLCN и pLCNG, основанных на репортерных генах LacZ и EGFP, соответственно. Размер этих конструкций 10425 п.о. и 7887 п.о. соответственно.
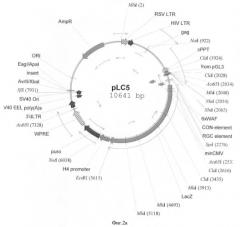
На фигуре 2(а, б) приведены схемы репортерных конструкций pLC5 и pLC5G, основанных на репортерных генах LacZ и EGFP, соответственно. Размер этих конструкций 10641 п.о. и 7969 п.о. соответственно.
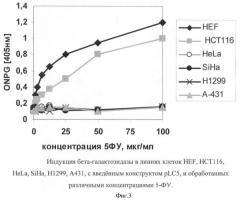
На фигуре 3 приведены результаты испытания в случае индукции бета-галактозидазы в линиях клеток HEF, HCT116, HeLa, SiHa, H1299, A431, с введенным конструктом pLC5, и обработанных различными концентрациями 5-ФУ.
На фигуре 4 представлена индукция бета-галактозидазы в линии клеток HI 299, с введенным конструктом pLCN, и обработанной различными концентрациями TNF-альфа.
На фигуре 5(а, б) приведены схемы репортерных конструкций pLCHRE и pLCHREG, основанные на репортерных генах LacZ и EGFP, соответственно.
На фигуре 6(а, б) приведены схемы репортерных конструкций pLCHSF и pLCHSFG, основанные на репортерных генах LacZ и EGFP, соответственно.
На фигуре 7(а, б) приведены схемы репортерных конструкций pLCCAT и pLCCATG, основанные на репортерных генах LacZ и EGFP, соответственно.
На фигуре 8(а, б) приведены схемы репортерных конструкций pLCFOXO и pLCFOXOG, основанные на репортерных генах LacZ и EGFP, соответственно.
На фигуре 9 представлены результаты определения активности транскрипционного фактора HIF1α на первичных фибробластах человека MRC5.
На фигуре 10 представлены результаты определения активности транскрипционного фактора HSF на линии клеток HeLa.
На фигуре 11 представлены данные по подавлению работы репортера pLCCAT в клетках SW480 после действия shRNA к бета-катенину.
На фигуре 12 представлены данные, свидетельствующие об изменении активности репортерной конструкции pLCFOXO в клетках MRC5 в условиях голодания и экспрессии онкогена Akt.
На фигуре 13 представлена интенсивность флуоресценции репортерных линий клеток после обработки индукторами р53 и NFkB.
На фигуре 14 показано изменение флуоресценции репортерных белков в клетках А549, несущих репортерные конструкции LCNG, LC5G и LCMV-dsRed, после обработки мышей адриамицином в дозе 50 микрограмм.
На фигуре 15 показана динамика увеличения экспрессии зеленого флуоресцентного белка трех линий клеток после введения путем трансдукции репортерных конструкций LC5G и LCNG.
На фигуре 16 показана индукция экспрессии зеленого флуоресцентного белка под действием химиотерапевтических препаратов в клетках опухолей HeLa, A431 и А549, инокулированных смесью вирионов pLC5G и pLCMV-dsRed.
Подробное описание изобретения
Определения
Генетические конструкции - генетические элементы, созданные на базе векторов, представленные кодирующими и (или) некодирующими последовательностями, экспрессия которых необходима для получения какого-либо генетического эффекта в экспериментах (in vitro или in vivo), a также для целей практики.
Онкоген - мутантный активированный протоонкоген, участвующий в злокачественном перерождении клетки.
Протоонкоген - клеточный ген, чаще всего обладающий регуляторными функциями, мутации которого могут приводить к его превращению в онкоген.
Лентивирусный вектор - сконструированный на основе природного лентивируса, сохраняющий только цис-элементы генома ретровируса и способный осуществлять перенос в геном клеток-мишеней клонированных в нем (векторе) целевых генов. По сути, лентивирусный вектор является лентивирусом одноразового действия, т.к. гены природного лентивируса, ответственные за инфекционный процесс, в векторе отсутствуют, а формирование вирусных частиц, содержащих геном рекомбинантного вектора, осуществляется только в специальных упаковывающих клетках, играющих роль помощника.
ОТ-ПЦР - обратная транскрипция, сопряженная с полимеразной цепной реакцией.
п.о. - пары нуклеиновых оснований.
5-ФУ - ДНК-повреждающий химиотерапевтический препарат 5-фторурацил.
bcr-Abl - фермент киназа, часто выявляемая в случае острого миелоидного лейкоза.
eGFP - усиленный зеленый флуоресцирующий белок.
CMV - цитомегаловирус.
LacZ - ген, кодирующий бета-галоктозидазу. Применение гена LacZ позволяет проводить количественную оценку экспрессии.
HIV - (ВИЧ) вирус иммунодефицита человека.
LTR - длинные концевые повторы.
ONPG - о-нитрофенил-п-галактозид, используется для определения активности фермента бета-галактозидазы методом цветной реакции.
р53, NFkB, TCF1, HIF1α, FOXO3A, β-катенин - транскрипционные факторы, активность которых кардинально влияет на основные параметры опухолевой клетки, прогноз развития заболевания и чувствительность к терапевтическим воздействиям.
р53 - белок, кодируемый геном-супрессором опухолевого роста р53.
NFkB - это семейство белков транскрипционных факторов, которые включают в себя NFkB1 (105 кДа), NFkB2, RelA, RelB, Rel. Эти белки образуют NFkB комплекс. Они встречаются почти во всех животных клетках и являются частью сигнальных путей в ответ на стресс, цитокины, свободные радикалы, УФ-облучение, бактериальные и вирусные антигены. Эти белки играют ключевую роль в регулировании иммунного ответа против инфекции. Они также регулируют экспрессию генов, контролирующих клеточную пролиферацию и жизнеспособность и, следовательно, активность этих белков влияет на основные параметры опухолевой клетки.
TCF1 - это транскрипционный фактор (48 кДа), который связывается с энхансерной областью гена TCRA (Т-клеточным рецептором альфа). Гиперэкспрессия этого гена ассоциирована с раком прямой кишки.
HIF1α - это субъединица HIF1 (120 кДа) - транскрипционного фактора, который отвечает за экспрессию генов в клетках в состоянии гипоксии. В обычных условиях HIF1α разрушается в клетке протеиназой и не активен. При гипоксии HIF1α убиквитинируется и меньше подвергается разрушению протеиназой. Мутации и конститутивная экспрессия HIF1α приводит к опухолевым образованиям.
FOXO3A - это транскрипционный фактор. При фосфорилировании эти белки транслоцируются в ядро. Он регулирует экспрессию генов, ответственных за развитие апоптоза. Кроме этого есть данные, что он повышает экспрессию анти-апоптотических генов, например flip. Изменение паттерна экспрессии белка FOXO3A ассоциировано с развитием опухолей.
Бета-катенин (88 кДа) - этот белок является частью кадгеринового белкового комплекса. Он имеет повторы армадилло, которые позволяют белку взаимодействовать со многими другими белками, и участвует во многих сигнальных путях (например Wnt-сигнальный путь). При попадании в ядро β-катенин образует комплексы с другими транскрипционными факторами и влияет на экспрессию многочисленных генов. Повышенная активность β-катенина ассоциирована с опухолевыми образованиями.
pREV, pGAG и pVSV-G - упаковывающие плазмиды, которые кодируют, соответственно, обратную транскриптазу, белок GAG вируса иммунодефицита человека (ВИЧ1) и G-белок вируса везикулярного стоматита.
НЕК293 - перевиваемые клетки почки эмбриона человека, используемые в качестве упаковывающих клеток при создании инфекционных лентивирусных векторных частиц (рекомбинантных лентивирусов).
HEF - перевиваемые клетки эмбриона человека.
НСТ116 - клетки карциномы прямой кишки человека.
HeLa - клетки карциномы шейки матки человека.
SiHa - клетки чешуйчато-клеточной карциномы шейки матки человека.
H1299 - клетки рака легкого.
А431 - клетки эпидермальной карциномы человека.
Для создания лентивирусных репортерных векторных систем, пригодных для анализа сигнальных путей, контролируемых транскрипционными факторами р53 и NFkB, в качестве основы был использован разработанный ранее лентивирусный вектор серии pLC-0. Векторы этой серии включают самоинактивирующийся лентивирусный остов, экспрессия которого в упаковывающей линии клеток контролируется сильным промотором вируса саркомы Рауса, но после заражения клеток-мишеней рекомбинантными вирионами транскрипция содержащейся в векторе репортерной кассеты зависит от минимального промотора цитомегаловируса (CMV). В отсутствии дополнительных энхансеров минимальный промотор неактивен и не может обеспечивать экспрессию репортерного гена. В качестве репортерного гена на начальном этапе использовали LacZ, кодирующий бета-галактозидазу, а также ген eGFP, кодирующий зеленый флуоресцентный белок. Применение гена LacZ позволяет проводить количественную оценку экспрессии и влияние на нее активности транскрипционных факторов, что особенно важно при испытании эффективности создаваемых репортерных систем. В то же время, поскольку в дальнейшем активность сигнальных путей будет оцениваться по флуоресцентным белкам, вторая серия репортерных конструкций построена с применением зеленого флуоресцентного белка (GFP).
Остов репортерных векторов содержит ген устойчивости к антибиотику пуромицину, что позволяет проводить позитивную селекцию клеток после введения лентивирусной конструкции. Ген устойчивости к пуромицину контролируется слабым конститутивным промотором гена гистона Н4, который не содержит энхансерных элементов и поэтому не влияет на работу расположенного вблизи минимального промотора CMV. Оба транскрипта, которые кодируют репортерный ген или ген устойчивости к пуромицину, подвергаются полиаденилированию за счет сигнальной последовательности, расположенной в правом LTR провирусной кассеты. Между геном устойчивости к пуромицину и правым LTR вируса HIV расположен элемент из генома вируса гепатита американского сурка (WPRE), который обеспечивает эффективную трансляцию мРНК и их транспорт из ядра в цитоплазму, минуя стадию сплайсинга. Плазмидная часть конструкции, предназначенная для наращивания в бактериях, построена на основе производных плазмиды Col-E1 и содержит ген устойчивости к ампицилину.
В качестве специфических респонсивных элементов, связывающих транскрипционные факторы и определяющих активацию транскрипции на минимальном промоторе CMV, были использованы следующие последовательности.
1. Для репортерных конструкций, реагирующих на активность транскрипционного фактора р53 - шесть копий 20-членного сайта связывания р53 из гена CDKN1A (р21), одна копия высокоаффинного консенсусного сайта связывания р53 (p53-CON), сегмент кластера генов рибосомных РНК (RGC), содержащий пять сайтов связывания р53.
CTCGAACTGCAGCTCGAGAACATGTCCCAACATGTTGTCGAGAAC ATGTCCCAACATGTTGTCGAGAACATGTCCCAACATGTTGTCGAGAACA TGTCCCAACATGTTGTCGAGAACATGTCCCAACATGTTGTCGAGAACAT GTCCCAACATGTTGTCGAGGACATGCCCGGGCATGTCCACGTTTGCCTT GCCTGGACTTGCCTGGCCTTGCCTTGATCCACTAGT (SEQ ID NO:1)
2. Для репортерных конструкций, реагирующих на активность транскрипционного фактора NFkB - три блока респонсивных последовательностей, содержащих высокоаффинные сайты связывания NFkB - из гена фруктозо-1,6-дифосфатазы, гена глутамат-карбопептидазы и гена рецептора 2 интерферона гамма (IFg-R2).
GGGGACTTTCCCAGAGAGAGAGGGGACTTTCCCAGAGAGAGAGG GGACTTTCCCGA (SEQ ID NO:2)
Схемы репортерных конструкций pLCN и pLCNG, основанных на репортерных генах LacZ и EGFP, соответственно приведены на фигуре 1. Размер этих конструкций 10425 п.о. и 7887 п.о. соответственно.
Схемы репортерных конструкций pLC5 и pLC5G, основанных на репортерных генах LacZ и EGFP, соответственно приведены на фигуре 2. Размер этих конструкций 10641 п.о. и 7969 п.о. соответственно.
Введение репортерных кассет в культуры клеток.
Использовали перевиваемые клетки эмбриона человека линии HEK 293, HEF, HCT116, HeLa, SiHa, H1299, A431. Клетки этих линий выращивают на стандартной среде DMEM и RPMI, содержащей 10% эмбриональной сыворотки крупного рогатого скота, 4 мМ L-глутамина, 1 мМ пирувата натрия, стрептомицин/пенициллин в концентрации 100 мкг/мл и 100 ед/мл соответственно, рН 8,1±0,1 при температуре (36-38)°С в атмосфере 5% СО2.
Испытание репортерных конструкций на клеточных моделях проводили следующим образом. Вначале выделенные плазмидные препараты вводили в упаковывающие клетки для получения рекомбинантных вирионов. Введение плазмид в клетки трансформированного эпителия почки человека (клетки 293Т) проводили с помощью наборов для липофекции фирмы Invitrogene (LipofectAMINE Plus). Одновременно с ленивирусными конструкциями вводили три упаковывающие плазмиды: pREV, pGAG и pVSV-G, которые кодируют, соответственно, обратную транскриптазу, белок GAG вируса иммунодефицита человека (ВИЧ1) и G-белок вируса везикулярного стоматита. Оптимальное соотношение плазмид при трансфекции, дающее максимальные титры рекомбинантных вирионов, определяли экспериментально (вектор:pREV:pGAG:pVSV-G=2:4:2:1). Это соотношение применялось во всех дальнейших опытах. Рекомбинантные вирионы собирали в течение 72 часов с интервалами в 8 часов. Супернатанты объединяли и вирионы осаждали 12% полиэтиленгликолем при 4°С 12 часов с последующим центрифугированием в течение 10 минут при 5000 об/мин. Вирионы затем суспендировали в свежей среде (1/10 от исходного объема) и фильтровали через стерилизующую насадку для шприца. Стерильные вирионы расфасовывали на порции и хранили в заморозке при -70°С.
Для введения репортерных конструкций в испытуемые культуры клеток проводили их заражение с последующей селекцией на антибиотике пуромицине.
Определение чувствительности детекции активности транскрипционных факторов при использовании разных типов репортерных генов.
Для испытания репортерной конструкции, экспрессирующей фермент бета-галактозидазу под р53-регулируемым промотором (pLC5) было получено несколько линий, различающихся по статусу функционирования гена р53. В качестве линий клеток с неповрежденными р53-зависимыми механизмами использовали первичные фибробласты эмбриона человека (HEF) и клетки рака толстого кишечника НСТ116. В качестве р53-негативных клеток использовали линии рака шейки матки HeLa и SiHa, a также клетки карцином HI 299 и А431. Индукцию функционально-активного белка р53 проводили обработкой ДНК-повреждающим химиотерапевтическим препаратом 5-фторурацилом (5-ФУ) в течение 14 часов. Активность фермента бета-галактозидазы проводили с помощью цветной реакции с о-нитрофенил-п-галактозидом (ONPG) и учитывали с помощью планшетного флуориметра.
Изучение влияния активаторов и репрессоров сигнальных путей р53 и NFkB на экспрессию репортерных генов.
На фигуре 3 приведены результаты испытания в случае индукции бета-галактозидазы в линиях клеток HEF, НСТ116, HeLa, SiHa, H1299, А431, с введенным конструктом pLC5, и обработанных различными концентрациями 5-ФУ. Видно, что р53-позитивные линии клеток HEF и НСТ116 демонстрируют зависимое от дозы 5-ФУ повышение ферментативной активности, что соответствует индукции активного транскрипционного фактора р53. В то же время р53-негативные линии клеток никак не реагируют на обработку 5-ФУ.
Для испытания репортерной конструкции, экспрессирующей бета-галактозидазу под промотором, реагирующим на транскрипционный фактор NFkB (pLCN), последний вводили в клетки H1299 (карцинома легкого), после чего проводили обработку повышающими концентрациями TNF-альфа в течение 12 часов. Затем уровень фермента определяли колориметрически в реакции с ONPG (Фигура 4).
В качестве контрольной обработки к клеткам добавляли повышающие концентрации 5-ФУ. Видно, что наблюдается зависимое от дозы TNF-альфа повышение ферментативной активности, в то время как 5-ФУ на работу репортерной системы не влиял.
Принципиально схожие результаты были получены при испытании клеток с введенными репортерными конструкциями, несущими ген зеленого флуоресцентного белка EGFP. В данном случае повышение уровня репортерного белка регистрировали с помощью проточного цитофлуоримента.
Из полученных результатов следует, что репортерные системы чувствительно и высокоспецифически реагируют на активность транскрипционных факторов р53 и NFkB.
Создание репортерных конструкций для транскрипционных факторов hif1α, hsf, foxo3a и β-катенин испытание их активности на культурах клеток.
Поиск оптимальных ДНК-связывающих элементов.
Для определения активности транскрипционных факторов HIF1α, HSF, FOXO3A и β-катенин были созданы базовые репортерные лентивирусные конструкции. Указанные транскрипционные факторы относятся к сигнальным путям клетки, наиболее часто подвергающимся изменениям при злокачественных заболеваниях. Общая схема для создания репортерных конструкций аналогична описанной выше. Так же как и для репортерных конструкций, измеряющих активность транскрипционных факторов NFκB и р53, создавались парные репортерные конструкции, на основе репортерных генов LacZ и зеленого флуоресцентного белка GFP. Кассета, экспрессирующая ген устойчивости к пуромицину, контролировалась промотором гена гистона Н4. Обе экспрессирующие кассеты, для обеспечения оптимального транспорта матриц в цитоплазму, в С-концевой области содержали элемент WPRE.
В качестве специфических респонсивных элементов, связывающих транскрипционные факторы и определяющих активацию транскрипции на минимальном промоторе CMV, были использованы следующие последовательности.
1. Для репортерных конструкций, реагирующих на активность транскрипционного фактора HIF1α - двенадцать блоков респонсивных последовательностей, содержащих высокоаффинные сайты связывания HIF1α - из гена фосфоглицерат киназы (PGK1), гена енолазы (ENO1) и гена лактат дегидрогеназы (LDHA).
GACGTGACAAACGAAGCCGCACGTCAGGGCCGGACGTGGGGCCCCAG AGCGACGCTGAGTGCGTGCGGGACTCGGAGTACGTGACGGAGCCCCAC ACGTGGGTTCCCGCACGTCCGC (SEQ ID NO:3)
2. Для репортерных конструкций, реагирующих на активность транскрипционного фактора HSF (фактор теплового шока) - три блока респонсивных последовательностей, содержащих сайты связывания HSF - из гена множественной лекарственной устойчивости (MDR1), из гена Hsp40 и из гена Hsp70.
AGAACATTCCTCAGAGAGAGAGGAAGGTTCTGGAGGAGACCTGGAATA TTCCCG (SEQ ID NO:4)
3. Для репортерных конструкций, реагирующих на активность транскрипционного фактора TCF/β-катенин - три блока респонсивных последовательностей, содержащих сайты связывания TCF - из гена livin, гена с-myc и высокоафинный консенсусный сайт TCF.
|CACTTTGATTTCTAGAGAGACACCTTTGATTTCAGAGAGAG|CACCTTTGATCC (SEQ ID NO:5)
4. Для репортерных конструкций, реагирующих на активность транскрипционного фактора FOXO - три блока респонсивных последовательностей, содержащих сайты связывания FOXO - из гена IGFBP-1-IRE и DBE1.
CAAGCAAAACAAACCACAAGGTAAACAAACCACAAGCAAAACAAACCA (SEQ ID NO:6)
Создание векторных репортерных конструкций.
Схемы репортерных конструкций pLCHRE и pLCHREG, основанные на репортерных генах LacZ и EGFP, соответственно приведены на фигуре 5.
Схемы репортерных конструкций pLCHSF и pLCHSFG, основанные на репортерных генах LacZ и EGFP, соответственно приведены на фигуре 6.
Схемы репортерных конструкций pLCCAT и pLCCATG, основанные на репортерных генах LacZ и EGFP, соответственно приведены на фигуре 7.
Схемы репортерных конструкций pLCFOXO и pLCFOXOG, основанные на репортерных генах LacZ и EGFP, соответственно приведены на фигуре 8.
Испытание лентивирусных репортерных конструкций на культурах клеток с различающейся активностью транскрипционных факторов и испытание влияния обработок химиотерапевтическими препаратами на активность репортерных систем.
Полученные препараты плазмид использовали для упаковки лентивирусных векторных частиц путем трансфекции в клетки 293Т в присутствии упаковочных конструкций pREV, pGAG и pVSV-G, как подробно описано выше. Вирионы концентрировали высаживанием полэтиленгликолем. Концентрированные препараты лентивирусных векторных частиц использовали для заражения клеток-мишеней. Селекцию клеток мишеней проводили культивированием на среде, содержащей 1 мкг/мл пурамицина.
Испытание конструкций для определения активности транскрипционного фактора HIF1α проводили на первичных фибробластах человека MRC5, а в качестве контроля использовали линию клеток рака почки 786-0, в которой экспрессия HIF1α отсутствует. После введения конструкций pLCHRE и селекции клетки обрабатывали симулятором гипоксии дефероксамином в течение 12 часов и измеряли уровень фермента бета-галактозидазы. Результат представлен на фигуре 9.
Размер столбцов отражает кратность индукции фермента в ответ на обработку дефероксамином.
Репортерный вектор, реагирующий на фактор теплового шока HSF, проверяли на линии клеток HeLa, после введения репортерной конструкции pLCHSF и обработки в течение 4 часов при температуре 40°С, а также при обработке 0,5 мМ H2O2 (фигура 10).
Кратность индукции фермента бета-галактозидазы при обработке репортерной линии клеток HeLa-pLCHSF окислителем Н2О2 и при повышенной температуре.
Для испытания конструкций, реагирующих на активность бета-катенина (pLCCAT), их вводили в клетки карциномы толстого кишечника SW480, в которых наблюдается ядерная локализация бета-катенина за счет делеции гена АРС. Для подавления активности бета-катенина в клетки вводили лентивирусную конструкцию pLSLP-shCatenin, экспрессирующую shPHK к бета-катенину. На фигуре 11 видно заметное снижение активности репортера после подавления активности бета-катенина в клетках SW480.
Для проверки работы репортера, измеряющего активность транскрипционного фактора FOXO3A, репортерную конструкцию pLCFOX вводили в первичные фибробласты легкого человека MRC5. В качестве контроля индукции FOXO репортерные клетки инкубировали 12 часов в среде с 1% сыворотки и 1/10 концентрацией глюкозы. Подавление активности FOXO достигалось введением в клетки MRC5-pLCFOX конструкции pLCMV-MyrAkt, экспрессирующей конститутивно-активную протеинкиназу В (онкоген Akt). Результаты представлены на фигуре 12.
Из полученных результатов следует, что репортерные системы чувствительно и высокоспецифически реагируют на активность транскрипционных факторов HIF1α, HSF, FOXO3A и β-катенин.
Примеры
В приведенных ниже примерах использовали перевиваемые клетки линии НЕК 293, HeLa, A549, А431. Клетки линий выращивают на стандартной среде DMEM и RPMI, содержащей 10% эмбриональной сыворотки крупного рогатого скота, 4 мМ L-глутамина, 1 мМ пирувата натрия, стрептомицин/пенициллин в концентрации 100 мкг/мл и 100 ед/мл соответственно, рН 8,1±0,1 при температуре (36-38)°С в атмосфере 5% СО2.
Пример 1. Анализ активности сигнальных путей и испытание пригодности культур клеток для культивирования на мышах.
В этом примере осуществляли испытания лентивирусных репортерных систем in vivo, на опухолевых клетках человека, культивируемых на иммунодефицитных («голых») мышах. Испытание проводили с использованием в качестве модели репортерных конструкций, регистрирующих активность транскрипционных факторов р53 и NFkB.
Были проведены предварительные этапы.
Во-первых, были отработаны условия роста линий опухолевых клеток человека на голых мышах. Для опытов использовали три линии клеток - клетки рака шейки матки человека HeLa, клетки немелкоклеточного рака легкого A549 и клетки эпидермальной карциномы А431. Клетки HeLa экспрессируют белки вируса папилломы, которые дестабилизируют транскрипционный фактор р53. Клетки А431 несут мутантную форму р53 (His273), а клетки A549 экспрессируют р53 дикого типа. В данные культуры предварительно были введены лентивирусным переносом репортерные конструкции pLC5G и pLCNG, экспрессирующие зеленый флуоресцентный белок под контролем р53- и NFkB-зависимых промоторов. После селекции на пуромицине в те же линии были введены конструкции pLCMV-dsRed-neo, которые экспрессируют р53 под контролем конститутивного промотора цитомегаловируса. В результате селекции на антибиотике G418 получали сублинии трансгенных клеток.
Данные сублинии клеток испытывали на способность образовывать опухоли на бестимусных иммунодефицитных мышах. Клетки вводили группам из 5 мышей в количестве 10000, 50000 и 500000, подкожно, в физиологическом растворе, после чего наблюдали за появлением опухолей. Наибольшей скоростью образования опухолей обладали клетки А431, которые образовывали опухоли размером с горошину уже на 7-10 день после введения. Опухоли образовывались даже при минимальной дозе клеток. Клетки HeLa образовывали опухоли на 14-16 день при введении 50000 клеток. Наименьшей скоростью опухолеобразования характеризовались клетки А549, которые давали прощупываемые опухоли на 21-24 день, при введении 50-500 тыс. клеток.
Пример 2. Изучение влияния химиотерапевтических препаратов на ростовые характеристики опухоли.
После селекции на антибиотике G418 полученные in vitro сублинии клеток проверяли на экспрессию флуоресцентных белков методом цитофлуориметрии, после обработок, индуцирующих активность р53 или NFkB (фигура 13).
Обработка TNFα приводила к значительной стимуляции зеленой флуоресценции в клетках HeLa и А549, несущих репортер NFkB, но в меньшей степени - в клетках А431. Обработка ДНК-повреждающим индуктором р53 приводила к индукции р53-зависимого репортера на основе клеток А549, но практически не влияла на линии клеток HeLa и А431.
Для определения экспрессии репортерных белков опухоли, имеющие размер до 1 см в диаметре, подвергали диспергированию с помощью продавливания через мелкую металлическую сетку. Клетки отмывали фосфатным буфером и дополнительно инкубировали в растворе трипсина и коллагеназы, после чего суспендировали в ростовой среде, фильтровали через нейлоновую сетку и подвергали цитофлуориметрии. Уровни флуоресценции сравнивали с клетками, культивируемыми in vitro. Было установлено, что уровни флуоресценции в опухоли практически соответствовали таковым в культуре.
Для определения возможности индукции флуоресцентного репортерного белка in vivo при обработке индукторами р53 мышам,