Способ количественного анализа количества клеток представляющей интерес бактерии в живом состоянии с применением ррнк в качестве мишени
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, а именно к способу количественного анализа количества клеток представляющей интерес бактерии в живом состоянии, праймеру для применения в данном способе и к набору для осуществления данного способа. Предложенное изобретение может быть использовано для количественного определения бактерий в живом состоянии. Предложенный способ включает амплификацию продукта посредством ПЦР, выполненной с применением праймеров, способных к специфической гибридизации с рРНК представляющей интерес бактерии. После чего осуществляют анализ количества клеток представляющей интерес бактерии в живом состоянии с учетом количества циклов ПЦР. Предложенное изобретение позволяет точно определять количество клеток представляющей интерес бактерии в живом состоянии в пробе для тестирования. 3 н. и 5 з.п. ф-лы, 7 ил., 4 табл.
Реферат
Область техники
Изобретение относится к способу количественного анализа или обнаружения микроорганизма, особенно в живом состоянии, с применением рРНК в качестве мишени.
Предпосылки создания изобретения
В качестве способа количественного определения микроорганизма традиционно применялся главным образом способ, включающий получение культуры микроорганизма в предварительно подвергнутой оценке селективной среде и измерение количества микробных клеток, и способ, включающий культивирование микроорганизмов в жидкой селективной среде и измерение оптической плотности или поглощения. Следующие способы также применялись для процедуры идентификации микроорганизма, необходимой для обнаружения микроорганизма в пробе: например, способ, включающий идентификацию его посредством морфологического изучения, окрашивания по Грамму и микробиологических характеристик, таких как потребность в кислороде, способность ассимилировать сахара и условия для роста в среде; способ, включающий определение микроорганизма при помощи теста ДНК-ДНК гомологии; и способ определения с применением моноклонального антитела к поверхностному антигену микробной клетки. Однако эти способы требуют времени и квалификации и, следовательно, представляли собой проблему с точки зрения быстроты и простоты.
В последние годы способы амплификации генов, включающие способ ПЦР, применялись в широком диапазоне областей в качестве методов для определения следовых количеств нуклеиновых кислот. Эти способы имеют преимущества, способные приводить к ускорению и упрощению, включая отсутствие обязательных требований для культивирования микроорганизма, содержащегося в пробе, и возможность непосредственного использования пробы в качестве образца. Таким образом, способы исследовались на предмет применения в количественном анализе и обнаружении микроорганизма.
В качестве примера, в котором способ ПЦР применялся для анализа микроорганизма, известен способ для количественного определения бактерий посредством способа ПЦР, в котором используется препарат суммарной ДНК в качестве последовательности-мишени и универсальные праймеры (Патентный документ 1). Также были получены способы с применением 16S рДНК в качестве мишени. Известные их примеры включают способ количественного анализа при помощи ПЦР с применением 16S рДНК в качестве последовательности-мишени (Патентный документ 2), способ определения кишечных бактерий посредством способа ПЦР с применением 16S рДНК в качестве последовательности-мишени (Патентный документ 3) и способ обнаружения бактерии бактериального штамма рода Lactobacillus, вызывающей помутнение пива (Патентный документ 4). Однако эти способы были проблематичны тем, что они не могут применяться в качестве альтернативы общепринятому способу, который традиционно применялся, поскольку чувствительность детекции не достигнет той величины, которую получают при применении культурального способа. В качестве примера, осуществление способа количественного анализа, как он раскрыт в Патентном документе 2, требует большого количества матрицы ДНК, соответствующего микробному числу 105/мкл или более, что делает способ практически нецелесообразным. Низкая чувствительность определения связана, вероятно, с низким числом копий (количеством матрицы) суммарной ДНК или 16S рДНК, предоставленной в качестве матрицы для ПЦР в микроорганизме. Поскольку известно, что ДНК сохраняется даже после смерти микроорганизма, эти способы позволяют только выполнить количественный анализ и обнаружить мертвых и живых бактерий вместе, что также вызывает проблему, которая заключается в том, что они сложны для точного количественного анализа и обнаружения живых микроорганизмов (Непатентный документ 1).
В качестве примеров применения способа ПЦР для анализа микроорганизмов также осуществлялись попытки использовать способы с применением мРНК в качестве последовательности-мишени; известные примеры этих способов включают количественный анализ лактобактерий в фекалиях, с использованием мРНК в качестве последовательности-мишени (Непатентный документ 2). Известны также способы определения раковых клеток, которые используют в качестве последовательностей-мишеней мРНК, специфичные для раковых клеток в пробах (Патентные документы 5 и 6). Однако даже эти способы не обеспечивают чувствительность определения в пределах, которые могут сравниться с традиционным способом в качестве способов количественного анализа. В частности, предел обнаружения для количественного анализа, как показано в Патентном документе 2, составляет только 103,5 или более клеток/г фекалий; способ анализа не мог применяться в качестве альтернативы общепринятому культуральному способу в связи с чувствительностью обнаружения. Кроме того, эти способы нацелены на мРНК генов, уникальных для микроорганизмов, и были непригодны для обнаружения микроорганизмов в тестируемой пробе, содержащей множество микроорганизмов, в связи с такими проблемами, как сложность конструирования праймеров и сниженная специфичность.
Соответственно, ожидалась разработка способа, который обеспечивает чувствительность определения в такой же степени, что и общепринятые способы определения, будучи быстрым способом, использующим метод ПЦР или тому подобные, и который дополнительно позволяет точно провести количественный анализ и обнаружить наличие живых микроорганизмов.
Для повышения чувствительности возможно изменение строения мишени таким образом, чтобы мишень могла быть представлена в более стабильном состоянии или в большем относительном количестве в клетках. Однако такая стабильная мишень является, возможно, нежелательной для обнаружения только живого микроорганизма, учитывая, что ожидается ее длительное сохранение также и в мертвых клетках. Таким образом, нелегко одновременно достичь определения только живых клеток и достаточно высокой чувствительности определения.
Также известно, что рРНК составляет приблизительно 85% от всего содержания РНК в клетке в виде многих копий и что рРНК является стабильной по сравнению с мРНК, поскольку она образует комплекс с белком. Также сообщается, что рРНК определяется в течение периода времени порядка 48 часов после микробной смерти (Непатентный документ 3) и, следовательно, обычно считается непригодной для обнаружения живых микроорганизмов (Непатентный документ 1).
Патентный документ 1: Опубликованный патент Японии № 2002-238585
Патентный документ 2: Опубликованный патент Японии № 2003-259879
Патентный документ 3: Опубликованный патент Японии № 2001-112485
Патентный документ 4: Опубликованный патент Японии № 10-210980
Патентный документ 5: Опубликованный патент Японии № 10-248600
Патентный документ 6: Международная публикация WO 00/17395 каталог
Непатентный документ 1: J Food Prot, vol. 67, No. 4: 823-832 (2004)
Непатентный документ 2: FEMS Microbiology Letters, vol. 231: 125-130 (2004)
Непатентный документ 3: Appl. Environ. Microbiol., vol. 64, No. 11: 4264-4268 (1998)
Целью настоящего изобретения является предоставить способ количественного анализа микроорганизмов, который позволяет достигать чувствительности определения в таких пределах, которые позволяют заменить общепринятый культуральный способ, и более точного обнаружения живых микроорганизмов.
Раскрытие изобретения
В результате интенсивных исследований, авторы настоящего изобретения обнаружили, что рРНК (т.е. 5S, 16S и 23S у бактерий и 5S, 18S, 26S или 28S в эукариотических клетках), которая, как считалось, является непригодной для определения живых микроорганизмов с точки зрения стабильности, может неожиданно быть использована в качестве мишени для точного количественного анализа и определения количества живых микробных клеток без включения мертвых клеток и, более того, что применение способа ПЦР в количественном анализе и определении может достигать такой чувствительности определения, которая позволяет заменить общепринятый способ, и таким образом, настоящее изобретение достигло своей цели.
Таким образом, настоящее изобретение предоставляет способ количественного анализа представляющих интерес микроорганизмов с применением в качестве показателя количества рРНК микроорганизма в тестируемой пробе.
Настоящее изобретение также предоставляет способ определения представляющих интерес микроорганизмов с применением в качестве показателя присутствия рРНК микроорганизма в тестируемой пробе.
Настоящее изобретение также предоставляет фрагмент нуклеиновой кислоты, используемый в вышеописанном способе, где фрагмент представляет собой фрагмент нуклеиновой кислоты, содержащий последовательность оснований, описанную в одной из SEQ ID NO: 2, 3 и 5-28, или комплементарную ей последовательность оснований, или фрагмент нуклеиновой кислоты, содержащий последовательность оснований, гомологичную или функционально эквивалентную ей.
Настоящее изобретение дополнительно предоставляет набор для осуществления вышеописанного способа.
Способ определения с использованием в качестве мишени рРНК в соответствии с настоящим изобретением может применяться для достижения высокой чувствительности определения по сравнению со способом, использующим общепринятую мишень, вследствие присутствия мишени в большом количестве, при также более точном определении и количественном анализе живых микроорганизмов. Способ ПЦР может также применяться при определении для достижения такой чувствительности определения, которая позволяет заменить общепринятый культуральный способ. Кроме того, способ с применением способа ПЦР может обеспечивать заметную быстроту и простоту по сравнению с общепринятыми способами, такими как культуральный способ. Другими словами, способ по настоящему изобретению может применяться для одновременного обеспечения высокой чувствительности определения, более точного количественного анализа и/или определения живых организмов и быстроты и простоты. Таким образом, способ по настоящему изобретению может применяться на практике, когда требуется обнаружить и/или оценить количественно микроорганизм, так как это делается при исследовании кишечной флоры, и определение и/или количественный анализ микроорганизмов, живущих в пробе, взятой из пищевого продукта или организма.
Краткое описание чертежей
Фигура 1 представляет собой ряд графиков, показывающих корреляцию между ростом различных микроорганизмов и значением транскрипции рРНК.
Фигура 2 представляет собой ряд графиков, каждый из которых показывает стандартную кривую, полученную посредством количественного способа RT-ПЦР, и сравнения по диапазону определения этого способа и способа количественной ПЦР.
Фигура 3 представляет собой график, показывающий предел определения P. aeruginosa из фекалий человека.
Фигура 4 представляет собой график, показывающий сопоставление количественных значений для энтеробактерий в фекалиях человека при определении способом количественной RT-ПЦР и культуральным способом.
Фигура 5 представляет собой ряд графиков, показывающих чувствительность определения E. coli, S. aureus и B. cereus в коровьем молоке.
Фигура 6 представляет собой ряд графиков, показывающих чувствительность определения P. aeruginosa и S. aureus в крови.
Фигура 7 представляет собой график, показывающий чувствительность определения E. coli в ферментированном молочном продукте.
Лучшие варианты осуществления изобретения
Способ количественного анализа или определения представляющих интерес микроорганизмов в соответствии с настоящим изобретением характеризуется применением показателя численности или наличия рРНК микроорганизма в тестируемой пробе.
Под рРНК представляющего интерес микроорганизма подразумевается рРНК, которую может иметь микроорганизм, который должен быть подвергнут количественному анализу и определению. Примеры рРНК включают прокариотические 5S, 16S и 23S рРНК и эукариотические 5S, 5.8S, 18S, 26S и 28S рРНК; 16S, 23S, 18S и 26S рРНК являются особенно предпочтительными тем, что они в основном применяются в качестве надежных показателей в современной классификации микроорганизмов. Под представляющим интерес микроорганизмом подразумевается микроорганизм, который должен быть обнаружен и подвергнут количественному анализу, и не является ограниченным каким-либо образом. Примеры таких микроорганизмов включают микроорганизмы семейства Enterobacteriaceae и родов Enterococcus, Lactobacillus, Streptococcus, Staphylococcus, Veillonella, Pseudomonas, Clostridium, Bacteroides, Bifidobacterium, Eubacterium, Prevotella, Ruminococcus, Fusobacterim, Propionibacterium, Peptostreptococcus, Vibrio, Bacillus, Campylobacter, Acinetobacter, Lactococcus, Pediococcus, Weissella, Leuconostoc, Oenococcus, Helicobacter, Neisseria, Listeria, Haemophillus, Mycobacterium, Gardnerella, Legionella, Aeromonas, Moraxella и Candida, и микроорганизмы, как описано в Таблицах 2 и 3, которые будут упоминаться далее. Представляющий интерес микроорганизм в соответствии с настоящим изобретением представляет собой понятие, включающее не только микроорганизм одного штамма, но также и одной группы, рода и семейства, которые состоят из популяции 2 штаммов или более, обладающих определенными свойствами.
Тестируемая проба относится к объекту, который должен быть исследован на предмет наличия, численности микроорганизма или тому подобного. Примеры тестируемых проб включают пробы из биологического источника, такого как мазок из конъюнктивы глаза, зубной камень, зубной налет, мокрота, мазок из зева, слюна, выделения из носа, бронхоальвеолярный смыв, плевральный выпот, желудочный сок, смыв из желудка, моча, цервикальная слизь, влагалищные выделения, участки повреждения кожи, фекалии, кровь, асцитическая жидкость, ткань, спинномозговая жидкость, синовиальная жидкость и смыв с участка повреждения; и объекты, потенциально содержащие микроорганизмы, такие как пища, лекарственные препараты, косметические средства, полупереработанные пищевые продукты (полуфабрикаты), лекарственные препараты и косметические средства, микробный бульон, растения, почва, активированный ил и дренажная вода. Образец пробы для тестирования относится к образцу, взятому или полученному из пробы для тестирования, и конкретно никак не ограничен, при условии, что образец способен отражать наличие или численность микроорганизма в пробе. Примеры образцов включают смеси, содержащие нуклеотиды, и смеси, содержащие РНК, содержащиеся в пробе для тестирования; предпочтительной с точки зрения применения способа ПЦР является смесь, содержащая РНК, присутствующие в пробе для тестирования.
Образец пробы для тестирования может быть подходящим образом получен, например, из целой или части пробы для тестирования при помощи известного способа, при необходимости, после предварительной обработки с применением способов экстракции, сепарации и очистки. В качестве примера, смесь, содержащая РНК, может быть получена, например, посредством экстракции с применением универсального способа, такого как “способ ультрацентрифугирования в среде, содержащей хлорид гуанидин-цезия”, “способ, включающий обработку кислой смесью гуанидин-фенол хлороформ (AGPC)”, “способ магнитных бус” и “способ кремниевой колонки”, при необходимости, после предварительной обработки, включающей известный способ, такой как фильтрация, центрифугирование и хроматография; также для этого может применяться коммерческий набор (например, QIAGEN RNeasy Kit, TRIZOL).
Применяемый образец пробы для тестирования предпочтительно представляет собой РНК в стабилизированном состоянии в микроорганизме, с целью предотвращения его распада для сохранения высокой чувствительности определения. Стабилизация может выполняться с применением, например, коммерческих стабилизирующих агентов (например, RNAprotect Bacterial Reagent, RNAlater). Стабилизация предпочтительно осуществляется непосредственно после взятия пробы, для того, чтобы избежать изменения количества РНК в микроорганизме.
В количественном анализе представляющего интерес микроорганизма в соответствии с настоящим изобретением используется в качестве показателя количество РНК микроорганизма в пробе для тестирования. Здесь количество РНК представляющего интерес микроорганизма в пробе для тестирования может быть определено, например, посредством (1) получения количества продукта, амплифицированного при помощи ПЦР с применением фрагментов нуклеиновой кислоты, способных к специфической гибридизации с рРНК представляющего интерес микроорганизма, и образца пробы, (2) осуществления эффективной гибридизации между фрагментами нуклеиновой кислоты, способными к специфической гибридизации с рРНК представляющего интерес микроорганизма, и образца пробы или (3) применения количественного способа с применением другого известного способа.
Здесь, в случае (1) применения способа ПЦР, “фрагменты нуклеиновой кислоты, способные к специфической гибридизации с рРНК представляющего интерес микроорганизма” могут быть сконструированы посредством сравнения последовательности оснований микроорганизма с последовательностями оснований других микроорганизмов для выбора последовательностей, специфичных для рРНК, которые может иметь представляющий интерес микроорганизм. В данном описании последовательность рРНК, которую может иметь микроорганизм, может быть получена, например, посредством проверки на соответствие с базой данных (DDBJ, GenBank и так далее). Также последовательности оснований могут быть выровнены с применением программного обеспечения (например, Clustal X) для обнаружения специфических последовательностей визуальным или любым другим способом. Последовательности, специфичные для представляющего интерес микроорганизма, предпочтительно выбирают с учетом ширины границ, в которые попадает микроорганизм(ы), подвергающийся количественному анализу. В частности, например, если штамм должен быть точно определен количественно, предпочтительно выбирают последовательности, специфичные для штамма; если должен быть проведен количественный анализ рода, предпочтительно выбирают последовательности, специфичные для рода. Выбор может соответствующим образом осуществляться с применением известного способа.
В дополнение к последовательностям, сконструированным таким образом, фрагменты нуклеиновой кислоты, способные к гибридизации с рРНК представляющего интерес микроорганизма, могут быть каждый должным образом установлены на основании общеизвестных принципов в данной области; последовательность оснований, комплементарная описанной выше последовательности оснований, последовательность оснований, гомологичная ей, так же пригодна для количественного анализа представляющего интерес микроорганизма, и подобные последовательности также могут быть применены. Примеры гомологичной последовательности оснований включают фрагмент нуклеиновой кислоты, содержащий (а) описанную выше последовательность оснований, которая дополнительно содержит замену, вставку или делецию одного или нескольких, предпочтительно от 1 до 10 оснований, (b) последовательность оснований, идентичная описанной выше последовательности оснований на 90% или более, предпочтительно 95% или более, более предпочтительно, 99% или более, или (с) последовательность оснований, способную к гибридизации при строгих условиях с ДНК-содержащей последовательностью оснований, комплементарной описанной выше последовательности оснований.
Фрагмент нуклеиновой кислоты может также представлять собой часть фрагмента нуклеиновой кислоты, к которой с одного или обоих концов, предпочтительно, с 5'-конца, добавлены предпочтительно 100 оснований, более предпочтительно, 20 оснований, еще более предпочтительно, 10 оснований или менее.
Длина фрагмента нуклеиновой кислоты не является конкретно ограниченной; однако, фрагмент предпочтительно содержит от 5 до 50, более предпочтительно, от 12 до 35 оснований.
Фрагмент нуклеиновой кислоты, сконструированный таким образом, может быть синтезирован искусственно, например, на синтезаторе ДНК в соответствии с его последовательностью оснований. Фрагмент предпочтительно является таким, чтобы его специфичность была проверена. Здесь специфичность может быть проверена, например, посредством подтверждения того, что применение представляющей интерес рРНК в качестве матрицы обеспечивает получение определенного амплифицированного при помощи ПЦР продукта, при сравнении с подходящим контролем.
Примеры фрагмента нуклеиновой кислоты включают фрагменты нуклеиновой кислоты, содержащие последовательности оснований, описанные в SEQ ID NO: 1-30, или последовательности оснований, комплементарные им, или фрагменты нуклеиновых кислот, содержащие последовательности оснований, гомологичные или функционально эквивалентные им. В данном описании, примеры фрагментов нуклеиновой кислоты, содержащих последовательности оснований, гомологичные или функционально эквивалентные им, включают фрагменты нуклеиновой кислоты, как показано в пунктах (а)-(с) ниже, которые могут применяться для количественного анализа и определения рРНК представляющего интерес микроорганизма.
(а) Фрагмент нуклеиновой кислоты, содержащий последовательность оснований, представленную одной из SEQ ID NO: 1-30 или последовательностью оснований, комплементарной ей, где фрагмент содержит делецию, замену или вставку одного или нескольких оснований.
(b) Фрагмент нуклеиновой кислоты, последовательность которого на 90% или более, предпочтительно, 95% или более, более предпочтительно, 99% или более, идентична последовательности оснований, представленной одной из SEQ ID NO: 1-30, или последовательности оснований, комплементарной ей.
(c) Фрагмент нуклеиновой кислоты, содержащий последовательность оснований, способную к гибридизации в жестких условиях с ДНК, содержащей последовательность оснований, представленную одной из SEQ ID NO: 1-30, или последовательность оснований, комплементарную ей.
В данном документе идентичность последовательностей оснований рассчитывается с применением программы поиска гомологии GENETYX (R).
“Жесткие условия” включают, например, проведение гибридизации при 42°С в течение от 16 до 24 часов в растворе, содержащем 50% формамид, 5×SSC, 5×раствор Дэнхарда и 250 мг/мл ДНК спермы лосося.
Фрагмент нуклеиновой кислоты, пригодный для количественного анализа и обнаружения рРНК представляющего интерес микроорганизма, может быть получен, например, посредством осуществления метода ПЦР для отбора фрагмента нуклеиновой кислоты, который обеспечивает получение продукта амплификации, если в качестве матрицы применяется рРНК данного микроорганизма, но не дает продукта при использовании в качестве матрицы другой мишени, например, рРНК другого микроорганизма или мРНК.
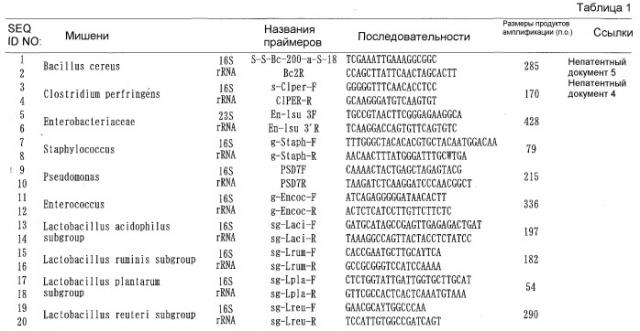
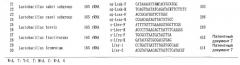
Затем, (1) фрагмент нуклеиновой кислоты, содержащий последовательность оснований, описанную в SEQ ID NO: 1 или 2, или последовательность оснований, комплементарную ей, или фрагмент нуклеиновой кислоты, содержащий последовательность оснований, гомологичную ей и функционально ей эквивалентную, может быть применен для специфического количественного анализа и обнаружения Bacillus cereus; (2) фрагмент нуклеиновой кислоты, содержащий последовательность оснований, описанную в SEQ ID NO: 3 или 4, или последовательность оснований, комплементарную ей, или фрагмент нуклеиновой кислоты, содержащий последовательность оснований, гомологичную ей и функционально ей эквивалентную, может применяться для специфического количественного анализа и обнаружения Clostridium perfringens; (3) фрагмент нуклеиновой кислоты, содержащий последовательность оснований, описанную в SEQ ID NO:5 или 6, или последовательность оснований, комплементарную ей, или фрагмент нуклеиновой кислоты, содержащий последовательность оснований, гомологичную ей и функционально ей эквивалентную, может применяться для специфического количественного анализа и обнаружения Enterobacteriaceae; (4) фрагмент нуклеиновой кислоты, содержащий последовательность оснований, описанную в SEQ ID NO: 7 или 8, или последовательность оснований, комплементарную ей, или фрагмент нуклеиновой кислоты, содержащий последовательность оснований, гомологичную ей и функционально ей эквивалентную, может быть применен для специфического количественного анализа и обнаружения Staphylococcus; (5) фрагмент нуклеиновой кислоты, содержащий последовательность оснований, описанную в SEQ ID NO: 9 или 10, или последовательность оснований, комплементарную ей, или фрагмент нуклеиновой кислоты, содержащий последовательность оснований, гомологичную ей и функционально ей эквивалентную, может быть применен для специфического количественного анализа и обнаружения рода Pseudomonas; (6) фрагмент нуклеиновой кислоты, содержащий последовательность оснований, описанную в SEQ ID NO: 11 или 12, или последовательность оснований, комплементарную ей, или фрагмент нуклеиновой кислоты, содержащий последовательность оснований, гомологичную ей и функционально ей эквивалентную, может быть применен для специфического количественного анализа и обнаружения рода Enterococcus; (7) фрагмент нуклеиновой кислоты, содержащий последовательность оснований, описанную в SEQ ID NO: 13 или 14, или последовательность оснований, комплементарную ей, или фрагмент нуклеиновой кислоты, содержащий последовательность оснований, гомологичную ей и функционально ей эквивалентную, может быть применен для специфического количественного анализа и обнаружения подгруппы Lactobacillus acidophilus; (8) фрагмент нуклеиновой кислоты, содержащий последовательность оснований, описанную в SEQ ID NO: 15 или 16, или последовательность оснований, комплементарную ей, или фрагмент нуклеиновой кислоты, содержащий последовательность оснований, гомологичную ей и функционально ей эквивалентную, может быть применен для специфического количественного анализа и обнаружения подгруппы Lactobacillus ruminis; (9) фрагмент нуклеиновой кислоты, содержащий последовательность оснований, описанную в SEQ ID NO: 17 или 18, или последовательность оснований, комплементарную ей, или фрагмент нуклеиновой кислоты, содержащий последовательность оснований, гомологичную ей и функционально ей эквивалентную, может быть применен для специфического количественного анализа и обнаружения подгруппы Lactobacillus plantarum; (10) фрагмент нуклеиновой кислоты, содержащий последовательность оснований, описанную в SEQ ID NO: 19 или 20, или последовательность оснований, комплементарную ей, или фрагмент нуклеиновой кислоты, содержащий последовательность оснований, гомологичную ей и функционально ей эквивалентную, может быть применен для специфического количественного анализа и обнаружения подгруппы Lactobacillus reuteri; (11) фрагмент нуклеиновой кислоты, содержащий последовательность оснований, описанную в SEQ ID NO: 21 или 22, или последовательность оснований, комплементарную ей, или фрагмент нуклеиновой кислоты, содержащий последовательность оснований, гомологичную ей и функционально ей эквивалентную, может быть применен для специфического количественного анализа и обнаружения подгруппы Lactobacillus sakei; (12) фрагмент нуклеиновой кислоты, содержащий последовательность оснований, описанную в SEQ ID NO: 23 или 24, или последовательность оснований, комплементарную ей, или фрагмент нуклеиновой кислоты, содержащий последовательность оснований, гомологичную ей и функционально ей эквивалентную, может быть применен для специфического количественного анализа и обнаружения подгруппы Lactobacillus casei; (13) фрагмент нуклеиновой кислоты, содержащий последовательность оснований, описанную в SEQ ID NO: 25 или 26, или последовательность оснований, комплементарную ей, или фрагмент нуклеиновой кислоты, содержащий последовательность оснований, гомологичную ей и функционально ей эквивалентную, может быть применен для специфического количественного анализа и обнаружения Lactobacillus brevis; (14) фрагмент нуклеиновой кислоты, содержащий последовательность оснований, описанную в SEQ ID NO: 27 или 28, или последовательность оснований, комплементарную ей, или фрагмент нуклеиновой кислоты, содержащий последовательность оснований, гомологичную ей и функционально ей эквивалентную, может быть применен для специфического количественного анализа и обнаружения Lactobacillus fructivorans; и (15) фрагмент нуклеиновой кислоты, содержащий последовательность оснований, описанную в SEQ ID NO: 29 или 30, или последовательность оснований, комплементарную ей, или фрагмент нуклеиновой кислоты, содержащий последовательность оснований, гомологичную ей и функционально ей эквивалентную, может быть применен для специфического количественного анализа и обнаружения Lactobacillus fermentum.
В данном описании фрагмент нуклеиновой кислоты, содержащий последовательность оснований в SEQ ID NO: 1, является известным фрагментом нуклеиновой кислоты, как описано в FEMS Microbiology Letters, vol. 202: 209-213 (2001). Фрагмент нуклеиновой кислоты, содержащий последовательность оснований в SEQ ID NO: 4, является известным фрагментом нуклеиновой кислоты, как описано в Microbiol. Immunol., vol. 46, No. 5: 353-358 (2002). Фрагмент нуклеиновой кислоты, содержащий последовательность оснований в SEQ ID NO: 29 или 30, является известным фрагментом нуклеиновой кислоты, как описано в Опубликованном патенте Японии № 11-151097. В отличие от этого, фрагменты нуклеиновой кислоты, содержащие последовательности оснований, описанные в SEQ ID NO: 2, 3 и 5-28, являются фрагментами нуклеиновой кислоты, найденными авторами настоящего изобретения.
Способ ПЦР с применением фрагментов нуклеиновой кислоты, полученных таким образом, и образца пробы для тестирования может осуществляться посредством “ПЦР в реакционной системе, содержащей образец, с применением фрагментов нуклеиновой кислоты в качестве праймеров и рРНК представляющего интерес микроорганизма в качестве матрицы”. Способ ПЦР не является конкретно ограниченным, при условии, что в реакции специфически амплифицируется нуклеотидный фрагмент, производный из рРНК представляющего интерес микроорганизма. Предпочтительным является способ, включающий этап использования рРНК представляющего интерес микроорганизма в качестве матрицы для получения кДНК с применением фермента, предпочтительно, обратной транскриптазы или тому подобного. Более предпочтительным является способ, включающий, в дополнение к этапу, описанному выше, стадию использования кДНК, полученной таким образом, в качестве матрицы для амплификации нуклеотидного фрагмента. Способ ПЦР может выполняться с применением, например, известной RT-ПЦР. В данном описании RT-ПЦР может проводиться с применением известного способа, такого как двухэтапный RT-ПЦР и одноэтапный RT-ПЦР; однако одноэтапный RT-ПЦР является предпочтительным, поскольку он является особенно простым и предотвращает перекрестное загрязнение.
Способ одноэтапного RT-ПЦР может выполняться с применением, например, коммерческого набора (например, набор QIAGEN One-Step RT-PCR). Фермент, имеющий транскрипционную активность, который может применяться в RT-реакции, может представлять собой любую из различных обратных транскриптаз, таких как обратная транскриптаза M-MHV. ДНК-полимераза, применяемая в амплификации ДНК при помощи ПЦР, предпочтительно, является термостабильной при температуре 90°С и выше.
ПЦР может проводиться посредством осуществления от одного до нескольких циклов реакции температурной денатурации для преобразования двуспиральной ДНК в односпиральную ДНК, реакции отжига для гибридизации праймеров на матрице кДНК и реакции достройки (удлинения) для предоставления возможности действовать ДНК-полимеразе при температуре от 90 до 98°С, от 37 до 72°С и от 50 до 75°С, соответственно. Предпочтительный пример условий реакции является термическая денатурация при 95°С в течение 30 секунд, отжиг при 60°С в течение 30 секунд и достройка (удлинение) при 72°С в течение 60 секунд.
Для ПЦР два типа праймеров, предпочтительно, применяются как комплект. В данном описании необходимо составить два праймера для образования комбинации лидирующей цепи и запаздывающей цепи. Фрагменты нуклеиновой кислоты, предоставленные настоящим изобретением, составлены каждый таким образом, чтобы иметь приблизительно постоянную температуру отжига в RT-ПЦР, которая позволяет фрагментам нуклеиновой кислоты множества микроорганизмов исследоваться одновременно. Фрагмент нуклеиновой кислоты настоящего изобретения может также применяться в качестве зонда и может также быть использован в комбинации с другим известным универсальным праймером, олигонуклеотидом или тому подобным.
Образец пробы для тестирования, содержащий рРНК, обеспечивающую матрицу для RT-ПЦР, предпочтительно, имеет общее содержание РНК от 1 пг до 1 мкг, более предпочтительно, от 10 пг до 0,1 мкг.
Когда ПЦР проводится должным образом, обычно существует корреляция между “количеством продукта, амплифицированного при помощи ПЦР”, “количеством циклов ПЦР” и “количеством матрицы для ПЦР”. Так, количество рРНК представляющего интерес микроорганизма может быть определено, если подсчет осуществляется должным образом с учетом количества амплифицированного продукта, образовавшегося в результате проведенной таким образом ПЦР и количества циклов ПЦР.
Как показано на Фигуре 1 Примера, который будет описан, было показано, что существует также четкая корреляция между “количеством рРНК представляющего интерес микроорганизма”, определенным таким образом, и “количеством клеток представляющего интерес микроорганизма”. Количество клеток представляющего интерес микроорганизма может, следовательно, быть определено, если подсчет осуществляется с учетом “количества рРНК представляющего интерес микроорганизма”, определенного таким образом. Даже без процесса вычисления “количества рРНК представляющего интерес микроорганизма”, количество клеток микроорганизма может быть определено посредством соответствующего расчета с учетом “количества амплифицированного продукта, образовавшегося в результате ПЦР” и “количества циклов ПЦР”, полученных описанным выше образом.
Количество амплифицированного в результате ПЦР продукта и количество циклов ПЦР можно узнать при помощи любого способа без какого-либо определенного ограничения, например, посредством определения количества циклов ПЦР, при котором количество ДНК достигает произвольно выбранного уровня. Определение может осуществляться, например, посредством применения “способа ПЦР, включающего мечение продукта ПЦР, в сочетании со способом ПЦР, включающим измерение количества метки во времени” для определения количества циклов ПЦР до достижения некой выбранной интенсивности флуоресценции. В данном описании определенная интенсивность флуоресценции предпочтительно выбирается “в диапазоне значений, которых интенсивность может достигать, когда количество продукта амплификации логарифмически возрастает”, как отражение соответствующей корреляции между ними. Диапазон значений можно должным образом понять с применением известного способа. В данном описании примеры мечения включают мечение флуоресцентным красителем; примеры измерения количества метки включают измерение интенсивности флуоресценции. Здесь примеры мечения флуоресцентным красителем включают мечение интеркалирующим флуоресцентным красителем. Примеры интеркалирующих флуоресцентных красителей включают SYBR(R) Green I. Интеркалирующий краситель имеет свойство, согласно которому интенсивность флуоресценции повышается при его включении в двуспиральную нуклеиновую кислоту, приводя, таким образом, к испусканию флуоресценции, имеющей интенсивность, которая отражает количество амплифицированного в результате ПЦР продукта. Мечение флуоресцентным красителем может также осуществляться с применением пробы TaqMan, Молекулярного маяка или тому подобного, меченными флуоресцентным красителем. Проба TaqMan или Молекулярный маяк являются пробами, в которых флуоресцентный краситель и гаситель связаны с олигонуклеотидом, гомологичным внутренней последовательности участка, амплифицированного при помощи ПЦР, и применяются благодаря возможности сосуществования в системе ПЦР. Взаимодействие флуоресцентного красителя и гасителя, связанных с пробой, делает возможным испускание флуоресценции в ответ на реакцию амплификации при ПЦР, позволяя, таким образом, наблюдение количества продукта амплификации при ПЦР по мере измерения интенсивности флуоресценции на каждом этапе ПЦР. Однако проба TaqMan, Молекулярный маяк или тому подобное делают необходимым подбор специфической для