Способ получения электролитических порошков металлов
Иллюстрации
Показать всеИзобретение относится к способу получения электролитических порошков металлов электролизом из водного раствора, содержащего соль соответствующего металла и буферные добавки. При этом используют растворимый и нерастворимый аноды, которые подключают к отдельным источникам тока для контроля растворения растворимого анода в течение процесса электролиза и концентрации ионов металла в растворе с помощью корректировки соотношения анодных сил тока растворимого и нерастворимого анодов при постоянном значении катодной плотности тока. При этом постоянное значение катодной плотности тока достигают постоянством площади катода и суммы сил тока на растворимом и нерастворимом аноде. Технический результат заключается в исключении трудоемкой операции корректировки электролита за счет выравнивания катодного и анодного выходов по току при получении порошка металла. 8 ил.
Реферат
Заявляемое техническое решение относится к области порошковой металлургии, в частности к способам получения металлических порошков методом электролиза.
Получение электролитических порошков металлов основано на процессе электролиза водных растворов, содержащих соль соответствующих металлов и буферные добавки. [1] (Кудра О., Гитмен Е., Электрохимическое получение металлических порошков, Киев, 1952 г.).
В течение процесса электролиза в растворе меняются исходные концентрации веществ, что приводит к изменению условий получения порошка. Это обстоятельство создает проблему в промышленном применении такого метода при получении металлических порошков из-за трудоемких операций корректировки состава электролита. Главной причиной изменения концентраций веществ в растворе является разница в величинах катодного и анодного выходов по току. Тем более что анодное растворение некоторых металлов не встречает затруднений и они легко растворяются без признаков пассивирования. Между тем, помимо восстановления ионов металла на катоде в порошкообразном виде, как правило, протекает побочная реакция восстановления ионов водорода. Превышение анодного выхода над катодным выходом сказывается в накоплении в течение процесса электролиза катионов металла в растворе. Так как поддержание постоянства состава электролита является непременным условием получения порошков с заданными свойствами, то при электролизе необходимо организовать контролируемое растворение анодов.
Известен способ получения металлических порошков электрохимическим путем [2] (авторское свидетельство СССР №70696, дата приоритета 08.02.1947 г.), заключающийся в электроосаждении порошкообразного металла на горизонтально расположенном катоде с применением растворимых или нерастворимых анодов, расположенных вертикально вокруг катода по сторонам его или над ним.
В другом известном способе электролитического получения высокодисперсного магнитного порошка кобальта [3] (авторское свидетельство СССР №189155, дата приоритета 17.11.1966 г.), заключающемся в электролизе электролита, содержащего сульфат кобальта, с применением катодов из стали, меди и других металлов и анодов из кобальта (растворимыми) или свинца (нерастворимыми).
Недостатком указанных способов является то, что при замене растворимых анодов на нерастворимые в процессе электролиза происходит обеднение раствора ионами металлов (основному компоненту) и тем самым полное прекращение процесса осаждения порошкообразного металла. Таким образом, указанные способы также требуют трудоемкой операции корректировки состава электролита по катионам металла.
Наиболее близким по технической сущности и поэтому выбранным в качестве прототипа является способ усовершенствования методов получения чистого металлического кобальтового порошка [4] (патент Великобритании №403.281, дата приоритета 29.04.1932 г.), согласно которому электролитический кобальтовый порошок может быть получен электролизом водного раствора соли кобальта (преимущественно сульфата кобальта) с применением анода преимущественно из платины или чистого кобальта, а также при объединении двух видов анодов, которые образуют специальную платиновую секцию, которая не формирует электролитический экран относительно кобальта, помещенных в этом месте.
Согласно прототипу одновременное применение растворимого и нерастворимого анодов обеспечивает снижение интенсивности растворения кобальтовых пластин за счет уменьшения их рабочей поверхности. В то же время у указанного способа получения кобальтового порошка существует трудность в выборе оптимального соотношения площади растворимого анода к площади нерастворимого анода (Sp : Sн), которое позволяет поддерживать неизменную концентрацию ионов кобальта в течение процесса электролиза. Тем более что с течением времени кобальтовая пластина растворяется, следовательно, изменяется ее рабочая поверхность, что опять приводит к нарушению соотношения площадей анодов двух видов и изменению содержания катионов металла в растворе.
Задачей заявляемого технического решения является выравнивание катодного и анодного (растворимого анода) выходов по току при получении порошкообразного металла методом электролиза и тем самым исключение трудоемкой операции корректировки электролита при промышленном применении этого метода.
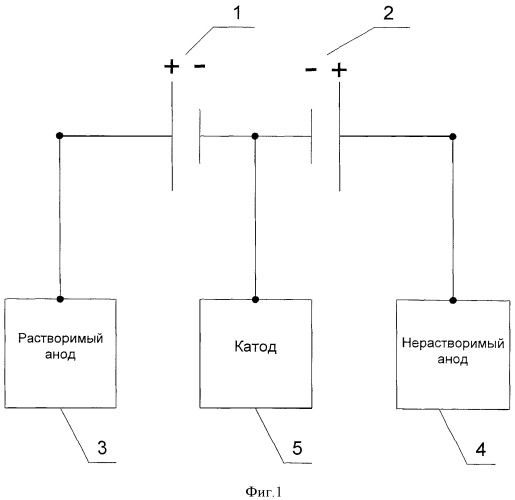
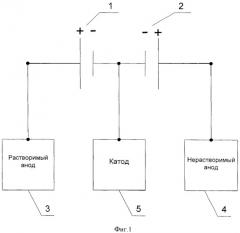
Данная задача решается за счет того, что в известном способе, включающем электроосаждение порошкообразного металла водного раствора соли с применением растворимых и нерастворимых анодов одновременно, предлагается дополнительно подключать их к разным источникам питания током. Заявляемое техническое решение поясняется схемой изображенной на фигурах 1 и 2. На фиг.1 представлен вариант схемы электроснабжения одного катода, одного растворимого анода и одного нерастворимого анода, где 1 - первый источник питания, 2 - второй источник питания, 3 - растворимый анод, 4 - нерастворимый анод, 5 - катод. На фиг.2 представлен вариант схемы электроснабжения двух катодов, трех растворимых анодов и одного нерастворимого анода, где 1 - первый источник питания, 2 - второй источник питания, 3 - растворимый анод, 4 - нерастворимый анод, 5 - катод.
Согласно заявляемому техническому решению, такая схема электроснабжения с помощью корректировки соотношения плотностей тока (силы тока) на растворимом (3) и нерастворимом (4) анодах (при постоянной катодной плотности тока или силы тока на катоде (5)) позволяет в процессе электролиза поддерживать равенство анодного выхода по току (растворимого анода) и катодного выхода по току, следовательно, постоянной концентрацию ионов металла в растворе. Постоянство катодной плотности тока достигается постоянством площади катода и суммы сил токов, подаваемых от источников питания (1) и (2):
IИТ1+IИТ2=Iобщ,
где Iобщ - суммарная сила тока в общем участке катодной цепи, А;
IИТ1 - сила тока на растворимом аноде, подаваемая источником (1), А;
IИТ2 - сила тока на нерастворимом аноде, подаваемая источником (2), А.
Величина Iобщ определяет постоянство катодной плотности тока при неизменной площади катода. Например, если в процессе электролиза происходит увеличение концентрации катионов металла, то необходимо уменьшить интенсивность растворения растворимого анода, что достигается уменьшением силы тока, допустим, на 10 А на источнике тока (1) и увеличением силы тока источнике тока (2) соответственно на 10 А. При этом сумма сил тока источника (1) и источника (2) остается постоянной.
При применении заявляемого технического решения используемая установка электролиза может иметь любую подходящую комбинацию и количество катодов, растворимых и нерастворимых анодов. Заявляемое техническое решение может применяться для получения любого порошкообразного металла методом электролиза водного раствора соли соответствующего металла. Предлагаемое техническое решение проверено при получении электролитических порошков никеля, кобальта и меди.
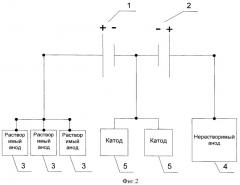
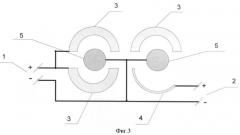
Примером конкретного применения заявляемого технического решения может служить описание технологического процесса получения кобальтового порошка в конической механизированной ванне с двумя вращающимися цилиндрическими катодами. В качестве анодов одновременно используют растворимые аноды засыпного типа (титановая корзина и металлический кобальт) и нерастворимый анод (окисно-рутениевый титановый анод), которые подключены к разным источникам тока. Схема электроснабжения ячейки приведена на фиг.3, где 1 - первый источник питания, 2 - второй источник питания, 3 - растворимый анод, 4 - нерастворимый анод, 5 - катод. Электролиз проводится в электролите, содержащем сульфат кобальта в количестве 35 г/л и в качестве буферной добавки сульфат аммония в количестве 50 г/л при pH электролита равного 5,8±0,6 и температуре 50±5°С. Катодная плотность тока равна 34 А/дм2. При подаче электрического напряжения на электродах протекают следующие электрохимические реакции:
на катоде:
Со2+ + 2е → Со;
2Н+ + 2е → H2↑;
на растворимом аноде:
Со - 2е → Со2+;
H2O - 2е → 2H+ + 0,5O2↑;
на нерастворимом аноде:
H2O - 2е → 2H+ + 0,5O2↑.
Кобальт в порошкообразном виде на катодах счищается каждые 30 минут при помощи скребка. Скребок, счищающий порошок сразу с обоих электродов, приводился в соприкосновение с поверхностями катодов через определенное время без выключения нагрузки. Кобальтовый порошок, накопившейся в течение 24 часов на дне ванны, отфильтровывается от электролита на нутч-фильтре, промывается дистиллированной водой, сушится, термообрабатывается в токе водорода и просеивается. Средний размер частиц полученного порошка кобальта равен 20 мкм. На фиг.4 представлена фотография кобальтового порошка, полученного по описанному выше способу, которая подтверждает его однородность при применении заявляемого технического решения.
Вторым примером конкретного применения заявляемого технического решения может служить описание технологического процесса получения никелевого порошка в конической ванне с одним титановым катодом в виде пластины. В качестве анодов одновременно используют растворимые аноды засыпного типа (титановая корзина и металлический никель) и нерастворимый анод (окисно-рутениевый титановый анод), которые подключены к разным источникам тока. Схема электроснабжения ячейки приведена на фиг.5, где 1 - первый источник питания, 2 - второй источник питания, 3 - растворимый анод, 4 - нерастворимый анод, 5 - катод в виде пластины. Электролиз проводится в электролите, содержащем сульфат никеля в количестве 15 г/л и буферную добавку, в качестве которой взят сернокислый аммоний в количестве 65 г/л, при pH электролита равного 5,5±0,5 и температуре 50±5°С. Катодная плотность тока равна 22 А/дм2. При подаче электрического тока на электродах протекают следующие электрохимические реакции:
на катоде:
Ni2+ + 2е → Ni;
2H+ + 2e → H2↑;
на растворимом аноде:
Ni - 2е → Ni2+;
Н2О - 2е → 2Н+ + 0,5O2↑;
на нерастворимом аноде:
H2O - 2е → 2H+ + 0,5O2↑.
Никель, образующийся на катоде в порошкообразном виде, счищается каждые 60 минут при помощи автоматизированного механического скребкового устройства типа «гильотина». Скребок, счищающий порошок сразу с обеих сторон электрода, приводился в движение через определенное время с выключением нагрузки на электроды. Никелевый порошок, накопившийся в течение 24 часов на дне ванны, отфильтровывается от электролита на нутч-фильтре, промывается дистиллированной водой, сушится, термообрабатывается в токе водорода и просеивается. Средний размер частиц полученного порошка никеля равен 25 мкм. На фиг.6 представлена фотография никелевого порошка, полученного по описанному выше способу, которая подтверждает его однородность при применении заявляемого технического решения.
Третьим примером конкретного применения заявляемого технического решения может служить описание технологического процесса получения медного порошка в конической ванне с одним титановым катодом в виде стержня. В качестве анодов одновременно используют растворимые литые медные аноды и нерастворимый свинцовый анод, которые подключены к разным источникам тока. Схема электроснабжения ячейки приведена на фиг.7, где 1 - первый источник питания, 2 - второй источник питания, 3 - растворимый анод, 4 - нерастворимый анод, 5 - катод в виде стержня. Электролиз проводится в электролите, содержащем сульфат меди в количестве 20 г/л и буферную добавку, в качестве которой взята серная кислота в количестве 150 г/л при температуре электролита 50±5°С. Катодная плотность тока равна 32 А/дм2. При подаче электрического тока на электродах протекают следующие электрохимические реакции:
на катоде:
Cu2+ + 2е → Cu;
2Н+ + 2е → H2↑;
на растворимом аноде:
Cu - 2е → Cu2+;
Н2О - 2е → 2H+ + 0,5O2↑;
на нерастворимом аноде:
Н2О - 2е → 2H+ + 0,5O2↑.
Медь, образующаяся на катоде в порошкообразном виде, счищается каждые 60 минут вручную при помощи специального скребка с выключением нагрузки на электроды. Медный порошок, накопившийся в течение 24 часов на дне ванны, отфильтровывается от электролита на нутч-фильтре, промывается дистиллированной водой, сушится, термообрабатывается в токе водорода и просеивается. Средний размер частиц полученного порошка меди равен 15 мкм. На фиг.8 представлена фотография медного порошка, полученного по описанному выше способу, которая подтверждает его однородность при применении заявляемого технического решения.
Заявляемое техническое решение позволяет выровнять катодный и анодный (растворимого анода) выходы по току при получении порошкообразного металла методом электролиза и тем самым сократить трудоемкую операцию корректировки электролита при промышленном применении этого метода.
Способ получения электролитических порошков металлов электролизом из водного раствора, содержащего соль соответствующего металла и буферные добавки, с использованием растворимых и нерастворимых анодов одновременно, отличающийся тем, что растворимый и нерастворимый аноды подключают к отдельным источникам тока для контроля растворения растворимого анода в течение процесса электролиза и концентрации ионов металла в растворе с помощью корректировки соотношения анодных сил тока растворимого и нерастворимого анодов при постоянном значении катодной плотности тока, которое достигают постоянством площади катода и суммы сил тока на растворимом и нерастворимом аноде.