Способ получения несимметричных 1,2-дитиенилзамещенных циклопентенов
Иллюстрации
Показать всеИзобретение относится к способу получения несимметричных фотохромных дитиенилзамещенных циклопентенов общей формулы I:
где R - хлор или алкил С1-С4, R1 - водород, галоген или алкил С1-С4, R2 и R3 - алкил С1-С4, заключающийся в том, что соответствующие производные тиофена общей формулы II:
где R и R2 имеют вышеуказанные значения, R4 - водород либо R2+R4 - -CH=CH-CR1=:CH-, где R1 имеет вышеуказанные значения, ацилируют глутаровым ангидридом в присутствии хлорида алюминия (III) в среде инертного органического растворителя, полученную при этом соответствующую кислоту переводят в хлорангидрид под действием оксалилхлорида и диметилформамида с последующим ацилированием полученного хлорангидрида соответствующим производным тиофена общей формулы II, где R, R1, R2 и R4 имеют вышеуказанные значения, в присутствии кислоты Льюиса и образующиеся при этом несимметричные 1,5-дикетоны подвергают внутримолекулярной циклизации на низковалентных титановых частицах при кипячении в среде инертного органического растворителя в присутствии пиридина. Технический результат - разработан способ получения новых фотохромных соединений, которые могут найти применение в качестве оптических переключателей в носителях информации большой емкости, используемых для записи, обработки и хранения данных.
Реферат
Изобретение относится к области получения органических фотохромов, в частности новых неописанных в литературе несимметричных фотохромных дитиенилэтенов, содержащих в качестве мостикового звена циклопентен. Фотохромные продукты этого класса находят широкое практическое применение в качестве оптических переключателей в носителях информации большой емкости, используемых для записи, обработки и хранения данных. Фотохромные соединения, которые могут быть использованы в этом качестве, должны обладать определенным набором эксплуатационных характеристик: термической необратимостью обеих форм, высоким квантовым выходом фотопревращения, а также высокой цикличностью. Одним из классов фотохромов, удовлетворяющих этим условиям, являются 1,2-тиенилэтены, в частности продукты, содержащие в качестве этенового мостика циклопентеновый фрагмент (Photochromic properties of perhydro- and perfluorodithienylcyclopentene molecular switches, de Jong J.J.D., Lucas L.N., Hania R., Pugzlys A., Kellogg R.M., Feringa B.L., Duppen K., van Esch J.H. Eur. J. Org. Chem., 2003, 1887-1893).
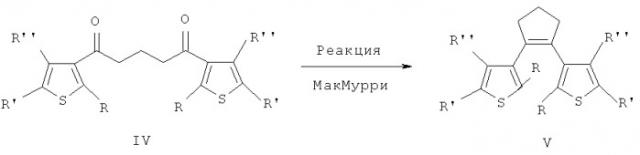
В настоящее время единственным известным способом получения симметричных дитиенилэтенов с мостиковым пергидроциклопентеновым фрагментом формулы V является конденсация соответствующего 1,5-дикетона формулы IV на низковалентном титане по реакции МакМурри (Реакция МакМурри в синтезе фотохромных дигетарилэтенов. Краюшкин М.М., Калик М.А., Мигулин В.А., Успехи Химии, 78(4), 2009, 355-363).
Данная реакция описана для ряда симметричных тиенилсодержащих 1,5-дикетонов, которые предварительно получают простым ацилированием производного тиофена с использованием глутарилдихлорида и кислоты Льюиса. Например, исходя из 2-метилтиофена было получено соединение 1 (A new class of photochromic 1,2-diarylethenes; synthesis and switching properties of bis(3-thienyl)cyclopentenes. Lucas L.N., van Esch J., Kellogg R.M., Feringa B.L. Chem. Commun., 1998, 2313-2314),
на основе которого впоследствии были синтезированы многочисленные фотохромные 5,5′-дизамещеные дитиенилпергидроциклопентены, обладающие разнообразными физико-химическими свойствами и представляющие прикладной интерес: такие как водорастворимые пиридиниевые цвиттер-ионы, хелаты, пригодные для считывания и хранения информации, S-ацильные производные для связывания с металлическими наноповерхностями, флюоресцентные фотохромы, фоточувствительные органические гелеобразующие соединения, фотохромные переключатели и др. (Реакция МакМурри в синтезе фотохромных дигетарилэтенов. Краюшкин М.М., Калик М.А., Мигулин В.А., Успехи Химии, 78(4), 2009, 355-363).
В настоящее время известно лишь два примера 3-бензотиенилзамещенных циклопентенов. Ацилирование соответствующих 2-метилбензо[b]тиофенов глутарилдихлоридом с последующей конденсацией по реакции МакМурри позволило получить соединения 2 (Facile synthesis of novel photochromic 1,2-diheteroaryl-substituted cycloalkenes by titanium-induced intramolecular coupling reaction. Huang Z.-N., Xu B.-A., Jin S., Fan M.-G. Synthesis, 1998, 1092-1094) и 3 (Synthesis and charachterisation of 1,2-dihetarylethenes containing chlorobenzothiophene moieties. Krayushkin M.M., Migulin V.A., Yarovenko V.N., Barachevskii V.A., Vorontsova L.G., Starikova Z.A., Zavarzin I.V., Bulgakova V.N. Mendeleev Commun., 17, 2007, 125-127).
Необходимо отметить, что 2 не содержит функциональных групп, в то время как последующая модификация соединения 3 оказалась затрудненной в связи с низкой реакционной способностью атома хлора в бензотиофеновом кольце.
Основным недостатком этого метода является невозможность получения по реакции МакМурри целевых соединений с неэквивалентными тиофеновыми или бензотиофеновыми фрагментами, ввиду отсутствия соответствущих исходных несимметричных 1,5-дикетонов. Кроме того, дальнейшая модификация структуры фотохрома по функциональной группе в бензотиофеновом фрагменте молекулы также является актуальной проблемой на сегодняшний день.
Задачей настоящего изобретения является разработка способа получения несимметричных органических фотохромов, в частности дитиенилэтенов, содержащих в качестве мостикового звена циклопентен, позволяющего получить новые соединения, с несимметричными гетероциклическими заместителями.
Поставленная задача достигается предложенным способом получения 1,2-дитиенилзамещенных циклопентенов общей формулы I:
где R - хлор или алкил C1-C4, R1 - водород, галоген или алкил C1-C4, R2 и R3 - алкил C1-C4,
заключающимся в том, что соответствующие производные тиофена общей формулы II:
где R и R2 имеют вышеуказанные значения, R4 - водород либо R2+R4 - -CH=CH-CR1=CH-, где R1 имеет вышеуказанные значения,
ацилируют глутаровым ангидридом в присутствии хлорида алюминия (III) в среде инертного органического растворителя, полученную кислоту формулы III:
где R1, R2 и R3 имеют вышеуказанные значения,
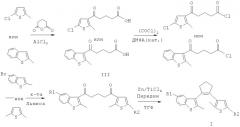
переводят в хлорангидрид под действием оксалилхлорида и диметилформамида с последующим ацилированием полученного хлорангидрида соответствующим производным тиофена общей формулы II, где R, R1, R2 и R4 имеют вышеуказанные значения, в присутствии кислоты Льюиса и образующиеся при этом несимметричные 1,5-дикетоны подвергают внутримолекулярной циклизации на низковалентных титановых частицах при кипячении в среде инертного органического растворителя в присутствии пиридина. В качестве инертного органического растворителя используют, например, хлористый метилен, тетрагидрофуран. Процесс протекает по следующей схеме:
Исходное тиенильное производное ацилируют глутаровым ангидридом в присутствии хлорида алюминия (III) в хлористом метилене. Полученную кислоту III выделяют из реакционной смеси в чистом виде с помощью хроматографии и перекристаллизации. Под действием оксалилхлорида в присутствии диметилформамида карбоновую кислоту переводят в хлорангидрид, который не выделяют в чистом виде, а ацилируют in situ в хлористом метилене соответствующим производным тиофена в присутствии кислоты Льюиса. Причем в качестве кислоты Льюиса используют, например, хлорид алюминия (III), хлорид олова (IV). Полученные несимметричные 1,5-дикетоны выделяют из реакционной смеси и подвергают внутримолекулярной циклизации по реакции МакМурри на низковалентных титановых частицах путем кипячения в тетрагидрофуране в присутствии пиридина. В свою очередь, низковалентные титановые частицы предварительно получают из хлорида титана (IV) и порошкообразного металлического цинка в абсолютном тетрагидрофуране. Целевой продукт общей формулы I выделяют в чистом виде с помощью хроматографии.
Предложенный способ позволяет получать новые фотохромные несимметричные дитиенилэтены с пергидроциклопентеновым мостиком в четыре простые по исполнению стадии, где одно из промежуточных соединений (хлорангидрид) можно не выделять в чистом виде, что, соответственно, упрощает общий синтез. Другие новые промежуточных соединения (карбоновые кислоты и 1,5-дикетон) легко выделяются в чистом виде и могут быть использованы для любых других целей в органическом синтезе.
Предложенный способ позволяет впервые получить несимметричные фотохромы, где с мостиковым циклопентеновым кольцом одновременно связаны как тиофеновый фрагмент, так и бензотиофеновый. Использование этого способа позволяет не только значительно расширить известный на сегодняшний день арсенал фотохромных соединений, но и получать соединения, обладающие разнообразными интересными физико-химическими свойствами.
Способ иллюстрируется следующими примерами.
Пример 1
Получение 3-(2-(2,5-диметилтиофен-3-ил)циклопент-1-енил)-2-метилбензо[b]тиофена формулы:
1.1 Получение 5-(2-метилбензо[b]тиофен-3-ил)-5-оксопентановой кислоты.
4.2 г (28.4 ммоль) 2-метилбензо[b]тиофена и 3.9 г (34.2 ммоль) глутарового ангидрида растворяют в 40 мл хлористого метилена и охлаждают до -5°C. 4.6 г (34.6 ммоль) хлорида алюминия (III) добавляют порциями к полученному раствору при перемешивании при этой температуре в течение 30 минут, после чего охлаждение убирают и перемешивают образующийся раствор в течение 5 часов при комнатной температуре. Затем к реакционной массе добавляют лед и экстрагируют хлороформом (3·50 мл), органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и упаривают. Остаток кристаллизуют из смеси хлористый метилен/гексан, получают 1.7 г продукта. Маточный раствор упаривают и хроматографируют на силикагеле (элюент плавно изменяют с гексан/этилацетат - 3:1 до гексан/этилацетат - 1:2). Фракции, содержащие продукт, объединяют и упаривают, остаток кристаллизуют из смеси хлористый метилен/гексан, выделяют дополнительно 1.65 г продукта. Выход 3.35 г (45%) белого порошка, т.пл. 108-110°C. Спектр ЯМР 1H (δ, м.д.) (CDCl3): 2.12 (м, 2H), 2.51 (т, 2H), 2.77 (с, 3H), 3.04 (т, 2H), 7.30-7.43 (м, 2H), 7.73 (дд, 1H), 8.11 (дд, 1H). ЯМР 13C (δ, м.д.) (CDCl3): 16.81, 19.03, 33.01, 42.34, 121.56, 123.45, 124.27, 125.08, 132.61, 137.19, 138.11, 148.20, 179.48, 197.89.
1.2 Получение 1-(2,5-диметилтиофен-3-ил)-5-(2-метилбензо[b]тиофен-3-ил)пентан-1,5-диона.
К охлажденному до -5°C раствору 2.4 г (19.1 ммоль) оксалилхлорида в 15 мл 1,2-дихлорэтана добавляют несколько капель диметилформамида. 0.65 г (2.4 ммоль) 5-(2-метилбензо[b]тиофен-3-ил)-5-оксопентановой кислоты добавляют порциями при перемешивании при этой температуре в течение 5 минут, после чего охлаждение убирают и перемешивают образующийся раствор в течение 12 часов при комнатной температуре. Реакционную смесь упаривают, сушат под вакуумом, получают 0.67 г хлорангидрида 5-(2-метилбензо[b]тиофен-3-ил)-5-оксо-пентановой кислоты, который используют без дополнительной очистки.
0.67 г (2.4 ммоль) хлорангидрида растворяют в 15 мл хлористого метилена и добавляют 0.54 г (4.8 ммоль) 2,5-диметилтиофена, раствор охлаждают до -5°C. 1.9 г (7.2 ммоль) хлорида олова (IV) добавляют по каплям к полученному раствору при перемешивании при этой температуре в течение 30 минут, после чего охлаждение убирают и перемешивают образующийся раствор в течение 12 часов при комнатной температуре. К реакционной массе добавляют лед и экстрагируют хлороформом (3·20 мл), органический слой последовательно промывают водным раствором карбоната натрия, насыщенным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и упаривают. Остаток хроматографируют на силикагеле (элюент - хлористый метилен) и кристаллизуют из системы эфир/гексан. Получают 0.46 г (54%) бежевого порошка, т.пл. 95-98°C. Спектр ЯМР 1H (δ, м.д.) (CDCl3): 2.18 (м, 2Н), 2.39 (с, 3Н), 2.67 (с, 3Н), 2.77 (с, 3Н), 2.92 (т, 2Н), 3.05 (т, 2Н), 6.99 (с, 1Н), 7.29-7.43 (м, 2Н), 7.73 (дд, 1Н), 8.11 (дд, 1H). ЯМР 13С (δ, м.д.) (CDCl3): 14.84, 15.93, 16.80, 18.78, 40.51, 42.71, 121.57, 123.52, 124.24, 125.05, 125.90, 132.92, 135.01, 135.32, 137.28, 138.25, 147.21, 147.75, 195.71, 198.59.
1.3 Получение 3-[2-(2,5-диметилтиофен-3-ил)циклопент-1-енил]-2-метилбензо[b] тиофена.
К охлажденной до -5°C суспензии 0.51 г (7.8 ммоль) порошкообразного цинка в 10 мл абсолютного тетрагидрофурана при перемешивании добавляют по каплям 0.49 г (2.6 ммоль) хлорида титана (IV), затем смесь перемешивают 1 час при комнатной температуре. К полученной суспензии, содержащей низковалентные титановые частицы, последовательно добавляют 0.21 г (2.6 ммоль) пиридина и 0.46 г (1.3 ммоль) 1-(2,5-диметилтиофен-3-ил)-5-(2-метилбензо[b]тиофен-3-ил)пентан-1,5-диона одной порцией, затем смесь кипятят с обратным холодильником в течение 8 часов. Растворитель упаривают, остаток в этилацетате фильтруют через слой силикагеля. Фильтрат упаривают, остаток хроматографируют на силикагеле (элюент - гексан) и кристаллизуют из гексана. Получают 0.36 г (86%) бесцветных кристаллов, т.пл. 97-98°C. Спектр ЯМР 1Н (δ, м.д.) (CDCl3): 1.88 (с, 3Н), 2.19 (с, 3Н), 2.21 (м, 2Н), 2.36 (с, 3Н), 2.65-3.15 (м, 4Н), 6.46 (с, 1H), 7.25-7.39 (м, 2Н), 7.63 (дд, 1Н), 7.77 (дд, 1H). ЯМР 13С (δ, м.д.) (CDCl3): 14.29, 14.52, 14.99, 23.58, 37.83, 38.03, 121.82, 122.32, 123.18, 123.70, 125.73, 130.94, 132.26, 132.91, 134.69, 134.77,135.47, 137.83,138.29,139.68.
Пример 2
Получение 5-Бром-3-(2-(5-хлор-2-метилтиофен-3-ил)циклопент-1-енил)-2-метилбензо[b]тиофена формулы:
2.1 Получение 5-(5-хлор-2-метилтиофен-3-ил)-5-оксопентановой кислоты.
15.2 г (115 ммоль) 2-хлор-5-метилтиофена и 15.7 г (138 ммоль) глутарового ангидрида растворяют в 200 мл хлористого метилена и охлаждают до 0°C. 38.2 г (287 ммоль) хлорида алюминия (III) добавляют порциями к полученному раствору при перемешивании при этой температуре в течение полутора часов, после чего охлаждение убирают и перемешивают образующийся раствор в течение 16 часов при комнатной температуре. Затем к реакционной массе добавляют лед и экстрагируют хлороформом (3·100 мл), органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и упаривают, остаток в системе хлористый метилен/этилацетат 3:1 фильтруют через слой силикагеля. Фильтрат упаривают, остаток хроматографируют на силикагеле (элюент плавно изменяют с гексан/этилацетат - 10:1 до этилацетата). Фракции, содержащие продукт, объединяют и упаривают, остаток кристаллизуют из смеси гексан/хлористый метилен. Получают 17.1 г (45%) бежевого порошка, т.пл. 79-80°C. Спектр ЯМР 1Н (δ, м.д.) (CDCl3): 2.02 (м, 2Н), 2.48 (т, 2Н), 2.66 (с, 3Н), 2.87 (т, 2Н), 7.17 (с, 1H), 11.08-11.15 (уш. с, 1H). ЯМР 13C (δ, м.д.) (CDCl3): 15.90, 18.68, 32.93, 40.25, 125.29, 126.65, 134.71, 147.81, 179.40, 194.71.
2.2 Получение 1-(5-бром-2-метилбензо[b]тиофен-3-ил)-5-(5-хлор-2-метилтиофен-3-ил)пентан-1,5-диона.
К охлажденному до 5°C раствору 0.57 г (2.3 ммоль) 5-(5-хлор-2-метилтиофен-3-ил)-5-оксопентановой кислоты и 3.1 г (24.4 ммоль) оксалилхлорида в 15 мл 1,2-дихлорэтана добавляют несколько капель диметилформамида. Образующийся раствор перемешивают в течение 12 часов при комнатной температуре, затем реакционную смесь упаривают, сушат под вакуумом, получают 0.61 г хлорангидрида 5-(5-хлор-2-метилтиофен-3-ил)-5-оксопентановой кислоты, который используют без дополнительной очистки.
0.61 г (2.4 ммоль) хлорангидрида растворяют в 15 мл хлористого метилена и добавляют 0.57 г (2.5 ммоль) 5-бром-2-метилбензо[b]тиофен, раствор охлаждают до -5°C. 1.9 г (7.2 ммоль) хлорида алюминия (III) добавляют по каплям к полученному раствору при перемешивании при этой температуре в течение 15 минут, после чего охлаждение убирают и смесь перемешивают в течение 12 часов при комнатной температуре. К реакционной массе добавляют лед и экстрагируют хлороформом (3·20 мл), органический слой последовательно промывают водным раствором карбоната натрия, насыщенным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и упаривают. Остаток хроматографируют на силикагеле (элюент - хлористый метилен) и кристаллизуют из системы хлористый метилен/гексан. Получают 0.33 г (31%) желтого порошка, т.пл. 142-145°C. Спектр ЯМР 1Н (δ, м.д.) (CDCl3): 2.16 (м, 2Н), 2.66 (с, 3Н), 2.79 (с, 3Н), 2.91 (т, 2Н), 3.05 (т, 2Н), 7.18 (с, 1H), 7.42 (дд, 1H), 7.59 (д, 1Н), 8.37 (д, 1Н). ЯМР 13С (δ, м.д.) (CDCl3): 15.91, 17.16, 18.47, 40.45, 42.49, 119.57, 122.67, 125.26, 126.58, 126.71, 127.47, 132.06, 134.83, 135.74, 140.00, 147.61, 149.71, 194.70, 197.5.
3.3 Получение 5-бром-3-[2-(5-хлор-2-метилтиофен-3-ил)циклопент-1-енил]-2-метилбензо[b]тиофена.
К охлажденной до -5°C суспензии 4.8 г (73.8 ммоль) порошкообразного цинка в 50 мл абсолютного тетрагидрофурана при перемешивании добавляют по каплям 3.7 г (19.5 ммоль) хлорида титана (IV), затем смесь перемешивают 1 час при комнатной температуре. К полученной суспензии, содержащей низковалентные титановые частицы, последовательно добавляют 1.5 г (19.0 ммоль) пиридина и 2.2 г (4.8 ммоль) 1-(5-бром-2-метилбензо[b]тиофен-3-ил)-5-(5-хлор-2-метилтиофен-3-ил)пентан-1,5-диона одной порцией, затем смесь кипятят с обратным холодильником в течение 8 часов. Растворитель упаривают, остаток в этилацетате фильтруют через слой силикагеля. Фильтрат упаривают, остаток хроматографируют на силикагеле (элюент-гексан). Получают 1.53 г (75%) бесцветного масла. Спектр ЯМР 1Н (δ, м.д.) (CDCl3): 1.80 (с, 3Н), 2.14 (с, 3Н), 2.15 (м, 2Н), 2.62-3.05 (м, 4Н), 6.51 (с, 1H), 7.33 (дд, 1Н), 7.56 (д, 1H), 7.60 (д, 1H). ЯМР 13С (δ, м.д.) (CDCl3): 14.34, 14.68, 23.42, 37.72, 37.85, 118.03, 123.21, 124.83, 125.00, 126.34, 126.39, 129.88, 133.37, 133.67, 134.35, 136.86, 137.32, 137.79, 140.91.
Таким образом, предложен удобный способ получения нового класса несимметричных фотохромов, где с мостиковым циклопентеновым кольцом одновременно связаны как тиофеновый фрагмент, так и бензотиофеновый. Использование этого способа позволяет не только значительно расширить известный на сегодняшний день арсенал фотохромных соединений, но и получать соединения, обладающие разнообразными интересными физико-химическими свойствами.
Например, уникальность синтезированного соединения 4 заключается в наличии фотохромных свойств в молекуле в кристаллическом состоянии, что является редким исключением для большинства известных фотохромов. В свою очередь, соединение 5 возможно использовать для дальнейшей химической модификации, проводя замещение как по атому брома в бензотиофеновом кольце, так и по атому хлора в тиофеновом цикле. Различные химические трансформации соединения 5 позволят получить разнообразные несимметричные дитиенилэтены с циклопентеновым мостиком, представляющие в потенциале прикладной интерес: например, в нанотехнологиях; как системы для считывания и хранения информации; в качестве молекулярных переключателей, фоточувствительных гелей, флуоресцентных сенсоров и др.
Способ получения несимметричных 1,2-дитиенилзамещенных циклопентенов общей формулы I: где R = хлор или алкил С1-С4, R1 = водород, галоген или алкил С1-С4, R2 и R3 = алкил С1-С4,заключающийся в том, что соответствующие производные тиофена общей формулы II: где R и R2 = имеют вышеуказанные значения, R4 = водород либо R2+R4=-CH=CH-CR1=CH-, где R1 = имеет вышеуказанные значения, ацилируют глутаровым ангидридом в присутствии AlCl3 в среде инертного органического растворителя, полученную кислоту формулы III: где R1, R2 и R3 = имеют вышеуказанные значения,переводят в хлорангидрид под действием оксалилхлорида и диметилформамида с последующим ацилированием полученного хлорангидрида соответствующим производным тиофена общей формулы II, где R, R1, R2 и R4 = имеют вышеуказанные значения, в присутствии кислоты Льюиса и образующиеся при этом несимметричные 1,5-дикетоны подвергают внутримолекулярной циклизации на низковалентных титановых частицах при кипячении в среде инертного органического растворителя в присутствии пиридина.