Способ определения эффективности гемостимуляторов при цитостатической миелосупрессии
Иллюстрации
Показать всеИзобретение относится к области экспериментальной биологии и медицины, конкретно к фармакологии и клеточным технологиям, и описывает способ определения эффективности гемостимуляторов при цитостатической миелосупрессии, заключающийся в исследовании клеток крови, при этом исследуют содержание и дифференцировку стволовых кроветворных клеток и коммитированных предшественников, и при дифференцировке стволовых кроветворных клеток преимущественно в предшественники гранулоцитарно-макрофагального и гранулоцитарного типа препараты относят к гемостимуляторам, стимулирующим грануломоноцитопоэз, а при дифференцировке только в гранулоцитарные клетки к гемостимуляторам гранулоцитарного ростка кроветворения. Предъявляемый способ позволяет производить выбор наиболее эффективных лекарственных средств для коррекции гематологических нарушений с учетом патогенеза и избежать развития осложнений. 12 табл.
Реферат
Изобретение относится к области экспериментальной биологии и медицины, конкретно к фармакологии и клеточным технологиям, и касается способа исследования направления дифференцировки стволовых кроветворных клеток.
Известны способы коррекции гипопластических состояний с использованием препаратов гемопоэтинов (рекомбинантные препараты гранулоцитарного колониестимулирующего фактора, эритропоэтин и т.п.) [1, 2, 3]. Действие указанных лекарственных средств связано со стимуляцией коммитированных кроветворных предшественников и морфологически распознаваемых миелокариоцитов. Однако следствием чрезмерной активации истощенного цитостатиками пула коммитированных предшественников могут выступать различные осложнения, в том числе депрессия эритропоэза и развитие вторичной нейтропении [3, 4]. Более эффективным подходом восстановления гемопоэза, с нашей точки зрения, может выступать мобилизация с последующей индукцией дифференцировки стволовых кроветворных клеток (СКК) в клетки тех линий, которые подвержены наибольшему цитостатическому воздействию.
Известен способ определения соединений, обладающих гемостимулирующей активностью, основанный на определении абсолютного содержания незрелых нейтрофильных гранулоцитов в костном мозге экспериментальных животных [5].
Данный способ является близким к заявляемому по технической сущности и достигаемому результату и выбран в качестве прототипа.
Недостатком способа является отсутствие оценки функциональной активности стволовых кроветворных клеток, которая во многом определяет активность гемопоэза при чрезвычайных воздействиях.
Задачей, решаемой данным изобретением, является выявление эффективных лекарственных средств, способных восстанавливать содержание морфологически распознаваемых клеток гранулоцитарного ростка кроветворения при цитостатической миелосупрессии.
Поставленная задача решается путем исследования стандартными культуральными методами при цитостатической миелосупрессии содержания и дифференцировки стволовых кроветворных клеток и коммитированных предшественников. При стимуляции дифференцировки стволовых кроветворных клеток преимущественно в предшественники гранулоцитарно-макрофагального и гранулоцитарного типа препараты относят к более эффективным стимуляторам гранулоцитопоэза, а при дифференцировке только в клетки гранулоцитарного типа к менее эффективным гемостимуляторам.
Новым в предлагаемом способе является исследование содержания стволовых кроветворных клеток, гранулоцито-эритроидно-макрофагально-мегакариоцитарных предшественников, коммитированных кроветворных предшественников в костном мозге, пролиферативного потенциала и дифференцировки стволовых кроветворных клеток для создания гемостимуляторов. Предлагаемый способ исследования дифференцировки полипотентных кроветворных предшественников в клетки конкретных линий позволит на качественно более высоком уровне производить поиск новых гемостимуляторов.
Алкилирующий цитостатический препарат циклофосфан (Р №000459/01-2001) обладает широким противоопухолевым спектром действия [3]. Механизм угнетения гемопоэза циклофосфаном заключается, прежде всего, в поражении пролиферирующих клеток (кроветворные предшественники) костного мозга и истощении пула морфологически распознаваемых миелокариоцитов [6].
Основные показания для назначения гранулоцитарного КСФ: профилактика и лечение разных видов нейтропений (и предупреждение связанного с ними снижения устойчивости к инфекционным осложнениям), профилактика и лечение осложнений у онкологических больных, подвергающихся миелосупрессивной химиотерапии [3]. Гранулоцитарный КСФ увеличивает число нейтрофилов путем воздействия, прежде всего, на зрелые клетки-предшественники нейтрофилов типа КОЕ-Г (колониеобразующая единица гранулоцитарная), посредством активации их пролиферации и дифференцировки [1, 6]. Поэтому у больных с пониженным содержанием указанных предшественников (например, подвергшихся интенсивной лучевой терапии или химиотерапии) восстановление гранулоцитарного ростка может быть затруднено. Кроме того, в последнее время стали появляться новые сведения о побочных эффектах и осложнениях после курсов Г-КСФ: у здоровых доноров в периферической крови обнаруживались тетраплоидные клетки миелоидного ряда, описан случай тяжелой тромбоцитопении, острого миелолейкоза, в эксперименте у мыши возникло миелопролиферативное заболевание [4, 7, 8, 9]. Механизм возникновения подобных осложнений до сих пор не исследован, что во многом ограничивает применение Г-КСФ. Поэтому при создании гемостимуляторов перспективно исследовать направление дифференцировки СКК (в частности, в коммитированные кроветворные предшественники), что позволит произвести отбор веществ, способных эффективно мобилизовать клетки глубокого резерва кроветворения и направить их дифференцировку в предшественники наиболее истощенного цитостатическим воздействием пула.
Основным фармакологическим свойством резерпина является его симпатолитическое действие, обусловленное ускоренным выделением катехоламинов из гранулярных депо пресинаптических нервных окончаний. Высвобожденные катехоламины инактивируются моноаминоксидазой, что ведет к уменьшению выхода катехоламинов в синаптическую щель [3]. В эксперименте показана способность резерпина препятствовать развитию цитостатической нейтропений [9].
Отличительные признаки проявили в заявляемой совокупности новые свойства, явным образом не вытекающие из уровня техники в данной области и неочевидные для специалиста. Идентичной совокупности признаков не обнаружено в проанализированной патентной и научно-медицинской литературе.
Способ может быть использован для повышения эффективности лекарственной химиотерапии и прогнозирования гемостимулирующих свойств веществ. Исходя из вышеизложенного заявляемое изобретение соответствует критериям патентоспособности изобретения «Новизна» и «Изобретательский уровень», и «Промышленная применимость».
Предлагаемый способ исследован в экспериментах на мышах-самцах линии CBA/CaLac в количестве 380 штук, массой 20-22 г. Животные первой категории, конвенциональные линейные мыши, получены из питомника отдела экспериментального биомедицинского моделирования НИИ фармакологии СО РАМН (сертификат имеется).
Способ осуществляют следующим образом.
У лабораторного животного (мыши) цитостатическую миелосупрессию моделировали однократным внутрибрюшинным введением в 1/3 МПД алкилирующего агента циклофосфана (83 мг/кг). За 30 мин до цитостатического воздействия животным первой опытной группы однократно внутрибрюшинно вводили симпатолитик резерпин ("Polfa", Польша) в дозе 2 мг/кг. В проведенных ранее экспериментах указанная доза была определена как максимально эффективная. Непосредственно перед использованием препарат растворяли в стерильном физиологическом растворе. Контрольным животным во всех сериях экспериментов в аналогичных условиях вводили эквивалентный объем физиологического раствора (0,2 мл).
На следующий день после введения цитостатика мыши второй опытной группы получали подкожные инъекции препарата негликозилированного гранулоцитарного колониестимулирующего фактора (Г-КСФ) человека (нейпоген, "Hoffman-La Roche Ltd", Швейцария). Нейпоген растворяли в стерильном фосфатном буфере (pH 7,2) и вводили в дозе 100 мкг/кг ежедневно в течение 5-ти дней. Выбор эффективной дозы Г-КСФ был осуществлен на основании литературных данных об его специфической активности у мышей [1, 8] и подтвержден в отдельной предварительной серии экспериментов. В качестве фона использовали интактных животных.
На 1-7-е сутки после введения цитостатика у мышей определяли количество нейтрофильных лейкоцитов в периферической крови, затем животных умерщвляли методом кранио-цервикальной дислокации под эфирным наркозом и производили подсчет количества зрелых и незрелых форм нейтрофильных гранулоцитов, эритрокариоцитов в костном мозге [11]. Изучали рост колоний гранулоцито-эритроидно-макрофагально-мегакариоцитарного типа (КОЕ-ГЭММ), состоящих их 4 различных линий гемопоэтических клеток (эритрокариоцитов, гранулоцитов, макрофагов и мегакариоцитов) и колоний гранулоцитарного (КОЕ-Г) и эритроидного (КОЕ-Э) типа в культуре неадгезирующих клеток костного мозга. Пролиферативная активность зрелых прекурсоров гемопоэза оценивалась методом "клеточного самоубийства" с использованием гидроксимочевины, а интенсивность их дифференцировки определяли по величине индекса созревания (отношения числа кластеров к количеству колоний, выросших в той же лунке) [11].
Используя метод лимитирующих разведений в костном мозге определяли концентрацию колониеобразующих единиц, содержащих недифференцированные клеточные элементы (КОЕ-Н) [11, 12]. По окончании культивирования КОЕ-Н собирали, разбивали на отдельные нуклеары путем пипетирования, отмывали от метилцеллюлозы, после этого клетки переносили в 35 мм чашки Петри, содержащие 2 мл среды, и инкубировали в стандартных условиях в течение 12 дней. Пассирование проводили трижды. После каждого пассажа производили подсчет выросших колоний и их цитоморфологический анализ. Далее изучали направление дифференцировки КОЕ-Н под влиянием ростовых факторов. Для этого агрегаты, полученные после третьего пассажа, разбивали на отдельные клетки, доводили концентрацию до 10000/мл в культуральных средах для роста КОЕ-ГМ и КОЕ-Г [11, 12], разливали по 150 мкл в 96-луночные плоскодонные планшеты. Перед инкубацией в культуру вносили Г-КСФ (4 нг/мл). Через 7 суток подсчитывали число образовавшихся КОЕ-ГМ и КОЕ-Г.
Обработку результатов проводили методом вариационной статистики с использованием t-критерия Стьюдента и непараметрического U-критерия Вилкоксона-Манна-Уитни. Частоту встречаемости КОЕ-Н в костном мозге определяли с помощью обобщенной линейной модели для распределения Пуассона. Соответствие данных, лимитирующих разведений одномерной модели Пуассона, оценивалось посредством линейной log-log регрессии. При этом теоретическая фракция отрицательных лунок µi распределялась как µi=exp(-fxi), где f - частота встречаемости КОЕ-Н, xi - количество клеток, высаженных в лунку [11, 12]. Использовалась программа Statistica 6.0.
Пример.
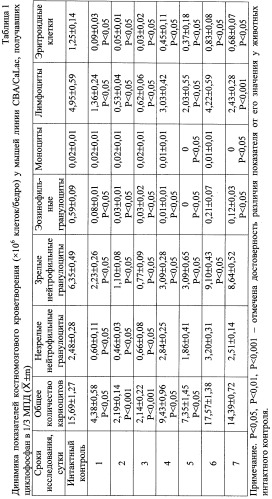
В ходе исследований установлено, что циклофосфан вызывает снижение содержания нейтрофильных гранулоцитов в костном мозге (1-3 сут) и развитие нейтрофильной лейкопении в периферической крови (1-5 сут) (табл.1, 4). С 4-х сут опыта постепенно возрастает (до исходных значений) число незрелых форм нейтрофильных гранулоцитов в костном мозге (4-7 сут), позднее, на 6-7-е сут, увеличивается количество зрелых клеточных элементов гранулоцитарного ростка кроветворения, эритрокариоцитов (табл.1). Вызванная цитостатиком депрессия эритропоэза регистрировалась на протяжении всего периода наблюдения.
Алкилирующий агент длительно ингибирует рост КОЕ-Г (1-7 сут), КОЕ-Э (1, 3-7 сут) (табл.5, 6). Восстановление величины пула митотически активных КОЕ-Г (до уровня интактного контроля) и стимуляция их дифференцировки регистрируются в сроки нормализации числа зрелых форм нейтрофилов (5-7 сут) (табл.7, 8). Вероятнее всего, регенерация подавленной цитостатиком кроветворной ткани, наблюдаемая с 4-х сут, связана с менее зрелыми гемопоэтическими предшественниками, но не с КОЕ-Г.
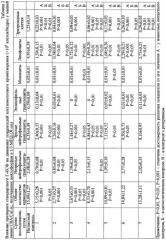
Активация примитивных предшественников кроветворения отмечается уже в период миелосупрессии. Так, на 2-е сут после назначения циклофосфана концентрация КОЕ-Н в кроветворной ткани возрастает и составляет одну колониеобразующую единицу на 14600 неадгезирующих миелокариоцитов (в интактном контроле одна колония встречается на 121 400 нуклеаров) (табл.9). Одно из выявленных свойств клеток, входивших в состав колоний, это способность к длительной репопуляции (более трех пассажей). Причем вторичные и третичные колонии имеют тот же размер (более 1300 бластных элементов) и ту же морфологию, что и первичные культуры: содержат не только недифференцированные клетки, но и агрегаты, состоящие из эритробластов, гранулоцитов, клеток системы мононуклеарных фагоцитов. Такие КОЕ, с нашей точки зрения, образуются из СКК. Показательно, что количество нуклеаров в КОЕ-Н в опыте на 30-50% превосходит таковое в интактном контроле, а число образовавшихся ассоциаций линейно зависит от количества вносимых в лунку ядросодержащих неадгезирующих миелокариоцитов. Эти данные косвенно указывают на то, что все мобилизуемые цитостатиком СКК обладают высокой пролиферативной активностью. В последующем (3-7 сут) содержание недифференцированных колониеобразующих единиц практически не отличается от такового в интактном контроле (табл.9).
Под влиянием циклофосфана резко расширяется и пул гранулоцито-эритроидно-макрофагально-мегакариоцитарных предшественников (6-е сут) (табл.12). Примечательно, что в опыте количество клеток, входящих в состав КОЕ-ГЭММ, превосходит 800, в интактном контроле число нуклеаров не превышает 500. На 2, 3, 4-е сут увеличивается содержание прекурсоров, способных формировать в культуре неадгезирующих миелокариоцитов колонии гранулоцитарно-макрофагального типа (табл.11).
Как видно из представленных данных культуральных исследований, в основе развития цитостатической миелосупрессии лежит истощение пула гранулоцитарных прекурсоров в костном мозге, регенерация кроветворной ткани сопряжена с последовательной активацией полипотентных, олигопотентных и бипотентных кроветворных клеток-предшественников.
Введение стандартного препарата Г-КСФ ускоряет регенерацию гранулоцитопоэза. Так, в условиях назначения циклофосфана препарат цитокина увеличивает содержание незрелых (2-4 сут) и зрелых (3-5 сут) нейтрофильных гранулоцитов в кроветворной ткани (табл.1, 2). В периферической крови наблюдается увеличение количества сегментоядерных нейтрофилов (2, 4, 5 сут) (табл.4), тогда как динамика содержания палочкоядерных нейтрофильных гранулоцитов практически не отличается от таковой в цитостатическом контроле. На протяжении всего периода исследования количество эритрокариоцитов в опыте остается ниже значений интактного контроля.
Применение Г-КСФ приводит к еще большему выходу КОЕ-Н на 3, 4-е сут после введения алкилирующего агента (соответственно в 2 и 4 раза, P<0,01 выше цитостатического контроля) (табл.9). Прослеживается линейная зависимость роста КОЕ-Н от концентрации нуклеаров в лунке, что свидетельствует о высокой пролиферативной активности клеток указанной популяции. Одновременно цитокин индуцирует формирование КОЕ-Г (2, 3, 6 сут) и уменьшает число КОЕ-ГМ (2, 4 сут) в культуре недифференцированных клеток третичных колоний (табл.10, 11). Из этого следует, что в условиях назначения Г-КСФ восстанавливается концентрация, прежде всего, наиболее чувствительных к цитостатику предшественников типа КОЕ-Г.
Парентеральное применение препарата цитокина в значительной степени стимулирует и рост КОЕ-ГЭММ (3-5-е сут) (табл.12). Размер агрегатов на 40-70% (P<0,05) превосходит таковой в цитостатическом контроле. Цитоморфологический анализ индивидуальных колоний показывает, что в их состав входят не только бластные формы гранулоцитов и промиелоциты, как в цитостатическом контроле (без препарата), но и метамиелоциты, и палочкоядерные гранулоциты. На 2-5-е сут после цитостатического воздействия Г-КСФ поступательно увеличивает индекс созревания КОЕ-Г (с максимальным значением на 5-е сут) (табл.5). Митотическая активность гранулоцитарных предшественников нормализуется на 3, 5-е сут эксперимента, а к концу исследования величина показателя уступает таковой в интактном контроле (6 сут) (табл.7). Следует отметить, что в опыте величина пула эритроидных предшественников несколько ниже, чем в цитостатическом контроле (табл.8).
Как видно, при введении циклофосфана Г-КСФ неоднозначно действует на кроветворные предшественники. Наблюдается преимущественное восстановление концентрации гранулоцитарных предшественников (за счет собственной стимуляции и индукции созревания КОЕ-Н). В то же время содержание эритроидных предшественников и скорость дифференцировки полипотентных предшественников в бипотентные клетки снижается.
При цитостатическом воздействии симпатолитик резерпин статистически достоверно увеличивает число не только незрелых (3 сут) и зрелых (2, 3 сут) форм нейтрофилов, но и эритрокариоцитов (5 сут) (табл.1, 3). В этих условиях возрастание количества сегментоядерных нейтрофилов в периферической крови отмечается не на 6, 7-е сут как в цитостатическом контроле, а на 5-е сут исследования (табл.4).
Резерпин увеличивает концентрацию кроветворных предшественников типа КОЕ-Н в костном мозге (2, 4 сут), а также скорость их созревания, на что указывает формирование гранулоцитарных клеточных ассоциаций (2, 3 сут) и гранулоцитарно-макрофагальных колоний (2 сут) в третичных культурах недифференцированных клеток (табл.9, 10, 11). В то же время при назначении Г-КСФ интенсивность дифференцировки полипотентных предшественников в клетки гранулоцитарно-макрофагального ряда снижается. Следует отметить, что количество нуклеаров в КОЕ-Н в опытной группе с резерпином выше такового в цитостатическом контроле на 30% (табл.9). Эти данные косвенно указывают на то, что мобилизуемые препаратами Г-КСФ полипотентные кроветворные предшественники, вероятнее всего, обладают более низкой пролиферативной активностью, чем в цитостатическом контроле (без препарата). Стимулирующее влияние резерпин оказывает и на предшественники типа КОЕ-ГЭММ (3, 5 сут), КОЕ-Г (4, 5, 7 сут) и КОЕ-Э (6, 7 сут) (табл.5, 6, 12).
Итак, гранулоцитопоэзстимулирующие эффекты резерпина связаны со стимуляцией пролиферации и дифференцировки полипотентных кроветворных предшественников (КОЕ-Н, КОЕ-ГЭММ), а также с увеличением функциональной активности выживших после назначения циклофосфана зрелых кроветворных предшественников типа КОЕ-Г. Следует отметить, что в условиях данной модели цитостатической миелосупрессии резерпин выступает препаратом выбора, так как в отличие от нейпогена инициирует созревание КОЕ-Н не только в КОЕ-Г, но и КОЕ-ГМ. Кроме этого, симпатолитик способствует восстановлению пула эритроидных предшественников и, как следствие, ускоряет регенерацию эритрона.
Таким образом, исследование концентрации полипотентных кроветворных предшественников, а также их способности к дифференцировке в гранулоцитарно-макрофагальные и гранулоцитарные предшественники продемонстрировало преимущество использования симпатолитика резерпина над нейпогеном в условиях цитостатической миелосупрессии, вызванной введением циклофосфана.
Предъявляемый способ позволяет производить выбор наиболее эффективных лекарственных средств для коррекции гематологических нарушений с учетом патогенеза и избежать развития осложнений.
Литература
1. Гольдберг Е.Д., Дыгай A.M., Жданов В.В. и др. Механизмы действия гранулоцитарного колониестимулирующего фактора на гемопоэз // Бюл. эксперим. биол. и медицины. - 2005. - Приложение №1. - С.5-13.
2. Миненко С.В., Птушкин В.В. Роль эритропоэтина бета (рекормон) в лечении анемии при опухолевых заболеваниях // Вместе против рака. Новое в химиотерапии злокачественных новообразований.- 2005 - Спец. выпуск №2.
3. Машковский М.Д. Лекарственные средства. - 15-е изд., перераб., испр. и доп. - М.: «Новая волна», 2006. - С.453-455, 716-717, 969.
4. Vial Т., Descotes J. Clinical toxicity of cytokines used as haemopoietic growth factors // Drug Saf. - 1995. - Vol.13. - №6. - P.371-406.
5. Дыгай A.M., Жданов B.B., Гольдберг B.E. и др. Методические указания по изучению гемостимулирующей активности фармакологических веществ // Ведомости научного центра экспертизы и государственного контроля лекарственных средств. - 2002. - №1. - С.29-32.
6. Гольдберг Е.Д., Дыгай A.M., Жданов В.В. Роль гемопоэзиндуцирующего микроокружения при цитостатических миелосупрессиях. - Томск, 1999. - С.43-44; 55-57.
7. Бигильдеев А.Е., Сац Н.В., Грищук А.Л. и др. Характеристика перевиваемого миелопролиферативного заболевания, развившегося после многократных введений гранулоцитарного колониестимулирующего фактора // Бюл. эксперим. биол. и медицины. - 2008. - Т.145, №2. - С.234-240.
8. Нифонтова И.Н., Свинарева Д.А., Чертков И.Л. и др. Отдаленные последствия длительного применения гранулоцитарного колониестимулирующего фактора у мышей // Бюл. эксперим. биол. и медицины. - 2008. - Т.145, №5. - С.568-573.
9. Lord B.I., Bronchud M.N., Owens S. The kinetics of human granylopoiesis following treatment with G-CSF in vivo // Proceedings of the National Academy of Sciences of the USA. - 1989. - V.86. - P.9499-9503.
10. Дыгай A.M., Скурихин Е.Г., Першина O.B. и др. Роль центральных адренергических структур в регуляции гранулоцитопоэза при цитостатических воздействиях // Бюл. эксперим. биол. и медицины. - 2008. - Т.145, №4. - С.383-388.
11. Гольдберг Е.Д., Дыгай A.M., Шахов В.П. Методы культуры ткани в гематологии. - Томск, 1992. - С.172-173, 208.
12. Ventura G.J., Hester J.P., Buescher E.S. at al. Hematopoiesis in Limiting Dilutin Cultures: Influence of Cytokines on Human Hematopoietic Progenitor Cells // Exp. Hematology. - 1990. - V.18. - P.878-882.
| Таблица 9 | |||
| Влияние препарата стандартного Г-КСФ и резерпина на частоту встречаемости КОЕ-Н во взвеси миелокариоцитов костного мозга мышей линии CBA/CaLac на фоне введения циклофосфана (одна клетка/количество миелокариоцитов) | |||
| Сроки исследования, сутки | Цитостатический контроль | Стандартный Г-КСФ | Резерпин |
| Интактный контроль | 1/121435 | 1/121435 | 1/121435 |
| 2 | 1/14586 | 1/17267 | 1/16876 |
| 3 | 1/301671 | 1/68537 | 1/207765 |
| 4 | 1/40216 | 1/16829 | 1/18856 |
| 5 | 1/168456 | 1/58904 | |
| 6 | 1/205567 | 1/146359 | |
| 7 | 1/301671 | 1/301671 | 1/301671 |
| Таблица 12 | ||||
| Влияние препаратов стандартного Г-КСФ и резерпина на динамику содержания КОЕ-ГЭММ в костном мозге мышей линии CBA/CaLac на фоне введения циклофосфана | ||||
| Сроки исследования, сутки | Цитостатический контроль | Стандартный Г-КСФ | Резерпин | |
| Интактный контроль | 2,0±0,19 | 2,0±0,19 | 2,0±0,19 | |
| 2 | 0,38±0,18 | 1,0±0,19 | 1,0±0,19 | |
| Р≤0,01 | А | |||
| Р≤0,05 | Р≤0,05 | Б | ||
| В | ||||
| 3 | 2,63±0,18 | 18,25±1,01 | 14,13±1,32 | |
| Р≤0,001 | Р≤0,001 | А | ||
| Р≤0,001 | Р≤0,001 | Б | ||
| Р≤0,05 | В | |||
| 4 | 1,75±0,16 | 9,0±0,8 | 2,75±0,25 | |
| Р≤0,001 | А | |||
| Р≤0,001 | Р≤0,05 | Б | ||
| Р≤0,001 | В | |||
| 5 | 1,88±0,23 | 4,25±0,7 | 3,13±0,3 | |
| Р≤0,01 | Р≤0,05 | А | ||
| Р≤0,01 | Р≤0,02 | Б | ||
| В | ||||
| 6 | 4,25±0,49 | 1,75±0,25 | 3,75±0,37 | |
| Р≤0,01 | Р≤0,01 | А | ||
| Р≤0,01 | Б | |||
| Р≤0,02 | В | |||
| Примечание. А - различия достоверны по отношению к интактному контролю, Б - различи* достоверны по отношению к цитостатическому контролю, В - по отношению к Г-КСФ |
Способ определения эффективности гемостимуляторов при цитостатической миелосупрессии, заключающийся в исследовании клеток крови, отличающийся тем, что исследуют содержание и дифференцировку стволовых кроветворных клеток и коммутированных предшественников, и при дифференцировке стволовых кроветворных клеток преимущественно в предшественники гранулоцитарно-макрофагального и гранулоцитарного типа препараты относят к гемостимуляторам, стимулирующим грануломоноцитопоэз, а при дифференцировке только в гранулоцитарные клетки к гемостимуляторам гранулоцитарного ростка кроветворения.