Способ моделирования туберкулезного остита различной степени тяжести
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине и фтизиатрии и касается создания модели костного туберкулезного поражения различной тяжести течения. Для этого перфорируют кортикальный слой вблизи суставной капсулы коленного сустава, формируют канал в губчатом веществе дистального эпифиза бедренной кости. В этот канала при помощи троакара вводят фрагмент гемостатической губки с жидкой культурой микобактерий туберкулеза от 1×103 до 1×108 клеток/µл. Затем аутокостным трансплантатом восполняют костный дефект при изоляции области заражения цементной пломбой. Способ обеспечивает ускорение развития туберкулезного процесса за счет наиболее точного интраоссального введения культуры микобактерий с заданной инфицирующей дозой и может быть использован для разработки приемов хирургического лечения туберкулезного остита различной степени тяжести. 4 ил.
Реферат
Изобретение относится к медицине, а именно к фтизиатрии, и может быть использовано для разработки способов хирургического лечения туберкулезного остита различной степени тяжести.
Появление новых хирургических технологий и необходимость дифференцированного подхода к выбору хирургической тактики в лечении туберкулеза костей и суставов определяет необходимость получения модели туберкулезного остита различной тяжести течения для продолжения экспериментального поиска новых методик оперативного лечения.
Применяемый в настоящее время способ моделирования туберкулезного остита вблизи коленного сустава в экспериментах на кроликах был разработан Э.Н.Беллендиром в экспериментальной лаборатории Ленинградского института хирургии туберкулеза в 1967 г. (Беллендир Э.Н. Экспериментальная модель туберкулезного остита вблизи коленного сустава. // Патогенез и саногенез очаговых и деструктивных форм туберкулеза. - М., 1967). При использовании данного метода осуществляется доступ к внутреннему мыщелку бедренной кости. Освобождается костная площадка в области эпиметафиза бедра. Формируют отверстие диаметром 1 мм, длинной 5 мм, через которое на кончике иглы вносится сухая культура микобактерий туберкулеза (МБТ) в дозе 0,5 мг. Рана обрабатывается противотуберкулезным препаратом в порошкообразной форме. Отверстие заполняется стоматологическим цементом, накладывается послойный шов раны.
Недостатки описанного способа моделирования - не позволяет использовать различные заражающие дозы; нет возможности получить различную тяжесть течения туберкулезного процесса; существует риск инфицирования культурой МБТ операционной раны на этапе ее внесения в сформированный костный дефект; есть опасность миграции агента заражения с током крови из костной ткани, что может изменить локализацию очага и течение туберкулезного процесса, а также повышает риск послеоперационных осложнений (абсцессы, свищи); длительные сроки развития туберкулезного очага.
Задачей предлагаемого способа является создание модели костного туберкулезного поражения различной тяжести течения.
Поставленная задача решается тем, что перфорируют кортикальный слой вблизи суставной капсулы коленного сустава, формируют канал в губчатом веществе дистального эпифиза бедренной кости, куда при помощи троакара вводят фрагмент гемостатической губки с жидкой культурой микобактерий туберкулеза в концентрации от 1×103 до 1×108 клеток/µл, а затем аутокостным трансплантатом восполняют костный дефект.
Способ поясняется чертежами, где:
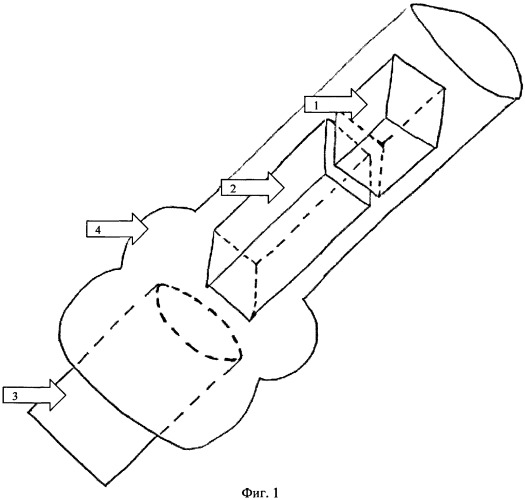
Фиг.1:
1. Гемостатическая губка, пропитанная жидкой культурой МБТ.
2. Аутокостный трансплантат.
3. Мандрен троакара.
4. Троакар.
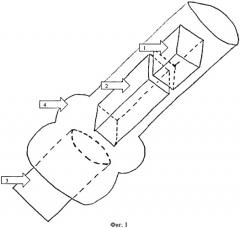
Фиг.2:
5. Дистальный эпиметафиз бедренной кости.
1. Гемостатическая губка, пропитанная жидкой культурой МБТ.
2. Аутокостный трансплантат.
6. Цементная пломба.
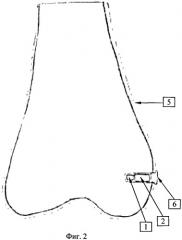
Фиг.3:
7. Коленный сустав кролика.
8. Туберкулезный очаг в дистальном эпиметафизе бедренной кости.
6. Цементная пломба.
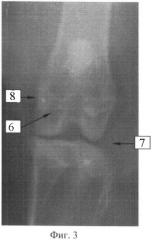
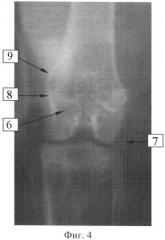
Фиг.4:
7. Коленный сустав кролика.
8. Туберкулезный очаг в дистальном эпиметафизе бедренной кости.
6. Цементная пломба.
9. Деформация контура медиального мыщелка.
Заявляемый способ позволяет:
1. Создавать модель костного туберкулезного поражения различной тяжести течения.
2. Ускорить скорость развития туберкулезного процесса.
3. Получить туберкулезный остит путем более точного интраоссального введения гемостатической губки, пропитанной суспензией культуры МБТ с заданной инфицирующей дозой.
4. Избежать миграции инфекта с помощью его фиксации аутокостным трансплантатом.
Способ осуществляется следующим образом.
С целью общей анестезии и седации перед оперативным вмешательством животному внутримышечно вводится раствор Рометара 2% (Xylazinum - препарат для использования в ветеринарии) в объеме 1,0-1,5 мл. Положение кролика на спине. Конечности колика фиксируются на станке в максимально вытянутом положении.
1-й Этап - подготовка и осуществление хирургического доступа. Кожный покров в области коленного сустава выстригается и обрабатывается раствором йода. Разрез кожи и подкожной клетчатки длиной 5 см производится по передне-медиальной поверхности нижней трети правого бедра, кпереди и параллельно боковой связке. Мягкие ткани рассекаются у переднего края боковой связки до кости и отодвигаются распатором вместе с надкостницей книзу и медиально.
2-й Этап - формирование канала в бедренной кости. Канал диаметром 2 мм и длиной 5 мм высверливался в области освободившейся костной площадки. Кровотечение из губчатой кости останавливается тампонадой канала турундой с перекисью водорода.
3-й Этап - заготовка аутотрансплантата. На 1,5-2 см проксимальнее области заражения из бедренной кости выкраивается кортикальный костный трансплантат 4×2×2 мм. Ему придается цилиндрическая форма.
4-й Этап - интраоссальное введение инфекта. Приготавливается суспензия культуры МБТ заданной концентрации (1×103 или 1×108 клеток/µл). Необходимая доза культуры вносится в гемостатическую губку размером 2×2 мм. Полученный инфекционный агент устанавливается в троакар, заряженный аутокостным трансплантатом (фиг.1). Троакар устанавливается в сформированный костный канал. После чего гемостатическая губка с трансплантатом выталкивается мандреном до дна костного дефекта.
5-й Этап - пломбирование. Наружная поверхность установленного трансплантата и прилегающие к нему края восполненного костного дефекта изолируются от параоссальных мягких тканей цементной пломбой (фиг.2.). На рану накладывается послойный шов.
Данная техника заражения позволяет формировать туберкулезный очаг у подопытных животных через 2-5 недель. Сроки возникновения и тяжесть течения туберкулезного процесса зависят от инфицирующей дозы, что позволяет разрабатывать хирургические методы лечения туберкулеза костей и суставов различных форм.
Пример №1
Кролик №4 породы шиншилла, пол - самец, исходная масса - 2950 г, температура - 39°C.
Внутримышечно введен 1,0 мл раствора Рометара 2%. Кролик зафиксирован в положении на спине. Конечности кролика фиксируются на станке в максимально вытянутом положении. Произведен разрез кожи и подкожной клетчатки длиной 5 см по передне-медиальной поверхности нижней трети правого бедра, кпереди и параллельно боковой связке. Мягкие ткани рассечены у переднего края боковой связки до кости и отодвинуты распатором вместе с надкостницей книзу и медиально. В области освободившейся костной площадки высверлен канал диаметром 2 мм и длиной 5 мм. Кровотечение из губчатой кости остановлено тампонадой канала турундой с перекисью водорода. На 1,5-2 см проксимальнее области заражения из бедренной кости выкраивается кортикальный костный трансплантат 4×2×2 мм. Ему придана цилиндрическая форма. Затем культура МБТ в дозе 1×103 клеток/µл погружается в сформированный костный канал с помощью троакара. Канал восполнен костным аутотрансплантатом. Область заражения изолирована от мягких тканей цементной пломбой при тщательном гемостазе. Рана послойно наглухо ушита кетгутом.
В раннем послеоперационном периоде животное ежедневно наблюдалось, производился осмотр животного, взвешивание, определение амплитуды движений в суставе. В дальнейшем клинический осмотр осуществлялся 1-3 раза в неделю. При осмотре животного отмечали его активность, позу и характер передвижения. Оперированный сустав пальпировали, сравнивали с контрлатеральным. Оценивали состояние кожных покровов, мягких тканей, окружающих сустав, определяли объем подвижности в суставе.
Было отмечено, что животное после оперативного вмешательства было малоактивно. К 9 суткам масса кролика незначительно снизилась. Наблюдалась инфильтрация мягких тканей в области послеоперационной раны. В последующем отмечался регресс воспалительных изменений в области вмешательства, увеличивалась амплитуда движений в суставе. При дальнейшем наблюдении было отмечено, что воспалительные явления и заживление операционной раны сопровождались улучшением общего состояния животного. Кролик был активен, набрал исходную массу. К 30-м суткам объем движений постепенно уменьшался.
Животное выведено из опыта на сроке 30 суток. Макроскопическая оценка костного препарата включала:
1) состояние миелоидного костного мозга дистального эпифиза бедренной кости - без дегенеративно-дистрофических изменений;
2) состояние суставной поверхности бедренной кости - выявлено истончение суставного хряща. Поверхность хряща имела синюшный оттенок.
Визуальный осмотр других органов и систем не выявил признаков туберкулезного поражения. Наличие очага деструкции размером около 1,0 мм отмечалось в месте введения культуры к 1-му месяцу после заражения, что подтверждено рентгенологически.
Гистологическое исследование показало, что в медиальном мыщелке дистального эпифиза бедренной кости определяется туберкулезный очаг диаметром 2,0 мм, содержащий казеозно-некротические массы. Отмечаются дегенеративно-дистрофические признаки в виде жировой дегенерации окружающей спонгиозной кости. Суставной хрящ фиброзно изменен в области медиального мыщелка, видны коллагеновые волокна и дистрофические изменения.
Пример №2
Кролик №5 породы шиншилла, пол - самец, исходная масса - 3100 г, температура - 38,5°C.
Животное было заражено предлагаемым способом. Заражающая доза составила 1×108 клеток/µл.
Аналогично описанному примеру проводился ежедневный детальный клинический осмотр животного. Кролик взвешивался, оценивалась амплитуда движений в суставе. Наблюдения показали снижение активности в раннем послеоперационном периоде, снижение аппетита. Течение раневого процесса было сходным с предыдущим примером. На 14 сутки отмечалось уменьшение объема движений в оперированном суставе.
После эвтаназии животного (30 суток после операции) при макроскопической оценке костного препарата выявлено: контур дистального эпифиза деформирован за счет выбухания по медиальной поверхности внутреннего мыщелка; выраженные дегенеративно-дистрофические изменения миелоидного костного мозга в дистальном эпифизе бедренной кости; суставной хрящ повсеместно истончен, в области медиального мыщелка определяются участки отсутствия хрящевого покрова. Очаг деструкции имел размеры около 3,5 мм. Туберкулезных изменений в других органах и системах не обнаружено.
Гистологически выявлен костно-деструктивный очаг размером 4 мм с казеозно-некротическими массами, значительные дегенеративно-дистрофические изменения в виде остеопороза и жировой дегенерации обоих мыщелков, наиболее выраженные в области заражения. Хрящевой покров истончен, местами замещен соединительной тканью. В области медиального мыщелка участки отслоения и отсутствия суставного хряща.
Таким образом, предлагаемый способ позволяет получить костно-деструктивные очаги туберкулезного воспаления разной степени выраженности на одном сроке после заражения. Это дает возможность разрабатывать тактику хирургического лечения туберкулеза костей и суставов на разных этапах его развития.
Способ моделирования туберкулезного остита различной степени тяжести путем местного заражения животных культурой микобактерий туберкулеза, отличающийся тем, что перфорируют кортикальный слой вблизи суставной капсулы коленного сустава, формируют канал в губчатом веществе дистального эпифиза бедренной кости, куда при помощи троакара вводят фрагмент гемостатической губки с жидкой культурой микобактерий туберкулеза в концентрации от 1·103 до 1·108 клеток/мкл, а затем аутокостным трансплантатом восполняют костный дефект при изоляции области заражения цементной пломбой.