Способ выявления апомиктичных растений сорго, возникших за счет псевдогамной формы диплоидного апомиксиса
Иллюстрации
Показать всеИзобретение относится к области сельского хозяйства, селекции, генетики и ботаники. Способ включает опыление метелок диплоидных линий, лишенных собственной фертильной пыльцы, пыльцой тетраплоидов, получение семян, их проращивание и отбор растений. Для отбора псевдогамных растений-апомиктов зерновки расщепляют пополам, причем одну половинку, несущую зародыш, используют для получения растения и анализа его морфологических признаков, а другую половинку - для электрофоретического анализа спектра белков эндосперма. При этом псевдогамными апомиктами считают растения матроклинного типа, выросшие из семян, у которых спектр белков эндосперма отличается от материнской линии. Способ позволяет выявлять апомиктичные растения, сформировавшиеся за счет псевдогамного апомиксиса при беспыльцевом режиме и использовать при отсутствии линий с маркерными генами. 2 табл., 2 ил.
Реферат
Изобретение относится к биотехнологии, генетике и репродуктивной биологии растений и может быть использовано в селекции и в теоретических исследованиях при мониторинге репродуктивного поведения растений.
Известен способ выявления апомиксиса, основанный на цитоэмбриологическом анализе женской генеративной сферы (Carman G.G. Methods for increasing the frequency of apomixis expression in angiosperms. Patent EP 1686846 (A2). 2006-08-09).
Недостатком этого способа является то, что он позволяет выявить формы, способные к апомиктичному развитию семян, но не позволяет выявить индивидуальные растения, произошедшие за счет апомиксиса, поскольку связан с анализом завязей, содержащих апомиктичные зародыши, зафиксированные на ранних стадиях развития и, в этой связи, не способные к дальнейшему развитию.
Известен также способ выявления семян, сформированных путем апомиксиса, включающий анализ фенотипических характеристик зародыша (Смолькина Ю.В. О возможности отбора на партеногенез у кукурузы среди близнецов полового происхождения // Бюл. Бот. сада Саратовского ун-та. Саратов: Изд-во Саратовского ун-та, 2002. С.96-98) или эндосперма семян (Morrison L.A., Metzger R.J., Lukashevski A.J. Origin of the blue-aleuron gene in sebesta blue wheat genetic stocks and a protocol for its use in apomixis screening // Crop. Sci., 2004. V.44. P.2063-2067), при котором апомиктичное происхождение зародыша или эндосперма соответственно устанавливается визуально по отсутствию доминантных маркерных признаков отцовского родителя.
Недостатком этого способа является то, что применение его ограничено случаями, когда в распоряжении исследователя имеются формы, обладающие маркерными признаками, которые возможно выявить визуально, либо при четком фенотипическом проявлении маркерных генов, не зависящем от изменяющихся условий внешней среды.
Также существует способ выявления растений, произошедших за счет апомиксиса, с помощью проточной цитофотометрии, которая позволяет установить плоидность зародыша и эндосперма семени, что дает возможность сделать вывод о репродуктивном механизме возникновения конкретного семени (Matzk F., Meister A., Shubert I. An efficient screen for reproductive pathways using mature seeds of monocots and dicots. Plant J., 2006. V.21. P.97-108).
Недостатками этого способа являются значительная дороговизна оборудования, используемого для определения плоидности зародыша и эндосперма и, главное, необходимость получения суспензии клеток, т.е. семя полностью разрушается.
Наиболее близким к предлагаемому является способ выявления апомиктичных растений у кукурузы в потомстве, полученном от разноплоидного скрещивания (2n×4n), в котором в качестве материнского родителя использовали диплоидную линию №8313 (происходящую от гибрида кукурузы с трипсакумом), характеризовавшуюся рецессивными аллелями маркерных генов а (отсутствие пурпурной окраски зерновки), g1 (наличие золотистой окраски стебля), lg (отсутствие лигулы), а в качестве отцовского родителя - тетраплоидную линию Пурпурный маркер, характеризовавшуюся доминантными аллелями этих генов: А (наличие пурпурной окраски зерновки), G1 (отсутствие золотистой окраски стебля), Lg (наличие лигулы) (Петров Д.Ф., Белоусова Н.И., Фокина Е.С. О передаче кукурузе способности к регулярному апомиктическому размножению // Проблемы апомиксиса и отдаленной гибридизации. Новосибирск: «Наука», 1987, c.29-41). Для выявления растений, развившихся путем апомиксиса, проводили искусственное опыление изолированных с помощью пергаментных изоляторов женских соцветий (початков) диплоидной линии пыльцой тетраплоидной линии. В потомстве от такого скрещивания отбирали формы с признаками материнской линии, при этом из 59 растений 58 были определены как апомиктичные. Причем как зародыш, так и эндосперм развились автономно.
Недостатками этого способа (прототипа) является его узкая применимость, поскольку гены, маркирующие визуально различимые признаки эндосперма, выявлены у ограниченного количества линий и видов растений, и их проявление в значительной мере модифицируется условиями окружающей среды. Поэтому вопрос о происхождении эндосперма, а следовательно, и семян вызывает, сомнение. Кроме того, существует вероятность ошибок при соблюдении в процессе работы беспыльцевого режима (искусственной изоляции, кастрации или стерилизации мужской генеративной сферы).
Задачей предлагаемого способа является повышение надежности выявления апомиктичных растений сорго, возникших путем псевдогамного апомиксиса, т.е. на основе партеногенетического развития яйцеклетки и оплодотворения центральной клетки зародышевого мешка.
Поставленная задача достигается тем, что по предлагаемому способу для выявления растений сорго, возникших путем псевдогамного апомиксиса, включающему опыление метелок диплоидных линий, лишенных собственной фертильной пыльцы и изолированных до начала цветения, пыльцой тетраплоидов, получение семян, их проращивание и отбор растений, фенотипически неотличимых от растений материнской линии (матроклинных растений), для отбора растений, возникших путем псевдогамного апомиксиса, зерновки расщепляют пополам, причем одну половинку, несущую зародыш, используют для получения растения и анализа его морфологических признаков, а другую половинку - для электрофоретического анализа спектра белков эндосперма, при этом псевдогамными апомиктами считают растения матроклинного типа, выросшие из семян, у которых спектр белков эндосперма отличается от материнской линии.
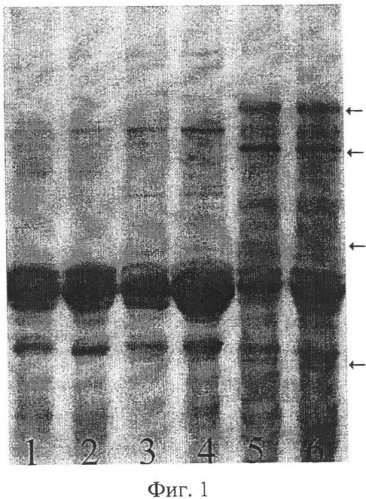
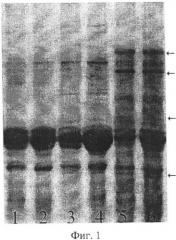
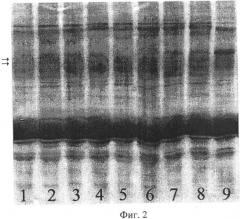
Предлагаемый способ иллюстрируется чертежами. На фиг.1 показаны результаты SDS-гель-электрофореза запасных белков эндосперма зерновок, полученных при опылении ЦМС-линии [9Е]Ж10 пыльцой тетраплоидной линии НТ-3366/2-тетра, при этом в дорожках 1, 2 представлены спектры белков эндосперма материнской линии, 3, 4 - отцовской линии, 5, 6 - зерновок, из которых развились матроклинные растения. Стрелками отмечены новые полипептиды, отсутствующие у родительских линий. На фиг.2 показаны результаты SDS-гель-электрофореза запасных белков эндосперма зерновок, полученных при опылении ЦМС-линии [9Е]Ж10 пыльцой тетраплоидной линии АС-1-30-тетра, при этом в дорожках 1-8 представлены спектры зерновок, из которых развились матроклинные растения, в дорожке 9 - белковый спектр материнской линии. Стрелками отмечены позиции спектров, в которых выявлены различия с материнской линией.
Предлагаемый способ выявления растений сорго, возникших путем псевдогамного апомиксиса, осуществляют следующим образом. Метелки растений сорго изолируют пергаментными изоляторами до начала цветения. Мужски-стерильные растения (несущие мутации цитоплазматической или генной мужской стерильности) используют без кастрации; мужски-фертильные растения перед изоляцией кастрируют. На рыльца изолированных соцветий наносят пыльцу тетраплоидных линий. С опыленных соцветий собирают выполненные семена. Острым инструментом зерновки раскалывают на две части: одна часть содержит зародыш и используется для его проращивания; другая часть используется для анализа запасных белков эндосперма методом SDS-электрофореза в полиакриламидном геле (SDS-ПААГ).
Сколы с зародышами помещают на влажную фильтровальную бумагу. У полученных проростков определяют плоидность. Проростки высаживают в вегетационные сосуды, а затем пересаживают в поле, где анализируют их признаки, при этом выявляют матроклинные растения (имеющие фенотип материнской линии). Методом SDS-электрофореза в ПААГ (2% SDS, 5% меркаптоэтанола) проводят сравнение спектров запасных белков семян, из которых были выращены матроклинные растения, и сравнивают его со спектром запасных белков семян материнской линии. Матроклинные растения, развившиеся из семян, спектры запасных белков которых отличались от спектров материнской линии, являются псевдогамными апомиктами.
По сравнению с прототипом предлагаемый способ отличается рядом преимуществ. Во-первых, автономность происхождения эндосперма в прототипе доказывалась отсутствием проявления одного маркерного отцовского гена, тогда как в соответствии с предлагаемым способом наличие или отсутствие отцовских генов в эндосперме устанавливается по электрофоретическому спектру белков, который позволяет проследить одновременно за поведением десятков генов, что делает вывод об автономной или гибридной природе эндосперма более надежным. Во-вторых, полиморфизм по белкам эндосперма встречается значительно чаще, чем по морфологически видимым признакам, к примеру по окраске алейронового слоя эндосперма, что делает предлагаемый способ более широко применимым, по сравнению с прототипом.
Примеры осуществления предлагаемого способа выявления растений сорго, возникших путем псевдогамного апомиксиса.
Пример 1. Для осуществления предлагаемого способа использовали растения стабильной ЦМС-линии сорго [Sorghum bicolor (L.) Moench] 9E Желтозерное-10 (9E Ж10). В качестве доноров пыльцы использовали растения индуцированной колхицином аутотетраплоидной линии НТ-3366/2-тетра, которые выращивали в соседних рядах.
До начала цветения метелки мужски-стерильных растений тщательно изолировали пергаментными изоляторами. После выбрасывания рылец у 90-100% цветков метелки опыляли пыльцой одной из тетраплоидных линий.
Как на контрольных (изолированных, но неопыленных) метелках, так и на опыленных пыльцой тетраплоидов наблюдали завязываемость нормальных зерновок с выполненным эндоспермом.
Формирование семян на контрольных метелках может произойти за счет спонтанного восстановления фертильности либо в результате автономного апомиксиса на базе диплоидных зародышевых мешков. Последнее маловероятно, учитывая известную закономерность, согласно которой нормально развитый эндосперм у злаков развивается при соотношении материнского и отцовского геномов соответственно 2м:1о (Соколов В.А. Импринтинг у растений // Генетика. 2006. Т.42, №9. С.1250-1260).
Формирование семян на метелках, опыленных пыльцой тетраплоидов, с учетом этой закономерности, может происходить за счет следующих механизмов:
а) спонтанного восстановления фертильности, при этом семя будет содержать материнский диплоидный зародыш и материнский триплоидный эндосперм;
б) двойного оплодотворения гаплоидных зародышевых мешков гаплоидными пыльцевыми зернами, которые могут формироваться у тетраплоидного отцовского родителя (Цветова М.И., Эльконин Л.А. Нестабильность уровня плоидности у аутотетраплоидов линии сорго с вариабельной мужской фертильностью // Генетика. 2002. Т.38. №5. С.641-646), при этом семя будет содержать гибридный диплоидный зародыш и гибридный триплоидный эндосперм;
в) двойного оплодотворения диплоидных зародышевых мешков диплоидными пыльцевыми зернами, при этом семя будет содержать гибридный тетраплоидный зародыш и гибридный гексаплоидный эндосперм;
г) псевдогамного апомиксиса на базе диплоидных зародышевых мешков, при этом семя будет содержать материнский диплоидный зародыш и гибридный гексаплоидный эндосперм;
д) за счет автономного апомиксиса на базе диплоидных зародышевых мешков, при этом семя будет содержать материнский диплоидный зародыш и материнский диплоидный эндосперм - что противоречит вышеупомянутой закономерности о соотношении материнского и отцовского геномов в эндосперме.
С опыленных и неопыленных (контрольных) метелок собрали выполненные семена. Среди опыленных были выявлены метелки с количеством зерновок до нескольких десятков, чего никогда не наблюдали в контроле (Табл.1).
| Таблица 1 | ||||
| Завязываемость семян на метелках ЦМС-линий сорго при опылении пыльцой тетраплоидов | ||||
| Комбинация | Всего | Число метелок с количеством зерновок, шт | ||
| 0 | 1-5 | 6 - несколько десятков | ||
| [9Е]Ж10 кон | 36 | 26 | 10 | - |
| [9Е]Ж10×НТ | 16 | 10 | 4 | 2* |
| [9Е]Ж10×АС-тетра | 8 | 3 | 2 | 5** |
| * р<0.05, в сравнении с контролем, в соответствии с F-критерием | ||||
| ** р<0.01, в сравнении с контролем, в соответствии с F-критерием |
| Таблица 2 | |||||
| Характеристика потомства, полученного из выполненных семян, завязавшихся на метелках ЦМС-линий, опыленных пыльцой тетраплоидов | |||||
| Комбинация | Число растений | ||||
| Всего, шт. | Матроклинных | Гибридных | |||
| шт. | % | шт. | % | ||
| [9Е]Ж10×НТ | 45 | 44 | 97,8 | 1 | 2,2 |
| [9Е]Ж10×АС-тетра | 64 | 64 | 100,0 | - | - |
От полученных зерновок отделили часть эндосперма. Сколы с зародышами поместили на влажную фильтровальную бумагу. С целью подсчета числа хромосом у полученных проростков корневые меристемы фиксировали в ацетоалкоголе (1:3), окрашивали в ацетогематоксилине и готовили давленные препараты с использованием 45% уксусной кислоты, подкрашенной ацетогематоксилином (Топильская Л.А., Лучникова С.В., Чувашина Н.П. Изучение соматических и мейотических хромосом смородины на ацетогематоксилиновых давленных препаратах // Бюл. Науч. Информации ЦГЛ им. И.В.Мичурина, 1975, вып.22. С.58-61). Проростки высадили в вегетационные сосуды, а затем пересадили в поле, где среди них были выявлены растения матроклинного типа и гибриды (Табл.2).
Для проверки предположения о происхождении растений материнского типа за счет псевдогамной формы апомиксиса провели SDS-электрофорез в ПААГ запасных белков эндосперма зерновок, полученных при опылении ЦМС-линии 9Е Ж10 тетраплоидной линией НТ3366/2, из которых развились матроклинные растения. На электрофореграммах были выявлены полипептиды, отсутствовавшие у материнской линии (фиг.1), указывавшие на гибридное происхождение эндосперма этих зерновок, что и следовало ожидать при псевдогамной форме апомиксиса.
Пример 2. Для осуществления предлагаемого способа использовали растения стабильной ЦМС-линии сорго [Sorghum bicolor (L.) Moench] 9Е Желтозерное-10 (9Е Ж10). В качестве доноров пыльцы использовали растения индуцированной колхицином аутотетраплоидной линий АС-1-30-тетра, которые выращивали в соседних рядах.
До начала цветения метелки мужски-стерильных растений тщательно изолировали пергаментными изоляторами. После выбрасывания рылец у 90-100% цветков метелки опыляли пыльцой одной из тетраплоидных линий.
Как на контрольных (изолированных, но неопыленных) метелках, так и на опыленных пыльцой тетраплоидов наблюдали завязываемость нормальных зерновок с выполненным эндоспермом, однако среди опыленных были выявлены метелки с количеством зерновок до нескольких десятков, чего никогда не наблюдали в контроле (Табл.1).
От полученных зерновок отделили часть эндосперма. Сколы с зародышами поместили на влажную фильтровальную бумагу. С целью подсчета числа хромосом у полученных проростков корневые меристемы фиксировали в ацетоалкоголе (1:3), окрашивали в ацетогематоксилине и готовили давленные препараты с использованием 45% уксусной кислоты, подкрашенной ацетогематоксилином, согласно вышеописанному способу. Проростки высадили в вегетационные сосуды, а затем пересадили в поле, где среди них были выявлены растения матроклинного типа и гибриды (Табл.2).
Для проверки предположения о происхождении растений материнского типа за счет псевдогамной формы апомиксиса провели SDS-электрофорез в ПААГ запасных белков эндосперма зерновок, полученных при опылении ЦМС-линии 9Е Ж10 тетраплоидной линией АС-1-30-тетра, из которых развились матроклинные растения. На электрофореграммах были выявлены полипептиды, отсутствовавшие у материнской линии (фиг.2), указывавшие на гибридное происхождение эндосперма этих зерновок, что и следовало ожидать при псевдогамной форме апомиксиса.
Таким образом, предлагаемый нами способ позволяет выделить среди сформировавшихся диплоидных матроклинных растений сорго экземпляры, образовавшиеся за счет псевдогамного апомиксиса, т.е. в результате партеногенетического развития яйцеклетки диплоидного зародышевого мешка и оплодотворения его полярных ядер диплоидным спермием. Предлагаемый способ может быть применим для выявления псевдогамного апомиксиса у мужски-стерильных либо кастрированных растений сорго у генотипов, не несущих маркерные гены признаков, выявляемых визуально. Биохимический анализ белков эндосперма позволяет безошибочно отделить псевдогамные апомиктичные растения от растений, сформированных за счет спонтанного восстановления фертильности или автономных форм апомиксиса, и тем самым решает задачу повышения надежности выявления апомиктичных растений сорго, возникших путем псевдогамного апомиксиса.
Способ выявления апомиктичных растений сорго, возникших за счет псевдогамного апомиксиса, включающий опыление метелок диплоидных линий, лишенных собственной фертильной пыльцы, пыльцой тетраплоидов, получение семян, их проращивание и отбор растений, отличающийся тем, что для отбора псевдогамных растений-апомиктов зерновки расщепляют пополам, причем одну половинку, несущую зародыш, используют для получения растения и анализа его морфологических признаков, а другую половинку - для электрофоретического анализа спектра белков эндосперма, при этом псевдогамными апомиктами считают растения матроклинного типа, выросшие из семян, у которых спектр белков эндосперма отличается от материнской линии.