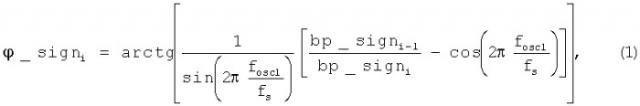Устройство слежения за электродами внутри тела пациента и способ его реализации
Иллюстрации
Показать всеИзобретение относится медицинской технике, в частности к способам и устройствам слежения за электродами-катетерами, введенными внутрь тела пациента, и может быть использовано в процессе лечения аритмий методом катетерной аблации. Устройство содержит генератор зондирующих частот с бифазными буферами для генерации электрического тока в теле пациента, коммутатор, многоканальный блок усилителей, блок оцифровки, блок гальванической изоляции от пациента, вычислительное устройство и монитор. В теле пациента формируют электрическое поле по трем ортогональным направлениям. Сформированные в теле пациента потенциалы поля регистрируют электродами, усиливают, оцифровывают и определяют координаты позиций электродов. Определение координат и визуализацию результатов осуществляют с помощью вычислительного устройства. По запомненным координатам позиций электродов формируют трехмерные поверхности объектов и визуализируют на них параметры электрической активности миокарда. Технический результат заключается в повышении точности и надежности определения координат электродов-катетеров в многоканальных устройствах. 2 н. и 9 з.п. ф-лы, 4 ил.
Реферат
Изобретение относится медицинской технике, в частности к устройствам и способам слежения за положением в пространстве электродов, и может быть использовано в процессе лечения аритмий методом катетерной аблации.
При лечении аритмий методом катетерной аблации вводят в камеры сердца эндокардиальные электроды, проводят манипуляцию электродами и изучают последовательность возбуждения миокарда и поиск источников аритмии. При нахождении такого источника его активность подавляют воздействием тепла от прохождения токов высокой частоты, который подают через электрод, находящийся в зоне источника аритмии. Особенностью метода катетерной аблации является отсутствие прямого визуального контроля за инструментом при выполнении манипуляций. Традиционно в ходе операции для контроля положения электродов применяют рентгеноскопию [1, 2], что приводит к облучению персонала и пациента. Рентгеноскопия имеет ограничения в связи с невозможностью трехмерной визуализации. Для преодоления перечисленных недостатков метода катетерной аблации создают специальные средства локации и визуализации, позволяющие определять координаты и отображать перемещения электродов в виртуальном пространстве без использования рентгеноскопического контроля. Принцип работы таких систем локации и навигации основан на методах определения координат электрода в среде безопасных неионизирующих полей, создаваемых в теле пациента.
Известно устройство, использующее магнитное поле для определения координат электрода [3]. Устройство содержит наружный излучатель низкоэнергетического магнитного поля (эмиттер), миниатюрное регистрирующее устройство (датчик), воспринимающее магнитное поле, и обрабатывающее устройство (CARTO™, Biosense Webster, USA). Эмиттер магнитного поля, который помещают под операционным столом, состоящий из трех катушек, генерирующих сверхнизкие магнитные поля (от 5×10-6 до 5×10-5 Тесла) с разными частотами внутри грудной клетки пациента. Миниатюрный пассивный датчик магнитного поля встроен в наконечник катетера выше 4-миллиметрового концевого электрода. Дистальный и проксимальный электроды катетера позволяют производить регистрацию обычных уни- и биполярных электрограмм. В наконечник катетера, также вмонтировано устройство для температурного контроля при проведении процедуры аблации. Устройство определяет и локализует положение наконечника катетера в пространстве, с одновременной регистрацией локальных внутрисердечных электрограмм. По последовательности запомненных положений наконечника электрода устройство программно формирует 3-мерную поверхность камеры сердца.
Недостатком указанного устройства является усложнение конструкции электрода за счет применения магнитного датчик положения и отсутствие возможности измерять координаты обычных многоэлектродных диагностических катетеров, традиционно используемых в ходе операции. Невозможность определения координат остальных внутрисердечных катетеров снижает достоверность системы на этапе диагностики и ограничивает выбор тактики лечения. Алгоритм формирования трехмерной поверхности имеет высокую вычислительную сложность.
Известно также другое устройство локации, которое использует один или более катетеров с источниками и приемниками ультразвуковых сигналов и определяет координаты в пределах сердца пациента, используя принципы триангуляции [4]. Устройство выдает координаты электрода в трехмерном виде на мониторе.
Недостатком этого решения является невысокая точность вычисления координат, связанная с большими изменениями градиентов ультразвукового поля и сложная конструкция катетеров и невозможность измерять координаты обычных электродов, не имеющих встроенных датчиков.
Известно также другое устройство и способ локации электродов, использующие векторное вращающееся электрическое поле, формируемое в теле пациента. Для получения информации о положении электрода создают два ортогональных вращающихся вектора электрического поля с частотой, лежащей вне полосы частот кардиосигнала. Сигналы с электродов обрабатывают для частот каждого электрического поля относительно заранее выбранного базисного вектора с известными координатами, в качестве которого выступают два внутрисердечных электрода. Углы направления векторов на лоцируемый электрод с начала и конца базисного вектора определяют по фазовым сдвигам регистрируемых сигналов электрических полей. Координаты в пространстве определяются в точках пересечения векторов. После вычисления результаты отображают на экране монитора [5].
Недостатком этого известного решения является ограниченные возможности по формированию идеального вектора поля из-за сильных отклонений геометрии тела пациента от идеальных геометрических фигур, что приводит к снижению точности расчета координат. Большое количество каналов генератора и большое количество закрепляемых на поверхности тела пациента электродов для создания вращающихся векторов электрического поля приводят к снижению эксплуатационной надежности устройства.
Известно также устройство и способ [6] для определения координат электродов внутри сердца. Данное устройство содержит генератор для формирования тестирующих импульсов, коммутаторы, устройства регистрации и обработки информации для расчета координат. Работа устройства заключается в том, что в камеру сердца вводят как минимум 2 многополюсных электрода и диагностический подвижный электрод. С помощью коммутатора на электроды многополюсных катетеров подают электрические импульсы для создания тестирующего электрического поля, потенциалы которого регистрируют полюсами подвижного электрода и затем вычисляют его координаты. Для нормальной работы устройства необходимо сначала определить координаты многополюсных электродов.
Недостатком этого известного решения невысокая точность вычисления координат, связанная с большими изменениями потенциалов тестирующего поля в зависимости от шага расположения контактов в многополюсных электродах, их ориентацией в пространстве и расстоянием до электрода, координаты которого определяются. Другим следствием высокой изменчивости уровня тестируемого поля является ограниченная зона устойчивого определения координат, что может приводить к срыву получения расчетных координат и как следствие снижению эксплуатационной надежности.
Основным недостатком применения известных устройств являются либо снижение надежности при создании многоканальных устройств, либо ограничение точности определения координат.
Наиболее близким аналогом (прототипом) предлагаемого в данном изобретении устройства является «Система локации катетера и способ» по патенту США №5983126 [7]. На основе данного патента созданы коммерческие устройства Localisa (Medtronic, USA) и NavX (Endocardial Solutions, USA). Устройство содержит электрод-катетер, опорный электрод, задающий генератор с тремя источниками тока на выходе для формирования зондирующего тока, коммутатор, узкополосные каналы регистрации, вычислительное устройство - компьютер, средства калибровки, средства визуализации запомненных трехмерных позиций электродов и трехмерных позиций электродов в реальном времени.
Определение позиции катетера при картировании сердца осуществляют следующим образом. Подают взаимно ортогонально через грудную клетку пациента три переменных электрических сигнала. Токи являются импульсными или переменными с частотой следования импульсов и амплитудой такой величины, чтобы не приводить к помехам при записи ЭКГ. На катетере, координаты которого определяют, должен быть электрод для регистрации потенциалов электрического поля. Измеряют потенциалы между электродом и опорным электродом на поверхности тела пациента. Одновременно регистрируют потенциалы активности миокарда. Обрабатывают раздельно зондирующие сигналы через три узкополосных канала, выделяют три компоненты координат x, у и z и определяют трехмерные позиции электродов в пределах тела пациента. Осуществляют масштабирование по осям координат. Осуществляют низкочастотную фильтрацию для подавления артефактов от дыхательных движений и от сокращения сердца. Визуализируют электроды в трехмерном пространстве.
Недостатком прототипа является необходимость использования трех узкополосных каналов с высокодобротной фильтрацией для каждого электрода для выделения компонент сигналов пропорциональных координатам x, y и z. К таким каналам предъявляются жесткие требования по временной и температурной стабильности полосы пропускания, что сказывается на эксплуатационной надежности устройства в целом. А использование цифровых сигнальных процессоров в начальном этапе обработки приводит к снижению точности. Эти проблемы усугубляются в многоканальных системах определения координат электродов, а при использовании коммутатора для временного разделения регистрации данных с большого количества электродов резко снижается точность определения координат. Так как зондирующие токи имеют в целях обеспечения электробезопасности пациента крайне низкие уровни, регистрируемый сигнал содержит значительную помеху, в несколько раз превышающую уровень полезного сигнала. Избавиться от таких помех возможно при усреднении сигналов на значительном временном интервале, но временное разделение препятствует этому. Еще одной проблемой прототипа является неоднозначность определения координат при использовании переменного тока в качестве зондирующего сигнала, связанная с переменой фазы сигнала в центре поля, что может приводить к периодическому срыву определения координат электрода. Использование импульсов постоянного тока для решения этой проблемы или использование опорного электрода, расположенного на поверхности тела пациента, приводит к снижению точности определения координат. Предлагаемый в прототипе способ компенсации дыхательных движений с помощью низкочастотной фильтрации приводит к сильному запаздыванию реакции устройства на перемещение электрода. Способ не включает операций по построению камеры сердца по последовательности точек координат электродов.
Технический результат заключается в повышении точности и надежности определения координат электродов-катетеров многоканальных устройств.
Указанный технический результат достигается с помощью устройства, содержащего генератор, подключенный к телу пациента, для создания зондирующего электрического поля, расположенный внутри тела пациента катетер с электродами, которые подключены к блоку усилителей через коммутатор, многоканальный блок оцифровки, стробирующие входы которого подключены к тактовому выходу генератора, а сигнальные входы соединены с выходом блока усилителей и сигналами зондирующих частот генератора, последовательно включенные устройство гальванической изоляции, вычислительное устройство для определения координат электродов и монитор для визуализации электродов в виртуальном трехмерном пространстве моделей объектов внутренних структур сердца.
Конструкция усилителя позволяет одновременно усиливать сигналы всех зондирующих частот.
Выходы сигналов зондирующих частот подключены к телу пациента через бифазные буферы предпочтительно во взаимно ортогональных направлениях.
К одному из усилителей через коммутатор подключен контакт опорного электрода, расположенного на поверхности тела пациента.
К электродам катетера через коммутатор могут быть подключены входы и выходы электрокардиостимуляторов, входы и выходы генераторов радиочастотного тока (аблатора) и входы усилителей электрограмм, используемых при диагностике и лечении.
Определение координат электродов-катетеров основано на измерении потенциалов зондирующего электрического поля внутри тела пациента и содержит следующую последовательность операций: создают зондирующее электрическое поле внутри тела пациента предпочтительно во взаимно ортогональных направлениях; вводят в тело пациента катетеры, содержащие электрические контакты электроды для регистрации сигналов зондирующего поля; усиливают и измеряют сигналы зондирующего поля, зарегистрированные в теле пациента с помощью электродов; регистрируют и измеряют сигналы зондирующих частот генератора; вычисляют амплитуды сигналов зондирующего поля раздельно по каждой частоте; вычисляют текущую фазу сигналов зондирующего поля и сигналов зондирующих частот генератора по каждой зондирующей частоте; вычисляют относительную фазу между сигналами зондирующего поля и сигналами зондирующих частот генератора по каждой зондирующей частоте и определяют знак направления координаты; вычисляют трехмерную координату электрода.
Зондирующее поле создают с помощью переменного тока.
Зондирующие частоты равномерно разносят и устанавливают в диапазоне от 2000 до 5000 Гц.
Вычислительное устройство по определению координат электродов осуществляет выполнение последовательности операций по фильтрации узкополосным высокодобротным цифровым фильтром сигналов с выхода блока оцифровки, по фильтрации узкополосным высокодобротным цифровым фильтром сигналов опорных частот с выхода блока оцифровки, по вычислению текущей фазы сигналов опорных и сигнальных каналов, по вычислению фазового сдвига сигналов опорных и сигнальных каналов, по вычислению амплитуды сигнала, по вычислению координат по трем ортогональным направлениям; по визуализации позиции электрода в виртуальном трехмерном пространстве на мониторе.
Алгоритм вычисления амплитуды и фазового сдвига работает таким образом, что амплитуду, текущую фазу сигналов и фазового сдвига вычисляют на каждом шаге тактового выхода генератора зондирующих сигналов.
Вычисляют вектор направления в трехмерном пространстве наконечника катетера, для этого используют результаты вычисления координат дистального и проксимального электродов катетера.
Тактовую частоту устанавливают ниже частот сигналов зондирующего поля.
Изобретение поясняется на фиг.1-4.
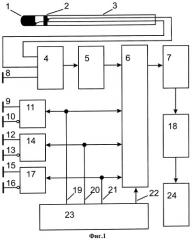
На фиг.1 изображена схема устройства для определения координат электродов внутри тела пациента.
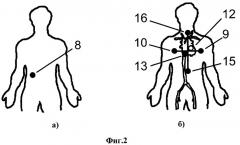
На фиг.2а изображена схема крепления опорного R электрода на теле пациента, а на фиг.2б схема крепления электродов на теле пациента для подключения выходов бифазных буферов генератора частот зондирующих сигналов.
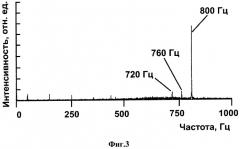
На фиг.3 изображен пример спектрограммы сигнала электрода, расположенного внутри тела пациента.
На фиг.4 представлен трехмерный объект в виртуальном пространстве, построенный из набора точек с определенными и запомненными координатами электродов, которые изображены в виде малых сферических объектов.
Описание устройства. Устройство для определения координат электродов внутри тела пациента содержит: три пары электродов 9-10, 12-13, 15-16, которые подключены к генератору зондирующих сигналов 23 через бифазные буферы 11, 14, 17, и расположены на теле пациента в следующих позициях: 12-й на спине; 13-й на груди; 9-й на левом боку; 10-й на правом боку; 15-й внизу живота со смещением на 30-50 мм влево; 16-й вверху грудной клетки вплотную к шее со смещением на 20-30 мм влево. Катетер 3, расположенный в теле пациента, с электродами 1 и 2, которые соединены с коммутатором 4. Выход коммутатора 4 подключен ко входу усилителей 5. Вход блока оцифровки 6 подключен к выходу усилителей 5 и к выходам 19-21 генератора сигналов зондирующих частот 23. Стробирующий вход блока оцифровки соединен с тактовым выходом генератора сигналов зондирующих частот 23. Выход блока оцифровки через устройство гальванической изоляции 7 подключен к вычислительному устройству 18, к выходу которого подключен блок визуализации 24.
Опорный электрод 8, расположен на теле пациента между электродами 10 и 15 и подключен к коммутатору 4.
Предлагаемое устройство работает следующим образом. На грудную клетку приклеивают пары электродов 9-10, 12-13, 15-16 во взаимно ортогональных направлениях согласно схеме крепления электродов зондирующих сигналов (фиг.2б) и соединяют их с выходами бифазных буферов 11, 14 и 17. Входы бифазных буферов 11, 14 и 17 подключают к выходам 19-21 генератора зондирующих частот. Включают генератор зондирующих частот 23. При прохождении электрического тока через тело пациента, которое обладает резистивным сопротивлением, образуется градиент сформированного электрического поля и в каждой точке пространства внутри тела создается уникальный уровень значений потенциалов поля. Приклеивают на грудную клетку опорный электрод 8 и соединяют его со входом коммутатора 4. В сердце пациента вводят катетер 3 и устанавливают в позиции, определяемой выбранной тактикой лечения и при необходимости перемещают в камерах сердца и сосудах в любой момент времени.
Электроды 1 и 2 катетера 3 подключают ко входу коммутатора 4. Регистрируют с помощью электродов 1 и 2 потенциалы зондирующего электрического поля и через коммутатор 4 передают их на входы усилителей 5. В усилителе 5 сигналы фильтруют и приводят к уровню входного диапазона блока оцифровки 6. Блок оцифровки стробируется сигналом тактовой частоты 22 генератора зондирующих частот 23. С выхода блока оцифровки 6 сигналы передают через устройство гальванической изоляции 7 на вычислительное устройство 18. Вычислительное устройство 18 выделяет из сигнала гармоники зондирующих частот генератора, пропорциональных координатам x, у и z. Затем для сигналов каждой координаты вычисляют значение текущей фазы для определения направления расчетного значения координат. Обрабатывают сигналы: три от генератора зондирующих частот, три сигнальных для каждого электрода и опорный. Методика расчета координат основана на расчете текущей амплитуды и фазы сигнала координат, которые определяются с помощью тригонометрических соотношений (1-3).
где: φ_signi - текущее значение фазы сигнала;
bp_signi - значение сигнала с выхода высоко добротного полосно-пропускающего цифрового фильтра на текущем шаге дискретизации по времени;
bp_signi-1 - значение сигнала с выхода высокодобротного полосно-пропускающего цифрового фильтра на предыдущем шаге дискретизации по времени;
fosc1 - частота зондирующего сигнала;
fs - частота дискретизации;
Аi - амплитудное значение гармоники на частоте зондирующего сигнала, вычисленное на текущем шаге дискретизации.
Амплитуду сигнала по каждой координатной оси вычисляют на каждом шаге дискретизации, что не требует включения в обработку пиковых детекторов и позволяет организовать эффективную фильтрацию шумовой составляющей ошибки определения координаты за счет усреднения данных или с помощью фильтра низких частот. Применение пиковых детекторов для цифровых сигналов осложняется из-за ошибок, связанных с шагом квантования по времени.
Пример спектрограммы регистрируемых устройством сигналов показан на фиг.3. На спектрограмме указаны спектральные линии разностной частоты зондирующих сигналов (720, 760 и 800 Гц).
Для сокращения интенсивности потока данных частоту дискретизации выбирают значительно ниже частоты генераторов. Блок оцифровки должен обеспечить стробируемый режим работы со временем захвата менее 1 мкс.
Вычисленные значения координат электродов используют для построения моделей электродов и объектов внутренних структур сердца виртуального трехмерного пространства, которые визуализируют на мониторе 24. Информация по значениям координат всех электродов, введенных в сердце пациента, позволяет осуществить расчет векторов направления в трехмерном пространстве электродов-катетеров.
Компенсацию артефактов дыхания пациента и сердечных сокращений при определении координат электродов, исходя из предположения их периодичности, производят с помощью алгоритма, содержащего следующую последовательность операций по каждой координате независимо.
Выделяют основную гармонику периодического сигнала артефактов дыхания пациента, для чего подвергают сигнал полосовой фильтрации в диапазоне 0,1…0,3 Гц по уровню -3 дБ. Для выделения основной гармоники периодического сигнала артефактов от сердечных сокращений сигнал подвергают полосовой фильтрации в диапазоне 0,5…4 Гц по уровню -3 дБ. Добротности фильтров выбирают таким образом, чтобы после фильтрации основные гармоники сигналов помехи были синусоподобными. Определяют частоту основной гармоники периодического сигнала помехи fпомехи и целое количество шагов квантования k, попадающих в период сигнала помехи Тпомехи:
,
, где i - номер последовательности шагов квантования сигнала; bpi - значение на выходе полосового фильтра на текущем шаге квантования i; bpi-1 - значение на выходе полосового фильтра на шаге квантования (i-1); bрi-2 - значение на выходе полосового фильтра на шаге квантования (i-2); fs - частота квантования.
Значение частоты основной гармоники помехи подвергают усреднению для увеличения точности вычислений.
Задают интервал L, содержащий целое число N периодов сигнала помехи, предпочтительно не более 60 с.
Определяют среднее значение текущего отсчета сигнала bpi и сигналов из предыдущих периодов принадлежащих одной фазе в пределах интервала L:
Определяют среднее значение сигнала bpi за текущий период помехи длительностью n отсчетов:
Выходное значение алгоритма компенсации определяют как:
outbpi=bpi-sbpi+pbpi
Время адаптации алгоритма зависит от длительности интервала L.
Предложенное устройство реализовано в виде блока в составе комплекса «Биоток 3D», предназначенного для определения координат электродов катетеров в камерах сердца при проведении операций по диагностике и лечению нарушений ритма сердца. Комплекс представляет собой аппаратно-программную систему, работающую совместно с персональным компьютером (ПК), и включает в себя устройство локации и программное обеспечение. Программное обеспечение комплекса из набора позиций электрода с координатами, принадлежащими внутренней поверхности камеры сердца позволяет создавать трехмерные модели камер сердца и визуализировать их на экране монитора. В функции комплекса включены возможности по редактированию моделей объектов внутренних структур сердца путем манипуляций с геометрическими размерами и положением в пространстве; по визуализации распространения фронтов возбуждения миокарда; по визуализации электродов катетеров; по измерению расстояний между позициями электродов, соответствующих запомненным точкам и набора позиций. Пример на фиг.4 демонстрирует изображение модели камеры сердца, полученной с помощью устройства локации электродов. Точки с определенными и запомненными координатами электродов изображены в виде малых сферических объектов.
Комплекс применяется в кардиохирургических отделениях аритмологического профиля лечебных учреждений при проведении малоинвазивных хирургических операциях на сердце методами катетерной аблации.
Устройство локации включает в себя блок генерации сигналов переменного электрического тока для формирования в теле пациента электрического поля по трем ортогональным направлениям и блоки регистрации потенциалов этого электрического поля через соответствующий электрод, при обработке которых в комплексе реализована возможность определения координат позиций электродов.
Электроды-катетеры представляют собой гибкие проводники, которые вводятся в камеры сердца через сосуды. Электроды-катетеры выполняются из изоляционного материала, а на конце электродов и в непосредственной близости устанавливаются электропроводные контакты (электроды). С помощью электродов осуществляется регистрация электрических сигналов из мест расположения в теле пациента.
Блок усилителей выполнен с возможностью пропускания сигналов всех зондирующих частот одновременно. Эта возможность обеспечена использованием широкой полосы пропускания каждого канала регистрации, что позволяет пропускать частоты от всех трех генераторов, дальнейшее разделение осуществляется высокостабильными и высокодобротными программными фильтрами. Применение широкополосных каналов регистрации приводит к сокращению в три раза необходимого количества каналов регистрации. Широкополосный канал регистрации чрезвычайно прост, менее критичен в точности настройки и обеспечении временной и температурной стабильности. Создаются условия простого наращивания количества каналов для реализации многоканальных систем, а использование АЦП для каждого канала является современной тенденцией в схемотехнике, в связи с их высокой точностью и доступностью. Использование широкополосных каналов регистрации позволяет осуществлять регистрацию с помощью одного канала как зондирующих сигналов, так и сигналов электрокардиограммы в диапазоне частот от 0,05 до 1000 Гц.
В устройстве используется один задающий генератор для синтеза частот зондирующих сигналов и тактовой частоты дискретизации. Этим обеспечивается простота настройки блока выделения полезного сигнала и независимость от стабильности частоты генератора поля, так как получается фиксированное и точное соотношение между расчетной частотой дискретизации и расчетной частотой полезного сигнала и задающего генератора, что дает возможность создания высокодобротных цифровых фильтров с крайне узкой полосой пропускания. Использование высокодобротных цифровых фильтров с полосой пропускания не более 1 Гц облегчает выделение полезного сигнала на фоне высокого уровня помех.
Увеличению объема данных, связанному с необходимостью оцифровки высокочастотных сигналов препятствует снижение частоты зондирующего сигнала до 2-5 кГц и применение синхронной оцифровки по каналам регистрации с тактовой частотой в несколько раз меньшей, чем частоты зондирующих сигналов, что позволяет сократить объем вычислений использованием в дальнейшей обработке в вычислениях разностных частот. Разностные частоты fΔi определяются как разница между частотами сигналов генератора зондирующих сигналов fGi и частотой тактового сигнала fS, умноженного на целое число n по формуле:
fΔi=fGi-n·fS, где i - соответствует номеру частоты зондирующего сигнала.
Для сокращения интенсивности потока данных тактовую частоту выбирают значительно ниже частоты зондирующих сигналов. Эффективная работа достигается применением синхронной работой АЦП со временем захвата менее 1 мкс.
В качестве зондирующих сигналов используется переменный электрический ток. Выходы сигналов зондирующих частот через бифазные буферы с помощью электродов подключены к телу пациента по возможности во взаимно ортогональных направлениях. Переменные токи дают возможность снизить уровни зондирующего тока до уровня допустимых токов утечки на пациента и использовать высокодобротные цифровые фильтры для выделения сигналов по координатам с увеличенной точностью. Устранение неоднозначности в определении координат при использовании переменного электрического тока в качестве зондирующего электрического поля осуществляется вычислением текущей фазы сигнала относительно фазы зондирующего сигнала. В качестве опорного электрода может быть подключен один из внутрисердечных электродов, имеющих устойчивую фиксацию (например, один из электродов в коронарном синусе). При использовании опорного электрода, расположенного внутри сердца, может быть уменьшено влияние дыхания на точность определения координат.
Изолирующее устройство, включенное между частью, имеющей контакт с сердцем пациента и другими частями устройства, которые могут иметь контакт с сетью 220В 50 Гц, обеспечивает ограничение уровня синфазных токов и, как следствие, снижение уровня синфазной помехи, что дополнительно приводит к увеличению точности определения координат. Изолирующее устройство включено между АЦП и блоком вычисления координат для передачи оцифрованных значений, регистрируемых с внутрисердечных электродов. Место выбора включения изолирующего устройства обусловлено помехоустойчивостью цифровых каналов передачи информации. В качестве цифрового канала передачи данных от изолирующего устройства к блоку вычисления координат используется протокол USB-2.
Коммутатор используется для подключения электродов катетеров к входам усилителей и для подключения электродов к другому электрофизиологическому оборудованию: регистраторам электрограмм, электрокардиостимуляторам, радиочастотному деструктору.
Для вычисления координат позиций электродов, запоминания их в памяти компьютера, визуализации электродов и сформированных программой объектов внутренних структур сердца используется ПК с процессором PENTIUM 4, работающим на тактовой частоте не менее 2,8 ГГц под управлением операционной системы Windows ХР, с видеокартой с графическим процессором, имеющей объем видеопамяти не менее 128 МБ. Визуализация осуществляется с помощью монитора с разрешением 1600×1280 пикселей и с частотой обновления экрана не менее 60 Гц. Связь устройства локации с ПК осуществляется по протоколу USB-2 по кабелю, подключаемому к типовому порту USB ПК.
Устройство изоляции может быть реализовано в виде оптопары, оптического кабеля или радиоканала. Электропитание изолированной части может быть осуществлено с помощью батареи или DC-DC преобразователя с высоким пробивным напряжением (~4000 В) и низкой проходной емкостью (не более 100 пФ).
Результаты измерений параметров устройства
Постоянный ток в цепи пациента блока генератора, протекающий через любой электрод не более 0,01 мА.
Переменный ток (зондирующий) в цепи пациента блока генератора, протекающий через любой электрод не более 0,1 мА.
Чувствительность каналов регистрации не менее 0,3 мкВ на 1 мм, что на порядок превосходит значение прототипа. Точность определения координат предложенного устройства оказалась настолько высокой, что стало возможным снизить амплитуду и соответственно частоту зондирующих сигналов до уровня 2,5-3 кГц без влияния на регистрацию внутрисердечных электрограмм.
Допустимое относительное отклонение вычисления расстояний между запомненными точками, в пределах ±1%.
Эффективность технического решения, достоверность и точность достигнутых результатов реализации подтверждается проверкой в клинических условиях.
Устройство локации электродов внутри тела пациента использовалось во время проведения катетерных операций на проводящей системе сердца, в операционной отделения сосудистой хирургии клиник ГОУ ВПО «Сибирский государственный медицинский университет» Росздрава, г.Томск. Всем пациентам стандартно по методике Сельдингера через бедренные и подключичные сосуды вводились диагностические многополюсные электроды и под рентгеноскопическим и электрофизиологическим контролем устанавливались в стандартные позиции: коронарный синус, область пучка Гиса, правое и левое предсердия, правый и левый желудочки. После этого через бедренные сосуды по Сельдингеру вводился аблационный электрод и под рентгеноскопическим контролем устанавливался в полостях сердца. С этого момента проводился нефлюороскопический контроль за положением аблационного электрода при помощи устройства.
В ходе операций проводилась оценка адекватной локации в операционном поле электродов аблационного и диагностических катетеров путем визуального контроля геометрии построенных камер сердца по запомненным позициям электродов, а также путем обработки захваченных видеокадров рентгеновского изображения и сравнением с известными расстояниями между полюсов электродов. С использованием устройства прооперировано 14 пациентов с различными нарушениями сердечного ритма. Устройство использовалось для построения объемного изображения полостей сердца и отображения в них положения и передвижения диагностических и аблационных катетеров с регистрацией и запоминанием любого количества точек.
Всего построено 75 камер сердца. В среднем на построение правого и левого предсердий потребовалось 30 точек; легочных, верхней и нижней полых вен, восходящей аорты - по 5-6; коронарного синуса - 15; левого и правого желудочков - по 20; легочного ствола и легочных вен - по 10.
Устройство продемонстрировало в работе высокую надежность и достоверность определения положения как диагностических, так и аблационных электродов, а также характер их перемещения в полостях сердца. Устройство позволяет выбирать опорный электрод по усмотрению оператора. Абсолютное отклонение в определении координат оказалось менее 2 мм, а визуально различимое смещение электрода составило менее 0,1 мм. Такая точность определения координат является приемлемой для прецизионного совмещения лечебного электрода с аномальной зоной миокарда.
Устройство локации электродов показало высокую надежность и отличное качество визуализации электродов, минимальное искажение при движении электродов и дыхательных движениях. Позиции электродов-катетеров определялись точно, что было подтверждено данными рентгеноскопии. В период проведения испытаний отказов в работе устройства обнаружено не было.
Литература
1. [Электронный ресурс]. - Режим доступа: - http://www.electropulse.ru/ru/medical-methods/for-patients/?PHPSESSID=a698d1c6708b569716e597e7854ba6c9/, свободный.
2. Ежова И.В., Ревишвили А.Ш., Меликулов А.Х., Рзаев Ф.Г., Давтян К.В. Успешная катетерная аблация пациентки с непароксизмальной атриовентрикулярной re-entry тахикардией и множественными дополнительными предсердно-желудочковыми соединениями с «медленными» свойствами // Вестник аритмологии. - 2001. - №22. - С.81-83.
3. Ревишвили А.Ш., Рзаев Ф.Г., Джетыбаева С.К. Электрофизиологическая диагностика и интервенционное лечение сложных форм нарушений ритма сердца с использованием системы трехмерного электроанатомического картирования // Вестник аритмологии. - 2004. - №34. - С.32-37.
4. Patent 6259941 United States, Intravascular ultrasound locating system / Chia, et al. July 10, 2001.
5. Бондарчук С.С., Ваизов В.Х., Комков А.Г., Оферкин А.И., Федотов Н.М., Шелупанов А.А. Технология оперативной пространственной визуализации структур сердца // Информационные технологии. - 2000. - №2. - С.38-41.
6. Patent 6516807 United States, System and methods for locating and guiding operative elements within interior body regions / Panescu D., at al., February, 11, 2003.
7. Patent 5983126 United States, Catheter location system and method / Wittkampf F., November, 9, 1999.
1. Устройство слежения за электродами внутри тела пациента, содержащее генератор зондирующих частот, подключенный через три независимых бифазных буфера к соответствующим трем парам электродов зондирующих сигналов, катетер, выполненный с возможностью установки внутри тела пациента и содержащий электроды, подключенные к блоку усилителей через коммутатор, опорный электрод, подключенный к блоку усилителей через коммутатор, вычислительное устройство для определения координат электродов, к выходу которого подключен блок визуализации результатов определения координат электродов, отличающееся тем, что блок синхронной многоканальной оцифровки подключен стробирующим входом к тактовому выходу генератора зондирующих частот, а его сигнальные входы соединены с выходом блока усилителей и с выходами генератора зондирующих частот, устройство гальванической изоляции, входы которого соединены с выходами блока синхронной многоканальной оцифровки, а выходы соединены со входом вычислительного устройства по определению координат электродов.
2. Устройство по п.1, отличающееся тем, что блок усилителей выполнен с возможностью пропускания сигналов всех зондирующих частот одновременно.
3. Устройство по п.1, отличающееся тем, что коммутатор имеет входы для соединения электродов с входами и выходами электрокардиостимуляторов, аблаторов и регистраторов электрокардиограмм.
4. Способ определения координат электродов внутри тела пациента путем закрепления на теле пациента во взаимно ортогональных направлениях трех пар электродов зондирующих сигналов, формир