Способ и система для создания контролируемых неоднородностей структуры и механических напряжений в хрящевых тканях (варианты), а также способ введения лекарственных и других полезных веществ для контролируемой активации регенерационных процессов (варианты)
Иллюстрации
Показать всеГруппа изобретений относится к медицине и может быть применима для модификации хрящевой ткани для стимуляции ее регенерации. Формируют в хрящевой ткани по меньшей мере один канал доступа. Вводят в, по меньшей мере, один сформированный канал доступа текучую среду, формирующую, по меньшей мере, один пузырек текучей среды. Вводят в, по меньшей мере, один сформированный канал доступа по меньшей мере один источник электромагнитного излучения, позиционируя его таким образом, чтобы, по меньшей мере, один образовавшийся пузырек находился в зоне воздействия электромагнитного излучения, по меньшей мере, одного источника электромагнитного излучения. Активируют указанный, по меньшей мере, один источник электромагнитного излучения. Группа изобретений позволяет вызвать рост хрящевой ткани для замещения патологически измененных структур. 5 н. и 34 з.п. ф-лы, 4 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области медицины, а именно к методам и устройствам для лечения заболеваний хрящевых тканей, в том числе межпозвонковых дисков (МПД), которые подвергаются дегенеративным изменениям при остеохондрозе и нестабильности позвоночника, и суставных хрящей, страдающих при остеоартрозах, травматических повреждениях и т.д.
Уровень техники
Заболевания хрящевых тканей относятся к числу высоко распространенных в человеческой популяции.
Известно, что питание таких хрящевых тканей, как гиалиновый хрящ суставных поверхностей и замыкательных пластинок МПД, волокнистый хрящ фиброзного кольца и ткань пульпозного ядра МПД, ввиду отсутствия в них кровеносных сосудов, осуществляется преимущественно путем диффузии. Важную роль при этом играют микропоры, являющиеся своеобразными каналами, по которым происходит транспорт тканевой жидкости, представляющей собою водный раствор солей и питательных веществ.
Особенно важны микропоры для питания тканей МПД. J. M Huyghe et al. (Huyghe et al., 2003) экспериментальным путем показали различие между неионизированной внутрифибриллярной и ионизированной межфибриллярной пористыми тканями фиброзного кольца МПД. Для описания изменений механических свойств гиалинового хряща, фиброхрящевой и фиброзной ткани была предложена пороэластическая модель и разработан соответствующий математический аппарат (Laible et al., 1994; Laible et al., 1993; Loboa et al., 2003; Riches et al., 2002). Результаты моделирования (Loboa et al., 2003) показали, что периодически воздействующее давление жидкости и растягивающее напряжение регулируют синтез протеогликанов и фибриллогенез коллагена, сборку волокон и формирование поперечных сшивок, упорядочивают ориентацию волокон, вызывая изменения проницаемости ткани, модуля сжимаемости и модуля упругости. Пористость определяет также степень гидратации ткани диска и, как следствие, ее электропроводность (Yong Gu et al., 2002).
При дегенеративных изменениях МПД и гиалиновых суставных хрящей структура межклеточного матрикса резко изменяется, что приводит к дезорганизации системы микропор и, как следствие, ухудшению питания и гибели клеток. Известно, что при дегенеративных изменениях в МПД коэффициент диффузии существенно снижается (Antoniou et al., 2004; Chiu et al., 2001; Kealey et al., 2005; Kerttula et al., 2001; Nguyen-minh et al., 1998).
Образование микропор в результате внешних воздействий улучшает питание клеток дистрофически измененной ткани и способствует активации регенерационных процессов.
Однако формирование слишком крупных пор приводит к уменьшению механической прочности тканей и может способствовать прорастанию кровеносных сосудов в хрящевые ткани. Функциональная дезинтеграция ткани, обусловленная ее структурной и метаболической неоднородностью, может увеличивать вероятность развития злокачественных опухолей (хондробластом) и повышать опасность фиксации опухолевых клеток и роста метастазов. Поэтому нужны микропоры с определенным распределением по размерам.
Радиографическое сканирование позвоночника, выполняемое в определенной проекции, в 50% случаев позволяет выявить в МПД области, содержащие газ (Goobar et al., 1987).
В настоящее время известны многочисленные способы оказания терапевтического воздействия на хрящевую ткань, и в частности на МПД, связанные с воздействием определенными видами энергии на определенные зоны хрящевой ткани.
Так в патенте США 6,503,269 раскрыт способ управляемого нагрева внутренней поверхности фиброзного кольца межпозвонкового диска, что приводит к уничтожению нервных окончаний в фиброзном кольце, развившихся после его повреждения и являющихся причиной так называемой "дискогенной боли". Способ содержит этапы, на которых формируют канал доступа через фиброзное кольцо МПД, вводят в МПД источник света, активируют источник света, излучающий диффузный свет, измеряют оптическими способами температуру ткани в непосредственной близости от источника света и меняют интенсивность света, излучаемого из источника, в соответствии с измеренной температурой. Облучение внутренней поверхности фиброзного кольца приводит к его нагреванию и уничтожению нервных окончаний.
В патенте США 5,571,147 раскрыт еще один способ уничтожения нервных окончаний в МПД, являющихся причиной "дискогенной боли", заключающийся в том, что формируют канал доступа, через который во внутреннюю часть МПД вводят оптоволокно. Электромагнитное излучение, подаваемое от источника через оптоволокно, поглощается в МПД, что приводит к нагреванию МПД и гибели нервных окончаний.
Недостатки перечисленных выше способов заключаются в следующем: а) терапевтическое воздействие выполняется после прорастания нервных окончаний, т.е. на поздней стадии патологического процесса; б) в результате терапевтического воздействия выполняется только уничтожение нервных окончаний, без оказания терапевтического воздействия непосредственно на поврежденную хрящевую ткань; в) поскольку для уничтожения нервных окончаний требуется нагревать большой объем ткани МПД до высокой температуры, существует высокая вероятность повреждения хрящевой ткани МПД и последующего повторного прорастания нервных окончаний.
В патенте США 6,733,496 раскрыты способ и устройство для модификации МДП, в частности, для лечения трещин в фиброзном кольце МДП, путем нагревания участков ткани в непосредственной близости от участка ткани с патологическими изменениями, причем в одном из вариантов осуществления способа предусмотрена доставка энергии (в том числе электромагнитной энергии и энергии ультразвуковых колебаний) к патологически измененному участку ткани МДП в количестве, не вызывающем удаления и/или испарения материала диска в непосредственной близости от устройства доставки энергии. В одном из вариантов осуществления в диск доставляется количество энергии, достаточное для изменения его биохимических и/или биомеханических свойств без структурной деградации ткани. Недостаток такого способа терапевтического воздействия заключается в том, что на хрящевую ткань оказывается непрерывное воздействие, приводящее к существенному изменению свойств хрящевой ткани, что создает высокий риск осложнений.
Таким образом, все известные в настоящее время способы терапевтического воздействия на хрящевую ткань, связанные с воздействием на хрящевую ткань определенными видами энергии, и, в частности, когерентным и некогерентным электромагнитным излучением, имеют своим недостатком то, что на хрящевую ткань оказывается непрерывное, относительно сильное воздействие, что дает кратковременный терапевтический эффект. Например, после физического разрушения нервных окончаний в МПД при нагревании участка ткани исчезает дискогенная боль, однако впоследствии боль может возобновиться вследствие образования грануляционной ткани в подвергаемой терапии области хряща, прорастания в ней сосудов и нервных окончаний.
Ни один из известных в настоящее время способов не приводит к замещению патологически измененных участков хрящевой ткани, такой как МПД или суставной хрящ, молодой (новообразованной) хрящевой тканью, т.е. не вызывает регенерации поврежденных или утраченных структур.
В способе согласно настоящему изобретению используется слабое, практически точечное воздействие электромагнитным излучением на хрящевую ткань, причем воздействие производится в виде нескольких серий импульсов. Такое воздействие приводит к возникновению в областях, прилегающих к области приложения воздействия, процессов, вызывающих активацию роста молодой (новообразованной) хрящевой ткани, которая замещает патологически измененные структуры МПД.
Способ по настоящему изобретению относится к лазерной реконструкции хрящевой ткани, в том числе межпозвонковых дисков, и является принципиально новой минимально инвазивной процедурой . В основу этого способа положен эффект регенерации тканей межпозвонкового диска под действием неразрушающего лазерного излучения.
Метод лазерной реконструкции дисков (ЛРД) является принципиально новым способом лечения больных с дегенеративными заболеваниями межпозвонковых дисков. В основе метода лежит обнаруженное в 1999 году явление регенерации ткани пульпозного ядра межпозвонкового диска под действием неразрушающего лазерного излучения. Процедура ЛРД подразумевает пункцию межпозвонкового диска, подведение лазерного излучения через иглу в область пульпозного ядра и лазерное облучение данной области с целью создания условий для запуска репаративных процессов в биологической ткани. Также к указанной области пульпозного ядра может прикладываться (например, через иглу) периодическое механическое воздействие. Лечебный эффект достигается путем создания пространственно-временных неоднородностей температуры и механических напряжений в хрящевой ткани путем ее нагрева лазерным излучением, модулированным в пространстве и во времени. Лазерное воздействие в режиме, применяющемся при ЛРД, не сопровождается разрушением и/или удалением части межпозвонкового диска, не приводит к некрозу тканей диска и не повреждает прилежащие к диску нервные и сосудистые структуры позвоночника.
Процедура пункционной лазерной реконструкции дисков проводится под местной анестезией с использованием рентген-телевизионного контроля при полном сознании пациента. Сама процедура пункционной ЛРД не требует специальной подготовки пациента и, поэтому, может проводиться на амбулаторной основе.
Преимуществами лазерного метода являются миниинвазивность, отсутствие наркоза, амбулаторный характер, простота и дешевизна лазерной процедуры.
Основное отличие способа настоящего изобретения от ранее разработанных способов лечения заключается в целенаправленном формировании пузырьков текучей среды в небольшом объеме подвергаемой терапии области и воздействии на них периодическим (например, импульсно-модулированным) электромагнитным (ЭМ) излучением. Электромагнитное излучение может быть доставлено в подвергаемую терапии область любым способом, известным в данной области техники, например, через введенный в подвергаемую терапии область ткани световод. Необходимо отметить, что характерный размер источника излучения (например, диаметр световода) составляет от примерно 0,2 мм до примерно 1,0 мм, при этом длину волны и интенсивность ЭМ-излучения подбирают таким образом, что по существу вся энергия ЭМ-излучения поглощается в малой окрестности источника ЭМ-излучения, далее в настоящем описании называемой областью приложения воздействия (менее 2 мм3, предпочтительно, менее 1 мм3), т.е. на ткань оказывается по существу точечное (локальное) воздействие. Другим принципиальным отличием способа настоящего изобретения от ранее разработанных способов лечения является то, что ЭМ-воздействие является импульсным. В отличие от ранее использовавшегося постоянного воздействия ЭМ-излучением на хрящевую ткань, что фактически сводилось к ее нагреву до определенной температуры, способ настоящего изобретения использует импульсное ЭМ-излучение, которое в результате комплексного взаимодействия с пузырьками текучей среды и тканью в облучаемой области приводит к возникновению в ткани акустических волн, потоков вещества в хрящевой ткани, при этом пузырьки текучей среды подвергаются дроблению (Фиг.1,А-1,Е) и перемещаются внутри хрящевой ткани, формируя новые и прочищая уже имеющиеся поры. Вышеперечисленные эффекты оказывают воздействие на ткань, находящуюся вне области ткани, подвергаемой облучению, приводя к ее модификации и замещению патологически измененных участков хрящевой ткани новообразованной хрящевой тканью.
Согласно способу настоящего изобретения, поры образуются при перемещении и слиянии газовых пузырьков в ткани в процессе локального лазерного воздействия. Размер пор контролируется с использованием известных методик, например акустических, спектроскопических и иных, позволяющих оценить факт возникновения пор, изменения состояния ткани и т.д.
Локальное периодическое лазерное воздействие вызывает колебательное давление и перемещение среды вследствие неоднородного нагрева небольших областей, причем размеры зон, в которых происходит это механическое воздействие, намного превышают размеры зон теплового воздействия излучения.
Кроме того, приложение дополнительного механического воздействия, например, ультразвуковых колебаний, или вибрации отдельных элементов инструмента (иглы), приводит к усилению эффекта механического воздействия, проявляющегося в активации клеток, прочищению микропор, улучшению питания клеток и удалению продуктов их метаболизма.
Принципиальным отличием предлагаемого способа от известных из уровня техники является контролируемость воздействия и предсказуемость результатов, которые достигаются путем выбора и поддержания определенных соотношений между частотами колебаний и амплитудами давления, размерами образующихся микропузырьков, с одной стороны, и характерными размерами микропор в хрящевой ткани, характерными размерами областей модификации ткани, с другой стороны.
Качественные соотношения между параметрами лазерного воздействия и характеристиками давления, пор, параметрами движения среды (скорости движения, характерных расстояний перемещения) следующие.
Характерные размеры микропор в фиброзном кольце хрящевого диска составляют 100 нм.
Размеры пузырьков предпочтительно должны быть несколько больше этих размеров, но иметь тот же порядок величины. (Слишком большие пузыри не эффективны для прочищения существующих и создания новых микропор.)
Периодичность лазерного воздействия предпочтительно должна соответствовать характерным частотам активации клеток (в диапазоне от 0,1 до 5 Гц). Промежутки между сериями облучения должны быть достаточны для стабилизации доменной структуры электрических диполей воды в хрящевой ткани, которая составляет для тканей межпозвонковых дисков человека от 5 секунд до 2 минут.
Размеры областей повреждения хрящей в межпозвонковых дисках и суставах обычно составляют несколько миллиметров. Расстояния, на которые происходят перемещения среды должны быть в диапазоне 1-10 миллиметров, что соответствует характерным размерам зон лечебного воздействия хрящевых тканей.
Настоящее изобретение решает перечисленные выше задачи, предоставляя способ реконструкции хрящевой ткани, включающий в себя этапы на которых:
формируют по меньшей мере один канал доступа к по меньшей мере одной области приложения воздействия, расположенной внутри области модификации хрящевой ткани;
формируют внутри указанной по меньшей мере одной области приложения воздействия по меньшей мере один пузырек текучей среды;
вводят в указанную по меньшей мере одну область приложения воздействия через указанный по меньшей мере один канал доступа по меньшей мере один источник электромагнитного излучения (ЭМИ);
активируют указанный по меньшей мере один источник электромагнитного излучения,
при этом электромагнитное излучение имеет параметры, позволяющие формировать в указанной по меньшей мере одной области приложения воздействия поле электромагнитного излучения, оказывающее указанное воздействие.
В одном из вариантов осуществления настоящего изобретения электромагнитное излучение является периодически модулированным и имеет следующие параметры:
- длина волны ЭМ-излучения от примерно 0,6 мкм до примерно 2,2 мкм, наиболее предпочтительно примерно 1,56 мкм;
- средняя мощность ЭМ-излучения от примерно 0,5 Вт до примерно 5 Вт, предпочтительно от примерно 1 Вт до примерно 2 Вт;
- длительность импульса от примерно 1 мс до примерно 3000 мс, предпочтительно от примерно 50 мс до примерно 300 мс;
- частота следования импульсов в серии от примерно 0,1 Гц до примерно 100 Гц, предпочтительно от примерно 1 Гц до примерно 20 Гц;
- интервал между сериями импульсов от примерно 5 с до примерно 60 с, предпочтительно от примерно 2 с до примерно 5 с;
- длительность серий импульсов составляет от примерно 5 с до примерно 60 с;
- количество серий импульсов составляет от примерно 1 до примерно 10.
В одном из вариантов осуществления настоящего изобретения источник электромагнитного излучения представляет собой световод с диаметром от примерно 0,1 мм до примерно 2 мм, предпочтительно примерно 0,6 мм.
В одном из вариантов осуществления настоящего изобретения этапы способа применяют к нескольким областям приложения воздействия хрящевой ткани, причем указанное применение может выполняться последовательно, параллельно либо последовательно-параллельно, при этом указанные области могут быть различными, пересекающимися или совпадающими.
В одном из вариантов осуществления настоящего изобретения способ реконструкции хрящевой ткани дополнительно включает в себя этапы, на которых в хрящевой ткани, подвергаемой реконструкции, возбуждают механические колебания при помощи по меньшей мере одного дополнительного источника механических колебаний
Канал доступа может быть сформирован при помощи введения в хрящевую ткань пустотелой иглы, причем источником механических колебаний является игла, формирующая канал доступа, и/или излучатель, введенный в указанную иглу.
Необходимо отметить, что хотя в настоящем описании в качестве иллюстративного примера раскрыт вариант осуществления способа, при котором текучая среда, формирующая пузырек, источник ЭМ-излучения и источник механических колебаний вводят в подвергаемую лечению область хрящевой ткани через один канал доступа, настоящее изобретение также охватывает варианты осуществления, в которых указанные операции выполняют через различные каналы доступа.
Настоящее изобретение также предоставляет систему, обеспечивающую реализацию способа модификации хрящевой ткани.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
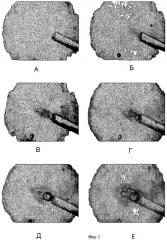
Фиг.1,А-1,E иллюстрируют образование и дробление пузырька текучей среды в хрящевой ткани под действием лазерного излучения.
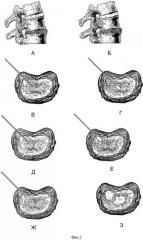
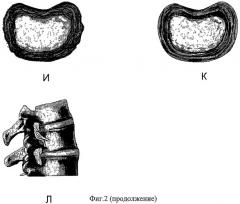
Фиг.2,А-2,Л иллюстрируют развитие гиалинового хряща после проведения процедуры ЛРД.
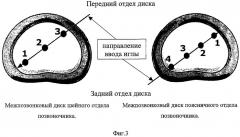
Фиг.3 - зоны облучения межпозвонковых дисков для шейного и поясничного отделов позвоночника.
Фиг.4 - блок-схема системы, позволяющей выполнять процедуру ЛРД.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Механизмы лечебного воздействия
Видеосъемка зоны воздействия (см. Фиг.1,А-Е) лазерного излучения на пульпозное ядро показывает следующее:
А. При всех используемых режимах лазерного воздействия на пути рядом с оптическим волокном в процессе облучения начинает образовываться темная зона, причем степень затемнения растет со временем облучения.
Б. В результате облучения меняется структура микропузырьков (размеры пузырьков уменьшаются, а их количество увеличивается).
В. Наблюдается движение пузырьков (характер движения зависит от параметров облучения). Наблюдаемое при видеосъемке затемнение нагреваемой лазером зоны в прошедшем свете, т.е. увеличение светорассеяния, является следствием уменьшения средней плотности пульпозного ядра вследствие а) образования пузырьков и б) нагрева пульпозного ядра.
Г. Наблюдается колебательное (обратно-поступательное) движение среды (жидкости) в области воздействия.
Основной механизм лечебного воздействия заключается в улучшении питания клеток за счет образования (восстановления) микропор и каналов в хрящевой ткани. Образование новых и/или прочистка, раскупоривание имеющихся, но забитых микропор происходит в гиалиновой пластине, которая является связующим звеном между хрящевой тканью МПД и кровеносной системой.
При естественных механических нагрузках жидкость выдавливается из МПД, при этом положительные ионы (кальция и натрия) уходят из МПД, но натрий движется быстрее, а кальций отстает и накапливается в порах. Микропоры могут быть забиты солями кальция, поэтому может быть полезным добавление веществ, например физиологического раствора, которые растворяют соли кальция и способствуют прочищению микропор.
Второй механизм связан с активацией (или спецификацией стволовых) клеток путем механического воздействия, в частности волнами напряжений, возникающими при неоднородном нагреве, волнами, возникающими при согласованных крутильных колебаниях электрических диполей воды в хрящевом матриксе, или волнами напряжений (давления), возникающими при введении в хрящевой матрикс (и движении по нему) микропузырьков газа или жидкости.
Третий механизм лечебного воздействия связан с воздействием на нервные окончания. Это может быть:
(а) дезактивация нервных окончаний термическим, механическим или химическим воздействием,
(б) механическое удаление или уменьшение объема давящего на нерв объекта, например, грыжи, секвестра мышцы, связки (путем его деформации, устранения патологического набухания путем уменьшения застойных явлений),
(в) долговременный эффект за счет изменения макроархитектуры диска путем его реконструкции (регенерации новой ткани), устранения нестабильности.
Стадии процедуры реконструкции хрящевой ткани
В общем случае способ реконструкции хрящевой ткани включает следующие этапы:
1. Введение заданного количества текучей среды и, при необходимости, организация возможности ее отвода (оттока).
2. Необязательное измерение динамики давления во время и после введения текучей среды.
При этом:
- если нет разрывов диска (а точнее фиброзного кольца), то во время введения текучей среды в диск внутридисковое давление возрастает, а после введения текучей среды давление в диске не изменяется (или снижается незначительно);
- если в диске имеются разрывы, то во время введения текучей среды в диск внутридисковое давление не изменяется или слабо возрастает, а после введения текучей среды давление быстро снижается до первоначального уровня.
Такое различное поведение давления (его динамика) определяет характер повреждений диска и, следовательно, выбор параметров воздействия.
3. Выбор начальных параметров воздействия.
4. Введение и позиционирование источника воздействия.
5. Измерение характеристик модификации хрящевой ткани (деформации, напряжения, температуру, структурные изменения).
6. Осуществление воздействия, приводящего к изменению поля механических напряжений с одновременным измерением характеристик модификации хрящевой ткани.
7. Корректирование параметров воздействия на основе показаний измерений, в частности, выключение (остановка) воздействия.
8. Перемещение источника воздействия в новое положение и повторение стадий 6 и 7.
Параметры воздействия
Тип воздействия (лазерное излучение, механические колебания, акустические волны или их комбинация).
Длительность импульса.
Частота следования импульсов.
Энергия импульсов (импульсная мощность воздействия).
Продолжительность одной серии (число импульсов в серии).
Длительность интервала между сериями.
Общая продолжительность воздействия (число серий).
Состав (фазовый, химический) текучей среды (в том числе доля жидкой и газообразной фаз, стволовые клетки и т.д.).
Давление при введении текучей среды.
Размеры области воздействия.
Расстояние между соседними областями воздействия.
Наличие (или отсутствие) и параметры (скорость, давление) отсоса текучей среды.
Приложение внешнего воздействия в области приложения воздействия
Способ реконструкции хрящевой ткани в общем случае включает в себя следующие основные этапы:
- формирование канала доступа к области приложения воздействия;
- введение специальных веществ (газов, жидкостей или их смесей, либо другой текучей среды);
- внешнее воздействие (воздействие лазерным излучением, механическими колебаниями), причем этот этап может выполняться одновременно, до или после по отношению к этапу введения либо как любая комбинация вышеперечисленных вариантов.
Воздух (или другая текучая среда) доставляется в пульпозное ядро межпозвоночного диска или в суставной хрящ через полую иглу, формирующую канал доступа к области приложения воздействия.
Например, при введении иглы в хрящевую ткань МПД или сустава в ее просвете находится мандрен, который затем извлекают из иглы, а вместо него в иглу помещают световод. Световод как поршень доставляет в ткань (пульпозное ядро МПД или суставной хрящ) некоторое количество воздуха (или другой текучей среды). В этот момент пузырек воздуха располагается вблизи конца иглы.
Внешнее воздействие (например, воздействие лазерным излучением, механическими колебаниями) провоцирует отрыв пузырька воздуха от конца иглы. Пузырек воздуха, введенный в МПД или суставной хрящ, перемещается на некоторое расстояние от иглы. Однако это перемещение осуществляется очень медленно (его скорость лимитирована размером пузырька).
Однако при последующем внешнем воздействии (например, облучении когерентным или некогерентным светом) запускаются физико-химические процессы, обусловливающие более эффективное распространение воздуха в хрящевой ткани.
Энергия лазерного излучения, преимущественно, поглощается жидкостью, содержащейся в межклеточном матриксе хрящевой ткани. Под действием лазерного облучения эта жидкость, неоднородно расширяясь и сжимаясь, разделяет воздушный пузырек на множество более мелких пузырьков. Такие микропузырьки периодически увеличиваются и уменьшаются в объеме, а также совершают поступательное перемещение по градиенту температуры в менее нагретые области (в направлении от конца световода), что приводит к распространению воздуха в подвергающейся описываемому воздействию ткани и увеличивает амплитуду волн давления (см. Фиг.1,А-1,С).
При воздействии лазерного облучения в первичном пузырьке текучей среды (например, воздушном пузырьке) могут активироваться реакции свободнорадикального окисления молекул кислорода. При возникновении активных форм кислорода, а также в результате электростатических взаимодействий с заряженными молекулами межклеточного матрикса поверхность воздушных микропузырьков может приобретать электрический заряд. Благодаря электростатическим взаимодействиям поверхности микропузырьков с рядом сигнальных молекул увеличивается активная поверхность межклеточных рецепторных взаимодействий и активизируется информационный метаболизм ткани.
Происходящее связывание свободных радикалов кислорода с ионизированными матриксными молекулами приводит к тому, что поверхность воздушного пузырька становится электрически нейтральной, что, во-первых, предотвращает перекисное окисление липидов клеточных мембран и, во-вторых, облегчает транспорт микропузырьков и молекул, взаимодействующих с их поверхностью через матрикс.
Необходимо отметить, что пузырьки (микропузырьки) в области приложения воздействия могут быть сформированы различными способами. Например, как указывалось выше, пузырьки могут образовываться в результате дробления под действием ЭМ-излучения первичного пузырька текучей среды (например, воздуха или другого газа), введенного в область приложения воздействия через канал доступа. Микропузырьки также могут образовываться при помощи введения в область приложения воздействия композиции, способствующей формированию пузырьков текучей среды, например в результате дегазации текучей среды, введенной в область приложения воздействия, в частности под действием ЭМ-излучения. Такой механизм образования микропузырьков проиллюстрирован на Фиг.1,А-1,Е. При этом возможно введение по сформированному каналу доступа соединения (композиции), способствующего формированию пузырьков, например, под действием электромагнитного излучения. Помимо вышеперечисленных способов, также возможно применение любых других способов формирования микропузырьков в среде, известных в данной области техники, а также любой их комбинации.
Таким образом, контролируемое внешнее воздействие (в частности, с помощью модулированного лазерного излучения) на пульпозное ядро и внутреннюю треть фиброзного кольца межпозвоночных дисков (либо на гиалиновый суставной хрящ), вызывающее формирование газовых областей, приводит к:
- измельчению первичных (доставленных с помощью иглы) пузырьков текучей среды (например, воздушных пузырьков), а затем к образованию, поступательному и колебательному движению микропузырьков;
- образованию микропористой структуры хряща,
- ускорению диффузии веществ;
- увеличению амплитуды волн давления;
- активации биосинтетических процессов в клетках хрящевой ткани в результате адекватной стимуляции механочувствительных внутриклеточных структур;
- высвобождению внутриклеточного Ca2+ и, как следствие, обновлению и "омоложению" клеточной популяции в результате интенсификации апоптотической гибели (Doty et al., 1999; Hashimoto et al., 1998) высокоспециализированных хондроцитов и пролиферации "молодых" хондрогенных клеток и хондробластов;
- увеличению функционально активной поверхности клеточных мембран и усилению межклеточных взаимодействий;
- включению механизмов аутокринной регуляции функциональной активности клеток в ответ на изменение физико-химических и биологических свойств клеточного микроокружения (продукции клетками биологически активных веществ, оказывающих регуляторное воздействие на клетки той же популяции в соответствии с изменениями в микроокружении клеток);
- инактивации нервных структур, возникающих в фиброзном кольце МПД и суставном хряще при дегенеративных и травматических повреждениях (Brown et al., 1997; Coppes et al., 1997; Freemont et al., 1997; Freemont et al., 2002; Lundon and Bolton, 2001; Roberts et al., 1995) и обеспечивающих передачу патологической болевой импульсации.
Совокупность перечисленных процессов обусловливает замещение патологически измененных участков МПД или суставного хряща молодой (новообразованной) хрящевой тканью, т.е. вызывает регенерацию поврежденных или утраченных структур.
Замещение поврежденных участков МПД молодым гиалиновым хрящом предотвращает образование грыж диска и протрузий фрагментов пульпозного ядра в периферические зоны диска и паравертебральное пространство, резко уменьшает механическую нестабильность позвоночника. В суставах новообразованный гиалиновый хрящ восполняет патологически измененные участки суставных поверхностей, возникшие в результате дегенеративных или травматических заболеваний (остеоартрозов, хондромаляции, травм сустава). Это обеспечивает клинически значимое восстановление функциональной активности сустава.
Контролируемость роста
Увеличение объема регенерирующей хрящевой ткани ограничено областью анатомической структуры (МПД или суставной поверхности), в которой в результате внешнего воздействия (в частности, лазерного облучения) создаются особые, пространственно однородные физико-химические и биологические условия. Характеристики модифицированной ткани таких областей (например, размер газовых пузырьков, размер микропор, механическое давление, градиент температуры, содержание кислорода и глюкозы, концентрация ионов кальция, цинка, показатель pH и др.) лежат в определенных пределах.
Границы области индуцированной регенерации могут быть заданы заранее - при выборе параметров внешнего воздействия, который осуществляется с учетом физических и химических различий здоровой и патологически измененной хрящевой ткани.
Введение специальных веществ в пульпозное ядро МПД или суставной хрящ
Возможно также введение на любой стадии процесса специальных веществ, соединений или объектов:
1) влияющих на метаболические процессы в хрящевой ткани;
2) модулирующих реакцию клеток хрящевой ткани на внешнее воздействие;
3) направленно-изменяющих состав клеточной популяции хрящевой ткани;
4) влияющих на гистологические элементы тканей других видов (нервной, сосудистой);
5) направленно-изменяющих физические и/или химические свойства хрящевой ткани;
6) обладающих комплексным воздействием и на биологические процессы в ткани, и на ее физико-химические свойства.
Например, возможно введение:
(1)
Гормонов коры надпочечников и их аналогов (дексаметазон);
Витаминов и витаминоподобных препаратов;
Ферментов и антиферментных препаратов;
Аминокислот;
Макроэргических соединений или их химических предшественников;
Глюкозы;
Антиоксидантов;
Витамина С;
Стекловидного тела или других биогенных стимуляторов;
Препаратов кальция.
(2)
- Факторов роста и цитокинов, стимулирующих репаративные процессы в хрящевой ткани (TGF-β, PDGF, IGF-1, FGF, EGF, OP-1, BMP-2 и BMP-12, и, возможно, некоторых других), а также индукторов экспрессии или синтеза этих факторов роста и цитокинов. По данным ряда исследователей(Andrades et al., 2003; Masuda and An, 2004; Nishida et al., 1999; Thompson et al., 1991; Wang et al., 2003), полученным в экспериментах с культурами хондроцитов, эти вещества повышают продукцию протеогликанов и коллагена II типа, усиливают экспрессию мРНК аггреканов, вызывают ускоренную пролиферацию клеток и подавляют их апоптотическую гибель. В исследованиях in vivo было выявлено увеличение веса МПД, регенераторные изменения в хрящевой ткани (повышение содержания протеогликанов и появление клеточных кластеров, аналогичных кластерам нормального гиалинового хряща)(Mwale et al., 2003; Walsh et al., 2004).
- Блокаторов (конкурентов) рецепторов факторов роста и цитокинов, обладающих провоспалительным действием; а также веществ, подавляющих или тормозящих синтез данного класса мембранных рецепторов;
Веществ, оказывающих влияние на ионную проницаемость наружных и внутриклеточных мембран хондроцитов (блокаторы и активаторы ионных каналов);
Термолабильных предшественников биологически активных веществ (например, некоторых металлопротеиназ - в малых дозах и при условии, что температура ткани не превышает 38°С);
Фотосенсибилизаторов или биологически активных веществ, конъюгированных с фотосенсибилизаторами.
(3)
- Стволовых клеток или их экстрактов. В экспериментах(Johnstone et al., 1998; Walsh et al., 2004) была обнаружена индукция хондрогенной диффреренцировки костномозговых стволовых клеток под действием TGF-β1, OP-1, глюкокортикоидов и др.
Комплексов суррогатной хрящевой ткани, приготовленных с использованием методов тканевой инженерии и состоящих из культивированных in vitro на специальных матриксных подложках (artificial tissue substitute) стволовых или хондрогенных клеток - при условии сохранения структурно-функциональных свойств таких тканевых «констрактов» при прохождении через иглу шприца.
(4)
Препаратов, оказывающих влияние на нервные окончания, которые в условиях патологии врастают в фиброзное кольцо МПД и суставной хрящ (местно-анестезирующие средства);
Препаратов, оказывающих влияние на сосуды грануляционной ткани, врастающие в дефекты хряща в условиях патологии (регуляторы сосудистого тонуса, реологических свойств крови, проницаемости сосудистой стенки).
(5)
Веществ, регулирующих микрокавитационные процессы (поверхностно активные добавки),
Веществ, восполняющих и поддерживающих объем тканевой жидкости в хрящевой ткани (препараты на основе декстрана);
Слабых ионизирующих и деионизирующих растворов.
(6)
Солевых растворов (коррекция кислотно-основного, осмотического и ионного состояний ткани; изменение электропроводности ткани);
Препаратов на основе желатина («Желатиноль» - действие на осмотическое равновесие в ткани; источник аминокислот для коллагена; возмещение/замещение объема тканевой жидкости).
Кроме перечисленных групп веществ и объектов, в диагностических целях возможно использование рентгеноконтрастных препаратов, веществ с флуоресцентной меткой; оптически анизотропных веществ (выявление патологических изменений клеток, областей некроза ткани, ультраструктурной неоднородности ткани, связанной с гетерогенным распределением микропузырьков/микропор).
Введение добавок может быть использовано также для диагностики позиционирования конца иглы в МПД или суставе вместо применяемых в настоящее время методов лучевой диагностики, либо в комбинации с ними.
Вышеуказанные препараты могут быть введены в МПД, но в силу затруднен