Композиция биоразлагающихся микросфер, пригодная для контролируемого высвобождения контролирующего уровень глюкозы пептида, и ее состав
Иллюстрации
Показать всеИзобретение относится к фармакологии и касается способа получения микросфер из биоразлагающегося полимера, включающего: добавление органического растворителя к полимеру с получением раствора полимера (стадия 1); диспергирование регулирующего уровень глюкозы пептида в растворе полимера стадии 1 с получением дисперсии лекарственного средства и смешивание спирта или смеси спирта и органической кислоты с дисперсией лекарственного средства с получением раствора с диспергированным в нем лекарственным средством (стадия 2); и получение микросферы из раствора с диспергированным в нем лекарственным средством стадии 2 (стадия 3), где регулирующий уровень глюкозы пептид представляет собой эксендин-4 и где биоразлагающийся полимер выбран из группы, состоящей из поли-L-молочной кислоты, сополимера D-молочной кислоты и гликолевой кислоты, сополимера L-молочной кислоты и гликолевой кислоты и сополимера D,L-молочной кислоты и гликолевой кислоты. Изобретение обеспечивает получение микросфер, которые не демонстрируют ни начального эффекта всплеска, ни неполного высвобождения, обеспечивает высвобождение лекарственных средств нулевого порядка и высокую эффективность инкапсулирования и высокую стабильность. 12 з.п. ф-лы, 7 табл., 5 ил.
Реферат
Область техники
Настоящее изобретение относится к биоразлагающейся полимерной микросфере, содержащей биоразлагающийся полимерный носитель с инкапсулированным в нем регулирующим уровень глюкозы пептидом, способной высвобождать регулирующий уровень глюкозы пептид контролируемым образом, и к способу ее получения.
Уровень техники
После перорального введения большинство белковых и пептидных лекарственных средств теряют их активные структуры в кислом окружении желудка или подвергаются ферментативному разложению. Также они всасываются через слизистую оболочку желудка или кишечника на очень низких уровнях. По этим причинам белковые или пептидные лекарственные средства, как правило, вводят не перорально, то есть их, как правило, вводят посредством инъекции. Непероральное введение белковых или пептидных лекарственных средств должно быть повторяющимся, поскольку большинство неперорально вводимых белковых или пептидных лекарственных средств демонстрирует короткое время полужизни и низкую биодоступность в организме. Кроме того, во многих случаях их введение может продолжаться в течение длительного периода времени, например месяцев. Для избежания этих проблем проведено активное исследование составов для дозировок с замедленным высвобождением, что привело к применению биоразлагающихся полимерных носителей с инкапсулированными в них белковыми или пептидными лекарственными средствами, которые могут высвобождать из них белковые или пептидные лекарственные средства по мере биоразложения полимерных носителей [Heller, J. et al., Controlled release of water-soluble macromolecules from bioerodible hydrogels, Biomaterials, 4, 262-266, 1983; Langer, R., New methods of drug delivery, Science, 249, 1527-1533, 1990; Langer, R., Chem. Eng. Commun., 6, 1-48, 1980; Langer, R. S. and Peppas, N. A., Biomaterials, 2, 201-214, 1981; Heller, J., CRC Crit. Rev. Ther. Drug Carrier Syst., 1(1), 39-90, 1984; Holland, S.J. Tighe, B. J. and Gould, P. L., J. Controlled Release, 155-180, 1986].
Алифатические полиэфиры, в настоящее время используемые в качестве полимерных носителей для белковых или пептидных лекарственных средств, получили одобрение FDA для их применения, поскольку была установлена их биологическая совместимость. Их широко используют в качестве носителей для доставки лекарственных средств или нитей для наложения швов при операциях.
Конкретные примеры алифатических полиэфиров включают поли-L-молочную кислоту, полигликолевую кислоту, сополимер D-молочной кислоты и гликолевой кислоты, сополимер L-молочной кислоты и гликолевой кислоты, сополимер D,L-молочной кислоты и гликолевой кислоты (в дальнейшем в настоящем документе обозначаемый как "PLGA"), поликапролактон, поливалеролактон, полигидроксибутират и полигидроксивалерат [Peppas, L. B., Int. J. Pharm., 116, 1-9, 1995]. С развитием в последние годы высокомолекулярных пептидов или белков в качестве новых лекарственных средств были предприняты различные попытки для высвобождения их из полимерных носителей контролируемым образом. Однако дозированные формы, содержащие полиэфирные микросферы с инкапсулированными в них белковыми лекарственными средствами, имеют недостатки, состоящие в том, что они демонстрируют исходный эффект всплеска, неконтролируемую скорость высвобождения в течение некоторого периода времени вследствие различных факторов или неполное высвобождение инкапсулированного лекарственного средства. Например, модельные белковые лекарственные средства, такие как бычий сывороточный альбумин, лизоцим и т.д., высвобождаются в больших количествах на начальной стадии, однако демонстрируют конечное высвобождение приблизительно 50% [Crotts, G. and Park, T. G., J. Control. Release, 44, 123-134, 1997; Leonard, N. B., Michael, L. H., Lee, M. M. J. Pharm. Sci., 84, 707-712]. Что касается микросфер с использованием алифатических полиэфирных носителей с инкапсулированным в них рекомбинантным гормоном роста человека, они исходно высвобождают лекарственное средство в количестве 30~50%, однако 40~60% лекарственного средства остается в микросферах [Yan, C, et al., J. Control. Release, 32, 231-241, 1994; Kim, H. K. and Park, T. G., Biotechnol. Bioeng., 65, 659-667, 1999].
Исходный всплеск высвобождения лекарственного средства объясняется тем фактом, что белковые лекарственные средства, агрегированные или адсорбированные на поверхностях или в пустотах микросфер, высвобождаются посредством быстрой диффузии на начальной стадии. В процессе изготовления микросфер белковые лекарственные средства могут денатурировать на границе контакта между водой и органическим растворителем, и таким образом они могут образовывать необратимые агрегаты, которые приводят к нестабильному высвобождению. Для предотвращения индуцируемой границей контакта денатурации белковых лекарственных средств описано применение при получении микросфер поверхностно-активных веществ (например, поверхностно-активного вещества неионного типа Tween, Pluronic F68, Brij 35 и т.д.) и стабилизаторов (например, маннита, желатина, трегалозы, карбоксиметилцеллюлозы и т.д.) или органического растворителя, не содержащего воды [Gombotz, W. R., Healy, M., Brown, L., патент США № 5019400].
Для решения проблемы неконтролируемых скоростей высвобождения лекарственного средства в течение некоторого периода времени и неполного высвобождения инкапсулированных лекарственных средств многие последние исследования связаны с альтернативными способами получения микросфер для замедленного высвобождения лекарственных средств, которые включают инкапсулирование лекарственного средства в смеси двух или более полимеров с различными скоростями разложения в заданном соотношении [Ravivarapu, H.B., Burton, K., Deluca, P.P., Eur J Pharm Biopharm 50(2) 263-270, 2000; патентная заявка Кореи № 1998-0062142] или смешение двух или более типов полимерных микросфер, имеющих различные скорости разложения с соответствующими инкапсулированными в них лекарственными средствами в заданном соотношении (патент США № 4897268), контролируя посредством этого как начальное высвобождение, так и постоянное высвобождение лекарственного средства или лекарственных средств из микросфер. Однако в микросферах, полученных общепринятыми способами, продукты разложения полимера с высокой скоростью разложения, например молочная кислота и гликолевая кислота, снижают значение pH, что обеспечивает разложение полимера, имеющего низкую скорость разложения, и это приводит к скорости высвобождения, совершенно отличной от вычисленных значений скоростей высвобождения лекарственных средств, инкапсулированных в соответствующих полимерах. Кроме того, получение двух или более типов микросфер для одной дозированной формы имеет недостатки с точки зрения процессов изготовления и экономии (патентная заявка Кореи № 2000-0036178).
Способы получения микросфер, фазового разделения (патент США № 4673595, патентная заявка Кореи № 2007-0031304), распылительной сушки (патентная заявка Кореи № 2003-0023130) и выпаривания органического растворителя (патент США № 4389330) главным образом известны. В способе фазового разделения используют растворитель метиленхлорид в сочетании с силиконовым маслом, гептеном и этиловым спиртом, однако все из них необходимо устранять, и таким образом они являются экономически невыгодными. Что касается способа распылительной сушки, он может привести к денатурации пептидного или белкового лекарственного средства, поскольку он требует распылительной сушки пептидного или белкового лекарственного средства при высокой температуре, такой как 60°С или более, вместе с органическим растворителем. По этим причинам при получении пептидных или белковых лекарственных средств наиболее широко применяют способ выпаривания органического растворителя. Одним из наиболее важных факторов в этом способе является эффективность инкапсулирования (патентная заявка Кореи № 2003-0081179).
Таким образом, существует необходимость в способе получения микросфер, которые не демонстрируют ни начального эффекта всплеска, ни неполного высвобождения, позволяют высвобождение лекарственных средств нулевого порядка, являются простыми и экономически выгодными и обеспечивают высокую эффективность инкапсулирования и высокую стабильность инкапсулированного лекарственного средства.
Регулирующие глюкозу пептиды относятся к группе пептидов, которые обладают терапевтическим потенциалом в отношении лечения инсулин-зависимого сахарного диабета, гестационного сахарного диабета или инсулинзависимого сахарного диабета, ожирения и нарушения метаболизма липидов (патент США № 6506724). Примеры регулирующих глюкозу пептидов включают эксендин-3, эксендин-4 и их гомологи и агонисты, и глюкагоны, глюкагон-подобные пептиды (например, GLP-1, GLP-2) и их гомологи и агонисты (патентная заявка Кореи № 2006-7015029).
Эксендин-4, выделенный из секретов слюнных желез ящерицы Heloderma horridum или Heloderma suspectum, представляет собой физиологически активный пептид, состоящий из 39 аминокислотных остатков. Эксендин-4 выполняет функцию стимуляции секреции инсулина из бета-клеток поджелудочной железы, снижения повышенной секреции глюкагонов и индукции повышения аппетита, таким образом являясь пригодным для лечения диабета и ожирения [Eng. J. et al. 1990; Raufman, J. P. 1992; Goeke, R. 1993; Thorens, B. 1993].
Для эффективной профилактики и лечения сахарного диабета проводили исследование микросфер для замедленного высвобождения эксендина-4 (патентная заявка Кореи № 2006-7023921). Однако общепринятые способы являются сложными и неэффективными, примером чего является применение и удаление многих органических растворителей в способе фазового разделения, разложение пептидов, свойственное применению высокой энергии в ультразвуковом процессе, и применение многих эксципиентов, включая стабилизаторы, такие как сахар, и усилители высвобождения (например, неорганические кислоты и неорганические соли).
Описание
Техническая проблема
Таким образом, задачей настоящего изобретения является предоставление микросфер, которые не демонстрируют ни начального эффекта всплеска, ни неполного высвобождения, позволяют высвобождение лекарственных средств нулевого порядка независимо от периода времени стабильного высвобождения, являются простыми и экономически выгодными с точки зрения их получения и обеспечивают высокую эффективность инкапсулирования и высокую стабильность инкапсулированного лекарственного средства, и способа их получения, в котором не используется ни множество органических растворителей, ни высокоэнергетическая обработка, такая как облучение ультразвуком, ни средства, способствующие высвобождению, и который является простым.
Техническое решение
Для решения указанной выше задачи настоящее изобретение относится к биоразлагающимся полимерным микросферам, содержащим биоразлагающийся полимерный носитель с инкапсулированным в нем регулирующим уровень глюкозы пептидом, способный высвобождать регулирующий уровень глюкозы пептид контролируемым образом. Также настоящее изобретение относится к способу получения биоразлагающихся полимерных микросфер.
Преимущественные эффекты
В дополнение к тому, что микросферы являются простыми и экономически выгодными с точки зрения их получения и обеспечивают высокую эффективность инкапсулирования и высокую стабильность инкапсулированного лекарственного средства, микросферы в соответствии с настоящим изобретением демонстрируют высвобождение лекарственных средств нулевого порядка, например эксендина-4, и таким образом позволяют лекарственным средствам непрерывно высвобождаться in vitro и in vivo из них в течение от трех до четырех недель как без начального эффекта всплеска, так и без неполного высвобождения.
Описание чертежей
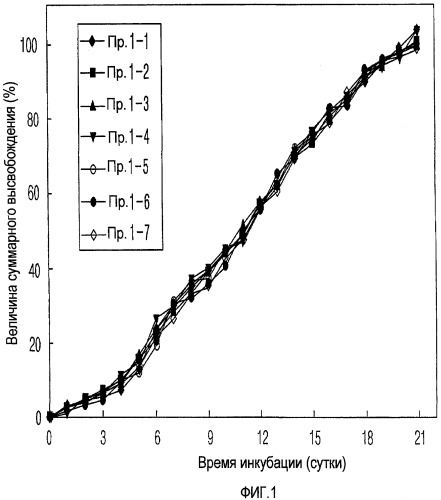
На ФИГ. 1 представлен график, на котором представлена кривая высвобождения in vitro для микросфер, полученных с помощью процесса диспергирования лекарственного средства примера 1 в соответствии с настоящим изобретением.
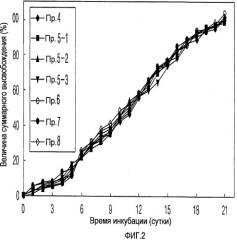
На ФИГ. 2 представлен график, на котором представлены кривые высвобождения in vitro для микросфер, полученных по примерам с 4 по 8 в соответствии с настоящим изобретением.
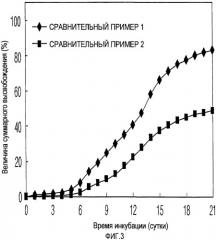
На ФИГ. 3 представлен график, на котором представлены кривые высвобождения in vitro для микросфер, полученных по сравнительным примерам 1 и 2.
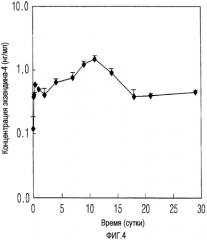
На ФИГ. 4 представлена кривая высвобождения in vivo для микросфер, полученных по примеру 1-1.
На ФИГ. 5 представлена хроматограмма эксендина-4, полученная для микросфер, полученных по примеру 1-1, анализированных обращенно-фазовой высокоэффективной жидкостной хроматографией (ОФ-ВЭЖХ).
Наилучший способ осуществления
Ниже приведено подробное описание настоящего изобретения.
Настоящее изобретение относится к биоразлагающейся полимерной микросфере для контролируемого высвобождения регулирующего уровень глюкозы пептида, содержащей биоразлагающийся полимерный носитель с инкапсулированным в нем регулирующим уровень глюкозы пептидом.
Примеры регулирующего уровень глюкозы пептида, пригодного для применения в настоящем изобретении, включают природные, рекомбинантные или синтетические эксендин-3, эксендин-4 и их гомологи и агонисты, глюкагон, глюкагон-подобные пептиды (например, GLP-1, GLP-2) и их гомологи и агонисты, и предпочтительными являются синтетический эксендин-3, эксендин-4 и их гомологи и агонисты. Наиболее предпочтительным является синтетический эксендин-4.
Содержание регулирующего уровень глюкозы пептида в микросферах может варьировать в зависимости от способа введения, дозировки и свойств белка.
Пригодными для применения в качестве биоразлагающегося полимерного носителя являются биоразлагающиеся полиэфирные полимеры. Являясь каркасом для микросферы и содержащегося в ней регулирующего уровень глюкозы пептида, биоразлагающиеся полиэфирные полимеры постепенно деградируют, высвобождая таким образом регулирующую глюкозу пептид. Примеры биоразлагающихся полиэфирных полимеров включают, но не ограничиваются ими, поли-L-молочную кислоту, полигликолевую кислоту, сополимер D-молочной и гликолевой кислоты, сополимер L-молочной кислоты и гликолевой кислоты, сополимер D,L-молочной кислоты и гликолевой кислоты, поликапролактон, поливалеролактон, полигидроксибутират и полигидроксивалерат. Поскольку в данной области обычно используют биоразлагающийся полиэфирный полимер, не налагается конкретных ограничений на применение его в настоящем изобретении. Полимер предпочтительно выбран из группы, состоящей из поли-L-молочной кислоты, сополимера D-молочной кислоты и гликолевой кислоты, сополимера L-молочной кислоты и гликолевой кислоты, сополимера D,L-молочной кислоты и гликолевой кислоты (PLGA) и их сочетания. Более предпочтительным является сополимер D,L-молочной кислоты и гликолевой кислоты (PLGA), отдельно или в сочетании с поли-L-молочной кислотой.
Также настоящее изобретение относится к способу получения биоразлагающейся полимерной микросферы для контролируемого высвобождения регулирующего уровень глюкозы пептида.
Способ получения биоразлагающейся полимерной микросферы включает:
добавление органического растворителя к полимеру с получением раствора полимера (стадия 1);
диспергирование регулирующего уровень глюкозы пептида в растворе полимера стадии 1 с получением дисперсии, с последующим добавлением спирта или смеси спирта и органической кислоты к дисперсии с получением раствора с диспергированным лекарственным средством (стадия 2); и
образование микросфер из раствора с диспергированным лекарственным средством стадии 2 (стадия 3).
Подробное описание способа приведено поэтапно.
Сначала на стадии 1 получают раствор полимера.
На стадии 1 полимер растворяют в органическом растворителе. Полимер является биоразлагающимся, и его можно использовать в качестве носителя. Предпочтительным является биоразлагающийся полиэфирный полимер.
Поскольку биоразлагающийся полимерный носитель обладает высокой растворимостью в нем и его можно удалять посредством выпаривания, можно использовать любой летучий органический растворитель без конкретного ограничения. В настоящем изобретении органический растворитель действует не только как солюбилизатор для растворения полимера, но также как диспергирующее вещество для равномерного диспергирования регулирующего уровень глюкозы пептида в растворе полимера. Примеры органического растворителя, пригодного для применения в настоящем изобретении, включают метиленхлорид, этилацетат, хлороформ, ацетон, диметилсульфоксид, диметилформамид, N-метилпирролидон, диоксан, тетрагидрофуран, этилацетат, метилэтилкетон, ацетонитрил и их сочетания, и предпочтительным является метиленхлорид, этилацетат и хлороформ, и наиболее предпочтительным является метиленхлорид.
Далее, стадия 2 приводит к получению раствора с диспергированным лекарственным средством. На стадии 2 регулирующий уровень глюкозы пептид диспергируют в растворе полимера. Регулирующий уровень глюкозы пептид является таким, как описано выше. Предпочтительно для получения дисперсии лекарственного средства добавляют синтетический эксендин-4. В дисперсии лекарственного средства соотношение регулирующего уровень глюкозы пептида и полимера (мас./мас.) выбирают из диапазона, достаточного для растворения регулирующего уровень глюкозы пептида.
Затем спирт отдельно или в сочетании с органической кислотой растворяют в дисперсии лекарственного средства. Спирт и органическая кислота действуют в качестве солюбилизаторов, способных растворять как полимер, так и регулирующий уровень глюкозы пептид. Кроме того, можно добавлять стабилизатор или поверхностно-активное вещество.
В способе в соответствии с настоящим изобретением очень важно проводить получение дисперсии лекарственного средства в порядке добавления органического растворителя к полимеру, добавления регулирующего уровень глюкозы пептида и добавления спирта или смеси спирта и органической кислоты. Когда порядок добавления меняют, то есть когда полимер добавляют с органическим растворителем и спиртом или смесью спирта и органической кислоты с последующим растворением регулирующего уровень глюкозы пептида, или когда раствор регулирующего уровень глюкозы пептида в спирте или смеси спирта и органической кислоты добавляют в раствор полимера, полученная микросфера демонстрирует неполную кривую высвобождения.
Пригодными в настоящем изобретении являются метиловый спирт, этиловый спирт, изопропиловый спирт и бутиловый спирт, и метиловый спирт является предпочтительным вследствие высокой растворимости для биоразлагающегося полимерного носителя и регулирующего уровень глюкозы пептида. Спирт, который предназначен для растворения дисперсии лекарственного средства, предпочтительно используют в наименьшем возможном количестве, однако его должно быть достаточно для растворения дисперсии лекарственного средства. Количество можно определять в зависимости от типа спирта. В случае метилового спирта соотношение лекарственного средства и спирта (об./об.) предпочтительно находится в диапазоне от 1:1 до 6:1, более предпочтительно от 3:1 до 4:1, для полного растворения дисперсии лекарственного средства. Также можно использовать любую органическую кислоту без ограничений, при условии, что она может растворять полимерный носитель и регулирующий уровень глюкозы пептид. Примеры органического растворителя, пригодного для настоящего изобретения, включают щавелевую кислоту, оксалоуксусную кислоту, фумаровую кислоту, яблочную кислоту, янтарную кислоту, уксусную кислоту, масляную кислоту, пальмитиновую кислоту, виннокаменную кислоту, аскорбиновую кислоту, мочевую кислоту, сульфоновую кислоту, сульфиновую кислоту, муравьиную кислоту, лимонную кислоту, изолимонную кислоту, альфа-кетоглутаровую кислоту, янтарную кислоту и нуклеиновые кислоты, и предпочтительными являются уксусная кислота, муравьиная кислота и их сочетание. Подобно спирту количество органической кислоты определяют в зависимости от ее типа.
На добавки не налагается конкретных ограничений при условии, что они могут растворять дисперсию лекарственного средства и являются растворимыми в растворителе для дисперсии лекарственного средства. Например, можно использовать полиэтиленгликоли (Solutol HS-15TM, TPGSTM, GelucireTM), масла (LabrafilTM, LabrasolTM, Medium Chain TriglycerideTM), белки (лектин), поверхностно-активные вещества (N-метилпирролидон, поливинилпирролидон, TweenTM, SpanTM, CremophorTM, PoloxamerTM, BrijTM, Sunsoft 818HTM) и гидропропилметилцеллюлозу. Их концентрация в солюбилизаторе находится в диапазоне от 0,01 до 15% (мас./об.) и предпочтительно от 0,1 до 12,5% (мас./об.).
Наконец, стадия 3 предназначена для образования микросфер из раствора с диспергированным лекарственным средством стадии 2.
Образования микросферы можно достигать диспергированием раствора с диспергированным лекарственным средством в водном растворе, содержащем эмульгатор, или с использованием распылительной сушилки.
Когда раствор с диспергированным лекарственным средством диспергируют в водном растворе, содержащем эмульгатор, используют мешалку и гомогенизатор для образования микросфер, которые затем высушивают. Эмульгатор, пригодный в настоящем изобретении, может представлять собой липофильный эмульгатор, диспергируемый в органических растворителях, или гидрофильный эмульгатор, диспергируемый в водных растворителях. Примеры гидрофильного эмульгатора включают Tween, Triton, Brij, поливинилпирролидон и поливиниловый спирт, и предпочтительным является поливиниловый спирт. Органический растворитель может быть насыщенным эмульгатором или ненасыщенным им. В качестве органического растворителя предпочтительно можно использовать метиленхлорид, этилацетат или хлороформ, и наиболее предпочтительным является метиленхлорид. Концентрация эмульгатора в водном растворе находится в диапазоне от 0,01 до 5,0% (мас./об.) и предпочтительно от 0,5 до 2% (мас./об.).
На этой стадии высушивание можно проводить с помощью сублимационной сушки или вакуумной сушки. Полученные микросферы можно собирать центрифугированием при сублимационной сушке или с помощью вакуумной фильтровальной системы при вакуумной сушке перед конечным высушиванием.
Микросферы, полученные согласно этому способу, представляют собой микросферы типа масло-в-воде, и их средний размер находится в диапазоне от 5 до 70 мкм и предпочтительно от 10 до 30 мкм, который пригоден для инъекции. Могут быть установлены различные значения размера частиц посредством контроля объемного соотношения масляной фазы, т.е. раствора с диспергированным лекарственным средством, и водной фазы, в которой растворен эмульгатор.
В случае распылительной сушки микросферы можно получать просто распылением раствора с диспергированным лекарственным средством из распылительной сушилки. В интересах эффективности получения распылительную сушку устанавливают на 115~125°C на входе и на 80~90°С на выходе. Затем высушенные распылительной сушкой микросферы можно подвергать дополнительному процессу сушки, такому как сублимационная сушка или вакуумная сушка, для удаления из них остаточных растворителей.
Кроме того, биоразлагающуюся полимерную микросферу в соответствии с настоящим изобретением можно получать способом, включающим:
добавление органического растворителя к полимеру с получением раствора полимера (стадия 1);
эмульгирование раствора полимера стадии 1 с водным раствором регулирующего уровень глюкозы пептида, содержащим поверхностно-активное вещество, с получением первичной эмульсии (стадия 2'); и
образование микросфер из первичной эмульсии стадии 2' (стадия 3').
На стадии 1 полимер растворяют в органическом растворителе. Полимер является биоразлагающимся, и его можно использовать в качестве носителя. Предпочтительным является полиэфирный полимер. Можно использовать любой летучий органический растворитель без конкретных ограничений, при условии, что он обладает высокой растворимостью для биоразлагающегося полимерного носителя и его можно легко удалять выпариванием. В настоящем изобретении органический растворитель действует не только в качестве солюбилизатора для растворения полимера, но также в качестве диспергирующего вещества для равномерного диспергирования регулирующего уровень глюкозы пептида в растворе полимера.
Примеры органического растворителя, пригодного для применения в настоящем изобретении, включают метиленхлорид, этилацетат, хлороформ, ацетон, диметилсульфоксид, диметилформамид, N-метилпирролидон, диоксан, тетрагидрофуран, этилацетат, метилэтилкетон, ацетонитрил и их сочетания, и предпочтительным является метиленхлорид, этилацетат и хлороформ, и наиболее предпочтительным является метиленхлорид.
На стадии 2' водный раствор регулирующего уровень глюкозы пептида, содержащий поверхностно-активное вещество, добавляют к раствору полимера с последующим эмульгированием с помощью мешалки или гомогенизатора с получением первичной эмульсии. В качестве регулирующего уровень глюкозы пептида предпочтительно можно использовать синтетический эксендин-4.
Добавление водного раствора регулирующего уровень глюкозы пептида, содержащего поверхностно-активное вещество, к раствору полимера приводит к образованию микросфер двойной эмульсии типа вода-в-масле-в-воде.
На стадии 2' в водном растворе регулирующего уровень глюкозы пептида может содержаться любое поверхностно-активное вещество, при условии, что он может растворять регулирующий уровень глюкозы пептид в водном растворе. Примеры поверхностно-активного вещества, доступного в настоящем изобретении, включают Tween, Triton, Brij, поливинилпирролидон и поливиниловый спирт.
Образования микросфер можно достигать диспергированием первичной эмульсии стадии 2' в водном растворе, содержащем эмульгатор, перемешиванием мешалкой и гомогенизатором и высушиванием. Эмульгатор, пригодный в настоящем изобретении, может представлять собой липофильный эмульгатор, диспергируемый в органических растворителях, или гидрофильный эмульгатор, диспергируемый в водных растворителях. Примеры гидрофильного эмульгатора включают Tween, Triton, Brij, поливинилпирролидон и поливиниловый спирт, и предпочтительным является поливиниловый спирт. Можно использовать эмульгатор, насыщенный или ненасыщенный в органическом растворителе. Предпочтительно в качестве органического растворителя можно использовать метиленхлорид, этилацетат или хлороформ, и наиболее предпочтительным является метиленхлорид. Концентрация эмульгатора в водном растворе находится в диапазоне от 0,01 до 5,0% (мас./об.) и предпочтительно от 0,5 до 2% (мас./об.).
На этой стадии можно прибегнуть к сублимационной сушке или вакуумной сушке. Полученные микросферы можно собирать центрифугированием при сублимационной сушке или с помощью системы вакуумного фильтра при вакуумной сушке, перед конечным высушиванием.
Обладая тем преимуществом, что они не демонстрируют ни начального эффекта всплеска, ни неполного высвобождения, поддерживают высвобождение эксендина-4 нулевого порядка, обеспечивают высокую эффективность инкапсулирования вследствие простого способа их получения и высокую стабильность инкапсулированного эксендина-4 и непрерывно высвобождают из них эксендин-4 in vitro и in vivo в течение трех или более недель, микросферы, полученные в соответствии с настоящим изобретением, пригодны в качестве средства для высвобождения эксендина-4 контролируемым образом.
Способы осуществления изобретения
Лучшее понимание настоящего изобретения можно получить с помощью следующих примеров, которые указаны ниже для иллюстрации, однако которые не следует истолковывать как ограничение настоящего изобретения.
ПРИМЕР 1: Получение микросфер с учетом типов полимеров и соотношений в смесях (эмульсия типа масло-в-воде)
300 мг полимера (Boehringer Ingelheim) полностью растворяли в метиленхлориде. В этом растворе полимера диспергировали 9 мг эксендина-4 (American Peptide) с получением дисперсии эксендина-4. Полимер, который использовали, как представлено в таблице 1, представлял собой один полимерный продукт или смесь двух различных полимерных продуктов в различных соотношениях в смеси. Для каждой из дисперсий лекарственного средства, которые отличались типом полимера и его соотношением в смеси, добавляли метиловый спирт в заданном количестве (дисперсия спирт:лекарственное средство 1:4 об./об.) с получением растворов с диспергированным в них лекарственным средством. 10 мл каждого раствора с диспергированным в нем лекарственным средством эмульгировали с помощью 250 мл 1% водного раствора насыщенного метиленхлоридом поливинилового спирта (мас./об.) с использованием мешалки или гомогенизатора для образования микросфер. По мере того как метиленхлориду позволяли медленно испаряться на воздухе перемешиванием при комнатной температуре в течение нескольких часов при атмосферном давлении, микросферы затвердевали. После центрифугирования собранные таким образом микросферы промывали дистиллированной водой, замораживали при -70°С и подвергали сублимационной сушке при комнатной температуре при 50 мТорр в течение 3 суток с использованием устройства для сублимационной сушки Advantage (VirTis, NY, U.S.A.) с получением микросфер типа масло-в-воде, которые могут высвобождать эксендин-4 контролируемым образом.
| ТАБЛИЦА 1 | |||||
| Примеры | Эксендин-4 (мг) | Полимер (мг) | Тип полимера | Соотношение для смешивания | |
| 1-1 | RG502H | 1 | |||
| 1-2 | RG502H:R202 | 90 | 10 | ||
| 1-3 | RG502H:R202 | 80 | 20 | ||
| 1-4 | 9 | 300 | RG502H:RG502 | 90 | 10 |
| 1-5 | RG502H:RG502 | 80 | 20 | ||
| 1-6 | RG502H:RG503 | 90 | 10 | ||
| 1-7 | RG502H:RG503 | 80 | 20 |
ПРИМЕР 2: Получение микросферы с учетом отношения спирта и дисперсии лекарственного средства (эмульсия типа масло-в-воде)
300 мг полимера (RG502H, Boehringer Ingelheim) полностью растворяли в метиленхлориде. В этом растворе полимера диспергировали 9 мг эксендина-4 (American Peptide) с получением дисперсии эксендина-4. К дисперсии лекарственного средства добавляли заданные количества метилового спирта (дисперсия спирт:лекарственное средство: 1:1-1:7 об./об.), как показано в таблице 2, с получением растворов с диспергированным в них лекарственным средством. Их эмульгировали и сушили аналогично примеру 1 с получением микросфер.
| ТАБЛИЦА 2 | |||
| Примеры | MeOH (об.) | Дисперсия эксендина-4 (об.) | Состояние раствора с диспергированным в нем лекарством |
| 2-1 | 1 | 1 | Раствор |
| 2-2 | 2 | Раствор | |
| 2-3 | 3 | Раствор | |
| 1-1 | 4 | Раствор | |
| 2-4 | 5 | Раствор | |
| 2-5 | 6 | Раствор | |
| 2-6 | 7 | Дисперсия |
Как показано в таблице 2, раствор не образовывался, когда объемное соотношение дисперсии лекарственного средства и метилового спирта составляло 7 или более.
ПРИМЕР 3: Получение микросфер из раствора с диспергированным в нем лекарственным средством, содержащего добавку (эмульсия типа масло-в-воде)
Микросферы получали аналогично примеру 1-1, за исключением того, что с раствором диспергированного в нем лекарственного средства смешивали различные добавки в количестве 0,1 или 12,5 об.% растворителя. В таблице 3 обобщенно представлены добавки и их об.%, смешанные с раствором.
| ТАБЛИЦА 3 | |||||
| Примеры | Эксендин-4 (мг) | Полимер (мг) | Добавки | Смешивание | |
| 9 | 300 | 0,1% | 12,5% | ||
| 3-1 | Solutol HS-15 | o | o | ||
| 3-2 | TPGS | o | o | ||
| 3-3 | Gelucire | о | о | ||
| 3-4 | Labrafil | o | o | ||
| 3-5 | Labrasol | o | o | ||
| 3-6 | Триглицерид средней цепи | o | o | ||
| 3-7 | Лецитин | o | o | ||
| 3-8 | N-метилпирролидон | o | o | ||
| 3-9 | Поливинилпирролидон | o | o | ||
| 3-10 | Гидроксипропилметил-целлюлоза | o | o | ||
| 3-11 | Tween | o | o | ||
| 3-12 | Span | o | o | ||
| 3-13 | Cremophor | o | o | ||
| 3-14 | Poloxamer | o | o | ||
| 3-15 | Brij | o | o | ||
| 3-16 | Sunsoft 818H | o | o |
Как показано на ФИГ. 3, с раствором диспергированного в нем лекарственного средства можно смешивать различные добавки в широком диапазоне концентраций.
ПРИМЕР 4: Получение микросфер из водного раствора эмульгатора, ненасыщенного органическим растворителем (эмульсия типа масло-в-воде)
Микросферы получали аналогично примеру 1-1, за исключением того, что раствор с диспергированным в нем лекарственным средством добавляли к 250 мл 1% водного раствора поливинилового спирта 1% (мас./об.), ненасыщенного метиленхлоридом и эмульгированного с использованием мешалки или гомогенизатора.
ПРИМЕР 5: Получение микросфер, имеющих различные размеры частиц (эмульсия типа масло-в-воде)
Микросферы получали аналогично примеру 1-1, за исключением того, что объемное соотношение насыщенного 1% водного раствора метиленхлоридом поливинилового спирта (мас./об.) и раствора с диспергированным в нем лекарственным средством, то есть объемное соотношение водной фазы и масляной фазы, было таким, как показано в таблице 4.
| ТАБЛИЦА 4 | |||
| Примеры | Эксендин-4 (мг) | Полимер (мг) | Водная фаза:масляная фаза (об./об.) |
| 5-1 | 9 | 300 | 1:15 |
| 5-2 | 1:30 | ||
| 5-3 | 1:60 |
ПРИМЕР 6: Получение микросфер на основании высушивания (эмульсия масло-в-воде)
Микросферы, затвердевшие после постепенного испарения метиленхлорида посредством перемешивания при комнатной температуре при атмосферном давлении в течение нескольких часов, как в примере 1-1, фильтровали через систему вакуумного фильтра, промывали дистиллированной водой и обезвоживали перед конечным высушиванием при комнатной температуре под давлением 50 мТорр в течение 3 суток с использованием устройства для сушки Advantage (VirTis, NY, U.S.A.).
ПРИМЕР 7: Получение микросфер с использованием распылительной сушки (эмульсия типа масло-в-воде)
Раствор с диспергированным в нем лекарственным средством, полученный по примеру 1-1, не смешивали с водным раствором эмульгатора, а инъецировали со скоростью 2,5 мл в мин в устройство для распылительной сушки (устройство для распылительной сушки Buchi Mini, B-290) при распылении со скоростью 400 нл/ч через насадку размером 0,7 мм. Полученные таким образом микросферы сушили в вакууме с получением дозировки микросфер, из которых может непрерывно высвобождаться эксендин-4. Температура устройства для распылительной сушки была установлена на 120+2°С на входе и 85+2°С на выходе.
ПРИМЕР 8: Получение микросфер с использованием водного раствора лекарственного средства (эмульсия типа вода-в-масле-в-воде)
300 мг полимера (RG502H, Boehringer Ingelheim) полностью растворяли в метиленхлориде. К этому раствору полимера добавляли водный раствор эксендина-4, полученный растворением 9 мг эксендина-4 (American Peptide) в 0,3 мл 0,5% водного раствора поливинилового спирта (мас./об.), а затем перемешивали с помощью гомогенизатора с получением первичной эмульсии. 10 мл первичной эмульсии эмульгировали с помощью 250 мл насыщенного метиленхлоридом 1% водного раствора поливинилового спирта 1% (мас./об.) с использованием мешалки или гомогенизатора для образования микросфер. По мере того как метиленхлориду позволяли медленно испаряться на воздухе посредством перемешивания при комнатной температуре в течение нескольких часов при атмосферном давлении, микросферы затвердевали. После центрифугирования собранные таким образом микросферы промывали дистиллированной водой, замораживали при -70°С и подвергали сублимационной сушке при комнатной температуре при 50 мТорр в течение 3 суток с использованием устройства для сублимационной сушки Advantage (VirTis, NY, U.S.A.) с получением микросфер типа вода-в-масле-в-воде, которые могут высвобождать эксендин-4 контролируемым образом.
СРАВНИТЕЛЬНЫЙ ПРИМЕР 1:
Получение микросфер типа масло-в-воде без процесса диспергирования лекарственного средства (1)
К раствору 300 мг полимера (RG502H Boehringer Ingelheim) в метиленхлориде добавляли метиловый спирт в количестве, соответствующ