Усиление действия противораковых агентов
Иллюстрации
Показать всеИзобретение относится к фармакологии и медицине и представляет собой фармацевтическую композицию, содержащую конъюгат или его фармацевтически приемлемую соль, где указанный конъюгат включает: полипептид, содержащий аминокислотную последовательность, по меньшей мере, на 80% идентичную последовательности Ангиопеп-2 (SEQ ID NO.:97); и, по меньшей мере, одну молекулу таксола, конъюгированную с указанным полипептидом; и Solutol® HS-15. Изобретение обеспечивает усиления действия противораковых лекарственных средств. 3 н. и 20 з.п. ф-лы, 7 табл., 34 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к конъюгатам носителей и фармацевтическим композициям и их применению для усиления действия лекарственных средств и для изменения фармакокинетики соединений. Более конкретно настоящее изобретение относится к конъюгатам, содержащим носитель, описанный в настоящей заявке, и их применению при лечении и диагностике рака.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Клинический прогресс в лечении первичных опухолей весьма замедлен, и одной из проблем, связанных с такими опухолями, является их слабый ответ на противораковые лекарственные средства. Эффективность химиотерапии и иммунотерапии нарушена из-за наследственного или приобретенного фенотипа множественной лекарственной резистентности (MDR) раковых клеток. Один из механизмов, вовлеченных в MDR-фенотип, вызван экспрессией Р-гликопротеина (P-gp), мембранного транспортера, который выкачивает из экспрессирующих MDR1 клеток различные противораковые лекарственные соединения. P-gp также экспрессируется в большом числе нормальных секреторных тканей, таких как почки, печень и кишечник. Этот выводящий насос сильно экспрессирован в клетках капилляров мозга, где его экспрессия в основном локализована в просветной мембране выстилающих их эндотелиальных клеток. У человека P-gp кодируется двумя MDR генами; MDR1 и MDR3. P-gр, кодируемый геном MDR1 человека, придает резистентный фенотип, в то время как P-gp, кодируемый геном MDR3 человека, не делает этого. Поэтому P-gp может рассматриваться как страж, который ограничивает вхождение лекарственных средств путем вытеснения их наружу из мозга или из раковых клеток, предотвращая накопление в них цитотоксических концентраций лекарственных средств.
Раковые клетки, образующие метастазы в мозге, в основном происходят из рака легкого или молочной железы, карциномы прямой и ободочной кишки, меланомы и рака органов мочевыделительной системы. Эти метастазы, которые образуются после хирургического вмешательства, первичной химио- или радиотерапии, устойчивы к химиотерапии. Химиотерапия против метастазов в мозге может быть эффективна, только если она эффективна против исходных опухолей, из которых происходят метастазы. Например, было показано, что метастазы в мозге, происходящие из мелкоклеточных карцином легких и стволовых клеток, отвечают на лечение в той же степени, что и метастазы другой локализации.
Резистентность к лекарственным средствам может быть собственным свойством опухолевых клеток или свойством, приобретенным после проведенного лечения. Было обнаружено, что в большинстве случаев первичного рака мозга присутствует выкачивающий насос P-gp, кодируемый MDR1 (также именуемый в этом описании Р-гликопротеином, MDR1 P-gp или MDR1), где большинство глиом, а более конкретно эндотелиальные клетки вновь образованных капилляров, положительно окрашивались на MDR1 P-gp. Поэтому многочисленные исследования поддерживают идею о том, что фенотип множественной лекарственной резистентности может быть вызван не только экспрессией P-gp в раковых клетках, но также и экспрессией во вновь образованных эндотелиальных клетках в опухолях. Уровень экспрессии MDR1 был также найден значительно более низким в метастазах в мозге из меланом и аденокарцином легких. В дополнение было показано, что лечение до хирургического вмешательства не оказывает большого влияния на уровень MDR1 в метастазах в мозге из меланом, поскольку они были одинаковы у пациентов, получивших радиотерапию, химиотерапию или оба типа лечения. В легочных метастазах MDR1 обнаруживали только у пациентов, получивших химиотерапию, что указывает на то, что предыдущее лечение могло вызвать его экспрессию, приводя к приобретенному MDR-фенотипу. Отсутствие экспрессии MDR1 в первичных опухолях легких и в соответствующих им метастазам мозга также указывает на то, что эти метастазы не приобретают тех же уровней экспрессии P-gp в ходе их развития, что и уровни экспрессии в нормальной ткани мозга. Эти результаты также указывают на то, что уровень MDR1 в эндотелиальных клетках из капилляров в метастазе мозга отличаются от уровня в первичных опухолях мозга. Отсутствие экспрессии MDR1 в некоторых случаях метастазов в мозг может частично объяснить, почему некоторые из них являются более чувствительными к химиотерапии, чем первичные опухоли мозга.
Способы транспортировки соединения через гематоэнцефалический барьер были описаны в международной заявке РСТ/СА2004/000011, опубликованной 22 июля 2004 года, под номером публикации WO20040/60403, содержание которой полностью включено в данное описание посредством ссылки. Кратко, в этом документе апротинин, фрагменты апротинина и аналоги были представлены как система доставки лекарственных средств для центральной нервной системы (ЦНС) и для лечения болезней, связанных с ЦНС.
Остается необходимость в усилении действия противораковых лекарственных средств.
Настоящее изобретение направлено на удовлетворение этих и других потребностей.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение в одном своем аспекте относится к носителю, содержащему аминокислотную последовательность, выбранную из группы, состоящей из аминокислотной последовательности апротинина, биологически активного фрагмента апротинина, Ангиопепа-1, Ангиопепа-2 и их биологически активных аналогов, производных или фрагментов. Последовательность апротинина, также как и некоторых примеров вариантов биологически активных аналогов, может быть найдена, например, в международной патентной заявке № РСТ/СА2004/000011.
Настоящее изобретение относится также к носителю, содержащему аминокислотную последовательность, выбранную из группы, состоящей из аминокислотной последовательности апротинина, биологически активного фрагмента апротинина, Ангиопепа-1, Ангиопепа-2 и их биологически активных аналогов, производных или фрагментов.
Примеры вариантов носителей, охватываемых настоящим изобретением, включают в себя те, которые могут быть выбраны, например, из группы, состоящей из
- апротинина (SEQ ID NO.:98),
- аналога апротинина,
- фрагмента апротинина, который может содержать (или может состоять в основном из) аминокислотную последовательность, определяемую SEQ ID NO.:1,
- биологически активного аналога SEQ ID NO.:1,
- биологически активного фрагмента SEQ ID NO.:1 и
- биологически активного фрагмента аналога SEQ ID NO.:1.
Более конкретно носитель может быть выбран, например, из группы
- фрагмента апротинина, который может содержать аминокислотную последовательность, определяемую последовательностью SEQ ID NO.:1,
- биологически активного аналога SEQ ID NO.:1,
- биологически активного фрагмента SEQ ID NO.:1 и
- биологически активного фрагмента аналога SEQ ID NO.:1.
Согласно изобретению фрагмент апротинина может состоять из последовательности, определяемой SEQ ID NO.:1. Далее, согласно изобретению фрагмент апротинина может содержать SEQ ID NO.:1 и может иметь длину, начиная примерно от 19 аминокислот примерно до 54 аминокислот, например, от 10 до 50 аминокислот в длину, от 10 до 30 аминокислот в длину и т.д.
Согласно изобретению биологически активный аналог SEQ ID NO.:1 может иметь длину примерно от 19 аминокислот примерно до 54 аминокислот (например, включающую от 21 до 23, от 25 до 34, от 36 до 50 и от 52 до 54 аминокислот) или примерно от 19 аминокислот примерно до 50 аминокислот, или примерно от 19 аминокислот примерно до 34 аминокислот (например, 19, 20, 21, 22, 23, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34), или примерно от 19 аминокислот примерно до 23 аминокислот, или примерно 19, 20, 21, 22, 23, 24, 35, 51 аминокислот.
Полипептиды согласно изобретению могут быть амидированы, т.е. могут иметь амидированную аминокислотную последовательность.
Биологически активный фрагмент полипептида (например, из 19 аминокислот), описанный в настоящей заявке, может включать в себя, например, полипептид, примерно из 7, 8, 9 или 10 до 18 аминокислот. Таким образом, согласно изобретению биологически активные фрагменты SEQ ID NO.:1 или аналога SEQ ID NO.:1 могут иметь длину примерно от 7 примерно до 18 аминокислот или примерно от 10 примерно до 18 аминокислот.
В патенте США № 5807980 описан полипептид, который указан в данном документе как SEQ ID NO.:102.
В патенте США № 5780265 описан полипептид, который указан в данном документе как SEQ ID NO.:103.
Аминокислотная последовательность апротинина (SEQ ID NO.:98), аминокислотная последовательность Ангиопепа-1 (SEQ ID NO.:67), а также некоторые последовательности биологически активных аналогов могут быть найдены, например, в международной заявке № РСТ/СА2004/000011, опубликованной 22 июля 2004 года в международной публикации под № WO2004/060403. Дополнительно в международной публикации № WO2004/060403 описан полипептид, который указан в данном документе как SEQ ID NO.:104.
В патенте США № 5118668 описаны полипептиды, которые имеют последовательность, показанную в SEQ ID NO.:105.
Еще более конкретно носитель может быть выбран, например, из группы
- аналога SEQ ID NO.:1, который может быть, по меньшей мере, на 35% сходен с аминокислотной последовательностью SEQ ID NO.:1,
- аналога SEQ ID NO.:1, который может быть, по меньшей мере, на 40% сходен с аминокислотной последовательностью SEQ ID NO.:1,
- аналога SEQ ID NO.:1, который может быть, по меньшей мере, на 50% сходен с аминокислотной последовательностью SEQ ID NO.:1,
- аналога SEQ ID NO.:1, который может быть, по меньшей мере, на 60% сходен с аминокислотной последовательностью SEQ ID NO.:1,
- аналога SEQ ID NO.:1, который может быть, по меньшей мере, на 70% сходен с аминокислотной последовательностью SEQ ID NO.:1,
- аналога SEQ ID NO.:1, который может быть, по меньшей мере, на 80% сходен с аминокислотной последовательностью SEQ ID NO.:1,
- аналога SEQ ID NO.:1, который может быть, по меньшей мере, на 90% сходен с аминокислотной последовательностью SEQ ID NO.:1 и
- аналога SEQ ID NO.:1, который может быть, по меньшей мере, на 95% (т.е. 96%, 97%, 98%, 99% и 100%) сходен с аминокислотной последовательностью SEQ ID NO.:1.
Например, биологически активный аналог SEQ ID NO.:1 может содержать аминокислотную последовательность, выбранную из группы, состоящей из аминокислотной последовательности, определяемой в любой из последовательностей от SEQ ID NO.:2 до SEQ ID NO.:62, от SEQ ID NO.:68 до SEQ ID NO.:93 и SEQ ID NO.:97, а также 99, 100 и 101.
Далее, согласно изобретению биологически активный аналог SEQ ID NO.:1 может содержать аминокислотную последовательность, определяемую последовательностью SEQ ID NO.:67. Более конкретно, эта последовательность может быть амидирована.
Например, и без ограничений конъюгаты, содержащие пептиды SEQ ID NO.: 102, 103, 104 и 105, также являются охваченными настоящим изобретением.
Далее, согласно изобретению биологически активный фрагмент SEQ ID NO.:1 или биологически активный фрагмент аналога SEQ ID NO.:1 могут содержать, по меньшей мере, 9 или, по меньшей мере, 10 (последовательных или непрерывных) аминокислот из SEQ ID NO.:1 или аналога SEQ ID NO.:1.
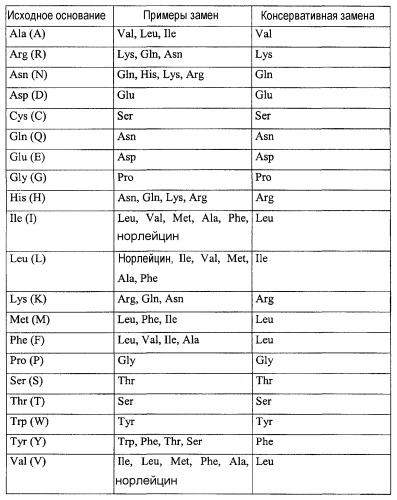
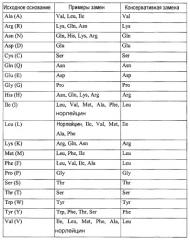
Полипептиды согласно изобретению могут иметь аминокислотную последовательность, которая может содержать от 1 до 12 аминокислотных замен (конкретно SEQ ID NO.:91). Например, аминокислотная замена может составлять от 1 до 10 аминокислотных замен или от 1 до 5 аминокислотных замен. Согласно изобретению аминокислотная замена может быть неконсервативной аминокислотной заменой или консервативной аминокислотной заменой.
Например, когда полипептид согласно изобретению содержит аминокислоты, которые идентичны аминокислотам из SEQ ID NO.:1, и другие аминокислоты, которые не идентичны (неидентичные аминокислоты), неидентичные аминокислоты могут являться консервативными аминокислотными заменами. Сравнение идентичных и неидентичных аминокислот можно осуществить путем сверки аминокислот в соответствующем положении.
Примеры аналога SEQ ID NO.:1, которые могут иметь, по меньшей мере, 35% сходства, включают в себя, например, полипептид, содержащий (состоящий из) аминокислотную последовательность, определяемую последовательностью SEQ ID NO.:91 (примерно 36,8% идентичности, т.е. 7 аминокислот из 19 аминокислот SEQ ID NO.:91 являются идентичными SEQ ID NO.:1), полипептид, содержащий (состоящий из) аминокислотную последовательность, определяемую последовательностью SEQ ID NO.:98 (примерно 68,4% идентичности, т.е. 13 аминокислот из 19 аминокислот являются идентичными SEQ ID NO.:1), полипептид, содержащий (состоящий из) аминокислотную последовательность, определяемую последовательностью SEQ ID NO.:67 (примерно 73,7% идентичности, т.е. 14 аминокислот из 19 аминокислот являются идентичными SEQ ID NO.:1), полипептид, содержащий (состоящий из) аминокислотную последовательность, определяемую последовательностью SEQ ID NO.:76 (примерно 73,7% идентичности, т.е. 14 аминокислот из 19 аминокислот являются идентичными SEQ ID NO.:1), и полипептид, содержащий (состоящий из) аминокислотную последовательность, определяемую последовательностью SEQ ID NO.:5 (примерно 79% идентичности, т.е. 15 аминокислот из 19 аминокислот являются идентичными SEQ ID NO.:1).
Примеры аналога SEQ ID NO.:1, которые могут иметь, по меньшей мере, 60% идентичности, включают в себя, например, полипептид, содержащий (состоящий из) аминокислотную последовательность, определяемую последовательностью SEQ ID NO.:98 (примерно 68,4% идентичности, т.е. 13 аминокислот из 19 аминокислот являются идентичными SEQ ID NO.:1), полипептид, содержащий (состоящий из) аминокислотную последовательность, определяемую последовательностью SEQ ID NO.:67 (примерно 73,7% идентичности, т.е. 14 аминокислот из 19 аминокислот являются идентичными SEQ ID NO.:1), полипептид, содержащий (состоящий из) аминокислотную последовательность, определяемую последовательностью SEQ ID NO.:76 (примерно 73,7% идентичности, т.е. 14 аминокислот из 19 аминокислот являются идентичными SEQ ID NO.:1), и полипептид, содержащий (состоящий из) аминокислотную последовательность, определяемую последовательностью SEQ ID NO.:5 (примерно 79% идентичности, т.е. 15 аминокислот из 19 аминокислот являются идентичными SEQ ID NO.:1).
Примеры аналога SEQ ID NO.:1, которые могут иметь, по меньшей мере, 70% идентичности, включают в себя, например, полипептид, содержащий (состоящий из) аминокислотную последовательность, определяемую последовательностью SEQ ID NO.:67 (примерно 73,7% идентичности, т.е. 14 аминокислот из 19 аминокислот являются идентичными SEQ ID NO.:1), в SEQ ID NO.:76 (примерно 73,7% идентичности, т.е. 14 аминокислот из 19 аминокислот являются идентичными SEQ ID NO.:1), в SEQ ID NO.:5 (примерно 79% идентичности, т.е. 15 аминокислот из 19 аминокислот являются идентичными SEQ ID NO.:1).
Согласно изобретению, носитель более конкретно может быть выбран из группы, состоящей из пептидов №№ 5, 67, 76, 91 и пептида 97 (т.е. SEQ ID NO.: 5, 67, 76, 91 и 97 (Ангиопеп-2)).
Настоящее изобретение относится, в частности, к применению носителя в фармацевтической композиции, описанной в настоящей заявке, для модификации и/или улучшения (in vivo) фармакокинетики соединения.
Согласно изобретению соединение может быть выбрано, например, из группы, состоящей из метки, белка, пептида и низкомолекулярного лекарственного соединения и их комбинаций.
Также согласно изобретению низкомолекулярное лекарственное соединение может являться, например, противораковым лекарственным средством.
Согласно изобретению противораковое лекарственное средство может быть конъюгировано с носителем, образуя при этом конъюгат. В примере осуществления изобретения конъюгат может содержать, например, по меньшей мере, одну молекулу противоракового лекарственного средства на каждую молекулу носителя. В другом примере осуществления изобретения конъюгат может содержать, по меньшей мере, две молекулы противоракового лекарственного средства на каждую молекулу носителя. В еще одном примере осуществления изобретения конъюгат может содержать, например, по меньшей мере, три молекулы противоракового лекарственного средства на каждую молекулу носителя.
Согласно изобретению носитель может усиливать накопление лекарственного средства в ткани, такой, например, как почка (ткань почки), печень (ткань печени), глаз (глазная ткань) и легкие (легочная ткань) индивидуума.
Также согласно изобретению носитель может модифицировать или улучшать биодоступность соединения.
Далее, согласно изобретению носитель также может изменять (обычное) распределение соединения в тканях.
Согласно изобретению носитель может также способствовать накоплению лекарственного средства в мозге (ткани мозга) индивидуума.
Согласно изобретению мозг может быть пораженным опухолью.
Далее, согласно изобретению мозг может содержать клетку рака легких.
Также согласно изобретению носитель может усиливать накопление лекарственного средства в раковой клетке (например, внутриклеточное накопление лекарственного средства в раковой клетке).
Используемый в данном документе термин «пораженный опухолью мозг» относится к мозгу, который содержит опухоль или первичную опухоль или метастазы, происходящие из других тканей, такие как без ограничений метастазы, происходящие из опухоли легкого, опухоли молочной железы, меланомы, опухоли прямой и ободочной кишки, опухоли органов мочевыделительной системы и др. Примеры клеток опухолей мозга, следовательно, включают в себя, например, глиобластомы и метастатическую клетку, происходящую, например, из легкого, молочной железы, толстой кишки, мочевыводящих путей или из меланомы.
Согласно изобретению носитель, следовательно, может быть использован, например, для снижения дозы лекарственного средства, необходимого для достижения такого же терапевтического эффекта (например, для достижения снижения роста опухолевых клеток и т.д.).
Настоящее изобретение далее относится к применению носителя, выбранного из группы, состоящей из апротинина, биологически активного фрагмента апротинина, Ангиопепа-1, Ангиопепа-2, их биологически активных аналогов, производных или фрагментов и их комбинаций, для переноса соединения в желаемое место-мишень, желаемую ткань-мишень или желаемую клетку-мишень.
Примеры низкомолекулярных лекарственных средств, которые могут быть конъюгированы с носителем согласно изобретению и которые охватываются настоящей заявкой, включают в себя, например, и без ограничений Таксол, производное Таксола, винбластин, винкристин, этопозид, доксорубицин, циклофосфамид, Таксотер, мелфалан, хлорамбуцил, фармацевтически приемлемые соли и т.д. и их комбинации, а также лекарственное средство, которое может служить субстратом P-gp.
Другое низкомолекулярное лекарственное средство, охватываемое настоящим изобретением, может включать в себя, например, лекарственное средство, имеющее группу, позволяющую соединить его с носителем согласно изобретению.
Согласно изобретению примеры производных Таксола (или аналоги) включают в себя, например, производные, раскрытые и упоминаемые в патенте США № 6911549, выданном 28 июня 2005 года, полное содержание которого включено в данное описание посредством ссылки.
Примеры меток, которые могут быть конъюгированы с носителем согласно изобретению и которые охватываются данным описанием, включают в себя, например, и без ограничений изотоп, флуоресцентную метку (например, родамин), репортерную молекулу (например, биотин) и т.д.
Примеры белков, которые могут быть конъюгированы с носителем согласно изобретению и которые охватываются данным документом включают в себя без ограничения антитело, фрагмент антитела, лекарственное средство на основе пептида или белка (например, положительный фармакологический модулятор (агонист) или фармакологический ингибитор (антагонист) и т.д.
Настоящее изобретение связано также с применением носителя, выбранного из группы, состоящей из апротинина, биологически активного фрагмента апротинина, Ангиопепа-1, Ангиопепа-2, их биологически активных аналогов, производных или фрагментов и их комбинаций, для усиления действия лекарственного средства. Более конкретно носитель может быть использован, например, для усиления действия лекарственного средства, которое может быть субстратом P-gp, или лекарственных средств, которые выталкиваются (т.е. удаляются, выбрасываются из клетки и т.д.) посредством P-gp или родственного P-gp белка (например, аллельного варианта P-gp человека или другого млекопитающего, например, изоформы mdr1a и/или mdr1b грызунов и т.д.).
Согласно изобретению носитель может, например, усиливать действия противоракового лекарственного средства, например, противоракового лекарственного средства, которое может являться субстратом P-gp.
В еще одном дополнительном аспекте настоящее изобретение более конкретно относится к применению носителя, конъюгата или фармацевтической композиции, описанных в настоящей заявке, для усиления (оптимизации) эффекта противоракового лекарственного средства против роста опухолей.
Настоящее изобретение далее связано с применением носителя, выбранного из группы, состоящей из апротинина, биологически активного фрагмента апротинина, Ангиопепа-1, Ангиопепа-2, их биологически активных аналогов, производных или фрагментов и их комбинаций, для переноса лекарственного средства или метки к или на желаемое место-мишень или для переноса лекарственного средства или метки внутрь клетки-мишени, и/или для усиления накопления лекарственного средства или метки внутри клетки, такой, например, как клетки, экспрессирующей P-gp на своей поверхности, или клетки, способной экспрессировать P-gp (на своей поверхности).
Носитель может быть использован, например, для усиления накопления внутри клетки лекарственного средства, которое характеризуется тем, что оно выталкивается из клетки (т.е. удалено, перенесено наружу клетки, выброшено) посредством P-gp или белка, родственного P-gp.
Согласно изобретению желательным местом локализации может являться, например, и без ограничений мозг или другие места вне мозга (например, вне черепа), такими, например, как почка, печень, поджелудочная железа, толстая кишка, глаза, легкие и их комбинация. Вследствие этого желательной мишенью может быть одна или более, выбранные из группы, состоящей из почки, печени, поджелудочной железы, толстой кишки, глаз, легких и их комбинации.
В соответствии с конкретным вариантом осуществления согласно изобретению желательной мишенью может быть, например, клетка или ткань мозга.
В соответствии с другим конкретным вариантом осуществления согласно изобретению желательной мишенью может быть, например, клетка или ткань печени.
В соответствии с дальнейшим конкретным вариантом осуществления согласно изобретению желательной мишенью может быть, например, клетка или ткань почки.
В соответствии с еще одним дальнейшим конкретным вариантом осуществления согласно изобретению желательной мишенью может быть, например, клетка или ткань поджелудочной железы.
В соответствии с другим конкретным вариантом осуществления согласно изобретению желательной мишенью может быть, например, клетка или ткань толстой кишки.
В соответствии с еще одним конкретным вариантом осуществления согласно изобретению желательной мишенью может быть, например, глаз или клетка глаза.
В соответствии с дальнейшим конкретным вариантом осуществления согласно изобретению желательной мишенью может быть, например, клетка или ткань легкого.
Далее согласно изобретению желательным место локализации может быть место, в котором находится клетка, экспрессирующая рецептор носителя или переносчик, например, клетка, экспрессирующая белок, родственный рецептору липопротеина низкой плотности (LRP). Клеткой может также быть клетка, которая совместно экспрессирует P-gp или родственный P-gp белок. Клеткой может быть, например, нормальная клетка, опухолевая клетка или метастатическая клетка. Носитель согласно изобретению может, следовательно, использоваться с тем, чтобы достичь клетки мозга, клетки печени, клетки почки, клетки поджелудочной железы, клетки толстой кишки, клетки глаза, клетки легкого и их комбинации (либо нормальной, либо опухолевой).
Настоящее изобретения также относится в своем более конкретном аспекте к применению носителя, описанного в настоящей заявке (например, такого, который может быть выбран из группы, состоящей из апротинина, биологически активного фрагмента апротинина, Ангиопепа-1, Ангиопепа-2 и их биологически активных аналогов, производных или фрагментов) или фармацевтической композиции, или конъюгата, описанных в настоящей заявке, для усиления внутриклеточного накопления соединения (т.е. усиления накопления соединения внутри клетки).
По одному из вариантов осуществления согласно изобретению соединение может быть выбрано, например, из группы, состоящей из метки, белка, пептида и низкомолекулярного лекарственного средства.
По дальнейшему варианту осуществления согласно изобретению клетка может являться клеткой, способной экспрессировать P-gp или которая экспрессирует P-gp. Более конкретно клетка может экспрессировать P-gp (MDR1) на клеточной поверхности.
Клетка может являться, например, опухолевой клеткой. Опухолевая клетка может происходить, например, и без ограничений из опухоли мозга, опухоли легкого, опухоли молочной железы, опухоли почки, опухоли глаза, опухоли печени, опухоли прямой и ободочной кишки, опухоли органов мочевыделительной системы и т.д.
Согласно изобретению клетка может находиться вне мозга индивидуума (млекопитающего, животного и т.д.). Например, клетка может являться опухолевой клеткой, которая может находиться вне мозга индивидуума (млекопитающего, животного и т.д.).
По дальнейшему варианту осуществления согласно изобретению клетка может находиться внутри мозга индивидуума. Клетка может являться, например, опухолевой клеткой, которая может находиться внутри мозга индивидуума (млекопитающего, животного и т.д.).
В примере осуществления согласно изобретению опухолевая клетка может являться клеткой опухоли мозга. Например, клетка опухоли мозга может происходить из глиобластомы или может являться глиобластомой.
В другом примере осуществления согласно изобретению опухолевая клетка может являться клеткой опухоли легкого.
Настоящее изобретение также относится в своем дополнительном аспекте к применению носителя, конъюгата или фармацевтической композиции, описанных в настоящей заявке, для уменьшения удаления лекарственного средства изнутри клетки, такой как, например, клетки, которая способна экспрессировать P-gp (MDR1) или которая экспрессирует P-gp. Согласно изобретению лекарственное средство может являться субстратом P-gp.
Также согласно изобретению клетка может являться раковой клеткой с множественной лекарственной резистентностью.
В своем еще одном дополнительном аспекте настоящее изобретение относится к применению носителя, конъюгата или фармацевтической композиции, описанных в настоящей заявке, для уменьшения роста клетки. Для этой цели носитель может быть конъюгирован с лекарственным средством, которое может быть способно снижать рост клетки.
По неограничивающим примерам осуществления изобретения носитель, конъюгат, созданный таким образом, или фармацевтическая композиция могут быть использованы для уменьшения роста опухолевой клетки или эндотелиальной клетки.
В частном варианте осуществления изобретения опухолевая клетка может быть способна экспрессировать или экспрессирует P-gp (MDR1).
В примере осуществления изобретения опухолевая клетка может являться клеткой опухоли мозга. Более определенно клетка опухоли мозга может происходить из глиобластомы или может являться глиобластомой.
В другом примере осуществления изобретения опухолевая клетка может быть клеткой опухоли легкого.
В еще одном другом примере осуществления изобретения опухолевая клетка может являться клеткой опухоли молочной железы.
В дальнейшем примере осуществления изобретения опухолевая клетка может являться клеткой опухоли почки.
В еще одном дальнейшем примере осуществления изобретения опухолевая клетка может являться клеткой опухоли глаза.
В дополнительном примере осуществления изобретения опухолевая клетка может быть из рака прямой и ободочной кишки.
В еще одном дополнительном примере осуществления изобретения опухолевая клетка может быть из опухоли органов мочевыделительной системы.
В частном варианте осуществления изобретения противораковое лекарственное средство более определенно может являться Таксолом, Таксотером или производным Таксола или Таксотера.
По другому варианту осуществления согласно изобретению противораковое лекарственное средство может являться, например, винбластином.
По еще одному другому варианту осуществления согласно изобретению противораковое лекарственное средство может являться, например, винкристином.
По дальнейшему варианту осуществления согласно изобретению противораковое лекарственное средство может являться, например, этопозидом.
По дальнейшему варианту осуществления согласно изобретению противораковое лекарственное средство может являться, например, доксорубицином.
По дополнительному варианту осуществления согласно изобретению противораковое лекарственное средство может являться, например, циклофосфамидом.
По еще одному дополнительному варианту осуществления согласно изобретению противораковое лекарственное средство может являться, например, мелфаланом.
По еще одному другому варианту осуществления согласно изобретению противораковое лекарственное средство может являться, например, хлорамбуцилом.
В другом аспекте настоящее изобретение относится к применению носителя, описанного в настоящей заявке, в создании фармацевтической композиции или медикамента для модификации фармакокинетики низкомолекулярного лекарственного средства.
Более конкретно носитель может быть использован для уменьшения роста клетки.
Также более конкретно носитель может быть использован для усиления накопления низкомолекулярного лекарственного средства внутри клетки.
В дополнение носитель может быть использован для уменьшения удаления низкомолекулярного лекарственного средства из клетки.
Также носитель может быть использован для увеличения эффекта низкомолекулярного лекарственного средства против роста опухолей.
Кроме того, носитель может быть использован для улучшения биодоступности низкомолекулярного лекарственного средства.
В дополнение и согласно изобретению носитель может быть использован для изменения (обычного) распределения в тканях низкомолекулярного лекарственного средства.
В дополнение настоящее изобретение относится к применению носителя, выбранного из группы, состоящей из апротинина, биологически активного фрагмента апротинина, Ангиопепа-1, Ангиопепа-2, их биологически активного аналога или комбинации, для лечения рака, метастазирующего рака и/или метастаза. Согласно изобретению примеры метастаза могут содержать без ограничений метастаз, который может происходить из опухоли молочной железы, опухоли легкого, меланомы и т.д.
Настоящее изобретение также относится к применению носителя, выбранного из группы, состоящей из апротинина, биологически активного фрагмента апротинина, Ангиопепа-1, Ангиопепа-2, их биологически активных аналогов, производных или фрагментов и их комбинации, для обнаружения желаемой клетки-мишени.
Настоящее изобретение далее связано с применением носителя, выбранного из группы, состоящей из апротинина, биологически активного фрагмента апротинина, Ангиопепа-1, Ангиопепа-2, их биологически активных аналогов, производных или фрагментов и их комбинации, для диагностики рака, метастазирующего рака и/или метастаза.
Настоящее изобретение дополнительно относится в дальнейшем аспекте к композиции (например, фармацевтической композиции), содержащей носитель (и/или его фармацевтически приемлемую соль) согласно изобретению, и фармацевтически приемлемый носитель.
Настоящее изобретение в дополнительном аспекте относится к конъюгату и/или к его фармацевтически приемлемой соли. Конъюгат может содержать, например, носитель, описанный в настоящей заявке, и лекарственное средство, метку или белок. Носитель может быть ковалентно присоединен к лекарству, метке, белку или пептиду.
Более конкретно конъюгат может содержать, например, носитель, выбранный из группы, состоящей из апротинина, биологически активного фрагмента апротинина, Ангиопепа-1, Ангиопепа-2, их биологически активных аналогов, производных или фрагментов и их комбинации, и соединение, выбранное из группы, состоящей из лекарственного средства, метки, белка и их комбинации. Согласно изобретению конъюгат может содержать одну или более молекул лекарственного средства.
Также согласно изобретению соединение может или не может высвобождаться из носителя. Вследствие этого, соединение может быть высвобождаемым из конъюгата (или из носителя).
Согласно изобретению конъюгат может содержать формулу R-L-M, где R является классом молекул, относящихся к апротинину (например, апротинином, фрагментом апротинина, Ангиопепом-1, Ангиопепом-2, аналогами, производными или фрагментами), L может являться линкером или связью, а М может являться агентом или лекарственным средством, выбранным из группы, состоящей из лекарственного средства (например, низкомолекулярного лекарственного средства), метки, белка (например, антитела, фрагмента антитела) и полипептида. Из данного документа понятно, что формула R-L-M не должна быть ограничена определенным порядком или соотношением. Как показывают приведенные в данном документе примеры, могут быть несколько соотношений М и R.
Настоящее изобретение относится в своем дальнейшем аспекте к применению конъюгата, который может содержать а) носитель, который может быть выбран из группы, состоящей из апротинина, биологически активного фрагмента апротинина, Ангиопепа-1, Ангиопепа-2 и их биологически активных аналогов, производных или фрагментов, и b) по меньшей мере, одно низкомолекулярное лекарственное средство или метку, для модификации фармакокинетики (in vivo) лекарственного средства или метки, которые к нему присоединены.
Согласно одному варианту осуществления согласно изобретению конъюгат может быть более конкретно использован для уменьшения роста клеток.
Далее согласно изобретению конъюгат может быть использован для усиления накопления низкомолекулярного лекарственного средства или метки внутри клетки.
Также согласно изобретению конъюгат может также быть использован для уменьшения удаления низкомолекулярного лекарственного средства или метки из клетки.
Далее согласно изобретению конъюгат может быть использован для увеличения эффекта низкомолекулярного лекарственного средства против роста опухоли.
Также согласно изобретению конъюгат может улучшить биодоступность соединения.
Далее согласно изобретению конъюгат может также изменить распределение соединения в тканях.
В одном варианте осуществления изобретения низкомолекулярное лекарственное средство может быть способно уменьшать рост клеток.
Настоящее изобретение также связано в своем дальнейшем аспекте с применением конъюгата, который может содержать а) носитель, который может быть выбран из группы, состоящей из апротинина, биологически активного фрагмента апротинина, Ангиопепа-1, Ангиопепа-2 и их биологически активных аналогов, производных или фрагментов, и b) по меньшей мере, одно низкомолекулярное лекарственное средство или метку, в изготовлении (производстве) фармацевтической композиции или медикамента для модификации фармакокинетики низкомолекулярного лекарственного средства.
Настоящее изобретение относится также к применению носителя в производстве композиции или медикамента для лечения заболевания, такого как рак, метастазирующий рак и/или метастаз.
Настоящее изобретение также связано в своем дальнейшем аспекте с применением конъюгата, который может содержать а) носитель, который может быть выбран из группы, состоящей из апротинина, биологически активного фрагмента апротинина, Ангиопепа-1, Ангиопепа-2 и их биологически активных аналогов, производных или фрагментов, и b) по меньшей мере, одно низкомолекулярное лекарственное средство или метку для детектирования клетки, которая может быть выбрана, например, из группы, состоящей из клетки глаза, клетки мозга, клетки молочной железы, клетки печени, клетки почки, клетки органов мочевыделительной системы, клетки толстой кишки, клетки прямой кишки и клетки