Комплементарный пептид к основному иммуногенному району рецептора ацетилхолина, терапевтическая композиция на его основе, способ изготовления пептида и его применение
Иллюстрации
Показать всеВ изобретении раскрывается комплементарный пептид, имеющий по меньшей мере последовательность, приведенную в тексте описания, комплементарную основному иммуногенному району рецептора ацетилхолина, участвующего в тяжелой псевдопаралитической миастении (myasthenia gravis), имеющий по меньшей мере последовательность SEQ ID NO:1 с триптофаном в положении 8 и несущий по меньшей мере одну необязательно замещенную углеводородную группу. Раскрыта терапевтическая композиция для лечения тяжелой псевдопаралитической миастении на основе комплементарного пептида и ее применение для приготовления вакцины для применения в терапевтическом и профилактическом лечении тяжелой псевдопаралитической миастении у млекопитающих. Описаны способы изготовления комплементарного пептида и лекарственного средства и способ лечения тяжелой псевдопаралитической миастении у млекопитающих с использованием терапевтической композиции. Изобретение обеспечивает пептид, имеющий антигенное поведение и который может быть применим в лечении MG у млекопитающих, в частности, домашних собак и людей. 12 н. и 10 з.п. ф-лы, 11 ил., 5 табл.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится к комплементарному пептиду, имеющему, по меньшей мере, последовательность, комплементарную основной иммуногенной области рецептора ацетилхолина тяжелой псевдопаралитической миастении, и, более конкретно, к его вакцинной композиции для терапевтического или профилактического лечения тяжелой псевдопаралитической миастении, в частности, домашних животных или людей.
Уровень техники
Тяжелая псевдопаралитическая миастения (myasthenia gravis, MG) является нервно-мышечным нарушением, отличающимся слабостью и утомляемостью скелетных мышц. Лежащим в ее основе дефектом является уменьшение количества доступных рецепторов ацетилхолина (AChR) в нервно-мышечных синапсах вследствие опосредованной антителами аутоиммунной атаки.
В нервно-мышечном синапсе ацетилхолин (ACh) синтезируется в окончании (терминали) двигательного нерва и хранится в везикулах (квантах). При перемещении потенциала действия по двигательному нерву и достижении окончания (терминали) нерва ACh из 150-200 везикул высвобождается и объединяется с AChR, которые плотно упакованы в пиках постсинаптических складок.
При объединении ACh с сайтами связывания на AChR каналы в AChR открываются, делая возможным быстрое вхождение катионов, в основном натрия, которое производит деполяризацию в области концевой пластинки мышечного волокна. Если эта деполяризация является достаточно большой, она инициирует потенциал действия, который распространяется вдоль мышечного волокна, запуская мышечное сокращение. Этот процесс быстро завершается гидролизом ACh ацетилхолинэстеразой (AChE) и диффузией ACh из этого рецептора.
В MG фундаментальным дефектом является уменьшение количества доступных AChR в постсинаптической мышечной мембране. Кроме того, постсинаптические складки уплощаются или «упрощаются». Эти изменения приводят к уменьшенной эффективности нервно-мышечной проводимости. Таким образом, хотя ACh высвобождается нормально, он производит малые потенциалы концевой пластинки, которые могут быть неспособны запускать мышечные потенциалы действия. Неспособность проводимости во многих нервно-мышечных синапсах приводит к слабости мышечного сокращения.
Нервно-мышечные отклонения от нормы в MG вызываются аутоиммунной реакцией, опосредованной специфическими анти-AChR-антителами. Анти-AChR-антителами называют патогенные антитела, и они уменьшают количество доступных AChR в нервно-мышечных синапсах посредством трех различных механизмов: (1) ускоренного оборота AChR посредством механизма, включающего в себя сшивание и быстрый эндоцитоз этих рецепторов; (2) блокады активного сайта AChR, т.е. сайта, который обычно связывает ACh; и (3) повреждения постсинаптической мышечной мембраны этим антителом во взаимодействии с комплементом. Эти патогенные антитела являются IgG и зависят от Т-клеток.
Клинические манифестации аутоиммунного заболевания MG коррелируют с присутствием этих патогенных антител, локализованных в нервно-мышечном синапсе.
До настоящего времени существует лишь небольшое число терапий, которые представляют собой либо симптоматическое лечение, либо иммунотерапию.
Эти терапии приносят пациентам клиническую пользу, которая может быть длительной, но требует довольно сложной клинической процедуры. Кроме того, эти существующие схемы лечения остаются только частично эффективными для многих пораженных пациентов, и большому проценту пациентов с этими заболеваниями необходимо изменить образ жизни.
Идеальным лечением аутоиммунных заболеваний могла бы быть селективная супрессия патогенных компонентов иммунной реакции (т.е. патогенных антител) через прямую анергию или прямое удаление клонов аутореактивных клеток.
Вакцинация пептидом, сконструированным в виде миметика рецептора антигена (ARM) для основных антигенов аутоиммунитета, показала значительную клиническую эффективность против моделей аутоиммунного заболевания животных, см. Патент США №5212072.
Такое лечение индуцирует анергию аутореактивных клонов, специфических в отношении этих иммунодоминантных белков, несмотря на их гетерологичное происхождение, а также притупление реакций против других близких антигенов. По-видимому, применение пептидных вакцин, контуры которых близко соответствуют контурам основных антигенов в аутоиммунитете (патологической реакции, направленной на собственные ткани и аутоантигены), может приводить к антиген-специфическим, индифферентным к классу рецепторов антигенов антиидиотипическим (Id) реакциям.
Эти пептиды, названные комплементарными пептидами, могут связывать детерминанту-мишень и в некотором смысле вести себя, как миметики рецептора антигена (Ag) (ARM). Следовательно, при использовании в качестве вакцин они индуцируют реакции антиидиотипического (Id) и антиклонотипического (Ag) антитела против антигенсвязывающих сайтов на некоторых аутореактивных лимфоцитах.
Таким образом, тяжелую псевдопаралитическую миастению исследовали на крысах, в которых тяжелая псевдопаралитическая миастения может быть индуцирована искусственным образом. Ее называют экспериментальной аутоиммунной тяжелой псевдопаралитической миастенией (EAMG).
В EAMG крысы, иммунизированные очищенным AChR, развивают сходное заболевание. На основании идеи, что антиген и антитело взаимодействуют на основе гидрофобной комплементарности, пытались индуцировать анти-Id-иммунитет против патогенных антител вакцинацией пептидом, комплементарным району основного иммуногена (MIR) AChR. Было обнаружено, что районом основного антигена рецептора AChR являются остатки 61-76 α-цепи рецептора AChR. Комплементарный пептид был назван RhCA 67-16. Крыс вакцинировали комплементарным пептидом RhCA 67-16, который был конъюгирован с гемоцианином морского блюдечка (KLH). Было показано, что как сывороточные препараты, так и препараты моноклональных антител из животных, вакцинированных комплементарным пептидом, связывают патогенные антитела, и заболеваемость этим заболеванием среди крыс в значительной степени уменьшается у вакцинированных животных (25%) в сравнении с KLH-иммунизированными, а также необработанными контролями (90%), в то время как балл клинической тяжести у животных с заболеванием имел среднюю величину 1,0 у вакцинированных животных в сравнении с 3,5 в положительных контролях. Кроме того, пассивное введение моноклонального анти-Id-антитела крысам в ходе индукции заболевания сходным образом уменьшало заболеваемость и тяжесть EAMG [Araga A et al., Prevention of Experimental Autoimmune Myasthenia Gravis by a Monoclonal Antibody to a Complementary Peptide for the Main Immunogenic Region of the Acetylcholine Receptor. J Immunol. 157, 386-392 (1996)].
В связи с предыдущими результатами вакцинации комплементарным пептидом RhCA 67-16 был сделан вывод, что этот иммуноген был структурно сходным с паратипом патогенных антител, и, следовательно, эта вакцина могла рассматриваться в качестве миметика рецептора В-клеточного Ag (ARM).
Для подтверждения результатов, полученных с комплементарным пептидом RhCA 67-16, получали вторую партию пептида RhCA 67-16. Пептид второй партии обнаруживал ожидаемую теоретическую молекулярную массу.
Пептид второй партии RhCA 67-16 опять испытывали, но, к сожалению, не наблюдали полученные ранее хорошие результаты в отношении частоты заболеваний.
Целью этого изобретения является обеспечение пептида, имеющего антигенное поведение, который может быть применим в лечении тяжелой псевдопаралитической миастении у млекопитающих, в частности домашних собак и людей (причем MG имеет необычный характер у кошек).
Раскрытие изобретения
Для этой цели это изобретение обеспечивает комплементарный пептид, характеризующийся тем, что этот комплементарный пептид имеет, по меньшей мере, последовательность SEQ ID NO:1 с триптофаном в положении 8, несущим, по меньшей мере, одну необязательно замещенную углеводородную группу.
Предпочтительно, последовательность этого пептида комплементарна остаткам 61-76 α-цепи AChR. Пептидом, имеющим, по меньшей мере, последовательность, комплементарную основному иммуногенному району (MIR) рецептора AChR, является пептид RhCA 67-16. Этот комплементарный пептид содержит триптофан в положении 8. До сих пор не было вполне понятно, но было неожиданно обнаружено, что указанная углеводородная группа имеет решающее значение для связывания этого пептида с анти-Id-антителом к патогенным антителам, нацеленным на остатки 61-76 α-цепи рецептора AChR собак.
Эта необязательно замещенная углеводородная группа является предпочтительно необязательно замещенной арильной группой или необязательно замещенной алкильной группой, в частности необязательно замещенной бензильной группой, замещенной, по меньшей мере, одной алкоксигруппой, наиболее предпочтительно 2,4,6-триметоксибензильной группой.
Поскольку MG собак и человека характеризуется, как имеющая реакцию AChR-антител (патогенных антител), которая направлена преимущественно (68%) против MIR (остатки 61-76 α-цепи AChR), предполагали, что может быть полезным обеспечение комплементарного пептида, направленного против MIR, для получения терапевтической композиции, которая может быть применима для лечения MG у млекопитающих, для развития в дальнейшем вакцины для человека. MG собак очень сходна с MG человека.
Эти сходства включают в себя природную распространенность этого нарушения, общие условия среды людей и собак, сходные клинические проявления, диагностическое AChR-аутоантитело со специфичностью к родственному эпитопу и коморбидность (сочетанное заболевание) MG с другими аутоиммунными заболеваниями.
Таким образом, другой целью этого изобретения является обеспечение терапевтической композиции, содержащей этот комплементарный пептид, имеющий, по меньшей мере, последовательность SEQ ID NO:1, и, по меньшей мере, один носитель.
Как упоминалось здесь ранее, при MG собаки и человека патогенные антитела нацелены против MIR AChR. Обеспечением пептида, комплементарного этому MIR, можно будет индуцировать антитела (антиидиотипические антитела), нацеленные на этот комплементарный пептид. Эти антиидиотипические антитела будут иметь антигенсвязывающий сайт, который будет сходным с MIR AChR, так как этот пептид является комплементарным этому сайту связывания. Таким образом, эти антиидиотипические антитела будут способны нейтрализовать патогенные антитела, и должна будет индуцироваться опосредованная В-клетками иммунная реакция.
Для получения композиции, которая могла бы давать хорошие результаты у млекопитающих, требовалась оптимизация этой композиции. Таким образом, было обнаружено, что пептид, имеющий, по меньшей мере, последовательность SEQ ID NO:1, должен был присутствовать в количестве в диапазоне от 750 до 25 микрограммов, предпочтительно от 500 до 50 микрограммов, предпочтительно от 100 до 50 микрограммов в 0,5 мл забуференного фосфатом солевого раствора.
Предпочтительно, эта терапевтическая композиция предназначена для использования в качестве вакцинной композиции для терапевтического или профилактического лечения MG. Эта вакцинная композиция предпочтительно содержит адъювант и пептидный носитель для усиления иммунной реакции. Поскольку эта композиция предназначена для увеличения опосредованной В-клетками реакции, она должна быть применима для использования адъюванта, подходящего для этой цели. Такие адъюванты и носители хорошо известны квалифицированным в данной области специалистам.
Примерами адъювантов могут быть адъювант в виде эмульсии типа вода-в-масле, в частности TiterMax®, квасцы, адъювант Фрейнда и т.п.
Примерами носителей могут быть дифтерийный токсоид, столбнячный токсоид, гемоцианин морского блюдечка и т.п.
Эти адъюванты и носители для терапевтического применения в MG у крыс обсуждаются подробно в статье McAnally JL, Xu L, Villain M, Blalock JE.: The role of adjuvants in the efficacy of a peptide vaccine for myasthenia gravis. Exp Biol Med 2001; 226:307-311, которая включена здесь в качестве ссылки.
Сообщалось также, что в тяжелой псевдопаралитической миастении участвует реакция Т-клеточного иммунитета. Действительно, патогенные антитела являются IgG, зависимыми от Т-клеток. Таким образом, наряду с районом AChRa 61-76, участвующим в опосредованной В-клетками иммунной реакции, предпринимались поиски другого района этого рецептора, который специфически узнается Т-клеткой.
В [Araga S. et al., A peptide vaccine that prevents experimental autoimmune myasthenia gravis by specifically blocking T-cell help, FASEB journal, vol. 14, 2000] сообщалось, что продуцирование патогенных антител у крысы Льюиса улучшалось Т-клетками, специфическими в отношении остатков 100-116 α-цепи AChR. Так, Araga S. et al. иммунизировали крыс Льюиса пептидом, комплементарным остаткам 100-116 α-цепи рецептора AChR (который был назван RhCA 611-001), имеющим, по меньшей мере, последовательность SEQ ID NO:2. Наблюдали, что полученные взаимодействия анти-ARM-антитело/рецептор антигена препятствовали аутореактивной помощи Т-клеток и подавляли аутореактивные В-клетки, уменьшая таким образом титры реактивных аутоантител, что приводило к заметному клиническому улучшению, пониженной смертности и сохранению уровней AChR на мышцах крысы Льюиса.
Пептидом, комплементарным этим остаткам 100-116 α-цепи рецептора AChR, является пептид RhCA 611-001, имеющий, по меньшей мере, последовательность SEQ ID NO:2.
Этот пептид испытывали на крысах для определения потенциала терапевтической вакцинной композиции, содержащей этот пептид, комплементарный Т-клеточному сайту узнавания рецептора AChR.
Было обнаружено, что комплементарный пептид, имеющий, по меньшей мере, последовательность SEQ ID NO:2, может быть вероятным кандидатом в терапевтической композиции для MG.
Таким образом, предполагалось, что объединение комплементарного В-пептида RhCA 67-16 и пептида, комплементарного Т-клеточному сайту узнавания, может привести к уменьшенной частоте заболеваний EAMG у крыс.
К сожалению, (см. сравнительный пример 3) частота заболеваний и тяжесть EAMG у крыс не уменьшались объединением обоих пептидов (ни при последовательном, ни при одновременном введении).
При одновременном введении обоих пептидов у крыс средняя тяжесть и процент смертности были сходными с величинами, наблюдаемыми с пептидом, имеющим, по меньшей мере, последовательность SEQ ID NO:2, что позволяет предположить, что не было синергического действия обоих пептидов на крыс.
Хотя AChR является высококонсервативным во время эволюции и хотя Т-клеточный иммунитет является, в свою очередь, очень зависимым от вида, неожиданно было обнаружено, что композиция, содержащая комплементарный пептид, имеющий, по меньшей мере, последовательность SEQ ID NO:1, и пептид, имеющий, по меньшей мере, последовательность SEQ ID NO:2, которая является комплементарной Т-клеточному сайту узнавания рецептора ацетилхолина, а также, по меньшей мере, один носитель, обеспечивает усиленное действие на MG у собак.
Действительно, на собаках было обнаружено синергическое действие В-комплементарного пептида и Т-комплементарного пептида.
Этот результат является даже более удивительным с учетом того, что пептид, имеющий, по меньшей мере, последовательность SEQ ID NO:2, комплементарен Т-клеточному сайту узнавания AChR у крыс. Т-клеточный иммунитет, хотя AChR является высококонсервативным в ходе эволюции, должен быть различным у крыс и собак.
Предпочтительно, последовательность SEQ ID NO:2 является комплементарной остаткам 100-116 α-цепи Т-клеточного сайта узнавания рецептора ацетилхолина.
Продуцирование патогенных антител усиливается Т-клетками, специфическими в отношении остатков 100-116 α-цепи рецептора AChR.
Предпочтительно, эта вакцинная композиция содержит 750-25 микрограммов, предпочтительно 500-50 микрограммов, предпочтительно 100-50 микрограммов каждого пептида, имеющего, по меньшей мере, последовательность SEQ ID NO:1 и/или SEQ ID NO:2, соответственно, в 0,5 мл забуференного фосфатом солевого раствора, по меньшей мере, с одним адъювантом.
Предпочтительно, оба пептида связаны с пептидным носителем, который является одним и тем же носителем или различными носителями.
Согласно модифицированному варианту осуществления этого изобретения композиция, содержащая оба пептида, содержит первый и второй составы.
Первый состав содержит пептид, имеющий, по меньшей мере, SEQ ID NO:1 согласно этому изобретению, а второй состав содержит пептид, имеющий, по меньшей мере, последовательность SEQ ID NO:2.
Предпочтительно, каждый первый и второй составы содержат независимо 750-25 микрограммов, предпочтительно 500-50 микрограммов, предпочтительно 100-50 микрограммов комплементарного пептида в 0,5 мл забуференного фосфатом солевого раствора, по меньшей мере, с одним адъювантом.
Предпочтительно пептид каждого состава должен быть связан с подходящим пептидным носителем.
Композиция, содержащая первый и второй составы, обеспечена для использования в виде вакцинной композиции для терапевтического или профилактического лечения MG у млекопитающих, причем каждый состав предназначен для одновременного или последовательного введения.
В каждом модифицированном варианте осуществления эта композиция обеспечена для индукции активации клеточно-опосредованного иммунитета, зависящего от В- и Т-лимфоцитов.
Это изобретение обеспечивает набор для детектирования, содержащий комплементарный пептид, имеющий, по меньшей мере, последовательность SEQ ID NO:1, обеспеченный для детектирования антиидиотипических антител основного иммуногенного района тяжелой псевдопаралитической миастении.
Пептид, имеющий, по меньшей мере, последовательность SEQ ID NO:1, находится предпочтительно в состоянии пептидного комплекса для использования в качестве комплекса покрытия в тесте ELISA, для связывания антиидиотипических антител в сыворотках домашних животных или человека, иммунизированных композицией в соответствии с этим изобретением. Меченый щелочной фосфатазой анти-IgG человека или собаки должен быть добавлен в лунки планшета ELISA для выявления связывания и, следовательно, детектирования анти-Id-антител с использованием хромогенного субстрата.
Альтернативно, анти-IgG может быть помечен пероксидазой хрена.
В одном варианте осуществления этот пептид находится в состоянии пептидного комплекса, содержащего, с одной стороны, пептид, имеющий, по меньшей мере, последовательность SEQ ID NO:1, и, с другой стороны, метку, такую как метка щелочной фосфатазы или пероксидазная метка, для применения в тесте ELISA или в Вестерн-блоте для детектирования антиидиотипических антител.
Целью этого изобретения является также обеспечение способа изготовления комплементарного пептида, имеющего, по меньшей мере, последовательность SEQ ID NO:1, предусматривающего стадии:
- синтеза комплементарного пептида, имеющего, по меньшей мере, последовательность SEQ ID NO:1, и
- присоединения углеводородной группы к остатку триптофана, расположенному в положении 8, в указанной последовательности SEQ ID NO:1.
Еще одной целью этого изобретения является обеспечение способа изготовления лекарственного средства для применения при тяжелой псевдопаралитической миастении, предусматривающего стадии:
- синтеза комплементарного пептида, имеющего, по меньшей мере, последовательность SEQ ID NO:1, и
- связывания этого комплементарного пептида, имеющего, по меньшей мере, последовательность SEQ ID NO:1, по меньшей мере, с одним носителем.
Еще одной целью этого изобретения является обеспечение способа изготовления лекарственного средства для применения при тяжелой псевдопаралитической миастении, предусматривающего стадии:
- синтеза комплементарного пептида, имеющего, по меньшей мере, последовательность SEQ ID NO:1,
- синтеза комплементарного пептида, имеющего, по меньшей мере, последовательность SEQ ID NO:2, и
- связывания обоих комплементарных пептидов, по меньшей мере, с одним носителем.
В модифицированном варианте осуществления это изобретение обеспечивает способ приготовления лекарственного средства для применения при тяжелой псевдопаралитической миастении, предусматривающий стадии:
- изготовления первого состава путем синтеза комплементарного пептида, имеющего, по меньшей мере, последовательность SEQ ID NO:1, и связывания его, по меньшей мере, с одним носителем, и
- изготовления второго состава путем синтеза комплементарного пептида, имеющего, по меньшей мере, последовательность SEQ ID NO:2, и связывания его, по меньшей мере, с одним носителем.
Предпочтительно, целью этого изобретения является также способ приготовления лекарственного средства, предназначенного для терапевтического или профилактического применения при тяжелой псевдопаралитической миастении, предусматривающий стадии:
- синтеза комплементарного пептида SEQ ID NO:1,
- синтеза комплементарного пептида SEQ ID NO:2,
- связывания этих комплементарных пептидов с носителем,
- смешивания обоих комплементарных пептидов, связанных с носителем, с солевым раствором и адъювантом.
Другие варианты осуществления согласно этому изобретению дополнительно описаны в прилагаемой формуле изобретения.
Данное изобретение относится также к способу лечения тяжелой псевдопаралитической миастении у млекопитающих, предусматривающему введение терапевтической композиции, содержащей комплементарный пептид, имеющий, по меньшей мере, последовательность SEQ ID NO:1, и необязательно комплементарный пептид, имеющий, по меньшей мере, последовательность SEQ ID NO:2.
Как упоминалось выше, комплементарный пептид, имеющий, по меньшей мере, последовательность SEQ ID NO:1, комплементарен основному иммуногенному району (MIR) из остатков 61-76 α-цепи рецептора ацетилхолина (AChR) тяжелой псевдопаралитической миастении (MG).
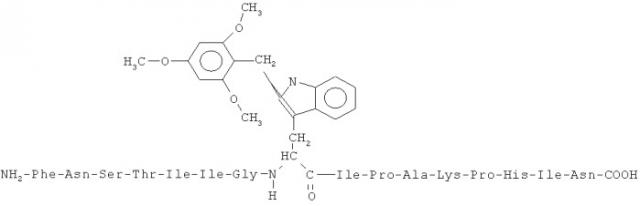
Последовательность остатков 61-76 α-цепи рецептора ацетилхолина (AChR α61-76) является следующей: NH2-Ile-Asp-Val-Arg-Leu-Arg-Trp-Asn-Pro-Ala-Asp-Tyr-Gly-Gly-Ile-Lys.
Пептид, комплементарный AChR α61-76, имеет следующую последовательность и назван RhCA 67-16:
Asn-Ile-His-Pro-Lys-Ala-Pro-Ile-Trp-Gly-Ile-Ile-Thr-Ser-Asn-Phe-NH2.
Таким образом, SEQ ID NO:1 является следующей:
NH2-Phe-Asn-Ser-Thr-Ile-Ile-Gly-Trp-Ile-Pro-Ala-Lys-Pro-His-Ile-Asn.
Пептид, имеющий, по меньшей мере, последовательность SEQ ID NO:1, синтезировали на синтезаторе Biosearch Peptide Synthesizer, Model 9500, с использованием f-moc-химии и очищали обращенно-фазовой высокоэффективной жидкостной хроматографией с использованием колонки Dynamax С18 300 ангстрем 15 µ(19×300 мм) и градиента 90% H2O (0,1% трифторуксусная кислота)/10% ацетонитрил (0,1% трифторуксусная кислота) - 10% H2O (0,1% трифторуксусная кислота)/90% ацетонитрил (0,1% трифторуксусная кислота) на протяжении 60 минут при скорости тока=5 мл/мин, причем время удерживания было равно 39-42 минуты, а молекулярная масса этого пептида с 2,4,6-триметоксибензилом была 1988.
RhCA 67-16, который является пептидом ARM для AChR α61-76, содержит триптофан в положении 8, который имеет присоединенную углеводородную группу, т.е. предпочтительно алкилирован или арилирован. Углеводородная группа, подходящая для такого присоединения, может быть выбрана из группы, состоящей из необязательно замещенной арильной группы и необязательно замещенной алкильной группы, в частности необязательно замещенной бензильной группы, предпочтительно бензильной группы, замещенной, по меньшей мере, одной алкоксигруппой, более предпочтительно 2,4,6-триметоксибензильной группой.
Предпочтительно, углеводородной группой является 2,4,6-триметоксибензильная группа, и эта химическая последовательность является следующей:
В-клеточный пептид синтезировали и 2,4,6-триметоксибензильную группу присоединяли к триптофану в положении 8 присоединением Tmob при отщеплении этого пептида от твердой подложки при кислых условиях (например, во время элюции трифторуксусной кислотой).
Присоединение углеводородной группы, в частности арилирование этого пептида, происходит во время отщепления пептида от твердой подложки при кислых условиях в присутствии Tmob. Пептид RhCA 67-16 связывали с гемоцианином морского блюдечка (KLH) в качестве белка-носителя, как описано ранее. KLH связывали с В-клеточным пептидом с использованием конъюгации с использованием глутарового альдегида для сохранения химических, физических и биологических свойств как KLH, так и пептида. В-клеточный пептид и белок-носитель (KLH) добавляют в раствор глутарового альдегида. Эта реакция показана здесь ниже:
Глутаровый альдегид не реагирует с белками или пептидами в его свободной форме, но реагирует в виде ненасыщенного полимера, который образует иминосвязи, стабилизированные конъюгацией.
В соответствии с этим изобретением белком-носителем может быть вышеуказанный KLH, но должно быть понятно, что могут быть использованы другие белки-носители, такие как, например, дифтерийный токсоид, или столбнячный токсоид, или любая большая молекула белковой природы, которая действует как подложка для этого пептида, так что этот пептид не является отдельным и слишком малым. Таким образом, пептид с этим белком-носителем не будет немедленно разрушаться иммунологической системой и является более иммуногенным.
Квалифицированному в данной области специалисту должно быть также понятно в связи с вышеупомянутым, что оба пептида (В-клеточный пептид и Т-клеточный пептид) могут быть связаны с одним и тем же белком-носителем или с различными белками-носителями, которые имеют идентичную или различную природу.
Для этого исследования клинические испытания выполняли на собаках. Единственная доза вакцины содержала 500 микрограммов в 0,5 мл забуференного фосфатом солевого раствора конъюгата пептид RhCA 67-16 - KLH, эмульгированного в 0,5 мл адъюванта вода-в-масле, предпочтительно адъюванта TiterMax® (TiterMax USA, Inc., Norcross, GA).
Пептид, имеющий последовательность SEQ ID NO:2, комплементарен Т-клеточному эпитопу (остатки 100-116) α-цепи AChR. Этот пептид синтезировали на синтезаторе Biosearch Peptide Synthesizer, Model 9500, с использованием f-moc-химии и очищали обращенно-фазовой высокоэффективной жидкостной хроматографией с использованием колонки Dynamax C18 300 ангстрем 15 µ(19×300 мм) и градиента 90% H2O (0,1% трифторуксусная кислота)/10% ацетонитрил (0,1% трифторуксусная кислота) - 10% H2O (0,1% трифторуксусная кислота)/90% ацетонитрил (0,1% трифторуксусная кислота) на протяжении 60 минут при скорости тока=5 мл/мин, время удерживания равно 18-20 мин, а молекулярная масса (MW) равна 2036.
Комплементарный пептид, имеющий SEQ ID NO:2, имеет следующую последовательность:
NH2-Tyr-Phe-Ser-Arg-Ile-Ile-Gln-Lys-Gln-Phe-Gly-His-Val-Asn-Asn-Gly-Lys.
Как описано ранее, этот пептид RhCA 67-16, также называемый здесь В-пептидом, и пептид RhCA 611-001, также называемый здесь Т-пептидом, испытывали по отдельности на крысах. Эти результаты указывают на то, что либо один В-пептид, либо один Т-пептид дают значимое уменьшение уровня патогенных антител. При тестировании в неопубликованных испытаниях на крысах В- и Т-пептиды вместе не давали лучшие результаты уровней патогенных антител, чем при введении одного Т-пептида. Эти результаты свидетельствуют о том, что не было синергического действия у крыс при использовании обоих пептидов.
Данное изобретение обеспечивает результаты на собаках, которые свидетельствуют о том, что имеется неожиданное синергическое действие при использовании обоих пептидов у собак при одновременном или последовательном введении.
Осуществление изобретения
Данное изобретение будет дополнительно подробно описано в следующих неограничивающих примерах.
ПРИМЕР 1
Материалы и способы. Двадцать девять собак, диагностированных с аутоиммунной MG с положительными титрами AChR-антител (>0,6 нМ) при помощи принятого способа клинического радиоиммуноанализа, были первоначально включены в это исследование. Пять животных (17%) умерли от аспирационной пневмонии, и одно умерло неожиданно после операции на тимусе по поводу тимомы перед завершением вакцинации. Коэффициент смертности в этом исследовании сравним с 6/35 (17%) и 2/12 (17%), сообщенными ранее в исторических контролях. Три собаки были потеряны для последующего наблюдения, и четыре выпали из этого исследования из-за некомплаентности; одна собака была выведена из этого исследования владельцем собаки перед завершением вакцинации из-за кожной реакции в месте иммунизации. Пять животных имели спонтанную ремиссию после диагноза, но перед началом вакцинации. Таким образом, 10 собак (5 самцов и 5 самок, в возрасте 1-10 лет) завершили это исследование, и ни одно из этих животных не имело тимомы или не принимало кортикостероиды или другие иммуносупрессоры. Время от появления клинических симптомов до подтвержденного диагноза с использованием анализа AChR-антител для этих животных было равно 2-4 неделям. Ремиссию определяли как долгосрочное возвращение титра AChR-антител к нормальному диапазону (<0,6 нМ) с клинической нормальностью в отсутствие ингибиторов ацетилхолинэстеразы. Временной ремиссией называют одно или несколько измерений титров AChR-антител ниже 0,6 нМ перед полным исчезновением MG и долгосрочным возвращением AChR-антител к нормальным величинам. Владельцы домашних животных давали информированное согласие, и это исследование было одобрено Институтским комитетом по уходу и использованию животных Университета Флориды.
В этих испытаниях использовали различные вакцинные композиции, перечисленные в таблице 1.
| Таблица 1 | |||||
| Композиции испытания на собаках | |||||
| Номер компози-ции | пептид SEQ ID NO:1 (микрограмм) | пептид SEQ ID NO:2 (микрограмм) | носитель | фосфатный солевой буфер | адъювант |
| 1 | 500 | 0 | KLH | 0,5 мл | Titer Мах® |
| 2 | 0 | 500 | KLH | 0,5 мл | Titer Мах® |
| 3 | 500 | 500 | KLH | 0,5 мл | Titer Мах® |
В этих клинических испытаниях на собаках композиции вводили подкожно, по меньшей мере, в четырех местах. Вакцинации начинали в момент подтвержденного диагноза и продолжали до четырех месяцев после диагноза для некоторых животных. Животных иммунизировали и повторно иммунизировали с 2-недельными интервалами.
Целью данного изобретения была оценка вышеупомянутых Т-клеточных и В-клеточных вакцин на способность уменьшать уровни AChR-антител в сравнении с историческими контролями в клиническом испытании в спонтанно приобретенной аутоиммунной MG в домашних собаках (Shelton GD et al., Neurology 2001; (57): 2139-2141). Контрольную группу миастенических домашних собак, иммунизированную белком-носителем (без пептидов ARM) в адъюванте, не включали в это время вследствие возможного отсутствия пользы на основании исследований крыс EAMG (Araga S, et al.) белка-носителя без связанного комплементарного пептида в 0,5 мл забуференного фосфатом солевого раствора с адъювантом.
Все статистические анализы выполняли с использованием программного обеспечения Instat biostatistics (программное обеспечение GraphPad, San Diego, CA). Для сравнения величин сывороточных антител и периодов времени ремиссии между группами использовали непарные t-критерии, за исключением случаев, когда ограничения набора данных требовали применения непарного t-критерия с поправкой Уэлча или критерия Манна-Уитни; нулевая гипотеза была такова, что вакцинация не уменьшала титры AChR-антитела или время ремиссии. Парные t-критерии использовали для анализа титров сывороточного антитела до и после вакцинации.
Для оценок конечных точек, например статистики ремиссии, выполняли анализ таблицы сопряженности признаков с точным критерием Фишера.
Результаты
Результаты проспективного исследования
Проспективно исследованная историческая контрольная группа состояла из 40 миастенических собак обоего пола, из которых 35 собак наблюдали в течение продолжительного времени, и результаты были известны. Эти животные были идентифицированы как AChR-антитело-положительные в когорте из 152 собак с идиопатическим мегаэзофагусом. Этих животных сравнивали с 20 собаками (за исключением животного, которое умерло после оперативного вмешательства по поводу тимомы) из исследования авторов, для которого этот результат был известен. Анализы AChR-антитела выполняла та же самая ветеринарная служба (UC San Diego, Comparative Neuromuscular Laboratory) для всех собак (исторических контролей и данного исследования).
| Таблица 2 | |||||
| Проспективные результаты для вакцинированных миастенических собак и исторических контролей | |||||
| Группа | Общее число собак | Имеющие ремиссию (%) | Не имеющие ремиссии (%) | Эвтаназия (%) | Смерть от аспирационной пневмонии (%) |
| Исторические контроли | 35 | 6 (17%) | 11 (31%) | 12 (34%) | 6 (17%) |
| Вакцинирован-ные | 20 | 15 (75%)A | 0B | 0C | 5 (25%)D |
| A: р<0,0001, B: р=0,0044, C: р=0,0022 и D: р=0,504, все в соответствии с точным критерием Фишера. Каждое сравнение рассматривает собак с указанными результатами в сравнении со всеми другими собаками в этой группе. |
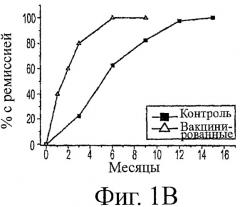
Таблица 2 показывает, что было значимое различие между количеством животных, которые умерли от аспирационной пневмонии или удушья в использованной авторами популяции в сравнении с историческими контролями (25% против 17% соответственно). Пять из 20 собак в исследовании авторов имели спонтанную ремиссию до долгосрочных уровней AChR-антител в нормальном диапазоне (<0,6 нМ) после диагноза, но перед вакцинацией. Таким образом, не было также различия в коэффициенте спонтанной ремиссии между этими двумя группами (25% против 17%). Эти результаты предполагают, что эти две когорты хорошо соответствуют одна другой. Значимое различие имелось в количестве эвтанизированных животных. Двенадцать собак (34%) в исторической контрольной группе были эвтанизированы вследствие их плохого прогноза. Животных в клинических испытаниях в соответствии с данным изобретением не эвтанизировали. Было высокозначимое различие в общих коэффициентах долгосрочной ремиссии между этими двумя группами. В то время как исторические контроли имели только 6 из 35 собак (17%) с ремиссией уровней AChR-антител, возвращающихся к нормальному диапазону, ремиссию 75% наблюдали у 20 вакцинированных собак. С учетом только животных, которые имели аспирационную пневмонию или были эвтанизированы, исторический контроль имел коэффициент ремиссии 35% (6/17) против 100% коэффициента ремиссии (15/15) (р<0,0001) в данном исследовании. Этот увеличенный коэффициент ремиссии полностью соответствовал 10 из 10 собак, которые имели ремиссию в связи с вакцинацией. Если учитывать наилучший возможный сценарий для исторических контролей и наихудший возможный сценарий для вакцинированных животных, все еще имеется значимо увеличенная ремиссия. Конкретно, если 5 собак, потерянных для последующего наблюдения в контрольной группе, предположительно имели ремиссию (11 из 40 с ремиссией, 27,5%), тогда как 9 собак в группе этого исследования авторов, потерянных для наблюдения или выбывших из этого исследования, предположительно не имели ремиссии (15 из 29 с ремиссией, 51,7%), вакцинация все еще вызывала значимое увеличение коэффициента ремиссии (р=0,0482, точный критерий Фишера).
Вакцинация приводит к ускоренному времени для ремиссии в сравнении со спонтанным выздоровлением от собачьей MG.
Историческую контрольную группу, состоящую из 47 миастенических собак, которые имели спонтанную ремиссию, анализировали ретроспективно и сравнивали с 10 вакцинированными животными в нескольких важных отношениях. Собак в обеих группах не лечили кортикостероидами или другими иммуносупрессорами; анализы AChR-антител выполнялись той же самой ветеринарной службой; время, протекшее от клинических симптомов до подтвержденного диагноза для вакцинированных собак (2-4 недели), попадало в пределы этого периода для исторических контролей (1 неделя - 5 месяцев), и эти две группы состояли из приблизительно сравнимых соотношений самцов и самок со сходными возрастными диапазонами и исследовались во время перекрывающегося периода времени (исторический контроль, 1990-2000 годы и вакцинированные животные, 1997-2003 годы).
Интересно, что в оценке данных, установленных для исторических контролей, наблюдали, что уровни AChR-антител обнаруживали одну из двух картин. Некоторые случаи имели однофазное снижение уровней AChR-антител, которое приводило к ремиссии, тогда как другие обнаруживали колеблющуюся картину увеличения и снижения уровней AChR-антител перед долгосрочной ремиссией. Уровни AChR-антител во времени у вакцинированных собак также разделялись на одну или другую из тех же самых двух групп (см. ниже). Таким образом, соответствующ