Пептидный модулятор пуринергических рецепторов
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к биологически активному пептиду. Пептид обладает модулирующим действием на участвующие в генерации нервного сигнала клеточные рецепторы. Данный пептид имеет аминокислотную последовательность: Gly1-Tyr2-Cys3-Ala4-Glu5-Lys6-Gly7-Ile8-Arg9-Cys10-Asp11-Asp12-Ile13-His14-Cys15-Cys16-Thr17-Gly18-Leu19-Lys20-Cys21-Lys22-Cys23-Asn24-Ala25-Ser26-Gly27-Tyr28-Asn29-Cys30-Val31-Cys32-Arg33-Lys34-Lys35. Предложенное изобретение может быть использовано в медицине для изучения механизмов возникновения боли, а также для обнаружения и тестирования новых модуляторов рецептора Р2Х3. 7 ил., 1 табл.
Реферат
Изобретение относится к биохимии, конкретно к биологически активным полипептидам, которые обладают модулирующим действием на участвующие в генерации болевого сигнала клеточные рецепторы и могут найти применение в медицине и научных исследованиях.
Согласно современным представлениям мембранные белки, обуславливающие передачу сигналов (различные рецепторы и ионные каналы), играют важнейшую роль в жизнедеятельности клеток. Нарушение работы рецепторных систем может быть причиной заболеваний и патологий. Одной из актуальных проблем современной физиологии, биоорганической химии и смежных наук является направленная регуляция функции клеточных рецепторов/ионных каналов с помощью селективного воздействия на эти мембранные белки. Пептидные токсины, содержащиеся в природных ядах и способные специфично воздействовать на потенциал-зависимые натриевые, кальциевые, калиевые каналы а также механо-, термо- и хемовозбудимые каналы, относящиеся к большой группе так называемых болевых рецепторов, являются мощным инструментом для структурных и функциональных исследований, а также основой для создания новых эффективных обезболивающих средств [Lewis R.J., Garcia M.L. Therapeutic potential of venom peptides // Nat. Rev. Drug Discov., 2003, V.2, P.790-802].
В настоящее время известен ряд компонентов природных ядов, которые оказывают обезболивающее действие, многие из них находятся на стадии клинических или доклинических испытаний. Так, анальгетической активностью обладают: α-конотоксин Vc1.1, действующий на нейрональные никотиновые ацетилхолиновые рецепторы [dark R.J. et al. The synthesis, structural characterization, and receptor specificity of the alpha-conotoxin Vc1.1 // J. Biol. Chem., 2006, Vol.281, P.23254-23263; US 7,348,400]; ω-конотоксины MVIIA (SNX-111) и CVID (AM-336), являющиеся блокаторами кальциевых каналов [Olivera B.M. et al. Neuronal calcium channel antagonists. Discrimination between calcium channel subtypes using omega-conotoxin from Conus magus venom // Biochemistry, 1987, Vol.26, P.2086-2090; Nielsen K.J. et al. Structure-activity relationships of omega-conotoxins at N-type voltage-sensitive calcium channels // J. Mol. Recognit., 2000, Vol.13, P.55-70; Scott D.A. et al. Actions of intrathecal omega-conotoxins CVID, GVIA, MVIIA, and morphine in acute and neuropathic pain in the rat // Eur. J. Pharmacol., 2002, V.451, P.279-286; US 7,101,849]; χ-конопептид MrIA-ингибитор транспортера норадреналина [Bryan-Lluka L.J. et al. chi-Conopeptide MrIA partially overlaps desipramine and cocaine binding sites on the human norepinephrine transporter // J. Biol. Chem., 2003, Vol.278, P.40324-40329; US 7,326,682]; контулакин G - агонист рецептора нейротензина [Craig A.G. et al. Contulakin-G, an O-glycosylated invertebrate neurotensin // J. Biol. Chem., 1999, Vol.274, P.13752-13759; US 6,696,408]; ρ-конопептид TIA-антагонист α-адренорецепторов [Sharpe I.A. et al. Allosteric alpha 1-adrenoreceptor antagonism by the conopeptide rho-TIA // J. Biol. Chem., 2003, Vol.278, P.34451-34457; US 6,849,601]. Практическое применение находит, например, указанный выше ω-конотоксин MVIIA («Зиконотид», «Приалт») [Miljanich G.P. Ziconotide: neuronal calcium channel blocker for treating severe chronic pain // Curr. Med. Chem., 2004, V.11, P.3029-3040; US 5,859,186].
Недостатками указанных средств являются:
(1) введение в организм таких препаратов, как «Приалт», проводится посредством инъекции в спинномозговой столб, что во многих случаях трудновыполнимо и требует применения специального медицинского оборудования (например, имплантированных насосов) и работы высококвалифицированного персонала;
(2) анальгетическая активность ряда веществ может сопровождаться побочными эффектами ввиду участия рецепторов-мишеней во многих физиологических процессах;
(3) в состав некоторых из указанных полипептидов входят остатки метионина, подверженные окислению, что приводит к снижению терапевтического потенциала соответствующих препаратов.
Ионотропные пуринергические рецепторы (Р2Х) являются лиганд-управляемыми ионными каналами, активируемыми внеклеточным аденозинтрифосфатом (АТФ), некоторыми другими нуклеотидами и их производными. Р2Х рецепторы широко распространены в теле человека. Так, они характерны для периферических нейронов, иннервирующих различные органы и ткани [Surprenant A., North R.A. Signaling at purinergic Р2Х receptors // Annu. Rev. Physiol., 2009, Vol.71, P.333-359]. Потенциальная важность этих мишеней для разработки медицинских препаратов обусловлена повсеместным присутствием их эндогенного лиганда АТФ в организме и разнообразием состояний, в которых он может реализовать свой активирующий эффект. АТФ - кофермент, участвующий в многочисленных важнейших реакциях, являющийся источником энергии для различных процессов, таких как мышечные сокращения и биосинтез белка. В то же время многочисленные исследования показали, что АТФ, освобожденный из поврежденных или воспаленных тканей, активирует Р2Х рецепторы и инициирует болевые сигналы. Предполагается участие Р2Х рецепторов в болевой чувствительности, связанной с травмами, опухолями, воспалением, мигренью, респираторными заболеваниями. У человека известно семь изоформ Р2Х рецепторов, среди которых изоформы Р2Х2, Р2Х3, Р2Х4 и Р2Х7, как полагают, участвуют в системе восприятия боли [Donnelly-Roberts D. et al. Painful purinergic receptors // J. Pharmacol. Exp. Ther., 2008, Vol.324, P.409-415]. Р2Х3 рецепторы являются важными и хорошо изученными «участниками» болевых процессов как в центральной, так и периферической нервной системе, что позволяет рассматривать их как перспективную мишень в лечении болевых состояний, а их антагонисты - как потенциальные анальгетические средства [Wirkner К. et al. Р2Х3 receptor involvement in pain states // Mol. Neurobiol., 2007, Vol.36, P. 165-183].
Специфичные и селективные ингибиторы или модуляторы Р2Х3 рецепторов в настоящее время недостаточно изучены. Известны некоторые низкомолекулярные антагонисты Р2Х3 рецепторов, например, 2′,3′-O-(2,4,6-тринитрофенил)-АТФ [Virginio С.et al. Trinitrophenyl-substituted nucleotides are potent antagonists selective for P2X1, Р2Х3, and heteromeric P2X2/3 receptors // Mol. Pharmacol., 1998, Vol.53, P. 969-973], другие производные моно- и динуклеотидов [Ford K.K. et al. The Р2Х3 antagonist PI, P5-di[inosine-5'] pentaphosphate binds to the desensitized state of the receptor in rat dorsal root ganglion neurons // J. Pharmacol. Exp. Ther., 2005, V. 315, P. 405-413; US 6,881,725], аналоги сурамина [Hausmann R. et al. The suramin analog 4,4′,4′′,4′′′-(carbonylbis(imino-5,l,3-benzenetriylbis (carbonylimino)))tetra-kis-benzenesulfonic acid (NF110) potently blocks Р2ХЗ receptors: subtype selectivity is determined by location of sulfonic acid groups // Mol. Pharmacol., 2006, V.69, P.2058-2067], спинорфин [Jung K.Y. et al. Structure-activity relationship studies of spinorphin as a potent and selective human Р2ХЗ receptor antagonist // J. Med. Chem, 2007, V.50, P.4543-4547], A-317491 [Jarvis M.F. et al. A-317491, a novel potent and selective non-nucleotide antagonist of Р2Х3 and P2X2/3 receptors, reduces chronic inflammatory and neuropathic pain in the rat // Proc. Natl. Acad. Sci. U.S.A., 2002, V.99, P.17179-17184], производные диаминопиримидина [Carter D.S. et al. Identification and SAR of novel diaminopyrimidines. Part 1: The discovery of RO-4, a dual P2X3/P2X2/3 antagonist for the treatment of pain // Bioorg. Med. Chem. Lett. 2009, Vol.19, P. 1628-1631; Jahangir A. et al. Identification and SAR of novel diaminopyrimidines. Part 2: The discovery of RO-51, a potent and selective, dual P2X3/P2X2/3 antagonist for the treatment of pain // Bioorg. Med. Chem. Lett. 2009, Vol.19, P.1632-1635; US 7,589,090; US 7,531,547], тетразола и ариламидов [US 7,595,405], а также пиперазина и фенилтиенопиразола [Brotherton-Pleiss C.E. Discovery and optimization of RO-85, a novel drug-like, potent, and selective P2X3 receptor antagonist // Bioorg. Med. Chem. Lett, 2010, Vol.20, 1031-1036; US 7,491,821].
Недостатками указанных веществ являются:
(1) существование других мишеней, помимо пуринергических рецепторов, у некоторых соединений;
(2) большинство обладают недостаточной селективностью в отношении гомомерных P2X3 рецепторов;
(3) низкий потенциал многих веществ с точки зрения создания лекарств ввиду неоптимальной химической структуры (например, наличия множества кислотных групп).
Известно наиболее близкое к заявляемому соединение RO-85 - производное пиперазина и фенилтиенопиразола [Brotherton-Pleiss C.E. Discovery and optimization of RO-85, a novel drug-like, potent, and selective P2X3 receptor antagonist // Bioorg. Med. Chem. Lett, 2010, Vol.20, 1031-1036]. Определенным недостатком известного соединения служит его структура: RO-85 может быть получено только с помощью многостадийного химического синтеза.
Изобретение решает задачу расширения ассортимента веществ, специфично воздействующих на P2X3 рецепторы.
Поставленная задача решается за счет структуры соединения РТ1, модулирующего активность пуринергических рецепторов P2X3. РТ1 является веществом полипептидной природы и может быть получен генно-инженерным способом.
РТ1 имеет следующую аминокислотную последовательность:
Glyl-Tyr2-Cys3-Ala4-Glu5-Lys6-Gly7-Ile8-Arg9-Cysl0-Asp11-Aspl2-Ilel3-Hisl4-Cys15-Cys16-Thrl7-Gly18-Leu19-Lys20-Cys21-Lys22-Cys23-Asn24-Ala25-Ser26-Gly27-Tyr28-Asn29-Cys30-Val31-Cys32-Arg33-Lys34-Lys35
Заявляемый пептид состоит из 35 аминокислотных остатков, может быть выделен хроматографическими методами из яда паука Geolycosa sp. или получен с помощью пептидного синтеза, а также генно-инженерными методами.
Заявляемый пептид способен селективно ингибировать токи, опосредованные пуринергическими рецепторами P2X3 в сенсорных нейронах крыс, а также в условиях экспрессии генов P2X3 рецепторов человека в клетках НЕК 293. Показано, что при действии наномолярных концентраций пептида значительно уменьшается активирующий эффект природного агониста АТФ, что связано, по-видимому, со стабилизацией десенситизированного состояния рецепторов. Концентрация РТ1, вызывающая 50%-ное ингибирование токов, опосредованных P2X3 рецепторами в сенсорных нейронах крыс, (IC50) составляет 12±2 нМ при коэффициенте Хилла (nH) 1,1±0,2 (для RO-85 IC50 в отношении рекомбинантных рецепторов крыс составляет ~31 нМ). Исследования активности РТ1 в отношении ряда ионных каналов и ионотропных рецепторов подтверждают специфичность действия пептида на Р2Х3 рецепторы.
Препараты на основе РТ1 могут оказаться эффективными в терапии болей различной этиологии. РТ1 является первым соединением полипептидной природы, способным оказывать селективное модулирующие действие на Р2Х3 рецепторы. Пептид характеризуется чрезвычайно стабильной структурой (содержит мотив так называемого «цистинового узла»), кроме того, не содержит остатков метионина. Это служит основанием для предположения высокого потенциала РТ1 с точки зрения создания лекарственных препаратов.
Изобретение иллюстрируют чертежи
Фиг.1. Выделение РТ1 из яда паука Geolycosa sp. (А) Эксклюзионная хроматография цельного яда на колонке TSK 2000SW (7,5×600 мм). Отмечена активная фракция (*). (Б) Обращенно-фазовая ВЭЖХ фракции I на колонке Vydac 218TP54 C18 (4,6×250 мм). Отмечена активная фракция (*). (В) Третья стадия очистки активного вещества (повторная хроматография фракции 1) с использованием той же колонки Vydac 218TP54. Активная фракция, соответствующая чистому РТ1, отмечена (*).
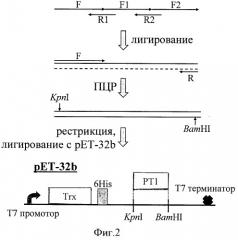
Фиг.2. Схема конструирования экспрессирующего вектора. Синтез гена РТ1 с использованием олигонуклеотидов (таблица 1), обозначенных стрелками, включает лигирование и ПЦР и сопровождается клонированием в вектор рЕТ-32b. Внизу показана часть полученного конструкта с функциональными элементами: промотором, геном тиоредоксина (Trx), гексагистидиновой последовательностью (6His), целевым геном РТ1, терминатором.
Фиг.3. Получение рекомбинантного РТ1. (А) Электрофоретическое разделение образцов, полученных в ходе выделения гибридного белка тиоредоксина с РТ1, в ДСН-ПААГ (12%). (1, 6) - стандарты, слева приведены значения молекулярных масс (кДа); (2) - тотальный клеточный лизат Е. coli BL21(DE3), несущих плазмиду рЕТ-32b со вставкой гена РТ1 перед добавлением ИПТГ; (3) - после индукции экспрессии целевого гена 0,2 мМ ИПТГ; (4) - фракция растворимых белков; (5) - слитный белок, очищенный с помощью аффинной хроматографии. (Б) Разделение продуктов гидролиза гибридного белка энтеропептидазой на колонке Jupiter C4 (10×250 мм). Отмечена фракция, соответствующая РТ1 (*).
Фиг.4. Влияние РТ1 на токи, опосредованные Р2Х3 рецепторами в культуре нейронов из ганглиев дорсальных корешков спинного мозга крыс. В качестве агониста используется ЦТФ в концентрации 100 мкМ. (А) Запись токов в ответ на приложение агониста в случае, когда РТ1 связывается с Р2Х3 рецепторами в закрытом состоянии. Приложение 10 нМ РТ1 приводит к увеличению амплитуды тока (черная кривая) по сравнению с контролем (серая кривая). (Б) Запись токов в случае, когда РТ1 связывается с Р2Х3 рецепторами в десенситизированном состоянии. Приложение 10 нМ РТ1 приводит к уменьшению амплитуды тока (черная кривая) по сравнению с контролем (серая кривая).
Фиг.5. Исследование механизма действия РТ1 на Р2Х3 рецепторы. По абсциссе отложено время приложения агониста от начала эксперимента. По ординате отложена амплитуда измеренных токов. Доверительные интервалы обозначают амплитуду шума в каждой конкретной записи ионного тока. Черная горизонтальная линия (РТ1, 20 нМ) показывает промежуток времени, в течение которого нейрон находился в растворе с 20 нМ РТ1. Увеличение периода между аппликациями агониста на фоне РТ1 приводит к ослаблению блокирования ионного тока, опосредованного Р2Х3 рецепторами. При дальнейшем увеличении этого периода блокирование переходит в потенцирование.
Фиг.6. Концентрационная зависимость эффекта РТ1 на Р2Х3 рецепторы в культуре нейронов из ганглиев дорсальных корешков спинного мозга крыс.
Фиг.7. Эффект РТ1 на рекомбинантные Р2Х3 рецепторы человека в клетках НЕК 293 (НЕЮ) и Р2Х3 рецепторы нейронов заднекорешковых ганглиев (ЗКГ) крыс. На диаграмме показано относительное снижение амплитуды ионного тока, вызванного приложением ЦТФ (100 мкМ) на Р2Х3 рецепторы, в присутствии РТ1 во внеклеточном растворе в концентрации 20 нМ и 50 нМ. Белые столбцы- эффект для нейронов ЗКГ крыс, серые столбцы - для клеток НЕК 293.
Изобретение иллюстрируют следующие примеры.
Пример 1. Выделение пептида РТ1
Цельный яд паука Geolycosa sp. (SPP код- A267TDLS2-KZARNA) предоставлен ТОО «Научно-производственное объединение Фауна» (Республика Казахстан). Высушенный лиофильно образец 25 мкл яда растворяют в 0,1 мл 150 мМ NaCl, 30 мМ NaH2PO4 и наносят на колонку для гель-фильтрации TSK 2000SW (7,5×600 мм, 125 А, 10 мкм; Beckman, США). Элюцию осуществляют тем же раствором со скоростью 0,5 мл/мин. Детекцию проводят по оптическому поглощению элюата при длине волны 214 нм (фиг.1А). Все фракции анализируют на активность в отношении Р2Х3 рецепторов.
Активную фракцию I далее разделяют с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии (ВЭЖХ) на колонке Vydac 218TP54 C18 (4,6×250 мм, 300 Å, 5 мкм; Separations Group, США) в линейном градиенте концентрации ацетонитрила (0-15% за 5 мин, 15-45% за 50 мин, 45-65% за 10 мин) в 0,1%-ной трифторуксусной кислоте (ТФУ) при скорости потока 1 мл/мин (фиг.1Б). Индивидуальный активный пептид РТ1 очищают в результате третьей стадии разделения активной фракции 1 с помощью обращенно-фазовой ВЭЖХ на той же колонке в «пологом» градиенте концентрации ацетонитрила (0-15% за 5 мин, 15-25% за 30 мин) (фиг.1В).
Пример 2. Определение молекулярной массы РТ1
Индивидуальность очищенного вещества подтверждают масс-спектрометрическим анализом. Используют десорбционный метод «мягкой» ионизации - времяпролетной матрично-активированной лазерной десорбции/ионизации (МАЛДИ). Масс-спектры получают на МАЛДИ масс-спектрометре Ultraflex II TOF/TOF (Bruker Daltonik, Германия) с времяпролетным масс-анализатором, идентификацию положительно заряженных ионов проводят в рефлекторном режиме. В качестве матрицы используют α-циано-4-гидроксикоричную кислоту (10 мг/мл) в 50%-ном ацетонитриле, содержащем 0,1%-ную ТФУ. Для калибровки прибора используют стандартную смесь пептидов и белков с диапазоном молекулярных масс 700-66000 Да (Sigma, США). Измеренная моноизотопная молекулярная масса природного РТ1 составляет 3833,5 Да.
Пример 3. Установление аминокислотной последовательности РТ1
Первичную структуру (аминокислотную последовательность) РТ1 устанавливают с помощью комбинации методов N-концевого секвенирования по Эдману, селективного протеолиза и масс-спектрометрии. Вначале проводят реакцию восстановления дисульфидных связей и алкилирования тиольных групп. Для этого 1 нмоль выделенного пептида растворяют в 40 мкл смеси: 0,5 М Трис-HCl (рН 8,5), 6 М гуанидингидрохлорид, 2 мМ ЭДТА. Добавляют 200-кратный избыток дитиотреитола (5 М раствор в ацетонитриле). Образец инкубируют при 40°С в течение 4 ч, после чего добавляют 3-кратный избыток (по отношению к дитиотреитолу) 4-винилпиридина (50%-ный раствор в изопропаноле). Модификацию проводят при комнатной температуре в течение 15 мин в темноте. Алкилированный пептид выделяют с помощью обращенно-фазовой ВЭЖХ на колонке Jupiter C5 (2×150 мм, 300 Å, 5 мкм; Phenomenex, США). Масса алкилированного восстановленного пептида составляет 4682,0 Да, что соответствует восьми присоединенным молекулам 4-винилпиридина (молекулярная масса 105,1 Да). Таким образом, РТ1 содержит восемь остатков цистеина, образующих четыре внутримолекулярные дисульфидные связи. Аминокислотную последовательность S-пиридилэтилированного РТ1 установливают по методу Эдмана на автоматическом секвенаторе Precise Model 492 (Applied Biosystems, США) в соответствии с методикой фирмы-изготовителя. В результате получают полную аминокислотную последовательность РТ1:
H2N-Glyl-Tyr2-Cys3-Ala4-Glu5-Lys6-Gly7-Ile8-Arg9-Cys10-Asp11-Asp12-Ile13-His14-Cys15-Cys16-Thr17-Gly18-Leu19-Lys20-Cys21-Lys22-Cys23-Asn24-Ala25-Ser26-Gly27-Tyr28-Asn29-Cys30-Val31-Cys32-Arg33-Lys34-Lys35-COOH
Расчетная моноизотопная молекулярная масса пептида составляет 3833,6 Да, отличается от измеренной на 0,1 Да. Таким образом, РТ1 не содержит каких-либо модификаций, за исключением четырех дисульфидных связей.
Пример 4. Получение рекомбинантного РТ1
Аминокислотную последовательность РТ1 преобразуют в соответствующую ей нуклеотидную с учетом частот использования кодонов у Escherichia coli. Синтезируют олигонуклеотидные фрагменты, перекрывающие полную последовательность гена РТ1, при этом «концевые» из них содержат сайты рестрикции для клонирования в плазмиду pET-32b (Novagen, США; см. таблицу 1, фиг.2).
Синтез полноразмерной последовательности РТ1 осуществляют с помощью метода лигирования-полимеразной цепной реакции (ПЦР). В смесь 1 вносят олигонуклеотиды F1 и F2 (по 2 мкМ), 1 мМ АТФ и 10 ед. полинуклеотидкиназы (Promega, США) в буферном растворе для лигирования (Promega, США). Смесь 2 содержит олигонуклеотиды F, R1, R2 (по 2 мкМ) и 1 мМ АТФ в буферном растворе для лигирования. Для проведения реакции фосфорилирования смесь 1 инкубируют в термостате при 37°С в течение 30 мин, затем для инактивации фермента прогревают при 70°С в течение 20 мин. Объединяют по 5 мкл смесей 1 и 2, инкубируют 15 мин при 96°С, медленно остужают до комнатной температуры, после чего добавляют 0,5 ед. ДНК-лигазы фага Т4 (Promega, США) и инкубируют 18 ч при 16°С. Затем проводят ПЦР, используя в качестве матрицы разбавленную в 100 раз лигазную смесь с праймерами F и R. ПЦР проводят на ПЦР-амплификаторе РТС-200 (MJ Research, США). Реакционная смесь (200 мкл) содержит: буферный раствор для ПЦР (ИБХ РАН), смесь четырех дезоксинуклеотидов (0,2 мМ каждого) (Promega, США), праймерные олигонуклеотиды (20 пмоль каждого), ~1 нг матричной ДНК и 2,5 ед. Taq-полимеразы (ИБХ РАН). Условия ПЦР: денатурация (96°С) - 20 сек; отжиг (50°С) - 20 сек; элонгация (72°С) - 30 сек, 25 циклов.
Рестрикцию ПЦР-продукта и плазмиды рЕТ-32b проводят в буфере MultiCore, оптимальном для работы ферментов BamHI и KpnI (Promega, США). Для расщепления 1 мкг ДНК используют 4 ед. каждой рестриктазы. Стандартная реакционная смесь (20 мкл) содержит 2 мкл 10-кратного буфера для рестрикции и по 2 мкл стокового раствора каждого фермента. Реакцию проводят в течение 2 ч при 37°С. В качестве контроля проводят рестрикцию плазмиды каждым из ферментов по отдельности, результат оценивают по изменению подвижности вектора при электрофорезе в агарозном геле. Очистку рестрицированных фрагментов ДНК и вектора проводят с помощью электрофореза в агарозном геле с последующим выделением ДНК из геля с использованием набора реактивов Wizard SV Gel and PCR Clean-Up System (Promega, США) в соответствии с методикой фирмы-производителя.
После обработки рестриктазами KpnI и BamHI синтетический ген РТ1 и экспрессирующий вектор рЕТ-32b лигируют друг с другом. Реакционная смесь (15 мкл) содержит: 1,5 мкл 10-кратного буфера для лигирования, 10 мМ АТФ, 10 нг плазмиды, расщепленной по сайтам BamHI и KpnI, 10 нг ПЦР-продукта, расщепленного по тем же сайтам рестрикции, и 1 ед. ДНК-лигазы фага Т4. Лигазную смесь инкубируют в течение 18 ч при температуре 16°С на водяной бане. В результате получают плазмиду, кодирующую химеру белка тиоредоксина с РТ1 под контролем Т7 промотера (фиг.2).
Полученной смесью трансформируют клетки Е.coli штамма XL1 Blue с помощью электропоратора Cellject (Eurogentec, Бельгия). Для проведения трансформации 45 мкл размороженной на льду суспензии компетентных клеток помещают в кювету для электропорации и добавляют 1 мкл лигазной смеси. Параметры электроимпульса выставляют согласно рекомендациям фирмы-производителя электропоратора. После импульса к клеткам сразу же добавляют 700 мкл охлажденной на льду среды LB, суспензию инкубируют 5 мин на льду, а затем 1 ч при 37°С. Весь объем суспензии переносят на чашку Петри с твердой средой LB с добавлением ампициллина (70 мкг/мл) в качестве селективного фактора. Чашки инкубируют при 37°С в течение 18 ч. Колонии Е.coli XL1 Blue, полученные на селективной среде после проведения трансформации, рассеивают штрихами на новой чашке Петри с твердой средой LB и ампициллином (70 мкг/мл). Чашки инкубируют 18 ч при 37°С. Проводят ПЦР со специфичными к интересующей последовательности олигонуклеотидными праймерами F и R, в качестве матрицы используют тотальную нуклеиновую кислоту из полученной клеточной массы. Клеточный материал (~1 мкл) ресуспендируют в реакционной смеси (20 мкл), проводят ПЦР. Отобранные трансформанты используют для получения ночной жидкой культуры. Небольшое количество клеточного материала переносят в 5 мл жидкой среды LB с добавлением ампициллина (70 мкг/мл), суспензию инкубируют 18 ч при 37°С. Процедуру препаративного выделения плазмидной ДНК проводят с использованием набора реактивов Wizard Plus SV Minipreps DNA Purification System (Promega, США) в соответствии с методикой фирмы-производителя.
Правильность сборки и дотирования проверяют секвенированием по методу Сэнгера на приборе Model 373 DNA Sequencer (Applied Biosystems, США) с использованием реактивов ABI PRISM BigDye Terminator Cycle Sequencing Ready reaction kit, ДНК-полимеразы AmpliTaq DNA polymerase, FS (Perkin Elmer, США) и праймера рЕТ-HindSeq (5'-CTTCCTTTCGGGCTTTG-3′) в соответствии с рекомендациями указанных производителей.
Наработку химерного белка проводят с помощью контролируемой экспрессии соответствующего гена в клетках Е. coli штамма BL21(DE3). Ночную культуру клеток, трансформированных экспрессионным вектором рЕТ-320, содержащим вставку гена РТ1, разбавляют в 200 раз жидкой питательной средой LB с антибиотиком ампициллином (100 мкг/мл). Клетки инкубируют при 37°С и перемешивании (200 об/мин) до достижения оптической плотности OD620=0,6, после чего к культуре добавляют индуктор (изопропил-β-D-1-тиогалактопиранозид, ИПТГ; 0,2 мМ) и инкубируют при комнатной температуре в течение 18 ч.
Клетки осаждают центрифугированием (10 мин, 4500 об/мин) и ресуспендируют в 25 мл стартового буфера для аффинной хроматографии (см. ниже) с добавлением 1% Тритона Х-100. Разрушение клеточных структур проводят с использованием ультразвукового дезинтегратора СРХ 750 (Cole-Parmer Instruments, США) при постепенном увеличении амплитуды от 25 до 35% с шагом в 2%. Выделение гибридного белка проводят с помощью аффинной хроматографии. Клеточный лизат наносят в стартовом буфере (50 мМ Трис-HCl, рН 8, 300 мМ NaCl) на колонку объемом 3 мл со смолой TALON Superflow Metal Affinity Resin (Clontech, США) со скоростью потока 1 мл/мин. Для исключения возможности неспецифической сорбции колонку промывают 50 мМ Трис-HCl, рН 8, содержащим 500 мМ NaCl, 5%-ный глицерин (v/v), 1%-ный Тритон Х-100 (v/v), 5 мМ имидазол. Для элюции целевого белка используют буфер, содержащий 50 мМ Трис-HCl, рН 8, 300 мМ NaCl, 150 мМ имидазол. Детекцию осуществляют по оптическому поглощению элюата при 280 нм. Контроль за выделением и очисткой гибридного белка ведут с помощью электрофореза аликвот получаемых фракций в полиакриламидном геле (фиг.3А).
Полученный слитный белок подвергают обессоливанию на колонке Jupiter C5 (4,6×150 мм, 300 Å, 5 мкм; Phenomenex, США). Элюцию осуществляют ступенчатым изменением концентрации ацетонитрила (0-70%) в 0,1%-ной ТФУ со скоростью потока 1 мл/мин. Белок высушивают на вакуумном концентраторе, растворяют в 50 мМ Трис-HCl, рН 8, конечная концентрация белка составляет ~1 мг/мл. К раствору белка добавляют раствор каталитической субъединицы энтерокиназы человека (ИБХ РАН) из расчета 1 ед. на 1 мг белка, гидролиз проводят при комнатной температуре в течение 18 ч. Разделение продуктов гидролиза гибридного белка проводят на колонке Jupiter С4 (250×10 мм, 300 Å, 10 мкм; Phenomenex, США) в линейном градиенте концентрации ацетонитрила (0-40% за 60 мин, 40-80% за 20 мин) в 0,1%-ной ТФУ при скорости потока 2 мл/мин. Детекцию осуществляют по оптическому поглощению элюата при 210 и 280 нм (фиг.3Б). В результате получают выход рекомбинантного РТ1 3 мг с 1 л бактериальной культуры. Идентичность рекомбинантного и природного пептидов доказывают при помощи масс-спектрометрии, N-концевого секвенирования, сравнения хроматографических подвижностей, а также биологических свойств.
Пример 5. Электрофизиологические исследования проводимости Р2Х3 рецепторов в культуре нейронов из ганглиев дорсальных корешков спинного мозга крыс
Нейроны для экспериментов выделяют из ганглиев дорсальных корешков спинного мозга (заднекорешковых ганглиев) 9-12 дневных крыс линии Wistar. Крысам быстро отрезают голову, затем вскрывают спинномозговой канал. По бокам спинномозгового канала в межреберном пространстве находятся ганглии, которые аккуратно вынимают с помощью пинцета и переносят в чашку Петри, наполненную внеклеточным раствором (130 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2, 2 мМ MgCl, 20 мМ HEPES, рН 7,4) комнатной температуры. После получения достаточного количества ганглиев их переносят в заранее подготовленный раствор ферментов (1 мг трипсина и 2 мг коллагеназы в 2 мл внеклеточного раствора), нагретый до 35°С. Ганглии в ферментном растворе инкубируют в течение 10 мин. Затем ганглии тщательно промывают чистым (без ферментов) внеклеточным раствором в другой чашке Петри. Из промытых ганглиев выделяют одиночные клетки с помощью тонких игл. Чашка с одиночными клетками переносится в электрофизиологическую установку. Эксперименты начинают после того, как все клетки осядут на дно чашки через ~30 мин после выделения.
Электрофизиологическое тестирование проводится с использованием классического метода "patch clamp" в конфигурации отведения напряжения от целой клетки ("whole cell") с применением подхода быстрого приложения вещества (агониста), которое связывается с Р2Х3 рецепторами и вызывает открытие ионного канала. Электрофизиологическая установка состоит из трех частей: микроскопа, системы приложения веществ на клетку («прыгающий столик»; Pharma Robot, Украина) и системы регистрации токов, протекающих через каналы в плазматической мембране клетки. Прыгающий столик является важнейшим элементом системы приложения веществ на клетку. Выделенные нейроны в чашке Петри располагают под микроскопом с фазовым контрастом на установке. Для эксперимента выбирают клетки диаметром 8-12 мкм. К выбранной клетке подводят стеклянную пипетку-электрод, заполненный внутриклеточным раствором (120 мМ CsF, 10 мМ Трис-HCl, рН 7,2), в результате формируется плотный контакт между пипеткой и клеточной мембраной с сопротивлением порядка ГОм. Затем клетку на пипетке поднимают со дна чашки и помещают в аппликационную трубку. Растворы, используемые в эксперименте, находятся в камерах прыгающего столика. В опыте используются четыре типа растворов: раствор №1 - базовый внеклеточный раствор, в котором хранятся полученные клетки, раствор №2 - базовый раствор с добавлением агониста в необходимой концентрации, раствор №3 - базовый раствор с РТ1 в необходимой концентрации, раствор №4 - базовый раствор с агонистом и РТ1 в необходимых концентрациях. Аппликационную трубку, в которой находится пипетка с исследуемой клеткой, опускают в камеру с раствором агониста. Камеру выбирают, поворачивая столик. После опускания аппликационной трубки в камеру открывается клапан, и под действием гидростатического давления в аппликационную трубку всасывается раствор из камеры прыгающего столика. Во время всасывания раствора в аппликационную трубку (приложения раствора) регистрируют ионный ток, проходящий через мембрану клетки. Сразу после этого (менее чем за 2 сек) аппликационная трубка перемещается в камеру с базовым внеклеточным раствором. Раствор из камеры затягивается в аппликационную трубку и омывает клетку. Таким образом осуществляется «отмывка» клетки от агониста. Процедуру отмывки проводят не менее 15 раз на протяжении 3 мин. Через 3 мин после приложения агониста процедуру повторяют по той же схеме. Три последовательных приложения агониста, которые приводят к регистрации трех идентичных ионных токов, считают статистически достоверным контролем. После получения контрольных токов к клетке прикладывают исследуемое вещество (РТ1) в разных концентрациях. Далее повторяют процедуру прикладывания агониста вместе с РТ1, при которых также регистрируются токи. После прикладывания агониста вместе с РТ1 отмывку клетки от агониста также проводят на фоне РТ1. Последовательное приложение агониста с РТ1 прекращают, когда амплитуда Р2Х3-опосредованого тока остается неизменной. Отношение амплитуды контрольного тока к установившейся амплитуде тока на фоне определенной концентрации РТ1 является показателем эффективности действия данной концентрации РТ1 и наносится в виде точки на график зависимости доза-эффект.
Добавление агониста во внеклеточный раствор, который омывает нейрон (приложение агониста), вызывает электрохимический ответ - открытие в плазматической мембране нейрона каналов, через которые протекает ионный ток. Ток регистрируется при комнатной температуре с помощью усилителя модели 2400 (А-М Systems, США). Электроды для электрофизиологических исследований изготовляют из боросиликатного стекла на специальной установке Р-97 Flamming/Brown (Sutter Instrument, США), их сопротивление составляет 3-5 МОм. Токи регистрируют при поддерживаемом потенциале -60 мВ, который близок к естественной величине потенциала покоя нервных клеток. В качестве агонистов, которые вызывают Р2Х-опосредованые токи, используют аденозинтрифосфат (АТФ) и цитидинтрифосфат (ЦТФ). Ток с быстрой фазой нарастания (до 12 мсек) и быстрой фазой спада (до 500 мсек) соответствует току, опосредованному Р2Х3 рецепторами. Р2Х3 рецептор имеет три основных конформационных состояния: закрытое, открытое, нечувствительное (десенситизированное). В отсутствие агониста во внеклеточном растворе рецептор находится в закрытом состоянии. Приложение агониста вызывает переход рецептора из закрытого состояния в открытое (активация). Далее рецептор переходит из открытого состояния в нечувствительное к агонисту состояние (десенситизация). Удаление агониста из внеклеточного раствора приводит к переходу комплекса из нечувствительного состояния в закрытое состояние (выход из десенситизации). Время активации комплекса при использовании обоих агонистов составляет от 2 до 4 мсек. Время десенситизации комплекса при использовании обоих агонистов составляет 20-100 мсек. Время выхода комплекса из десенситизации сильно зависит от агониста и составляет ~30 мин для АТФ и ~2 мин для ЦТФ. Действие РТ1 на каждое из состояний анализируют, подбирая соответствующий протокол. При использовании ЦТФ в качестве агониста действуют согласно протоколу, в котором ЦТФ прикладывают раз в три минуты в насыщающей концентрации (100 мкМ).
Эффект РТ1 зависит от состояния, в котором находится рецептор. Связывание РТ1 с рецептором в закрытом состоянии выражается в увеличении амплитуды тока по сравнению с контрольной (фиг.4А). Связывание РТ1 с комплексом в нечувствительном состоянии приводит к значительному уменьшению амплитуды тока (фиг.4Б). Оба эффекта полностью обратимы. Уменьшение амплитуды тока исчезает с увеличением периода между приложениями агониста (фиг.5). Это свидетельствует о том, что РТ1 замедляет выход рецептора из десенситизации. Экспериментальные данные анализируют по уравнению Хилла. Концентрация РТ1, при которой наблюдается уменьшение амплитуды тока в два раза по сравнению с контрольным значением, (IC50) составляет 12±2 нМ, коэффициент Хилла (nH) для зависимости величины эффекта РТ1 от концентрации составляет 1,1±0,2 (фиг.6).
Пример 6. Влияние РТ1 на проводимость Р2Х3 рецепторов человека в условиях экспрессии их генов в клетках НЕК 293
Ген Р2Х3 человека (исходная плазмида pReceiver-BO2a-P2X3, GeneCopoeia, США) клонируют в вектор pIRES2-EGFP (Clonteth, США) по сайтам рестрикции ЕсоRI и ApaI. Рестрикцию плазмид pReceiver-BO2a-P2X3 и pIRES2-EGFP проводят в буфере MultiCore. Для расщепления 1 мкг ДНК используют по 2 ед. рестриктаз EcoRI и ApaI (Promega, США). Стандартная реакционная смесь (20 мкл) содержит 2 мкл 10-кратного буфера для рестрикции и по 1 мкл стокового раствора каждого фермента. Реакцию проводят в течение 1 ч при 37°С. В качестве контроля проводят рестрикцию плазмид каждым из ферментов по отдельности.
После обработки рестриктазами ген Р2Х3 и вектор pIRES2-EGFP очищают и лигируют друг с другом. Реакционная смесь (15 мкл) содержит: 1,5 мкл 10-кратного буфера для лигирования, 10 мМ АТФ, 10 нг расщепленной по сайтам EcoRI и ApaI плазмиды, 10 нг расщепленного по тем же сайтам рестрикции фрагмента ДНК, кодирующего Р2Х3, и 1 ед. ДНК-лигазы фага Т4. Лигазную смесь инкубируют в течение 18 ч при температуре 16°С на водяной бане. Отбор клонов и выделение целевой плазмиды проводят аналогично процедуре, описанной в примере 4, используя в качестве селективного антибиотика канамицин (30 мкг/мл). Правильность лигирования проверяют секвенированием по методу Сэнгера на приборе Model 373 DNA Sequencer аналогично процедуре, описанной в примере 4, с использованием праймеров CF1 (5'-AGGCGTGTACGGTGGGA-3'), P2X3-F2 (5'-CTGGCCGCTGCGTGAACTAC-3'), P2X3-F3 (5′-CGTTTCTGAGAAAAGCAGCG-3′).
Полученную плазмиду pIRES2-EGFP-hP2X3 используют для трансфекции клеток НЕК 293. Для этого клетки инкубируют в среде DMEM (GIBCO Invitrogen, США), содержащей 10% эмбриональной бычьей сыворотки при 37°С в атмосфере 5% CO2. За день до проведения трансфекции клетки переносят в 24-луночный планшет и инкубируют в течение 18 ч до достижения конфлюентности клеток около 60%. Трансфекцию проводят с использованием липофектамина (Invitrogene, США). Для этого подготавливают два раствора: первый - 0,5 мкг плазмиды растворяют в 25 мкл среды DMEM без сыворотки; второй - 2 мкл липофектамина растворяют в 25 мкл среды DMEM без сыворотки. Осторожно добавляют раствор липофектамина в раствор ДНК, перемешивают, инкубируют 30 мин при комнатной температуре, добавляют 150 мкл среды DMEM без сыворотки. Меняют среду в лунках с клетками на свежую DMEM без добавления сыворотки, вносят по каплям 200 мкл разбавленного комплекса ДНК-липофектамин, осторожно перемешивают, покачивая планшет, инкубируют в течение 2 ч при 37°С в атмосфере 5% CO2. Затем меняют среду на DMEM с добавлением сыворотки, клетки инкубируют при 37°С в атмосфере 5% СО2, в течение 1-2 дней, после чего используют для проведения электрофизиологических экспериментов. В результате получают, что наблюдаемые эффекты при действии РТ1 на рекомбинантные Р2Х3 рецепторы человека в клетках НЕК 293 сходны с эффектами РТ1 на Р2Х3 рецепторы нейронов заднекорешковых ганглиев крыс, однако выражены слабее (фиг.7).
Пример 7. Селективность действия РТ1
В мембранах нейронов ганглиев дорсальных корешков спинного мозга кроме Р2Х3 рецепторов присутствуют также Р2Х2 и Р2Х2/3 рецепторы [Burgard E.C. et al. P2X receptor-mediated ionic currents in dorsal root ganglion neurons // J. Neurophysiol., 1999, V. 82, P. 1590-1598]. Для проверки влияния РТ1 на Р2Х2 и Р2Х2/3 рецепторы используют протокол, описанный в примере 5, со следующими отличиями. Так как время выхода из десенситизации Р2Х3 рецепторов очень велико по сравнению с Р2Х2 и Р2Х2/3 рецепторов, агонист прикладывают с периодом в 1 мин. В таком случае все наблюдаемые (кроме первого) ответы опосредованы только Р2Х2 и Р2Х2/3 рецепторами. Все известные в настоящее время агонисты любого из указанных рецепторов не являются селективными только к одному типу, однако чувствительность разных типов рецепторов к различным агонистам значительно отличается. В то время как чувствительность Р2Х2/3 рецептора к АТФ и к α,β-метилен-АТФ приблизительно одинакова (Kd ~30 мкМ), минимальная концентрация α,β-метилен-АТФ, необходимая для активации Р2Х2 рецепторов, составляет не менее 100 мкМ. Мембраны клеток могут содержать Р2Х2 и Р2Х2/3 рецепторы в разных соотношениях. Эквивалентность ионных токов, наблюдаемых в ответ на поочередное приложение АТФ и α,β-метилен-АТФ, свидетельствует о значительном преобладании Р2Х2/3 рецепторов в мембране клетки. Прикладывая РТ1 к такой клетке, изучают действие РТ1 на Р2Х2/3 рецепторы. В клетках, которые генерируют ионные токи разной амплитуды, большей в ответ на приложение АТФ и очень малой в ответ на приложение α,β-метилен-АТФ, мембрана содержит в основном Р2Х2 рецепторы. На таких клетках изучают влияние Р