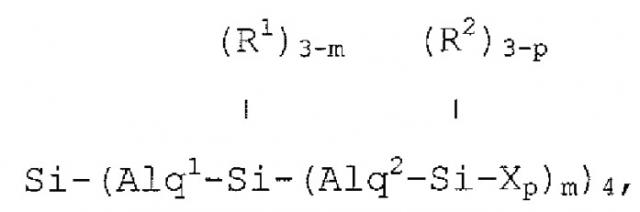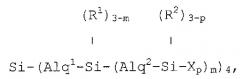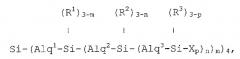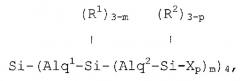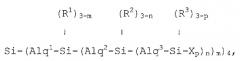Новые карбосилановые дендримеры, их получение и применение
Иллюстрации
Показать всеИзобретение относится к карбосилановым дендримерам, способу их получения и их применению. Предложены новые дендримеры, концы ветвей которых включают первичные, вторичные, третичные и четвертичные аминогруппы, способ их получения, композиция на их основе и варианты применения дендримеров. Технический результат - получение новых карбосилановых дендримеров, имеющих широкий диапазон применения в медицине, являющихся технологичными и биосовместимыми. Предложенные дендримеры могут быть использованы для транспорта анионных молекул в крови, таких как молекулы нуклеиновых кислот, включая молекулы ODN и RNAi, и других анионных лекарственных средств, с которыми они могут взаимодействовать, тем самым защищая их от взаимодействия с белками в плазме и/или усиливая степень их проникновения в целевые клетки. Дендримеры могут быть использованы для связывания анионных молекул с поверхностями, а также могут быть введены в качестве активных компонентов для предотвращения или лечения болезней, вызываемых вирусами, такими как ВИЧ или гепатит С, или прионами, жизненный цикл которых дендример способен нарушать. 14 н. и 158 з.п. ф-лы, 19 табл., 35 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение касается трехмерных молекул, называемых дендримерами, а именно тех из типа карбосиланов с концевыми фрагментами, которые содержат первичные, вторичные, третичные или четвертичные аминогруппы, способов их получения и их применения. Среди областей, где возможно их использование, на первый план выдвигается применение их в качестве носителей для нуклеиновых кислот и прочих фармакологически активных молекул с отрицательным зарядом, так как это позволяет увеличить полупериод названных лекарственных средств и их биологическую усвояемость и сократить дозу, необходимую для достижения желаемого биологического действия. Еще одной областью применения дендримеров согласно изобретению являются предотвращение или лечение болезней, вызываемых микроорганизмами, чьи структуру и/или жизненный цикл они нарушают.
Уровень техники
Дендримеры привлекли к себе повышенное внимание в последние годы благодаря возможности их использования в чрезвычайно разнообразных областях, таких как катализ на наноуровне, химические сенсоры, мономолекулярные мицеллы, имитация ферментативной активности, инкапсулирование молекул, распознавание на молекулярном уровне, диагностические средства, а также в качестве переносчиков для транспорта генов и лекарственных средств. Прекрасные обзоры, которые охватывают все эти области применения, опубликованы в литературе[1,31-38].
Одну из областей, где дендримеры были исследованы с наибольшей полнотой, представляет Генная Терапия (введение генного материала в клетку в терапевтических целях). До настоящего времени наиболее широко применяемыми переносчиками в транспорте нуклеиновых кислот были вирусные векторы. Однако использование вирусных векторов было связано с появлением некоторых проблем, таких как неблагоприятные иммунологические эффекты, лимфопролиферативные эффекты, связанные с нарушением регуляции онкогенов в человеческом геноме[2], и т.д. В попытках разрешить эти проблемы были разработаны другие типы невирусных переносчиков, такие как катионные липосомы, полимеры и также, как уже было упомянуто, дендримеры. Каждая из этих катионных систем формирует электростатические комплексы с нуклеиновыми кислотами, которые называются, соответственно, липоплексы, полиплексы или дендриплексы.
Применение липосом в качестве агентов трансфекции было первоначально описано в 1987 году[3]. Метод, наиболее употребимый для распределения генов, представлял собой инкапсулирование в катионных липидах, кстати, некоторые из этих производных, такие как CytofectinTM или LypofectinTM, доступны в продаже. Однако эти производные проявляют также побочные действия, такие как воспалительная реакция легких, и такие проблемы, как неудачная трансфекция в присутствии сыворотки[4].
Что касается общепринятых деградируемых полимеров, то применение их в качестве переносчиков имеет основным недостатком их термодинамическую нестабильность, которая создает активные частицы с очень коротким полупериодом in vivo[5].
Наибольшее преимущество дендримеров в области невирусных переносчиков состоит в единообразной структуре и в возможности самыми разнообразными способами модифицировать их скелет и поверхность, что позволяет точно охарактеризовать комплекс (нуклеиновая кислота/вектор) и систематически изучить способ трансфекции. Первая публикация, в которой было описано применение древовидно-разветвленных молекул как агентов трансфекции, появилась в 1993 году и представляла использование дендримеров, названных РАМАМ[6] (полиамидоамин), и с тех пор было проведено огромное количество исследований[7,39,40]. Применение этих дендримеров в качестве переносчиков основано на том факте, что при физиологическом значении рН некоторые из концевых групп протонируются, сообщая РАМАМ-дендримеру результирующий положительный заряд, хотя некоторые аминогруппы все же остаются непротонированными. Хорошие результаты трансфекции были также достигнуты с этими дендримерами, в особенности с дендримерами шестой и седьмой генераций, однако эффективность этого способа может быть повышена на два или три порядка величины, когда используются РАМАМ-дендримеры, активированные тепловой обработкой, как в случае с SuperfectTM или PolyfectTM.
Еще один класс потенциальных агентов трансфекции представляют дендримеры, которые содержат атомы фосфора[8], синтезированные Majoral и др. вплоть до двенадцатой генерации. В этом случае поверхность дендримеров была функционализирована протонированными или метилированными третичными аминами и была протестирована в качестве агентов трансфекции гена люциферазы клеток 3Т3. Эффективность увеличивается по мере нарастания генерации дендримера вплоть до достижения постоянной величины между третьей и пятой генерациями. Далее, мы должны подчеркнуть, что эти дендримеры проявляют лучшую эффективность трансфекции в присутствии сыворотки.
Наконец, другие макромолекулы, такие как полипропиленимин - (PPI)[9] или полилизин-дендримеры[10,41], проявились как системы для транспорта ДНК или олигодезоксинуклеотидов (ODN). Например, дендримеры из низших генераций PPI показали явную способность к in vitro трансфекции при низкой токсичности, хотя использовать более высокие генерации оказалось невозможным ввиду нарастания их токсичности.
Со своей стороны, олигонуклеотиды (ODN) исследуются в медицинских областях применения в различных направлениях. Так, например, антисмысловые олигонуклеотиды (ODNs) представляют собой короткие синтетические последовательности (15-30 оснований в длину) ДНК или аналогов, которые являются комплементарными (или антисмысловыми) целевой последовательности (последовательность РНК или последовательность ДНК, комплементарная таковой, из которой могла быть транскрибирована эта РНК), предназначенные для препятствования биологическим актам, таким как транскрипция, трансляция или явления расщепления и сплайсинга[11]. Эти молекулы предназначены для взаимодействия в качестве комплементарных последовательностей целевой информационной РНК, препятствуя синтезу белков путем деградации информационной РНК (mRNA) действием рибонуклеазы (RNase) или вмешательством в считывание рибосомой. Это называется «антисмысловой терапией». Антисмысловые олигонуклеотиды (ODNs) были использованы в разнообразных областях с 1978 года (противораковая терапия и инфекционная болезнь, главным образом), и до нынешнего времени, когда, после периода сомнений, антисмысловые олигонуклеотиды (ODNs) проявили свое значение как мощный инструмент в Молекулярной Биологии, в особенности после утверждения Американским Управлением по контролю за продуктами и лекарствами (FDA) антивирусного препарата Formivirsen[12], антисмыслового ODN, показанного при офтальмологической инфекции цитомегаловирусом (CMV) в контексте ВИЧ-инфекции. Еще один антисмысловый ODN, GEM231, постулирован как молекула с потенциальной возможностью применения против различных неоплазий[13]. Этот подход также исследуется на предмет возможности его применения в изотопной маркировке опухолей с использованием Позитронной Эмиссионной Томографии[14]. Более того, существует тип антисмыслового ODN, который, как предполагается, может действовать на уровне клеточной ДНК: они представляют собой сформированные в виде тройной спирали олигонуклеотиды (ODNs), некоторые из каковых предназначены для использования их в области ВИЧ-инфекций[15].
Еще одна, совершенно иная область состоит в использовании олигонуклеотидов (ODN), содержащих много неметилированных CpG-последовательностей, в качестве иммуномодуляторов. Эти последовательности управляют иммунной реакцией на Th1 профиль, характеризуемой усиленной секрецией Интерферона, фактора некроза опухоли, интерлейкина-2 и прочих факторов, которые усиливают способность иммунной системы удалять такие болезнетворные микроорганизмы, как вирусы и бактерии. Эти олигонуклеотиды (ODN) взаимодействуют с рецепторами на поверхности лимфоцитов, подобными таковым из семейства Toll-подобных рецепторов. Они исследуются для усиления иммунного ответа у иммунодефицитных пациентов и в контексте аллергических заболеваний, характеризуемых Th2-балансом, с целью сведения этого профиля к Th1[16].
Одна из главных проблем терапии с использованием ODN состоит в достижении уровней, достаточных для того, чтобы добиться терапевтического действия. Необходимо вводить большие количества олигонуклеотидов (ODN) для достижения биологического эффекта, так как они проявляют сильную склонность к связыванию с белками плазмы, такими как альбумин[17]. Связывание с белками плазмы и другими белками клеточной поверхности также считается ответственным за некоторые токсические действия олигонуклеотидов (ODN) in vivo (активация каскада комплемента, гемолиз, тромбоцитопения и т.д.)[18]. Поэтому считается, что применение переносчика, который предотвращает вышеупомянутое связывание с белками, могло бы обеспечить создание более высоких уровней активных олигонуклеотидов (ODN), более того, увеличить их полупериод и снизить их токсичность.
Проблема взаимодействия с белками и их связывания с ними существует также и для многих других субстанций, таких как лекарственные препараты, так как белки в общем (и белки плазмы в частности: альбумин, гликопротеины, липопротеины) содержат функциональные группы, которые потенциально способны взаимодействовать с веществами, присутствующими в среде, включая введенные лекарственные препараты. Это связывание является определяющим фактором распределения названных лекарственных средств при условии, что связанная доля лекарственного средства ввиду утраты способности к переносу не формирует часть сосудисто-тканевого баланса («резервуар»), не участвует в метаболизме, не выводится из организма и не оказывает никакого действия (если иное не определено вышеназванным связыванием).
Связывание белков плазмы (РРВ), без сомнения, составляет самый важный и определяющий фактор распределения лекарственных препаратов, так как связывание с тканевыми белками, в общем, сильно сокращено. Между прочим, это обусловлено тем фактом, что концентрация белков в плазме гораздо более высокая, чем интерстициальная концентрация в тканях, чьи белки, кроме того, обладают очень малой подвижностью и менее способны связывать субстанции, каковое свойство которых особенно значительно в случае альбумина, преобладающего белка в плазме в нормальных условиях, и с которым связываются, главным образом, кислотные лекарственные средства (хотя и некоторые щелочные тоже), в то время как кислые гликопротеины связывают эти щелочные лекарственные субстанции.
| Кислотные лекарственные препараты (альбумин) | Щелочные лекарственные препараты (альбумин-I1 кислый гликопротеин) |
| Аспирин | Хлордиазепоксид |
| Фуросемид | Диазепам |
| Пенициллин | Лидокаин |
| Фенитоин | Хинин |
| Толбутамид | Амитриптилин |
| Варфавин |
Поскольку структура альбумина с точки зрения связывания лекарственного средства является довольно сложной, могут быть определены две главных точки связывания, или локусы.
| ТОЧКА I («для вартавина») | ТОЧКА II («для диазепама») |
| Хлортиазид | Бензодиазепины |
| Фуросемид | Ибупрофен |
| Налидиксовая кислота | Клоксациллин |
| Салициловая кислота | Салициловая кислота |
| Толбутамид | Толбутамид |
| Индометацин | Индометацин |
Поэтому проблема связывания с белками плазмы затрагивает не только олигонуклеотиды (ODN), но также почти все общеупотребительные лекарственные препараты. Многих из этих проблем тоже можно было бы избежать применением переносчиков. Представляется вполне ясным, что переносчик, разрабатываемый для этой цели, должен иметь ряд характеристик, таких как:
- нетоксичный;
- неаллергенный (за исключением использования для вакцинации);
- биосовместимый;
- имеющий функциональные группы, пригодные для обеспечения химической фиксации;
- с ограниченным накоплением в организме;
- сохраняющий активность комплекса «лекарственное средство/олигонуклеотид (ODN)» вплоть до достижения зоны действия.
Более того, представляется очевидным, что разрабатываемый переносчик должен со временем высвобождать олигонуклеотид (ODN) или транспортируемое лекарственное средство с тем, чтобы оно смогло выполнить свое действие. В этом аспекте разработка переносчиков, которые обеспечивали бы контролируемое высвобождение олигонуклеотида (ODN) или определенных лекарственных препаратов, была бы очень желательной, чтобы добиться стабильно поддерживаемых уровней активной субстанции в организме с постепенно реализуемым действием их. По всем этим причинам, применение дендримеров представляет возможность, которая удовлетворяет желаемым требованиям, поскольку они могут действовать в качестве переносчиков активных субстанций, каковые могли бы защищать последние от разложения ферментами плазмы и от взаимодействия с белками, с которыми они могли бы связываться, тем самым повышая их уровни в крови и обеспечивая более высокую и/или более продолжительную активность. Олигонуклеотиды (ODNs), в частности, подобно многим обсуждаемым здесь лекарственным средствам, являются анионными молекулами (с отрицательным зарядом), по каковой причине применение в качестве их переносчиков дендримеров с группами, которые облегчают взаимодействие с ними, и, в особенности, таких дендримеров, которые имеют катионную природу при физиологическом значении рН, представляет собой весьма подходящий выбор, чтобы гарантировать стабильность комплекса в способе его транспорта. Поэтому изобретение разрабатывает новые дендримеры, а именно карбосиланового типа, и раскрывает варианты их использования, среди прочих, в качестве переносчиков для транспорта олигонуклеотидов (ODNs) и других представляющих интерес анионных молекул в крови и/или прочих жидкостях организма. Это включает новую область, так как до сих пор не было опубликовано никаких исследований относительно применения дендримеров с карбосилановой структурой, растворимых в воде, в качестве переносчиков, хотя было опубликовано сообщение о биосовместимости in vitro карбосилановых дендримеров, составленных из поли(этиленоксида)[21]. Более того, только три синтетических исследования катионных карбосилановых дендримеров были опубликованы до настоящего времени[22-24], но ни один из них не соответствует представленным в изобретении.
Среди лекарственных препаратов, для которых дендримеры могут действовать как переносчики, интересную группу составляют цитотоксические лекарственные средства, предназначенные для опухолевых клеток[73, 74]. Если рассматривать эту цель, то дендримеры могут быть направлены на опухолевые клетки с фолиевой кислотой, сверхэкспрессия рецепторов которой имеет место в опухолевых клетках, по каковой причине эти дендримеры имели бы преимущество в их поглощении названными клетками по сравнению с нормальными клетками. Недавно РАМАМ-дендримеры, модифицированные фолатом на их поверхности, были использованы в качестве переносчиков изотопа бора 10В в бор-нейтроннозахватной терапии рака[75]. Далее, РАМАМ-дендримеры, конъюгированные с цисплатином, действуют как макромолекулярный переносчик платины, противоопухолевый препарат, который высвобождается из дендример-платинового комплекса в контролируемой форме, приводя к более значительному накоплению последнего в солидных опухолях, и при меньшей токсичности, чем у свободного цисплатина[76]. Еще одна альтернатива контролируемого высвобождения состоит в создании ковалентных связей между дендримером и лекарственным средством с тем, чтобы это были биодеградируемые связи при физиологическом значении рН, как было испытано на дендримерах с первичными аминогруппами на поверхности и частично модифицированных 1-бромацетил-5-фторурацилом с образованием лабильной амидной связи, которая гидролизуется in vitro при физиологическом значении рН, в контролируемом режиме выделяя 5-фторурацил, мощный противоопухолевый препарат.
Другие представляющие интерес субстанции, для транспорта которых дендримеры могут быть применимыми, являются такими, которые становятся токсичными после их облучения благодаря in situ образованию небольших количеств кислорода в синглетном состоянии, каковой оказывает вредоносное физиологическое влияние[69]. Были опубликованы статьи о дендримерах, несущих фоточувствительные лекарственные препараты, например, с 5-аминолевулиновой кислотой на периферии, с предположением о перспективности этих дендримерных агентов в лечении кератиноцитарных опухолей[70]. Как возможные средства лечения солидных опухолей, дендримеры были оценены по полиарилэфирным дендримерам, содержащим протопорфирин как фотосенсибилизатор[71].
Дополнительная группа лекарственных препаратов, для которых дендримеры могли быть предложены как интересные переносчики, составлена такими лекарственными средствами, как нестероидные противовоспалительные препараты, которые проявляют побочные действия, такие как желудочно-кишечные альтерации или почечная токсичность, которых можно избежать, поскольку они вводятся трансдермальным путем, вместо классических орального или парентерального путей. Есть сведения, которые показывают, что если присутствие дендримеров, связанных с введенными лекарственными препаратами, ведет к кожным изменениям, которые увеличивают ее проницаемость[72], то это становится хорошей возможностью использования их в трансдермальной доставке лекарственных средств.
Поливалентность функциональных групп на поверхности дендримеров означает огромное разнообразие молекул, которые они могут транспортировать, даже включая дендримеры с различными функциональными группами: они представляют собой кластерные тектодендримеры, которые исследуются благодаря огромным потенциальным возможностям применения их в биомедицинских областях.
Потенциальные возможности дендримеров для транспорта лекарственных средств основываются не только на использовании возможных взаимодействий с внешней поливалентной поверхностью дендримера, но и на том факте, что структура дендримеров может быть использована для заключения в нее молекул, которые желательно транспортировать. Примером использования полостей дендримерной структуры является так называемый «дендритный бокс»[68], в котором PPI-дендример модифицирован на поверхности фенилаланиновыми группами, которые защищают внешний каркас, делая его более плотным. В способе роста дендримера молекулы различной величины инкапсулируются внутри него. Дендример может нести различное число молекул в зависимости от их размера. Когда дендример обрабатывают муравьиной кислотой, внешний каркас раскрывается, позволяя высвободить заключенные внутри молекулы.
Еще одна группа молекул, для которых дендримеры предположительно могут быть пригодными переносчиками, представляет собой молекулы с низкой молекулярной массой (такие как пептиды), против которых желательно вызывать иммунный ответ в организме, но которые, ввиду их малого размера, едва ли аллергенны или вызывают слабую реакцию после инъекции индивиду, которого желательно лечить. Эта проблема может быть разрешена путем увеличения их молекулярной массы, либо с помощью полимеризации, либо связыванием с переносчиком с высокой молекулярной массой (традиционно с белком). Дендримеры, которые имеют очень четко определенную структуру и многие функциональные группы, способны связывать антигены на своей периферии, чем представляют хорошую альтернативу для производства вакцин, которые имеют точно определенные иммуногены и которые обеспечивают высокую воспроизводимость. В этой области были разработаны МАР (мультиантигенный пептид) дендримеры[57,58], которые представляют собой клинообразные конструкции, сформированные последовательными генерациями лизиновых фрагментов. Эти дендримеры содержат большое количество первичных аминогрупп, которые могут быть связаны с низкомолекулярными антигенами, в целях повышения их иммуногенности, исключая необходимость применения белков-переносчиков. МАР-структуры, которые содержат Т и В клетки, стимулирующие пептиды Plasmodium falciparum, были использованы для генерирования иммунных ответов на этих паразитов[59]. Далее, было показано, что МАР-структуры действуют через антигенпрезентирующие клетки тем же путем, что и антигены, производные из внутриклеточных структур (например, такие как вирус), приводя к сильной иммунной реакции, включая выработку цитотоксических Т-клеток[60]. Дендримеры согласно изобретению, которые на концах своих ветвей имеют фрагменты, которые содержат аминогруппы, также могут быть использованы для вакцинации либо путем связывания ими низкомолекулярных антигенов с помощью аминогрупп, находящихся в фрагментах на концах их ветвей, либо тем, что вышеназванные фрагменты, которые содержат по меньшей мере одну аминогруппу, сами по себе представляют низкомолекулярные антигены, такие как антигены пептидной природы.
МАР-структуры были также использованы для транспорта непептидных антигенов, таких как углеводы, гаптены и т.д., в плане вакцин. Углеводы, в частности, представляют собой класс молекул, важных в биологическом распознавании. Гликодендримеры, полученные прививанием изотиоцианата маннозы, сиаловой кислоты или лактозы к концевым аминогруппам РАМАМ-дендримеров или лизиновых дендримеров, были использованы как антигены для вакцин[64,65]. В гликодендримерах с ассоциированным Т-антигенным дисахаридом βGal 1-3 αGalNAc, его способность связывания лектина (белок, который связывает углеводы) была также протестирована на специфичность к галактозе[66], с намерением использовать их для детектирования опухолей, которые экспрессируют Т-антигенные рецепторы, и направлять в них лекарственные средства. Кроме того, гликодендримеры могут быть использованы для усиления аффинности к лектинам, которые связаны с углеводом. Были найдены такие гликозилированные дендримеры[67], которые могут представлять интерес для применения в качестве микробных антиадгезинов, антагонистов токсинов, или в качестве противовоспалительных, противовирусных и противораковых лекарственных средств, так как лектин-углеводные взаимодействия были описаны в многочисленных случаях в иммунной системе (в ситуациях, которые ведут к активации клетки), в вирусных и бактериальных инфекциях, в отношении раковых заболеваний и роста клеток и т.д. Короче говоря, гликозилированные дендримеры могут имитировать природные гликоконъюгаты и эффективно взаимодействовать с природными рецепторами углеводов, давая характеристические эффекты взаимодействия с ними.
В дополнение к возможности использования их свойств для применения в качестве переносчиков, еще одна область, имеющая отношение к нуклеиновым кислотам, которые в настоящее время привлекают повышенное внимание, состоит в изготовлении микрочипов, которые содержат упорядоченные наборы последовательностей ДНК или РНК. При изготовлении этих микрочипов дендримеры выступают в качестве одной из альтернатив для поверхностей со стеклянным покрытием и реализуют свою способность к взаимодействию с нуклеиновыми кислотами, чтобы фиксировать названные молекулы на поверхности микрочипов[63]. Прочность связи между последовательностями нуклеотидов и дендримерами согласно изобретению делает их пригодными для использования их способности фиксировать нуклеиновые кислоты, чтобы служить в качестве подложки для производства этих ДНК- или РНК-микрочипов.
Наконец, существует также необходимость найти альтернативные способы борьбы с различными болезнетворными микроорганизмами, нарушая их жизненный цикл, и это та область, в которой дендримеры проявили себя как интересная альтернатива. Некоторые ранее описанные дендримеры показали себя способными ингибировать инфекцию, вызванную различными вирусами, препятствуя как попаданию вируса в клетку, так и последующим стадиям репродукции вируса. Это имеет место, например, в случае с простым герпесом (Herpes Simplex), инфицирование которым ингибируется in vitro действием дендримеров, модифицированных полилизином[50,51]. Репродукция вируса иммунодефицита человека (HIV) также была достигнута как на уровне поглощения клеткой, так и на последующих стадиях, в этом случае - применением ковалентно модифицированных РАМАМ-дендримеров, которые показали, что они способны интерферировать с обратной транскриптазой и интегразой вируса[19,52]. На основе этих свойств были разработаны вагинальные гели для предотвращения болезней, переносимых половым путем, имеющие составы на базе дендримеров, как в случае VivaGelTM (Starpharma), активным ингредиентом которого является полилизиновый дендример, функционализированный нафталиндисульфонатными фрагментами, которые представляются эффективными в профилактике ВИЧ благодаря способности связывать поверхностный гликопротеин gp120 вируса. Несмотря на то, что в разработке противовирусных дендримеров существует предпочтение для таких систем, которые имеют на своей поверхности группы, имитирующие таковые, какие присутствуют на клеточной поверхности и какие, поэтому, способны конкурировать с клетками за связывание с вирусом, создан также дендример с поверхностными амидными группами, который действует как ингибитор респираторно-синцитиального вируса, как представляется, благодаря образованию водородных связей между периферическими группами дендримера и белком слияния вируса, и поэтому предполагается, что дендримеры, функционализированные другими группами, способными образовывать водородные мостики с вирусными белками, будучи вовлеченными во взаимодействие на клеточной поверхности, также способны интерферировать с различными вирусами, подавляя вызываемую ими инфекцию.
В других случаях дендримеры были использованы в качестве антибактериальных средств или для разрушения клеточных мембран некоторых грибков. Когда они создаются для этой цели, существует предпочтение для дендримеров с катионными группами на их поверхности, такими как аминные и тетраалкиламмониевые группы, которые облегчают прилипание дендримеров к бактериальной мембране, вызывая лизис бактерии. Это касается полипропилениминных (PPI) дендримеров с третичными алкиламмониевыми группами на их поверхности, которые показали распространенную бактериальную активность против как грамположительных, так и грамотрицательных бактерий[53,54]. Эти дендримеры имеют более высокую бактерицидную способность, чем другие гиперразветвленные полимеры. Дендримеры согласно изобретению, также функционализированные фрагментами, которые содержат аминогруппы, представляют вариант, который также может быть использован для разрушения клеточных мембран бактерий или грибков.
Было также сообщено, что дендримеры обладают свойствами, которые позволяют им действовать как денатуранты белков. Некоторые типы дендримеров действуют путем снижения диэлектрической постоянной и вязкости воды и разупорядочивания ее регулярной структуры в результате реорганизации молекул воды на поверхности дендримера. Это ведет к нарушению гидрофобных взаимодействий, которое весьма дестабилизирует многие третичные структуры белков, вызывая их денатурацию: это называется «хаотропным (разобщающим)» эффектом, которым обладают денатурирующие агенты, такие как мочевина или гидрохлорид гуанидина. Очень интересная область, в которой предполагается использовать эту способность денатурировать белки, представляет собой применение для растворения прионных белков, таких как PrPSc [20]. Прионные белки способны принимать патогенную структурную организацию и вызывать смертельные невропатии, называемые губчатыми энцефалопатиями (болезнь Кройцфельдта-Якоба, болезнь коровьего бешенства», скрейпи у овец и пр.). Эти белки образуют агрегаты, которые локализуются в мозгу пораженных индивидов и растворимы только в растворителях, которые содержат детергенты как хаотропные агенты (типично шестимолярный раствор гидрохлорида гуанидина). Однако эти агрегаты могут быть переведены в растворимое состояние катионными дендримерами, такими как дендримеры PPI и РАМАМ: дендримеры более высокой генерации с бульшим количеством аминогрупп на поверхности являются наиболее эффективными. Поэтому новые дендримеры согласно изобретению, также функционализированные фрагментами, которые содержат аминогруппы, представляют новые соединения, употребимые как для растворения прионных агрегатов, так и в терапии других заболеваний, в развитии которых также происходит формирование патогенных белковых агрегатов, и, например, агрегатов амилоидных белков, которые возникают при болезни Альцгеймера[55,56].
Короче говоря, дендримеры представляют собой синтетические полимеры с хорошими свойствами для их использования в биологических областях: они предсказуемо ведут себя в растворе, они могут быть в широких пределах модифицированы для несения многообразных лигандов с биологической активностью, они могут преодолевать биологические барьеры и могут быть приготовлены с минимальными структурными дефектами. Поэтому их применение исследуется в разнообразных профилактических и терапевтических стратегиях, включая использование их для транспорта различных лекарственных средств, трансфекции олигонуклеотидных или полинуклеотидных молекул, разработки вакцин, введения в качестве антибактериальных, противогрибковых, противовирусных лекарственных препаратов или даже для снятия симптомов болезней различной этиологии, развитие которых включает формирование белковых агрегатов, таких как агрегаты прионного происхождения или отложения амилоидных белков, характерные для болезни Альцгеймера. Дендримеры согласно настоящему изобретению включают интересные альтернативы для этих областей биомедицины.
ОБЩЕЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение описывает новые разветвленные карбосилановые дендримеры с концевыми фрагментами на концах их ветвей, которые содержат первичные, вторичные, третичные или четвертичные аминогруппы, которые отвечают любой из формул:
если они представляют собой первую генерацию;
если они представляют собой вторую генерацию;
если они представляют собой третью генерацию;
или соответствующим аналогичным формулам в случае более высоких генераций, в которых формула, соответствующая каждой генерации i, должна быть результатом замещения Xp в формуле, соответствующей предшествующей генерации, новым блоком типа:
,
преобразуя группу, связанную с тем же атомом кремния, что и этот замещающий блок, и переходя с обозначения (Ri-1)3-p к обозначению (Ri-1)3-z,
формулы, в которых:
Alq1, Alq2, Alq3, …, Alqi представляют алкиленовые фрагменты из 2 до 4 атомов углерода, которые выбраны независимо друг от друга согласно длине ветвей в каждой генерации;
R1, R2, R3, …, Ri-1, Ri представляют фрагменты, которые выбраны независимо друг от друга из метила и фенила;
Х представляет фрагмент, который содержит по меньшей мере одну первичную, вторичную, третичную или четвертичную аминогруппу;
р представляет собой целое число, которое варьирует между 1 и 3;
m, n, …, z представляют собой целые числа, которые варьируют независимо между 1 и 3.
В предпочтительном варианте осуществления изобретения все фрагменты R1, R2, R3, …, Ri-1, Ri являются идентичными и соответствуют метильным группам.
В еще одном предпочтительном варианте осуществления изобретения фрагменты Alq1, Alq2, Alq3, …, Alqi выбираются из этиленового и пропиленового фрагментов. В еще одном более предпочтительном варианте выполнения изобретения все вышеназванные фрагменты идентичны и соответствуют пропиленовым фрагментам.
В еще одном из предпочтительных вариантов осуществления изобретения целые числа m, n, …, z одинаковы между собой и имеют значение 2.
В наиболее предпочтительном варианте осуществления изобретения все фрагменты R1, R2, R3, …, Ri-1, Ri являются идентичными и соответствуют метильным радикалам; фрагменты Alq1, Alq2, Alq3, …, Alqi идентичны друг другу и соответствуют пропиленовым фрагментам, и целые числа m, n, …, j одинаковы между собой и имеют значение 2.
Х представляет любой фрагмент, который содержит первичную, вторичную, третичную или четвертичную аминогруппу. Среди прочих, предпочтительны те фрагменты, в которых Х представляет либо -OCH2CH2N(CH3)2, -OCH2-(C6H3)-3,5-(OCH2CH2N(CH3)2)2, либо -OCH2CH2N(CH3)CH2CH2N(CH3)2, либо группу -CH2CH2(CH2)eNH2, в которой «е» представляет собой целое число от 0 до 2, в каковом случае предпочтительнее, чтобы оно принимало значение 1. Предпочтительными вариантами выполнения изобретения также являются такие, в которых Х представляет кватернизованные формы предыдущих фрагментов -OCH2CH2N+(CH3)3I-, -OCH2-(C6H3)-3,5-(OCH2CH2N+(CH3)3I-)2, -OCH2CH2N(CH3)CH2CH2N+(CH3)3I- или -CH2CH2CH2N+H3Cl-.
Когда Х представляет -OCH2CH2N(CH3)2, -OCH2-(C6H3)-3,5-(OCH2CH2N(CH3)2)2 или -OCH2CH2N(CH3)CH2CH2N(CH3)2, или их кватернизованные формы -OCH2CH2N+(CH3)3I-, -OCH2-(C6H3)-3,5-(OCH2CH2N+(CH3)3I-)2 либо -OCH2CH2N(CH3)CH2CH2N+(CH3)3I-, то является в особенности предпочтительным, что все ветви имеют концевые фрагменты, которые содержат аминогруппы, и что индекс «р» принимает значения 1 или 2, с тем, чтобы каждая ветвь заканчивалась бы, соответственно, единичным концевым фрагментом или двумя концевыми фрагментами. Когда Х представляет -CH2CH2CH2NH2 или его кватернизованную форму -CH2CH2CH2N+H3Сl-, то является в особенности предпочтительным, что все ветви имеют концевые фрагменты, которые содержат аминогруппы, и что «р» принимает значение 1, с тем чтобы каждая ветвь завершалась бы единичным аминным фрагментом.
Объем правовой охраны изобретения также включает случаи, в которых Х представляет антигенный фрагмент, который содержит по меньшей мере одну аминогруппу. Частным случаем вышесказанного должна быть ситуация, в которой антигенный фрагмент представляет собой пептид.
Изобретение также касается способа получения вышеназванных карбосилановых дендримеров, способ, который включает стадии:
а) получение скелета карбосиланового дендримера следующими стадиями:
а1) получение базового исходного карбосиланового дендримера формулы:
Si[(CH2)aCH=CH2]4,
где “а” варьирует между 0 и 2 согласно длине, желаемой для ветвей,
введением SiCl4 в реакцию с BrMg(CH2)aCH=CH2;
a2) получение карбосиланового дендримера первой генерации, прекурсора для дендримера высшей генерации, введением базового исходного карбосиланового дендримера из стадии а1) в реакцию с HSi(R1)3-mClm, с тем чтобы получить дендример следующей формулы:
,
где m варьирует между 1 и 3, и оно эквивалентно числу ветвей, которые могут быть созданы в следующей генерации, или числу концевых функциональных групп, которыми могут быть замещены Cl-группы