Генно-инженерная конструкция pgoatcasgcsf, обеспечивающая продукцию гранулоцит-колониестимулирующего фактора человека в молоко трансгенных животных
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и генетической инженерии, а именно к генно-инженерной конструкции pGoatcasGCSF для экспрессии гранулоцит-колониестимулирующего фактора человека (Г-КСФ). Предложенное изобретение может быть использовано для получения трансгенных животных, продуцентов гранулоцит-колониестимулирующего фактора человека. Создают генно-инженерную конструкцию pGoatcasGCSF, имеющую размер 6386 п.н., и установленную нуклеотидную последовательность, показанную в SEQ ID 1. Генно-инженерная конструкция pGoatcasGCSF включает в себя 5′-регуляторную последовательность гена αS1-казеина козы CSN1S1 размером 3387 п.н., соединенную с полноразмерным геном Г-КСФ человека размером 1485 п.н., и 3′-фланкирующую область гена CSN1S1 коровы размером 1514 п.н. Предложенное изобретение позволяет получить стабильный эффективный уровень экспрессии Г-КСФ человека в молоко трансгенных животных, а также исключить возможность эктопической экспрессии трансгена. 9 ил., 2 табл.
Реферат
Изобретение относится к области биотехнологии и генетической инженерии животных и может быть использовано для получения трансгенных животных, продуцентов белков человека.
Продукция фармакологически ценных белков человека в молоке трансгенных животных - одно из перспективных направлений современной биотехнологии. Стратегия создания сельскохозяйственных молочных животных в качестве биореакторов основана на введении в геном животных рекомбинантных генетических конструкций, содержащих последовательности генов человека, кодирующих биологически активные белки, и управляемые регуляторными элементами одного из «генов молока» коровы, козы или овцы [1, 2, 3]. Согласно этой стратегии такие трансгенные животные способны синтезировать на высоком уровне белок человека исключительно в молочной железе и секретировать его в молоко, которое, в свою очередь, становится источником для выделения белка человека [4]. В настоящее время созданы трансгенные козы, овцы, кролики, свиньи - продуценты человеческих белков. Некоторые из них, ATrin (антитромбин III), α-антитрипсин, сывороточный реактивный белок С, ММ-093 (α-фетопротеин), факторы VIII и IX свертывания крови, HGH (гормон роста человека), антималярийная вакцина, лактоферрин, кальцитонин, фибриноген, коллаген, альбумин и другие, уже проходят клинические испытания [5, 6, 7, 8].
Альтернативным источником для получения ценных биологически активных белков является технология с использованием бактериальных биореакторов, продуцирующих рекомбинантные белки. Однако система синтеза белков у бактерий не способна осуществлять посттрансляционные модификации эукариотических белков, такие, например, как гликозилирование и фосфорилирование, которые важны для их функциональной активности. Так, например, гликозилированная форма гранулоцит - колониестимулирующего фактора человека (Г-КСФ) существенно превосходит по способности стимулировать рост колоний гранулоцитов и быстрее приводит к положительному терапевтическому эффекту по сравнению с существующим коммерческим негликозилированным рекомбинантным препаратом Filgrastim, который, к тому же, обладает высоким аллергогенным потенциалом [9]. Проблема правильной посттрансляционной модификации рекомбинантных белков решается частично с использованием перевиваемых клеточных культур млекопитающих, способных, в силу наличия систем посттрансляционных модификаций, продуцировать полноценные белки человека. Недостатками этого метода являются нестабильность клеточного генома перевиваемых культур, приводящая к потере целевых генов, склонность к пермиссивным инфекциям и высокая стоимость продукта.
Получение ценных белков человека с помощью трансгенных животных-биореакторов выгодно отличается от перечисленных методов. Фармакологический рынок рекомбинантных белков, полученных из молока трансгенных домашних животных, оценивается в 1 миллиард долларов в настоящее время и прогнозируется его развитие до 18,6 миллиардов долларов к 2013 году [8]. Учитывая длительность репродуктивного периода большинства крупных животных, потенциальных продуцентов лекарственных белков человека и дороговизну экспериментов на них, тестирование новых генно-инженерных конструкций осуществляют на трансгенных мышах, что позволяет достаточно быстро отобрать из них наиболее перспективные с учетом уровня продукции требуемого белка, его биологической активности и тканеспецифичности экспрессии.
Гранулоцит - колониестимулирующий фактор человека (Г-КСФ) является ценным стимулятором кроветворения, широко применяемым в клинике при переливаниях крови, лечении последствий радио- и химиотерапии в онкологии [10, 11]. В последнее время Г-КСФ используется также в некоторых технологиях регенерационной медицины. В клинических исследованиях показано, что терапия с применением Г-КСФ предотвращает и лечит инфекции иммунонекомпетентных пациентов. Недавно появились сообщения, что Г-КСФ улучшает функции сердечной мышцы и уменьшает смертность после острого инфаркта миокарда при введении в область инфаркта стволовых клеток крови пациента. Используют в клинике рекомбинантный Г-КСФ, который получают из бактериальных клеток в виде коммерческого препарата Filgrastim. Использование прокариотов для получения рекомбинантных белков, как известно, не обеспечивает ряд посттрансляционных модификаций, в частности гликозилирование, фолдинг белка и отщепление лишнего метионина с N-конца белка, что приводит к снижению биологической активности получаемого препарата и нередко вызывает аллергические осложнения. Использование трансгенных молочных животных позволяет с минимальными затратами получать достаточное количество полноценного препарата. Создание животного-биореактора большая удача. Его потомки могут основать стадо трансгенных особей. При таком стаде трансгенных животных создается лаборатория по выделению и очистке рекомбинантного белка, который передается в соответствующие фарминституты для тестирования, проведения его предклинических и клинических испытаний и получения разрешения применения лекарства в медицинской практике.
Известны генетические конструкции с геном Г-КСФ человека под промоторами различных генов молока: гена (β-казеина с элементами β-лактоглобулина коровы (патент RU 2207373, опубл. 27.06.2003) и β-казеинового гена коровы [12]. При использовании первой конструкции получены трансгенные кролики с секрецией Г-КСФ в молоко, однако не получено потомство и не изучена эктопическая экспрессия трансгена. При использовании второй конструкции получены две трансгенные козы, у которых наблюдалась эктопическая экспрессия трансгена в легких, что неизбежно вызывает нарушение кроветворения трансгенных коз. Также не получено потомство, что не позволяет понять как трансген наследуется.
Наиболее ближайшей генно-инженерной конструкцией - прототипом является генно-инженерная конструкция pGCml, обеспечивающая секрецию рекомбинантного белка Г-КСФ в молоко трансгенных мышей [13]. Эта конструкция получена с использованием 5'-фланкирующей последовательности гена αS1-казеина коровы. Недостатком известной конструкции является то, что использованая короткая 5'-фланкирующая последовательность гена αS1-казеина коровы длиной 721 п.н. приводила к нестабильной секреции Г-КСФ человека у трансгенных мышей, которая варьировала в широких пределах от 0,008 мкг/мл до 1000 мкг/мл. Кроме того, относительно короткий промоторный район не гарантировал трансгенных мышей от эктопической экспрессии трансгена, что вызывало нежелательную стимуляцию кроветворения у некоторых трансгенных мышей.
Технической задачей изобретения является обеспечение стабильного эффективного уровня экспрессии Г-КСФ человека в молоко трансгенных животных, а также исключение возможности эктопической экспрессии трансгена.
Поставленная техническая задача достигается предлагаемой генно-инженерной конструкцией, содержащей ген Г-КСФ человека под контролем 5′-регуляторного района гена αS1-казеина козы.
Новая генно-инженерная конструкция pGoatcasGCSF состоит из следующих элементов:
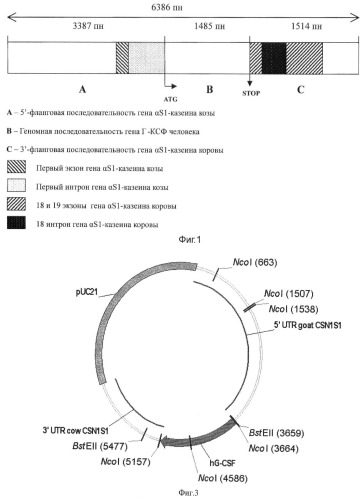
5′-регуляторной последовательности гена αS1-казеина козы (CSN1S1) размером 3387 п.н., соединенной с полноразмерным геном Г-КСФ человека размером 1485 п.н. и 3′-фланкирующей области гена CSN1S1 коровы размером 1514 п.н. Схема конструкции приведена на фиг.1. На фиг.2 представлен перечень последовательностей нуклеотидов заявляемой конструкции, показанный в SEQ ID NO. Обозначения кодирующих последовательностей приведены в соответствии со Стандартом 25 ВОИС по представлению перечней последовательностей нуклеотидов и аминокислот в патентных заявках.
5′-регуляторная область гена CSN1S1 козы была синтезирована с помощью амплификации геномной ДНК козы (праймеры: прямой - 5′ cas goat: Fw 5′- cac agc atg ctg ccc cat cac tt -3′ (23); обратный: Rev 5′- caa ggt gac cgg ttg tca aga tct atg taa gaa -3′ (33)). Этот фрагмент включает все известные регуляторные сайты, охарактеризованные к настоящему времени (CEB/R-1314/-1306; GATA-1217/-1212: MAF-753/-745: MILK BOX-157/-142: RC-132/-125: ТАТА-32/-29) [14].
3'-нетранслируемая область гена CSN1S1 коровы включает в себя 1514 п.н. вместе с экзонами 18 и 19 [праймеры: прямой Fw 5′- gtc cca tgg act cca cag tta tgg tct ttg -3′ (30); обратный: Rev 5′- ttc gag ctc ctc caa gaa gtc ctg cca aat -3′ (30)].
Полноразмерный ген, кодирующий Г-КСФ человека, был получен амплификацией геномной ДНК человека с использованием Pfu полимеразы (Stratagene) и праймеров GC1 (прямой):
5′-TATGGTCACCATGGCTGGACCTGCCACCCAGA-3′ и GC2 (обратный):
5′-ATGTCCATGGTCAGGGCTGGGCAAGGTGGCGTA-3'.
Подбор праймеров производили по опубликованной последовательности гена Г-КСФ (Х03656). Праймер GC1 содержал сайт для рекстриктазы BstEII, а праймер GC2 - для рекстриктазы NcoI. Продукт амплификации размером 1485 п.н. представлял собой ген Г-КСФ, включая дополнительные последовательности, необходимые для конструирования.
Предлагаемая конструкция, названная pGoatcasGCSF, отличается тем, что впервые используются регуляторные районы гена казеина козы для создания продуцентов именно этого вида сельскохозяйственных животных. Ранее подобные конструкции традиционно включали промоторные районы генов казеинов коровы. Необходимо подчеркнуть, что pGoatcasGCSF обеспечивает секрецию рекомбинантного белка Г-КСФ человека исключительно в молочной железе лактирующих самок. Это важный параметр поведения трансгена, особенно для биологически активных белков, к которым относятся стимуляторы гемопоэза и, в частности, Г-КСФ.
Тестирование конструкции pGoatcasGCSF для оценки ее эффективности проводили на трансгенных мышах.
Методом микроинъекций очищенной ДНК рекомбинантной конструкции в пронуклеусы зигот мышей были получены трансгенные потомки, послужившие основателями 4 трансгенных линий мышей в 4-5 поколениях не менее 50 особей в каждой из них. На них были изучены основные характеристики поведения конструкции pGoatcasGCSF после ее встраивания в геном мыши. Это позволило изучить основные свойства конструкции и параметры ее экспрессии и показать, что:
1. Эффективность интеграции трансгена в геном мыши находится на уровне 7,8%;
2. Трансген pGoatcasGCSF стабильно наследуется в ряду поколений по аутосомному типу;
3. Уровень экспрессии Г-КСФ человека в молоко трансгенных самок всех линий находится в пределах 10-100 мкг/мл;
4. Важнейшей позитивной характеристикой трансгена pGoatcasGCSF является отсутствие его эктопической экспрессии, то есть синтеза в других органах и тканях;
5. Гликозилирование Г-КСФ человека в молоке трансгенных мышей сходно с таковым природного Г-КСФ человека;
6. Г-КСФ человека у трансгенных мышей обладает высокой биологической активностью в тесте по стимулированию роста кроветворных колоний нейтрофильного ряда в культуре клеток пуповинной крови человека.
Полученные результаты позволяют рекомендовать данную конструкцию для получения трансгенных коз.
Изобретение иллюстрируется следующими примерами конкретного выполнения.
Пример 1. Выделение и очистка заявляемой генной конструкции pGoatcasGCSF для микроинъекций.
На фиг.2 представлена полная нуклеотидная последовательность генно-инженерной конструкции pGoatcasGCSF, где: 1-3387 п.н. 5′-регуляторная последовательность гена CSN1S1 козы, 3388-3394 п.н. сайт для рестриктазы BstEII, 3395-4880 п.н. ген hG-CSF человека, 4880-4886 п.н. сайт для рестриктазы NcoI, 4887-6400 п.н. 3′- фланкирующая область гена CSN1S1 коровы. Общая длина генно-инженерной конструкции составила 6400 п.н. (из которых 14 п.н. - сайты рестрикции BstEII и NcoI).
Генная конструкция pGoatcasGCSF была построена на основе вектора pGCml, созданного и описанного ранее [13]. При этом 5′-фланкирующая последовательность бычьего гена CSN1S1 размером 721 п.н. была заменена на 5′-фланкирующую последовательность гена CSN1S1 козы размером 3387 п.н., включающую его промотор.
5′-фланкирующая последовательность гена CSN1S1 козы была получена с помощью ПЦР из геномной ДНК козы. При этом были включены сайты узнавания для рестриктаз Sphl и BstEII. ПЦР была проведена с помощью фермента AccuPrime TaqPol (Invitrogen). Продукт амплификации был клонирован и секвенирован. Генную конструкцию pGCml обрабатывали рестриктазами Sphl(полный гидролиз) и BstEII (неполный гидролиз). Продукт рестрикции размером 6201 п.н., содержащий ген Г-КСФ человека и 3′-нетранслируемую область гена CSN1S1 коровы, был лигирован с 5′-фланкирующей последовательностью гена CSN1S1 козы.
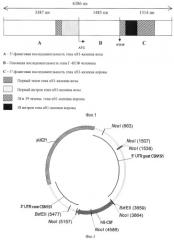
Конструкция pGoatcasGCSF была встроена в плазмидный вектор, схема которого приведена на фиг.3: 1-270 п.н. вектор pUC21, 271-3657 п.н. 5′- регуляторная последовательность гена CSN1S1 козы, 3658-3664 н.п. сайт для рестриктазы BstEII, 3665-5150 н.п. ген hG-CSF человека, 5151 - 5156 н.п. сайт для рестриктазы NcoI, 5157-6670 н.п. 3′- фланкирующая область гена CSN1S1 коровы и 6671-9588 н.п. вектор pUC21. Общая длина плазмиды, включающая генно-инженерную конструкцию, составила 9588 п.н., а размер генной конструкции в ее составе составляет 6386 п.н. (без 14 п.н. сайтов рестрикции).
Полученная генная конструкция была проверена с помощью рестриктного анализа и секвенирована на факт отсутствия возможности мутирования при использовании ПЦР технологии. Для этого ее ДНК была обработана рестриктазой Sall с целью последующего разделения и очистки от последовательности плазмидного вектора pUC21.
Электрофорез рекомбинантной ДНК проводили в 0,7% агарозном геле с добавлением красителя кристаллический фиолетовый. Для выделения целевого фрагмента из агарозного геля использовали колонки QIAquic Gel Extraction Kit ("Qiagen") в соответствии с рекомендациями изготовителя с последующей дополнительной очисткой на колонках "Schleicher-Schnell". Очищенную таким образом ДНК растворяли в буфере (0,001М Tris-HCl, 0,25 мМ EDTA, рН 7,4) до концентрации 5-8 нг/мкл и использовали для микроинъекций..
Пример 2. Получение и идентификация трансгенных мышей.
Эксперименты проводили на мышах линии С57В1/6 и CBA/Lac и их гибридах. Трансгенных животных получали стандартным методом микроинъекции раствора рекомбинантной ДНК в мужской пронуклеус оплодотворенной яйцеклетки [15, 16]. Донорами яйцеклеток служили 2-2,5-месячные самки СВА, спаренные с самцами С57В1/6, или гибридные самки F1 (С57В1/6 × CBA/Lac), покрытые такими же самцами. Микроинъекцию проводили в мужской пронуклеус зиготы под инвертированным микроскопом "Olympus" (Япония) с интерференционной оптикой Номарского и микроманипуляторами Narishige (Япония). На фиг.4 представлен момент введения ДНК в мужской пронуклеус зиготы мыши с помощью микроинъекции (× 240).
Инъецированные неповрежденные зиготы трансплантировали псевдобеременным самкам, спаренным предварительно с вазэктомированными самцами. Трансплантацию зигот проводили под общим наркозом (авертин, 0,25 мл, внутрибрюшинно) по 10-15 зигот на одну самку.
Полученное потомство анализировали на интеграцию конструкции. Выделение ДНК проводили из тканей кончика хвоста мышей по общепринятой методике [17].
Идентификацию трансгенных животных проводили с помощью полимеразной цепной реакции с использованием двух пар праймеров: PrA (прямой): 5′-ААА GGA ТАА GGC ТАА TGA GG-3′ (20), PrB (обратный): 5′-CGT TGT ACT TTT GTA CTG AGC-3′ (21); PrC (прямой): 5′-TCT GCA AAA GCA GGC ТАА AGG-3′ (21), PrD (обратный): 5′-GCC AAG АСА СТС ACC CAT CAG-3′ (21). С использованием первой пары праймеров (PrA, PrB) получается продукт размером 705 п.н. С использованием второй пары (PrC, PrD) получается продукт размером 531 п.н. Позиции праймеров в конструкции следующие: PrA - во второй половине гена Г-КСФ человека (в положении 4543), PrB - в начале 3′-polyA казеина (в положении 5247), PrC - в конце промотора (в положении 3188), PrD - в начале гена Г-КСФ человека (в положении 3718).
В реакционную смесь объемом 23 мкл, содержащую 2,5 мМ MgCl2, по 1 мкМ прямого и обратного праймера, 0,5 ед Taq-полимеразы, буфер (20 мМ Tris-HCl рН 8,4; 50 мМ КС1), по 0,2 мМ каждого дезоксинуклеотида (dATP, dCTP, dGTP, dTTP), добавляли по 2 мкл исследуемой ДНК и помещали в пробирки Eppendorf объемом 0,5 мл. Условия ПЦР: денатурация геномной ДНК при 95°С в течение 3 мин, с последующей амплификацией (35 циклов), денатурация при 95°С - 30 с, отжиг праймеров на матрице при температуре 55°С - 30 с, элонгация при 72°С - 30 с. ПЦР проводили на автоматическом амплификаторе РТС-100 (MJ Research Inc.). ПЦР продукт хранился при -8°С.
Из 327 трансплантированных после микроинъекции ДНК зигот был получен 51 потомок, что составило 15,6%. Эффективность рождаемости соответствует общепринятым нормам (15-30%). Это свидетельствует о том, что вводимая ДНК не являлась токсичной или тератогенной [15]. На фиг.5 представлены результаты анализа выделенной ДНК от новорожденных мышей, полученные с помощью ПЦР, где выявлено четыре трансгенных потомка (7,8%): две самки #58, #78 и два самца #60, #83.
Все первичные трансгенные мыши оказались фертильными и посредством скрещивания с нетрансгенными животными основали четыре индивидуальные линии. Создание соответствующих линий было необходимо для изучения наследования трансгена и получения лактирующих самок для анализа экспрессии Г-КСФ человека. Получено не менее 50 особей в 4-5 поколениях в каждой линии, сопровожденных родословными с присвоением каждой особи соответствующего номера.
Пример 3. Анализ транскрипции гена Г-КСФ человека в молочной железе.
Транскрипцию трансгена анализировали с помощью обратной транскрипционной полимеразной цепной реакции (ОТ-ПЦР). Выделенную стандартным способом [17] суммарную РНК нагревали в течение 5 мин при 65°С и затем охлаждали на льду в течение 2 мин. Первую нить кДНК синтезировали добавлением 200 ед. обратной транскриптазы типа SuperScript II RNase H, 4 мкл 5х буфера, 2 мкл 0.1 М ДТТ, 1 мкл 40 ед/мл ингибитора РНКазы типа OUT, 1 мкл 10 мМ смеси дезокси-трифосфатов, 1 мкл 0,5 мг/мл олиго-дТ и воды (обработанной диэтилпирокарбонатом) до конечного объема 20 мкл. Смесь инкубировали при 42°С в течение 60 мин, инактивировали транскприптазу нагреванием до 70°С в течение 15 мин, затем добавляли 0,5 мкл РНКазы Н (концентрация 2 ед/мкл) на 15 мин при 37°С (Invitrogen, USA).
ПЦР проводили, используя в качестве матрицы 1 мкл кДНК, синтезированной в первой ОТ-ПЦР-реакции, в 25 мкл, содержащих: 2,5 мкл 10х буфера, 0,7 мкл 50 мМ MgCl2, 0,5 мкл 10 мМ смесь дезокси-трифосфатов, 1 мкл 10 мМ прямого и обратного праймеров и 1 ед. Platinum Taq полимеразы. В ПЦР реакции использовали праймеры для Г-КСФ: прямой - 5′-GAGAAGCTGGTGAGTGAGTGTG-3′ и обратный - 5′-ACGACACCTCCAGGAAGCTC-3′. Реакцию проводили следующим образом: денатурация при 94°С - 2 мин, затем 35 циклов при 94°С - 20 с, при 62°С - 20 с, при 72°С - 30 с и конечный этап при 72°С - 5 мин. Ожидаемый ПЦР продукт имел размер 406 п.н. В качестве контроля проводили ОТ-ПЦР для бета-актина мыши (размер 328 п.н.). Как видно на фиг.6 проведенный анализ выявил экспрессию трансгена в лактирующих молочных железах у всех линий мышей. Этот результат был подтвержден и при иммунофлуоресцентном анализе тканей лактирующих молочных желез трансгенных самок, где можно наблюдать ярко выраженную положительную реакцию в эпителиальных клетках долек молочных желез (фиг.7).
Пример 4. Количественное определение содержания Г-КСФ человека в молоке и сыворотке крови.
Образцы молока из молочных желез трансгенных самок получали с помощью микронасоса на 10-12 дни лактации под общим наркозом. Для стимуляции молокоотделения мышам вводили 0,5 ед. окситоцина. Образцы молока замораживали и хранили при -70°С. Количественное определение содержания Г-КСФ человека в молоке и сыворотке крови проводили с помощью иммуноферментного анализа ELISA (Enzyme-Linked Immunosorbent Assay), используя набор реактивов и протокол реакции «Quantikine»:»(Human G-CSF (R&D Systems, USA). Измерение оптической плотности раствора в каждой лунке производили с помощью спектрофотометра EIA READER (BIO-RAD, model 2550) при длине волны 450 нм. Количество белка в образцах определяли с помощью калибровочного графика, построенного при использовании стандарта Г-КСФ человека, прилагаемого к набору реактивов «Quantikine». Количество белка в образцах определяли с помощью калибровочного графика, построенного при использовании стандарта Г-КСФ человека, прилагаемого к набору реактивов «Quantikine». В таблице 1 представлены результаты анализа образцов молока трансгенных лактирующих самок.
| Таблица 1 | |||
| Трансгенная линия | Количество исследованных животных | Содержание Г-КСФ человека в молоке трансгенных лактирующих самок в мкг/мл | Содержание Г-КСФ человека в сыворотке крови в мкг/мл |
| №58 | 10 | 17-100 | 0 |
| №60 | 12 | 10-30 | 0 |
| №78 | 18 | 10-100 | 0 |
| №83 | 32 | 10-100 | 0 |
| Контроль (нетрансгенные самки) | 5 | 0 | 0 |
Из таблицы 1 видно, что содержание Г-КСФ человека в молоке трансгенных лактирующих самок составляет от 10 мкг/мл до 100 мкг/мл. Анализ эктопической экспрессии трансгена по тесту присутствия Г-КСФ человека в крови трансгенных мышей показал, что у самцов и самок всех четырех трансгенных линий рекомбинантный белок не определяется, что говорит о том, что анализируемая конструкция является высокотканеспецифичной.
Пример 5. Определение гликозилирования молекулы рекомбинантного Г-КСФ человека.
Выявление гликозилированной и негликозилированной форм Г-КСФ проводили методом вестерн-блотинга с использованием поликлональных кроличьих антител против Г-КСФ человека (Immunogen, USA), с последующей обработкой вторыми антителами, конъюгированными с щелочной фосфатазой и гистохимическим выявлением продукта с использованием системы BCIP/NBT (Sigma, USA) или с использованием ECL Detection Reagents (Amersham). В качестве стандарта негликозилированной формы использовали рекомбинантный Г-КСФ E.coli (Granulen, Eurofarma) с приблизительной молекулярной массой 20 кД. Известно, что Г-КСФ человека гликозилирован по Thrl33 и имеет молекулярный вес примерно 22 кД [18].
На фиг.8 приведены результаты Вестерн-блот анализа образцов молока трансгенных самок четырех линий с использованием антител против Г-КСФ человека. Видно, что в молоке трансгенных самок (дорожки 4-7) присутствуют обе формы Г-КСФ: гликозилированная (20 кД) и негликозилированная (18 кД), но с количественным преобладанием гликозилированной формы, а коммерческие препараты рекомбинантного бактериального Г-КСФ человека Filgrastin и Granulen (дорожки 2 и 3 соотвественно) представлены негликозилированной формой белка с мол. весом 18 кД.
Пример 6. Оценка биологической активности Г-КСФ в образцах молока трансгенных мышей.
В качестве тест-системы оценки биологической активности Г-КСФ была использована культура пуповинной крови человека. Известно, что пуповинная кровь содержит в 5 раз больше незрелых кроветворных клеток-предшественников, чем костный мозг [19]. Для проведения исследования пуповинную кровь разводили в соотношении 1:2 средой 199 (Sigma, USA) и добавляли Геспан (Hespan, гидроксилэтилированный крахмал, фирмы McGay Inc.Irvin, USA) в соотношении 1:6 и оставляли на 30 мин при комнатной температуре для седиментации эритроцитов и образования слоя ядросодержащих клеток, который отбирали и подсчитывали количество клеток. В 35 мм пластиковые чашки помещали 1 мл 3% агара (Sigma, USA), содержащего 20% фетальной коровьей сыворотки. На агаровую поверхность высевали 5×105 клеток пуповинной крови в 1 мл среды Iscove, содержащей 2% агара и 20% фетальной коровьей сыворотки. В гель и суспензию клеток добавляли либо рекомбинантный Г-КСФ человека (Granulen, Eurofarma) (позитивный контроль) в конечной концентрации 10 нг/мл или аликвоты сыворотки молока трансгенных и нетрансгенных (негативный контроль) мышей. Молоко трансгенных мышей добавляли из расчета конечной концентрации 10 нг/мл Г-КСФ, установленной ранее с помощью ELISA (см. выше). Культивирование клеток проводили при температуре 37°C в атмосфере 5% СO2 в течение 10 дней. Культуры фиксировали в парах формальдегида в течение 12 ч и подсчитывали число колоний под инвертированным микроскопом. Для анализа морфологии клеток агаровый слой снимали, дегидратировали и окрашивали азур-эозином по Май-Грюнвальд-Гимза. Активность Г-КСФ оценивали по количеству выросших нейтрофильных колоний.
В таблице 2 приведены данные по биологической активности Г-КСФ в молоке трансгенных животных в тесте колониеобразования в культуре клеток пуповинной крови человека.
| Таблица 2 | ||
| Экспериментальная группа | Количество экспериментов | Число колоний клеток гранулоцитарного ряда |
| Молоко линии №58 | 10 | 16,4±1,25** |
| Молоко линии №60 | 10 | 17±3,53** |
| Молоко линии №78 | 10 | 14,3±1,3** |
| Молоко линии №83 | 10 | 20,3±1,87** |
| Положительный | 10 | 16±2,1** |
| контроль, рекомбинантный Г-КСФ человека (Granulen) | ||
| Молоко нетрансгенных самок | 10 | 2,8±0,61 |
| ** - Р<0,001 |
Из табл.2 видно, что активность Г-КСФ молока сопоставима или выше таковой рекомбинантного бактериального Г-КСФ (Filgrastin, USA) и статистически достоверно превышает негативный контроль.
На фиг.9 (а, б, в, г) представлены образцы кроветворных колоний, которые по морфологическим характеристикам соответствуют типичным клеткам гранулоцитарного ряда на разных стадиях дифференцировки. Полученные результаты свидетельствуют о высокой гемопоэтической активности и функциональной полноценности Г-КСФ человека, секретируемого в молоке трансгенных мышей.
Таким образом, использование предлагаемой генно-инженерной конструкции позволит получить стабильный эффективный уровень экспрессии Г-КСФ человека в молоко трансгенных животных, а также исключить возможность эктопической экспрессии трансгена.
Источники информации
1. Hennighausen L., Ruiz L., Wall R. Transgenic animals-production of foreign proteins in milk // Curr. Opin. Biotechnol. 1990. V.1. P.74-78.
2. Разин С.В., Вербовая Л.В., Гольдман И.Л. Новые подходы к созданию трансгенных животных с высоким уровнем тканеспецифической экспрессии чужеродных генов: конструирование и реконструкция геномных доменов // Генетика. 2000. Т.36. С.1443-1453.
3. Maga E.A. RecA and transgenic livestock production: a method to improve efficiency // ISB News Report. Animal Research. 2003. P.6-8.
4. Ebert K.M., DiTullio P., Barry C.A., et al. Induction of human tissue plasminogen activator in the mammary gland of transgenic goats. // Biotechnology. 1994. V.12. 699-702.
5. Rudolph N.S. Biopharmaceutical production in transgenic livestock // Trends Biotechnol. 1999. V.17. P.367-374.
6. Гольдман И.Л., Захарова Е.С., Якубовская Р.И. и др. Лактоферрин: свойства и перспективы биотехнологического производства // Биотехнология. 1998. №4. С.3-6.
7. Гольдман И.Л., Кадулин С.Г., Разин С.В. Трансгенные козы в мировой фармаиндустрии XXI века // Генетика. 2002. Т.38. С.5-21.
8. Niemann H., Kues W.A. Transgenic farm animals: an update // Reprod. Fertil. Dev. 2007. V.19. P.762-770.
9. Nissen С. Glycosilation of recombinant human granulocyte colony stimulating factor for stability and potency. Eur. J. Cancer, 1994. 30A. Suppl 3: p.12-14.
10. Hübel K., Engert A. Clinical applications of granulocyte colony-stimulating factor: an update and summary // Ann. Hematol. 2003. V.82. P.207-213.
11. Nomura H., Imazeki I., Oheda M. et al. Purification and caracterization of human granulocyte colony-stimulating factor (G-CSF) // EMBO J. 1986. V.5. 871-876.
12. Ко JH, Lee CS, Kim К H, Pang MG, Koo JS, Fang Net al. Production of biologically active human granulocyte colony stimulating factor in tche milk of transgenic goat // Transgenic Research, 2000. P.9215-9222.
13. Дворянчиков Г.А., Серова И.А., Андреева Л.Е., Диас Л.П.Б., Азеведо С., Серов О.Л.. Секреция биологически активного гранулоцит колониестимулирующего фактора (Г-КСФ) человека в молоке трансгенных мышей. Генетика, 2005. Т.41. С.1330-1337.
14. Ramunno L., Cosenza G., Rando A., Illario R., Gallo D., Di Berardino D., Masina P. The goat alphasl-casein gene: gene structure and promoter analysis. // Gene. 2004. V. 334. P. 105-111.
15. Hogan В., Beddington R., Constantini F., Lacy E. "Manipulating the Mouse Embryo. A Laboratory Manual". Gold Spring Harbor Laboratory Press, New York, 1994.
16. Brem G., Krausslich H. Production of chimeras by embryo microsurgery and their possible application in cattle breeding // Tierarztl Prax Suppl. 1985 V.1. P.50-57.
17. Маниатис E., Фрич Э., Сэмбрук Дж. Молекулярное клонирование. М.: Мир,1990.
18. Kubota N., Orita Т., Hattori К. et al. Structural characterization of natural and recombinant human granulocyte colony-stimulation factors. // J.Biochem. 1990. V.107. P.486-492.
19. Broxmeyer HE, Douglas GW, Hangoc G. Human umbilical cord blood as a potential source of transplantable hematopoietic stem/progenitor cells // Proc. Natl. Acad. Sci. 1989. V.86. P.3828-3832.
Генно-инженерная конструкция pGoatcasGCSF для экспрессии гранулоцит-колониестимулирующего фактора человека (Г-КСФ), имеющая установленную нуклеотидную последовательность, показанную в SEQ ID 1, состоящая из 5′-регуляторной последовательности гена αS1-казеина козы CSN1S1 размером 3387 п.н., соединенной с полноразмерным геном Г-КСФ человека размером 1485 п.н., и 3′-фланкирующей области гена CSN1S1 коровы размером 1514 п.н., и приведенная на фиг.1, обеспечивающая синтез и секрецию Г-КСФ в молоко трансгенных животных.