Способ бактериального окисления сульфидных золотоносных концентратов
Иллюстрации
Показать всеИзобретение относится к гидрометаллургии цветных металлов, в частности к способу бактериального окисления сульфидных золотоносных концентратов перед цианированием. Способ включает подачу в биопульпу концентрата питательных для микроорганизмов солей, содержащих в своем составе азот, фосфор и калий. При этом бактериальное окисление ведут в две стадии. На первой стадии азот и 50% фосфора подают в виде мочевины и ортофосфорной кислоты до окисления 80-85% пирротина и арсенопирита. Остальное количество фосфора и все количество калия подают на второй стадии в виде двухзамещенного фосфорнокислого калия и сернокислого калия в количестве, необходимом для перевода (15,2÷15,6)% сурьмы из концентрата в жидкую фазу биопульпы в виде сульфата калия сурьмы (III). Техническим результатом является увеличение степени окисления сульфидной серы до 96,5%, антимонита до (94÷96)%, снижение содержания элементарной серы в биокеке до (0,4÷0,5)% и повышение скорости биоокисления сульфидов в 1,6 раза. 1 ил., 2 табл.
Реферат
Изобретение относится к гидрометаллургическим методам извлечения золота из сульфидных концентратов, которые перед цианированием окисляют с помощью микроорганизмов. Для жизнедеятельности бактерий, кроме сульфидов MeS и Fe2+, S0, необходимы питательные среды, содержащие источники азота, фосфора, углерода, калия и магния.
На практике при биоокислении золотоносных сульфидных концентратов применяют добавки в биопульпу аммофоса [(NH4)2HPO4+NH4H2PO4] и сульфата аммония [Совмен В.К., Гуськов В.Н., Белый А.В. и др. Переработка золотоносных руд с применением бактериального окисления в условиях Крайнего Севера. - Новосибирск: Наука, 2007. - 144 с.], но их использование приводит к образованию большого количества (до 30-35%) труднорастворимого соединения - ярозита железа (III) М·Fe3(SO4)2(ОН)6, который адсорбируется на поверхностях сульфидов металлов и обусловливает невысокую степень окисления сульфидной серы (84÷89%), большую длительность процесса (120 час), низкую производительность оборудования (≈2,44 т/час на одной цепочке из 6 реакторов объемом по 440 м3) и высокое содержание элементарной серы (4÷8%) в биокеке.
Известна питательная среда для микроорганизмов, содержащая азот, лактозу, манит, NaCl, Na2HPO4, (NH4)2SO4, K2SO4, MgSO4 и Na2CO3 [RU 95100460 A1, опубл. 27.12.1996], но она предназначена для бактерий, функционирующих в нейтральных средах при рН=7,0÷7,2 и не может быть использована для биоокисления сульфидных минералов в кислой среде (рН≤2,1).
Наиболее близким к предложенному способу бактериального окисления сульфидных концентратов с использованием питательных солей, содержащих азот, фосфор и калий, является способ биоокисления с питательной средой №9 К Сильвермана-Люндгрена [Каравайко Г.И., Росси Дж., Агате А. и др. Биотехнология металлов. Практическое руководство. - М.: Центр международных проектов ГКНТ, 1989. - 375 с.]. В этой среде минеральные соли представлены FeSO4, (NH4)2SO4, K2HPO4, MgSO4, KCl и H2SO4 (pH=1,3÷2,1). Однако эта среда предназначена для железоокисляющих бактерий T.ferrooxidans, а для бактериального окисления упорных сульфидных минералов (пирит и антимонит) малопригодна: содержащиеся в ее составе ионы аммония NH4 + и сульфата SO4 2- способствуют образованию ярозитов железа (III). Кроме того, небольшое количество ионов калия в солях не обеспечивает перевод в биопульпу труднорастворимых оксидных соединений сурьмы и степень окисления антимонита не превышает 40%.
Задачами изобретения являются увеличение скорости бактериального окисления сульфидных золотосодержащих концентратов и степени окисления сульфидных минералов, снижение концентрации элементарной серы в продукте биоокисления - биокеке.
Достигается это тем, что в способе бактериального окисления сульфидных золотоносных концентратов для извлечения золота, включающем подачу в биопульпу концентрата питательных для микроорганизмов солей, содержащих в своем составе азот, фосфор и калий, бактериальное окисление ведут в две стадии: на первой стадии азот и 50% фосфора подают в виде мочевины и ортофосфорной кислоты до окисления 80-85% пирротина и арсенопирита, а остальное количество фосфора и все количество калия подают на второй стадии в виде двухзамещенного фосфорнокислого калия и сернокислого калия в количестве, необходимом для перевода (15,2÷15,6)% сурьмы из концентрата в жидкую фазу биопульпы в виде сульфата калия сурьмы (III).
Сущность предлагаемого изобретения основана на том, что увеличение скорости бактериального окисления и повышение степени окисления сульфидных минералов обеспечивается высокими скоростями подвода микроорганизмов и диффузии реагентов к поверхности MeS, свободной от труднорастворимых соединений железа (III), мышьяка (V) и оксидов сурьмы (III).
На стадию приготовления исходной пульпы, состоящей из сульфидного концентрата и оборотного биофильтрата для снижения вероятности образования аммонийного ярозита железа (III) NH4Fe3(SO4)2·(ОН)6 подаются мочевина и ортофосфорная кислота, не имеющие в своих составах ионов NH4 + и SO4 2-. Кроме того, эти вещества являются ингибиторами процесса окисления железа [Краткая химическая энциклопедия. Т.II / Под редакцией Кнуньянца И.Л. - М.: Советская энциклопедия, 1963. - 1088 с.] и препятствуют переходу ионов Fe2+ в Fe3+ и образование скородита по реакции
становится маловероятным.
Для освобождения поверхности антимонита от оксидов сурьмы и создания благоприятных условий бактериального окисления Sb2S3 в биопульпу после окисления основной массы сульфидов железа дозируются K2HPO4 и K2SO4. Растворение оксидов сурьмы протекает с участием ионов калия по реакции [Некрасов Б.В. Основы общей химии. Т.1. - М.: Химия, 1969. - 519 с.]:
Образующийся комплекс сурьмы KSb(SO4)2 переходит в жидкую фазу пульпы и освобождает поверхность Sb2S3 для окисления микроорганизмами.
Анион HPO4 2-, вводимый в пульпу с K2HPO4, стабилизирует ионы Fe3 + в растворе за счет образования более устойчивого соединения Fe2(HPO4)3, чем [Лурье Ю.Ю Справочник по аналитической химии. М.: Химия, 1971. - 465 с.]). Стабилизация ионов Fe3+ в растворе также снижает вероятность осаждения труднорстворимых соединений железа (III) - ярозита, скородита и гетита (FeOOH).
При добавке в биопульпу ингибиторов окисления железа (мочевина, ортофосфорная кислота H3PO4, пирофосфорная кислота H4P2O7, другие фосфаты и анионы кремневой кислоты SiO4 4- [Краткая химическая энциклопедия. Т.II / Под редакцией Кнуньянца И.Л. - М.: Советская энциклопедия, 1963. - 1088 с.]) процесс образования ионов Fe3+ в растворе сводится к минимуму и реакция окисления пирротина железом (III):
практически не протекает, что обусловливает снижение концентрации элементарной серы в биокеке.
Изобретение осуществляется следующим образом.
В пульпу бактериального окисления сульфидного золотоносного концентрата на первую стадию процесса подаются мочевина и 50% фосфора от его общего количества в виде ортофосфорной кислоты. После окисления (80-85)% пирротина и арсенопирита на вторую стадию биоокисления вводятся остальное количество фосфора и весь калий с двухзамещенным фосфорнокислым и сернокислым калием в количестве, необходимом для перевода (15,2÷15,6)% сурьмы из концентрата в жидкую фазу биопульпы в виде KSb(SO4)2. Окончание биоокисления определяется по стабилизации рН и Eh пульпы и постоянству концентраций железа и мышьяка в жидкой фазе биопульпы. По данным рентгенографического и химического анализов биокека и раствора рассчитывались степени окисления минералов и содержание элементарной серы.
По предлагаемому изобретению было проведено две серии опытов. В первой серии варьировали состав питательных солей.
Влияние состава питательных солей и их дозировка в пульпу по стадиям на показатели бактериального выщелачивания сульфидного золотоносного концентрата приведено в таблице 1.
Представленные данные свидетельствуют о преимуществе использования нового состава питательных солей и раздельного их введения в пульпу: концентрация ярозита железа (III) в биокеке снизилась с 30,8% до 5,6%; повысилась степень окисления как сульфидных минералов на (5÷21)%, так и сульфидной серы на 10,5%, увеличилась скорость бактериального окисления с 0,88 до 1,43 кг/м3·час, т.е. в 1,62 раза, и уменьшилось содержание элементарной серы в биокеке с (4÷8)% до 0,45%. В ходе экспериментов по влиянию рецептуры питательных солей на жизнедеятельность микроорганизмов отклонений не выявлено: концентрация биомассы в ходе опытов снижалась с 1,5 г/л до 1,1 г/л, а дыхательная активность изменялась с 50 до 20 мкл O2/мл·15 мин.
| Таблица 1 | ||
| Влияние рецептуры питательных солей на основные показатели бактериального окисления сульфидного концентрата | ||
| Показатели бактериального выщелачивания концентрата | Питательные соли и их дозировка по стадиям процесса | |
| Практическая рецептура ЗАО «Полюс», дозировка на стадию приготовления пульпы, кг/т концентрата: аммофос - 2,5; сульфат аммония - 2,5; сульфат калия - 0,3 | Предлагаемая рецептура, дозировка на первую стадию бактериального окисления пульпы, кг/т концентрата: мочевина - 2,9; ортофосфорная кислота - 1,1; подача на 2-ю стадию окисления Sb2S3 и FeS2: K2HPO4 - 2,0; K2SO4 - 2,6 | |
| Содержание ярозита в биокеке, % | 30,8 | 5,6 |
| Степень окисления, %: | ||
| Fe7S8 | 91 | 100 |
| FeAsS | 94 | 99 |
| FeS2 | 76 | 97 |
| S2- | 86 | 96,5 |
| Производительность, кг/м3·час | 0,88 | 1,43 |
| Содержание элементарной серы в биокеке, % | 4-8 | 0,4-0,5 |
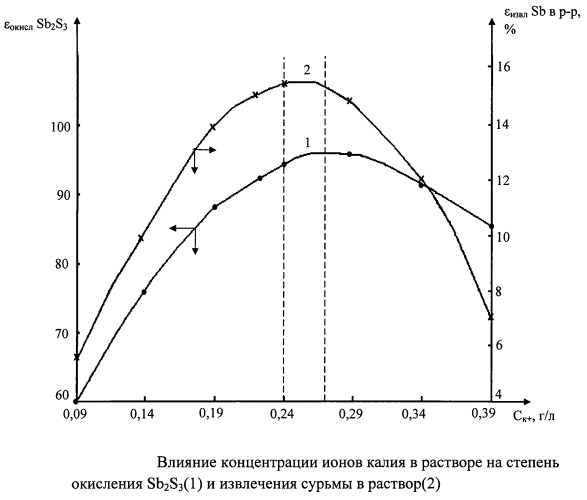
Во второй серии опытов варьировали расход K2SO4 и концентрацию ионов калия в жидкой фазе биопульпы при раздельном дозировании питательных солей, кг/т концентрата: 2,9 мочевины и 1,1 H3PO4 подавали на первую стадию окисления биопульпы, а 2,0 K2HPO4 и K2SO4 - на вторую стадию бактериального процесса (таблица 2, чертеж).
Изучение влияния концентрации ионов калия в растворе на степень окисления антимонита и извлечение сурьмы из концентрата в раствор позволили установить оптимальные значение этого показателя εsb=(15,2÷15,6)% и расход сульфата калия (2,6÷3,0) кг/т концентрата, обеспечивающие биоокисление антимонита на (94÷96)% (см. чертеж). Увеличение концентрации ионов К+ в растворе более 0,29 г/л приводит к непроизводительному расходованию реагента K2SO4 и к образованию калиевого ярозита железа (III) KFe2(SO4)2·(ОН)6, осаждению его на поверхности сульфидов и снижению степени окисления антимонита.
Таблица 2. Влияние расхода K2SO4 и концентрации ионов калия в растворе на степень окисления Sb2S3 и степень перехода сурьмы в жидкую фазу биопульпы (Условия бактериального окисления: содержание концентрата в пульпе 10%, (CSb)к-те=4,91%, Vпульпы=2 л, температура 38°С, скорость вращения мешалки 400 об/мин, концентрация бактерий в инокулянте 1,5 г/л, объем инокулянта 0,5 л, активность бактерий 40 мкл O2/мл·15 мин, питательные соли, кг/т концентрата: 2,9 мочевина; 1,1 H3PO4; 2,0 K2HPO4, K2SO4).
| Таблица 2 | ||||
| № п/п | Расход K2SO4, кг/т к-та | Концентрация ионов К+ в растворе*, г/л | Показатели биоокисления Sb2S3 | |
| Степень окисления Sb2S3, % | Степень перехода Sb из концентрата в раствор, % | |||
| 1 | 0 | 0,09 | 60,0 | 5,5 |
| 2 | 0,91 | 0,14 | 76,4 | 10,3 |
| 3 | 1,95 | 0,19 | 88,3 | 14,0 |
| 4 | 2,58 | 0,22 | 93,1 | 15,2 |
| 5 | 3,0 | 0,24 | 95,6 | 15,6 |
| 6 | 4,03 | 0,29 | 95,1 | 14,8 |
| 7 | 5,08 | 0,34 | 91,3 | 11,9 |
| 8 | 6,12 | 0,39 | 84,7 | 7,0 |
| * - концентрация ионов калия в жидкой фазе пульпы рассчитана с учетом расхода 2 кг/т концентрата K2HPO4 (0,898 кг К+) |
Уменьшение концентрации ионов калия в растворе менее 0,22 г/л обусловливает снижение степени окисления антимонита, что приводит к значительными потерям золота на операции цианирования биокека [Котляр Ю.А., Меретуков М.А. Металлургия благородных металлов. М.: АСМИ, 2002, 466 с.].
Определяющей величиной, влияющей на степень окисления антимонита, является извлечение сурьмы из концентрата в раствор, так как сернокислый калий может расходоваться не только на растворение оксидных соединений сурьмы, но и на образование труднорастворимых осадков железа (III).
Таким образом, новой рецептурой питающих солей и оптимальными условиями их использования для железо- и сероокисляющих микроорганизмов в способе бактериального окисления сульфидных золотоносных концентратов являются:
- мочевина и ортофосфорная кислота (50% от общего расхода фосфора) дозируются на первую стадию бактериального окисления сульфидного концентрата;
- остальное количество фосфора и весь калий подаются в пульпу на вторую стадию биоокисления с двухзамещенным фосфорнокислым и сернокислым калием в количестве, необходимом для перевода (15,2÷15,6)% сурьмы из концентрата в жидкую фазу биопульпы в виде KSb(SO4)2.
Проведение бактериального окисления сульфидного концентрата с предложенным составом питающих солей и оптимальной технологией их дозирования в пульпу позволяет увеличить степень окисления сульфидной серы до 96,5%, антимонита до (94-96)%, снизить содержание элементарной серы в биокеке до 0,4-0,5% и повысить скорость биоокисления сульфидов в 1,6 раза.
Пример осуществления опыта.
Приготовление пульпы осуществлялось в реакторе с механическим перемешиванием (n=500 об/мин) при температуре 40°С в течение 3 ч. В реактор сначала заливался биофильтрат объемом 0,6 л, содержащий, г/л: 20 Fe3+; 4 As5+; 0,9 Sb3+ и рН=2,0, затем дозировался гидрофилизатор - 2 мл кислого кремнекалиевого раствора (CSiO2=19,2 г/л; СК+=13,4 г/л) и порционно в течение 30 минут загружался золотоносный сульфидный концентрат, массой 300 г. Нейтрализация карбонатной составляющей концентрата осуществлялась до рН=2,8. Исходная пульпа загружалась в титановый реактор объемом 2,5 л для бактериального выщелачивания. В пульпу подавали инокулянт микроорганизмов, представленных S.olympiadicus, F.acidiphilun, L.ferrooxidans, с концентрацией бактерий 1,5 г/л и дыхательной активностью 50 мкл О2/мл·15 мин, питательные соли (2,9 г/т к-та) и ортофосфорная кислота (1,1 г/т к-та). Затем биопульпу разводили водой до концентрации твердого в ней 10%, подавали разбавленную 1:1 H2SO4 до рН=2,1. Бактериальное окисление осуществлялось при температуре 38°С с частотой вращения лопастной мешалки 400 об/мин. Воздух в биопульпу не подавался, так как насыщение ее кислородом происходило за счет перемешивания.
Бактериальное окисление пирротина и арсенопирита происходило в первую очередь и характеризовалось высокой скоростью прироста концентраций железа и мышьяка в растворе. Скорость увеличения этих концентраций определяли по тангенсу угла зависимости концентрации металла от продолжительности процесса СМе=f(τ). При окислении (80÷85)% пирротина и арсенопирита величина dCMe/dτ снижается в 2-3 раза и это явление служило сигналом для дозирования второй порции питательных солей: двузамещенного фосфорнокислого калия (2 кг/т к-та) и сернокислого калия (2,6 кг/т к-та). Эти соли подавали в биопульпу в виде растворов. Процесс биоокисления пульпы завершался при стабилизации рН, Eh и концентрации Fe3 + и Аs5+ в жидкой фазе биопульпы. Скорость биоокисления определялась по формуле:
где mк-та - масса загруженного концентрата, кг;
τ - продолжительность процесса, час;
V - объем биопульпы, м3.
По окончании процесса биопульпа фильтровалась под вакуумом, биокек промывался водой, сушился, усреднялся и направлялся на химический и рентгенофазовый методы анализа. По содержанию минералов, серы сульфидной и элементарной в биокеке рассчитывались степени окисления пирротина, пирита, арсенопирита и антимонита. По концентрации сурьмы в жидкой фазе биопульпы определялось извлечение сурьмы из концентрата в раствор.
Основные результаты бактериального окисления сульфидного концентрата приведены в таблице 1.
Сорбционное цианирование биокека с активированным углем позволило извлечь золото в металл на 96,7%. При этом расход цианистого натрия не превысил 12 кг/т биокека.
Способ бактериального окисления сульфидных золотоносных концентратов для извлечения золота, включающий подачу в биопульпу концентрата питательных для микроорганизмов солей, содержащих в своем составе азот, фосфор и калий, отличающийся тем, что бактериальное окисление ведут в две стадии: на первой стадии азот и 50% фосфора подают в виде мочевины и ортофосфорной кислоты до окисления 80-85% пирротина и арсенопирита, а остальное количество фосфора и все количество калия подают на второй стадии в виде двухзамещенного фосфорнокислого калия и сернокислого калия в количестве, необходимом для перевода (15,2÷15,6)% сурьмы из концентрата в жидкую фазу биопульпы в виде сульфата калия сурьмы (III).