Способ моделирования неолимфогенеза в эксперименте
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к экспериментальной онкологии, и касается моделирования неолимфогенеза. Для этого у экспериментального животного формируют перевивную опухоль. После достижения перевивной опухоли размера не менее 0.5 см в диаметре у животного отмечают в регионарной области со стороны опухоли рост новых лимфатических узлов. Способ обеспечивает моделирование неолимфогенеза с увеличением числа лимфатических узлов в 2-3 раза. 2 ил.
Реферат
Изобретение относится к медицине, а именно к онкологии, и направлено на изучение теоретических основ противоопухолевого надзора, улучшение результатов лечения больных со злокачественными новообразованиями.
У млекопитающих, в том числе и у человека, число лимфатических узлов постоянное (600-800 ед.). Они закладываются внутриутробно и функционируют в течение жизни. С возрастом число функционирующих лимфатических узлов уменьшается (300-600 ед.). Снижение числа лимфатических узлов и их активности создают предпосылки к развитию различных заболеваний, в том числе и рака. В результате проведенных авторами исследований на анатомических комплексах (молочная железа и жировая клетчатка подмышечной области) при раке молочной железы установлен факт неолимфогенеза (Креативная хирургия и онкология 2009, № 1, с.6-9). Вновь образованные лимфатические узлы имеют свои особенности. Они имеют один приносящий и один выносящий лимфатические сосуды, располагаются в цепочку до 5-6 ед. и располагаются вблизи тотально пораженных раком лимфатических узлов (афункциональных узлов). Неолимфогенез при раке - пример адаптационных ресурсов и саморегуляции биологических систем в противостоянии неопластическим процессам.
С целью противодействия развитию неопластических процессов японские ученые осуществили пересадку мыши искусственного лимфатического узла, и он успешно начал производить иммунные клетки. Искусственный лимфатический узел, который используют Noriaki Okamoto, Risa Chihara, Chiori Shimizu, Sogo Nishimoto and Takeshi Watanabe [J. Clin. Invest., 2007. - 117(4): 997-1007] из института физических и химических исследований RIKEN в Японии (Institute of Physical and Chemical Research - RIKEN) состоит из коллагенового каркаса, пропитанного стромальными и дендритными клетками, полученного из тимуса новорожденных мышей. Эту «конструкцию» сначала имплантировали мыши со здоровой иммунной системой, которую вакцинировали безвредным антигеном, что вызывает иммунный ответ. Стромальные клетки привлекали в искусственный узел клетки иммунной системы (T и B лимфоциты) здорового организма. После этого лимфатический узел перенесли в мышь с нефункционирующей иммунной системой. Лимфоциты быстро распространялись из искусственного узла в собственные лимфатические узлы животных, которые были «пустыми» из-за отсутствия иммунной активности. Когда исследователи ввели безвредные антигены мышам с иммунной недостаточностью, пересаженная иммунная система активно откликнулась, производством большого количества лимфоцитов для нейтрализации чужеродных молекул, эта реакция сохранилась и через месяц. Данный способ взят за прототип.
Технический результат - увеличение числа лимфатических узлов путем стимуляции неолимфогенеза (появления новых лимфатических узлов).
Предполагаемый способ осуществляется следующим образом. У экспериментального животного формируют перевивную опухоль.
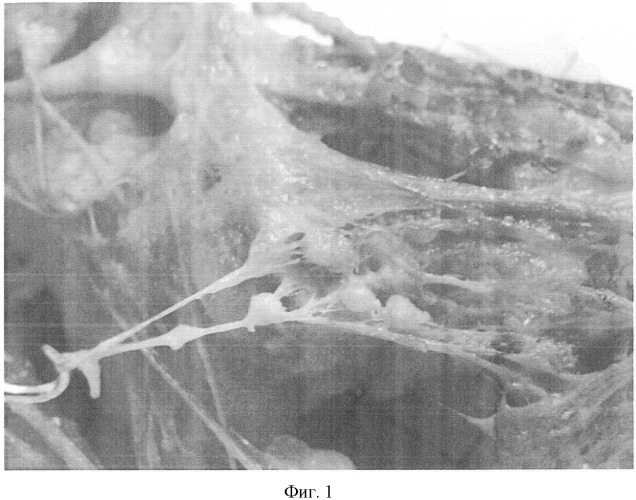
Для эксперимента были сформированы две группы мышей. I группа - контрольная. II группа - основная. Во II группе смоделированы опухоли и неолимфогенез. В качестве модельной опухоли использовалась меланома B16. В I группу включено 10 мышей, во II группу 15 мышей. Мышам II группы вводилась меланома B16 подкожно, в правую боковую область живота. После достижения перевивной опухоли размера не менее 0.5 см в диаметре исследовалась паховая область со стороны опухоли. Исследование выполнялось с использованием операционного микроскопа с увеличением 40 раз. В региональной области со стороны опухоли у мышей II группы отмечался рост новых лимфатических узлов (неолимфогенез). Количество лимфатических узлов увеличивалось в 3-4 раза по сравнению с контрольной группой. Также во II группе наблюдался выраженный неолимфангиогенез (увеличение количества приносящих лимфатических сосудов). Стимуляция развития приносящих лимфатических сосудов связана с продукцией VEGF (фактор роста эндотелия сосудов) первичной опухолью (А.А.Фильченков; Лимфангиогенез и метастазирование опухолей; Онкология, 2009, т.11, № 2, с.94-103). Вновь образованные лимфатические узлы изучены гистологически. Все они имели типичную гистологическую структуру лимфатического узла. Появление вновь образованных лимфатических узлов при раке можно рассматривать как компенсаторный механизм естественной противоопухолевой защиты. Лимфоциты, содержащиеся в этих лимфатических узлах, обладают высоким противоопухолевым потенциалом. Это объясняется индукцией специфического противоопухолевого иммунитета.
На фиг.1 продемонстрирован неолимфогенез - рост новых лимфатических узлов, на фиг.2 - неолимфангиогенез - увеличение числа приносящих лимфатических сосудов.
Аналогичные эксперименты проведены с различными перевивными опухолями - меланома B16, карцинома Эрлиха и др. Во всех достигнут заявляемый технический результат.
Авторами в доступной патентной и научно-медицинской литературе не было обнаружено сведений об известности предлагаемого способа моделирования неолимфогенеза. Таким образом, заявляемое изобретение соответствует критерию «новизна».
Авторами впервые установлено, что приведенная совокупность отличительных признаков способа стимулирует неолимфогенез. Таким образом, заявляемое изобретение соответствует критерию «изобретательский уровень».
Способ моделирования неолимфогенеза находится на стадии экспериментального исследования. В дальнейшем возможно его клиническое применение, а также создание моделей неолимфогенеза для фундаментальных исследований в области противоопухолевого надзора. Таким образом, заявляемое изобретение соответствует критерию «промышленная применяемость».
Способ моделирования неолимфогенеза в эксперименте, отличающийся тем, что формируют перевивную опухоль у экспериментального животного.