Экстракты применяемого в китайской медицине растения chenopodium ambrosioides l., композиции, включающие упомянутые экстракты, способ их получения и применение
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности, а именно к растительным экстрактам растения Chenopodium ambrosioides L., лекарственным композициям с этими экстрактами, способам получения экстрактов и применению экстрактов. Экстракты Chenopodium ambrosioides L. и лекарственные композиции, содержащие их, могут применяться для изготовления лекарств для лечения гастрита и пептической язвы, вследствие инфицирования HP. Лекарственные композиции обладают выраженным положительным воздействием и малыми побочными эффектами. 4 н. и 20 з.п. ф-лы, 5 табл., 7 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к растительным экстрактам, в частности экстрактам применяемого в китайской медицине растения Chenopodium ambrosioides L., препаратам, включающим упомянутые экстракты, и способам их получения. Настоящее изобретение также относится к применению упомянутых экстрактов в лекарственном препарате для лечения гастрита или язвы желудка, вызванной Helicobacter Pylori (HP).
Предпосылки создания изобретения
Желудочные болезни являются распространенными заболеваниями, часто встречающимися в клинической практике. С тех пор, как Marshall и Warren в журнале "Lancet" в 1983 г. (Warren J.R., Marshall BJ. Lancet, 1983, 1:1273□1275) сообщили о том, что на слизистой оболочке желудка человека была культивирована разновидность спиральной аэробной бактерии, получившей название Helicobacter Pylori или сокращенно HP, и доказано, что она имеет отношение к гастриту, был дан толчок революционным изменениям, связанным с распознаванием заболеваний верхних дыхательных путей (Xu, Ling, Journal of First Military Medical University, 1995, 15(4):360-361). В результате глубоких исследования было постепенно выяснено, что спиральная бактерия является причиной различных желудочных болезней. Например, Liu и др предположили, что заболевания, вызванные инфицированием HP, включают гастрит, рак желудка, лимфому желудка, заболевания двенадцатиперстной кишки и т.д. (Liu, Junying; Ma, Cailian, Journal of Practical Medical Techniques, 1998, 5(7):542-544). Также сообщалось, что HP способна провоцировать различные желудочные болезни, например хронический гастрит, способный впоследствии вызвать язву желудка или атрофический гастрит и даже перерасти в рак желудка (Recent Developments in Science & Technology Abroad, 2003, (4):44-45).
На основании упомянутого выше открытия были начаты исследования лекарственных средств против HP, и в настоящее время в клинической практике чаще всего применяют сочетание различных химических лекарственных веществ. Например, Мо было изучено 55 групп лекарственных сочетаний, применяемых за рубежом (Мо, Jianzhong, Chinese Journal of Digestion, 1995, 15(3):164). У Huang и др. сообщается о сочетании омепразола и антибиотиков (Huang, Xuerui; Chang, Heling, Northwest Pharmaceutical Journal, 1998, 13(1):33-34). Упомянутые выше композиции в основном представляют собой сочетание ингибиторов протонового насоса и антибактериальных лекарств, способное вызывать серьезные побочные эффекты, а антибиотики могут легко провоцировать устойчивость к лекарствам и дисбактериоз.
Китайская медицина знаменита своими незначительными побочными эффектами. Как показала проверка применяемых в китайской медицине средств против HP, Coptis chinensis Franch, Rheum officinale, Cortex Phellodendri., Herba Taraxaci, Polygonum cuspidatum Sieb. et Zucc., A. Sativam L. var. Viviparum Regel, Romulus Cinnamomi., Eugenia caryophyllata Thunb. и т.д. обладают высокой чувствительностью (Chen, Zhenmin, Liaoning Journal of Traditional Chinese Medicine, 1995, 22(10):472). Chenopodium ambrosioides L. представляет собой цельную наземную часть растения Chenopodium ambrosio des L. семейства Chenopodiaceae с семенным колосом. Упомянутая цельная наземная часть содержит 0,4-1% эфирного масла из Chenopodium ambrosioides L., включающего аскаридол, р-цимол и другие терпены, такие как аритазон, лимонен и т.д. в качестве основных компонентов; Chenopodium ambrosioides L. обладает способностью рассеивать запах, противоглистным действием, очищающим и обезболивающим действием. До настоящего времени нет данных о действии Chenopodium ambrosioides L. при лечении гастрита и пептической язвы, вызванной HP.
Подробное описание изобретения
Основной задачей настоящего изобретения является преодоление недостатка известных из уровня техники лекарственных средств и создание экстрактов Chenopodium ambrosioides L. из легкодоступного сырья, обладающих выраженным действием и меньшими побочными эффектами.
Другой задачей настоящего изобретения является создание композиций, включающих упомянутые экстракты.
Дополнительной задачей настоящего изобретения является создание способа получения экстрактов и композиций, включающих упомянутые экстракты.
В настоящем изобретении также предложено применение упомянутых экстрактов и их композиций в лекарственном препарате для лечения гастрита и язвы желудка, вызванной HP.
Для обозначения экстракта Chenopodium ambrosioides L. в настоящем изобретении также используется термин "эфирное масло из Chenopodium ambrosioides L.".
Для осуществления настоящего изобретения предложены следующие технические решения.
Предложенные в настоящем изобретении экстракты Chenopodium ambrosioides L. подвергают анализу методом газовой хроматографии-массовой спектрометрии, при этом масс-спектр имеет два следующих пика:
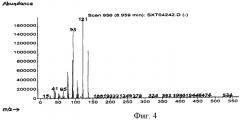
пик 1: время удерживания составляет 8,0-9,5 мин, фрагментарные ионы m/е - 121 и 93; и
пик 2: время удерживания составляет 9,0-10,0 мин, фрагментарные ионы m/е - 120, 119 и 134.
Предпочтительно по данным метода газовой хроматографии-массовой спектрометрии масс-спектр дополнительно включает два следующих пика:
пик 3: время удерживания составляет 10,0-20,5 мин, фрагментарные ионы m/е - 119, 121 и 136; и
пик 4: время удерживания составляет 15,0-20,5 мин, фрагментарные ионы m/е - 135, 43 и 97.
Более предпочтительно по данным метода газовой хроматографии-массовой спектрометрии масс-спектр дополнительно включает еще два следующих пика:
пик 5: время удерживания составляет 5,5-15,5 мин, фрагментарные ионы m/е - 93 и 91; и
пик 6: время удерживания составляет 12,5-20,0 мин, фрагментарные ионы m/е - 71, 126, 69 и 41.
Условия проведения анализа:
Подготовка образцов: экстракты Chenopodium ambrosioides L. растворяли в этилацетате;
Условия проведения газовой хроматографии:
Хроматографическая колонка: гибкая силикатная капиллярная колонка HP-5MS, 60 м × 0,25 мм × 0,25 мкм, содержащая 5% фенилметилсилоксан;
Термопрограммирование: температуру повышают с 80°С до 100°С, затем до 150°С и, наконец, до 300°С.
Температура испарения: 250°С;
Газ-носитель: гелий высокой степени чистоты (99,999%);
Массовый расход газа-носителя: 1,0 мл/мин;
Вводимый объем образца: 1 мкл (раствор этилацетата);
Индекс разведения: 30:1;
Условия масс-спектра:
Источник ионов: EI;
Температура источника ионов: 230°С;
Температура квадрупольных стержней: 150°С;
Напряжение умножителя: 1781 В;
Температура поверхности контактного взаимодействия: 280°С;
Диапазон сканирования массы: 10-550 атомных единиц массы.
Предложенные в настоящем изобретении экстракты Chenopodium ambrosioides L. имеют следующее весовое содержание компонентов: α-терпинен - 15-35% и р-цимол - 15-25%.
Предпочтительно предложенные в настоящем изобретении экстракты Chenopodium ambrosioides L. имеют следующее весовое содержание компонентов: α-терпинен - 15-35%, р-цимол - 15-25%, аскаридол - 10-20% и α-терпинолен - 32-40%.
Более предпочтительно предложенные в настоящем изобретении экстракты Chenopodium ambrosioides L. имеют следующее весовое содержание компонентов: α-терпинен - 20-30%, р-цимол - 18-22%, аскаридол - 12-18% и α-терпинолен - 32-35%.
Еще более предпочтительно предложенные в настоящем изобретении экстракты Chenopodium ambrosioides L. имеют следующее весовое содержание компонентов: α-терпинен - 22-25%, р-цимол - 19-21%, аскаридол - 13-15% и α-терпинолен - 32-33%.
Более предпочтительно предложенные в настоящем изобретении экстракты Chenopodium ambrosioides L. имеют следующее весовое содержание компонентов: α-терпинен - 15-35%, р-цимол - 15-25%, аскаридол - 10-20%, α-терпинолен - 32-40%, γ-терпинен - 0,5-0,7% и лимонен - 0,6-0,8%;
или α-терпинен - 15-35%, р-цимол - 15-25%, аскаридол - 10-20%, α-терпинолен - 32-40% и γ-терпинен - 0,5-0,7%;
или α-терпинен - 15-35%, р-цимол - 15-25%, аскаридол - 10-20%, α-терпинолен - 32-40% и лимонен - 0,6-0,8%.
Наиболее предпочтительно предложенные в настоящем изобретении экстракты Chenopodium ambrosioides L. имеют следующее весовое содержание компонентов: α-терпинен - 22-25%, р-цимол - 19-21%, аскаридол - 13-15%, α-терпинолен - 32-33%, γ-терпинен - 0,5-0,6% и лимонен - 0,6-0,7%.
В настоящем изобретении также предложены лекарственные композиции, включающие упомянутые экстракты и фармацевтически приемлемые адъюванты.
Предложенные в настоящем изобретении лекарственные композиции могут дополнительно включать другой действующий ингредиент. Например, упомянутым действующим ингредиентом в лекарственных композициях, предложенных в настоящем изобретении, является масло, полученное из Adina pilulifera (Lam.) Franch.
Предложенные в настоящем изобретении лекарственные композиции могут быть изготовлены в виде различных лекарственных форм. Упомянутые лекарственные формы включают без ограничения капсулы, жестких капсулы, мягкие капсулы (также называемые желатиновыми пилюлями), инъекции, капельные растворы, впрыскиваемые порошки, гранулы, таблетки, инфузионные гранулы, порошки, пероральные жидкости, таблетки с сахарным покрытием, таблетки с пленочным покрытием, таблетки с энтеросолюбильным покрытием, таблетки для медленного растворения в щечном кармане, пилюли, мази, драже, средство для распыления, капельные пилюли, распадающиеся в полости рта таблетки, микропилюли, аэрозоль и т.д.
Упомянутыми капсулами могут являться обычные капсулы или самоэмульгирующийся препарат в форме капсул.
Предпочтительно лекарственная композиция, включающая в качестве действующего ингредиента предложенный в настоящем изобретении экстракт Chenopodium ambrosioides L., имеет форму желатиновой пилюли, состоящей из содержимого и материала покрытия. Упомянутым содержимым желатиновой пилюли является экстракт Chenopodium ambrosioides L., и растительное масло.
Упомянутым растительным маслом является фармацевтически приемлемое масло, такое как арахисовое масло, рапсовое масло, масло из семян чайного дерева и т.д., из которого извлечены твердые кислоты жирного ряда.
Весовое соотношение экстрактов Chenopodium ambrosioides L. и растительного масла составляет 1:(1~3), предпочтительно - 1:(1~2); наиболее предпочтительно - 1:1.
Упомянутый материал покрытия желатиновой пилюли включает желатин и смягчитель, при этом смягчитель выбирают из группы, включающей глицерин, ксилит, сорбит и гидрогенизированный кукурузный экстракт; предпочтительно - глицерин и ксилит; наиболее предпочтительно - глицерин.
Предпочтительно лекарственная форма, включающая предложенные в настоящем изобретении экстракты Chenopodium ambrosioides L., может быть изготовлена в виде самоэмульгирующихся препаратов. Так называемые самоэмульгирующиеся препараты являются предшественником эмульсий и представляют собой твердые формы или однородные прозрачные жидкие формы, включающие лекарственное вещество, жировую фазу, поверхностно-активное вещество и вторичное поверхностно-активное вещество. Основной характеристикой самоэмульгирующихся препаратов является то, что в эмульсиях типа "масло в воде", спонтанно образующихся в желудочно-кишечном тракте (ЖКТ) или в условиях окружающей температуры (обычно относящихся к температуре тела человека 37°С) и легкого перемешивания, значительно улучшается растворение не растворимых в воде лекарств в ЖКТ за счет увеличения удельной площади поверхности мелких капелек масла, в результате чего существенно повышается биологическая доступность лекарств. Кроме того, полученные таким способом эмульсии способны уменьшать раздражение ЖКТ, вызываемое лекарствами. Самоэмульгирующиеся препараты способны преодолевать недостатки традиционных препаратов, такие как нестабильность, низкая биологическая доступность, трудоемкие процедуры получения, большие дозы и т.д.
Предложенный в настоящем изобретении самоэмульгирующийся препарат имеет следующее весовое содержание компонентов: экстракт Chenopodium ambrosioides L. - 1-95%, рапсовое масло - 4-39%, поверхностно-активное вещество - 1-45% и вторичное поверхностно-активное вещество - 0-15%; предпочтительно весовое содержание компонентов составляет: экстракт Chenopodium ambrosioides L. - 20-70%, рапсовое масло - 10-30%, поверхностно-активное вещество - 15-40% и вторичное поверхностно-активное вещество - 5-10%.
Кроме того, предложенный в настоящем изобретении самоэмульгирующийся препарат также может включать масло из Adina pilulifera (Lam.) Franch. Препарат имеет следующее весовое содержание компонентов: экстракт Chenopodium ambrosioides L. и масло из Adina pilulifera (Lam.) Franch. - 1-95%, рапсовое масло - 4-39%, поверхностно-активное вещество - 1-45% и вторичное поверхностно-активное вещество - 0-15%; предпочтительно имеет следующее весовое содержание компонентов: экстракт Chenopodium ambrosioides L. и масло из Adina pilulifera (Lam.) Franch. - 20-70%, рапсовое масло - 10-30%, поверхностно-активное вещество - 15-40% и вторичное поверхностно-активное вещество - 5-10%. Весовое соотношение экстракта Chenopodium ambrosioides L. и масла из Adina pilulifera (Lam.) Franch. составляет (1~5):1, предпочтительно 3:1,
Упомянутое поверхностно-активное вещество выбирают из группы, включающей конденсат полиоксиэтилена и касторового масла, конденсат полиоксиэтилена и гидрогенизированного касторового масла, полисорбат, фосфолипиды и т.д. или их смесь.
Упомянутый конденсат полиоксиэтилена и касторового масла представляет собой конденсат, имеющий различное число полиоксиэтиленовых связей на молекулу, например полиоксиэтилен (35) и касторовое масло, полиоксиэтилен (60) и касторовое масло и т.д. Упомянутый конденсат полиоксиэтилена и гидрогенизированного касторового масла представляет собой конденсат, имеющий различное число полиоксиэтиленовых связей на молекулу, например полиоксиэтилен (35) и гидрогенизированное касторовое масло, полиоксиэтилен (60) и гидрогенизированное касторовое масло и т.д. Предпочтительный полисорбат выбирают без ограничения из полисорбата 60 и полисорбата 80. Упомянутые фосфолипиды включают натуральные и синтезированные фосфолипиды. Упомянутые натуральные фосфолипиды включают лецитин яичного желтка и соевый лецитин. Упомянутые синтезированные фосфолипиды включают без ограничения дипальмитоилфосфатидилхолин, дистеароилфосфатидилхолин, димиристоилфосфатидилхолин и т.д.
Упомянутое вторичное поверхностно-активное вещество выбирают из группы, включающей этанол, гликоль, пропандиол, n-бутанол, изопропанол, полигликоль 4000 и полигликоль 6000.
В настоящем изобретении также предложен способ получения лекарственных композиций, содержащих экстракты Chenopodium ambrosioides L., включающий следующие стадии, на которых:
а. получают экстракты Chenopodium ambrosioides L. путем обычного экстрагирования;
b. обычным путем добавляют в экстракты фармацевтически приемлемые адъюванты с целью получения желаемых препаратов.
Экстракт Chenopodium ambrosioides L. может быть получен обычными методами экстрагирования эфирного масла, такими как паровая дистилляция, пропитывание органическим растворителем (орошение органическим растворителем), одновременная дистилляция-экстрагирование (SDE), закритическое экстрагирование двуокиси углерода, холодное прессование и т.д. предпочтительно, методом паровой дистилляции и закритического экстрагирования двуокиси углерода и наиболее предпочтительно методом паровой дистилляции.
Используют следующий оптимальный процесс паровой дистилляции: добавляют семена или цельные наземные части Chenopodium ambrosioides L. в дистиллятор, подают пар в коллектор, поддерживают температуру экстрагирования 85-100°С, осуществляют дистилляцию в течение определенного времени, например 40 минут, и извлекают эфирное масло из Chenopodium ambrosioides L.
Масло из Adina pilulifera (Lam.) Franch. может быть получено обычными методами экстрагирования эфирного масла, такими как паровая дистилляция, пропитывание органическим растворителем (орошение органическим растворителем), одновременная дистилляция-экстрагирование (SDE), закритическое экстрагирование двуокиси углерода, холодное прессование и т.д., предпочтительно методом паровой дистилляции и закритического экстрагирования двуокиси углерода и наиболее предпочтительно методом паровой дистилляции. Осуществляют следующий оптимальный процесс: добавляют в дистиллятор стебли и листья Adina pilulifera (Lam.) Franch., подают пар в коллектор, поддерживают температуру экстрагирования 85-100°С, осуществляют дистилляцию в течение определенного времени, например 40 минут, и извлекают эфирное масло.
В качестве альтернативы Chenopodium ambrosioides L. и Adina pilulifera (Lam.) Franch. могут быть смешаны и экстрагированы обычными методами экстрагирования эфирного масла, такими как паровая дистилляция, пропитывание органическим растворителем (орошение органическим растворителем), одновременная дистилляция-экстрагирование (SDE), закритическое экстрагирование двуокиси углерода, холодное прессование и т.д., предпочтительно методом паровой дистилляции и закритического экстрагирования двуокиси углерода, более предпочтительно методом паровой дистилляции. Осущестляют следующий оптимальный процесс экстрагирования: добавляют в дистиллятора семена или цельные наземные части Chenopodium ambrosioides L. и стебли и листья Adina pilulifera (Lam.) Franch., подают пар в коллектор, поддерживают температуру экстрагирования 85-100°С, осуществляют дистилляцию в течение определенного времени, например 40 минут, и извлекают эфирное масло.
Способ получения предложенных в настоящем изобретении композиций, представляющих собой желатиновые пилюли, включает стадии, на которых: растворяют фармацевтический желатин и смягчитель в дистиллированной воде и фильтруют с целью получения раствора желатина; сольватируют и разбавляют эфирное масло из Chenopodium ambrosioides L. растительным маслом с целью получения неочищенного масла; добавляют неочищенное масло и раствор желатина в устройство для изготовления желатиновых пилюль и получают желатиновые пилюли с маслянистой жидкостью в качестве содержимого.
Упомянутый смягчитель выбирают из группы, включающей глицерин, ксилит, сорбит и гидрогенизированный кукурузный экстракт.
Способ получения предложенных в настоящем изобретении композиций, представляющих собой самоэмульгирующиеся препараты, включает стадии, на которых: смешивают установленную дозу эфирного масла из Chenopodium ambrosioides L. или эфирного масла из Chenopodium ambrosioides L. и масла из Adina pilulifera (Lam.) Franch., рапсового масла, поверхностно-активных веществ или дополнительного вторичного поверхностно-активного вещества, нагревают смесь в водяной бане при температуре 30-80°С или с помощью ультразвуковой установки и получают однородный и прозрачный раствор, из которого затем формируют препараты в виде мягких или жестких капсул.
Поверхностно-активные вещества, используемые в упомянутом способе получения упомянутых самоэмульгирующихся препаратов композиций, могут быть выбраны из конденсата полиоксиэтилена и касторового масла, конденсата полиоксиэтилена и гидрогенизированного касторового масла, полисорбата и фосфолипида.
Кроме того, упомянутый конденсат полиоксиэтилена и касторового масла выбирают из полиоксиэтилена (35) и касторового масла, полиоксиэтилена (60) и касторового масла; упомянутый конденсат полиоксиэтилена и гидрогенизированного касторового масла выбирают из полиоксиэтилена (35) и гидрогенизированного касторового масла и полиоксиэтилена (60) и гидрогенизированного касторового масла; упомянутый полисорбат выбирают из полисорбата 60 и полисорбата 80; упомянутые фосфолипиды выбирают из лецитина яичного желтка, соевого лецитина, дипальмитоилфосфатидилхолина, дистеароилфосфатидилхолина и димиристоилфосфатидилхолина. Упомянутое вторичное поверхностно-активное вещество выбирают из этанола, гликоля, пропандиола, n-бутанола, изопропанола, полигликоля 4000 и полигликоля 6000.
Экстракт Chenopodium ambrosioides L. и лекарственная композиция, включающая предложенные в настоящем изобретении упомянутые экстракты, может применяться для лечения желудочных болезней, вызванных HP, таких как гастрит, пептическая язва и т.д.
В настоящем изобретении предложен экстрагированный из применяемого в китайской медицине лекарственного растения Chenopodium ambrosioides L. действующий ингредиент для лечения желудочных болезней, таких как гастрит, пептическая язва и т.д., спровоцированных HP, при этом его исходное сырье легкодоступно, способы получения являются простыми и осуществимыми, а контроль качества несложным. Кроме того, действующий ингредиент обладает выраженным действием, незначительными побочными эффектами и легко применим. Получаемые затем самоэмульгирующиеся препараты являются препаратами направленного действия и легче всасываются, за счет чего повышается биологическая доступность лекарств. К тому же препарат способен ослаблять отрицательную реакцию пациентов, а стабильность лекарств повышена за счет предотвращения влияния на препарат нестабильных факторов, например воды, кислорода и т.д.
Описание чертежей
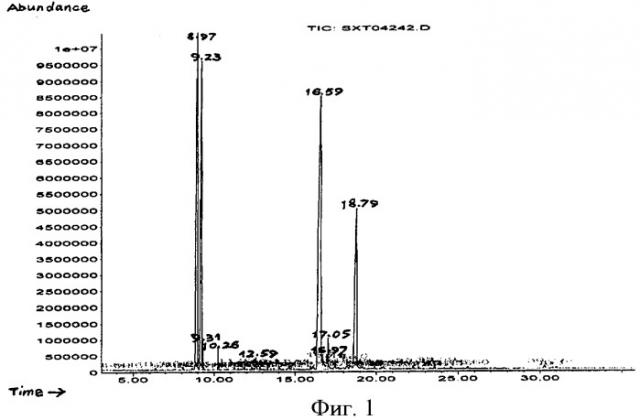
На фиг.1 показан спектр полного ионного тока эфирного масла из Chenopodium ambrosioides L. из провинции Фуцзянь, Китай,
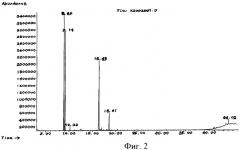
на фиг.2 - спектр полного ионного тока эфирного масла из Chenopodium ambrosioides L. из провинции Хунань, Китай,
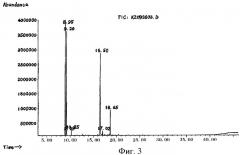
на фиг.3 - спектр полного ионного тока эфирного масла из Chenopodium ambrosioides L. из провинции Шэньси, Китай,
на фиг.4 - массовая хроматограмма α-терпинена,
на фиг.5 - массовая хроматограмма р-цимола,
на фиг.6 - массовая хроматограмма α-терпинолена,
на фиг.7 - массовая хроматограмма аскаридола.
С целью дополнительного пояснения настоящего изобретения, но не его ограничения каким-либо образом, далее приведены следующие экспериментальные примеры.
Экспериментальный пример 1
Анализ эфирного масла из Chenopodium ambrosioides L. методом газовой хроматографии-массовой спектрометрии
1. Экстрагирование эфирного масла из Chenopodium ambrosioides L.
1.1. Лекарственные материалы
Лекарственными материалами являются свежесобранные растения Chenopodium ambrosioide L. из провинции Фуцзянь, Китай, классифицированные отделом контроля качества Тяньцзиньской компании Tasly Pharmaceutical Co., Ltd. как растение Chenopodiaceae, Chenopodium, Chenopodium ambrosio des L. Растения Chenopodium ambrosioides L. из провинции Хунань и провинции Шэньси были поставлены подразделениями по выращиванию лекарственных материалов Тяньцзиньской компании Tasly Pharmaceutical Co., Ltd. в провинции Хунань и провинции Шэньси.
1.2. Метод экстрагирования
300 г свежих цельных наземных частей Chenopodium ambrosioides L. мелко порезали и подвергли дистилляции водяным паром при нормальном давлении. Дистиллят собирали до полной отгонки капель масла. Жировую фазу в верхнем слое отделили и высушили с помощью безводного сульфата натрия, и получили около 2,2 мл бледно-желтого эфирного масла с особым запахом. Выход масла составил около 0,75%.
2. Установка и реактивы
2.1. Установка
Использовался газовый хроматограф/масс-спектрограф НР6890/НР5973 производства компании Agilent Co., Ltd., США.
2.2. Реактивы
Этилацетат (чистый для анализа, Тяньцзиньский завод № 2 по выпуску реактивов); безводный сульфат натрия (чистый для анализа, Тяньцзиньский завод № 2 по выпуску реактивов); деионизированная вода (поставлена водопроводной станцией Тяньцзиньской компании Tasly Pharmaceutical Co., Ltd.).
3. Условия хроматографии
3.1. Условия газовой хроматографии
Хроматографическая колонка: гибкая силикатная капиллярная колонка HP-5MS, 60 м × 0,25 мм × 0,25 мкм, содержащая 5% фенилметилсилоксан;
Термопрограммирование: температуру доводят до 80°С и поддерживают на уровне 80°С в течение 10 мин, а затем повышают до 100°С со скоростью 4°С/мин и поддерживают на этом уровне в течение 5 мин, повышают до 150°С со скоростью 5°С/мин и поддерживают на этом уровне в течение 5 мин, доводят до 300°С со скоростью 20°С/мин и поддерживают на этом уровне в течение 2,5 мин.
Температура испарения: 250°С;
Газ-носитель: гелий высокой степени чистоты (99,999%);
Массовый расход газа-носителя: 1,0 мл/мин;
Вводимый объем образца: 1 мкл (раствор этилацетата);
Индекс разведения: 30:1.
3.2. Условия масс-спектра
Источник ионов: EI;
Температура источника ионов: 230°С;
Температура квадрупольных стержней: 150°С;
Энергия электрона: 70 эВ;
Ток эмиссии: 34,6 мкА;
Напряжение умножителя: 1781 В;
Температура поверхности контактного взаимодействия: 280°С;
Диапазон сканирования массы: 10-550 атомных единиц массы.
4. Процедуры
4.1. Качественный анализ
Ввели 1 мкл этилацетатного раствора эфирного масла из Chenopodium ambrosioides L. и подвергли анализу методом газовой хроматографии-массовой спектрометрии, в результате чего выявили 70 хроматографических пик в ходе полной ионной хроматографии (TIC), в результате которой было идентифицировано 33 компонента методом поиска в стандартной базе данных масс-спектрометрии Nist98 химической станции HP MSD и обращения к ряду соответствующих источников.
4.2. Содержание каждого компонента в эфирном масле
С помощью системы обработки данных химической станции HP MSD было рассчитано относительное процентное содержание каждого компонента методом нормализации площади пика.
5. Результаты
На фиг.1-3 проиллюстрирована полная ионная хроматография (TIC) эфирного масла из провинции Фуцзянь, провинции Хунань и провинции Шэньси, проведенная в соответствии с упомянутыми экспериментальными условиями и процедурами, а в таблице 1 приведены полученные результаты в отношении общих компонентов.
Таблица 1. Результаты обнаружения компонентов в эфирном масле из Chenopodium ambrosioides L.
| Соединения | Молекулярная формула | CAS | Химическая структура | Относительное содержание % | |
| 1 | 2-пинен | C10H16 | 80-56-8 | 0,063% | |
| 2 | Пинен | C10H16 | 127-91-3 | 0,043% | |
| 3 | Мирцен | C10H16 | 123-35-3 | 0,064% | |
| 4 | 3-карен | C10H16 | 13466-78-9 | 0,080% | |
| 5 | α-терпинен | C10H16 | 99-86-5 | 24,418% | |
| 6 | р-цимол | С10Н14 | 99-87-6 | 20,142% | |
| 7 | (+)-(R)-Лимонен | C10H16 | 5989-27-5 | 0,677% | |
| 8 | γ-терпинен | C10H16 | 99-85-4 | 0,595% | |
| 9 | р-изопропенилтолуол | C10H12 | 1195-32-0 | 0,188% | |
| 10 | 3,4-диметилфенол, 6-этил- | С10Н14О | 2219-78-5 | 0,059% | |
| 11 | Цимол | C10H14 | 25155-15-1 | 0,077% | |
| 12 | 2-циклогексен-1-ол, 1-метил-4-(1-метил-винил)-, транс- | C10H16O | 7212-40-0 | 0,086% | |
| 13 | Циклооктанон | C8H14O | 502-49-8 | 0,542% | |
| 14 | 1,3,8-р-ментатриен | C10H14 | 21195-59-5 | 0,091% | |
| 15 | Цимол | С10Н14 | 25155-15-1 | 0,128% | |
| 16 | Дурол | C10H14 | 95-93-2 | 0,043% | |
| 17 | Циклопентан, 1-метил-2-ацетил-3-(1-метилвинил)- | C11H18O | 55757 | 0,038% | |
| 18 | Транскарвеол | C10H16O | 1197-07-5 | 0,138% | |
| 19 | 8-оксабицикло[5,1,0]-окт-5-ен-2-ол, 1,4,4-триметил- | C10H16O2 | 58795-43-0 | 0,173% | |
| 20 | Терпинолен | C10H16 | 586-62-9 | 32,483% | |
| 21 | 7-оксабицикло[4,1,0]-гептан-2-он, 3-метил-6-(1-метил этил)- | С10Н16О2 | 5729-99-7 | 0,407% | |
| 22 | р-ментан-3-он, 1,2-эпокси- | C10H16O2 | 5286-38-4 | 0,580% | |
| 23 | m-тимол | С10Н14О | 89-83-8 | 0,287% | |
| 24 | Аскаридол | C10H16O2 | 512-85-6 | 14,787% | |
| 25 | Перилловый альдегид | C10H14O | 2111-75-3 | 0,076% | |
| 26 | 3-карен-10-ал | С10Н14О | 151860 | 0,072% | |
| 27 | Кариофиллен | С15Н24 | 87-44-5 | 0,155% | |
| 28 | Изобутилтиглат | С9Н16О2 | 61692-84-0 | 0,057% | |
| 29 | Прекоцен I | C12H14O2 | 17598-02-6 | 0,177% | |
| 30 | β-кубебен | C15H24 | 13744-15-5 | 0,041% | |
| 31 | m-мент-3(8)-ен | C10H18 | 13828-34-7 | 0,067% | |
| 32 | 5-нонанол, 2,8-диметил- | C11H24O | 19780-96-2 | 0,074% | |
| 33 | Прекоцен II | С13Н16О3 | 644-06-4 | 0,210% |
Экспериментальный пример 2
Испытание фармакодинамического действия эфирного масла из Chenopodium ambrosioides L.
Экспериментальные материалы
1. Испытанное лекарство
Эфирное масло из Chenopodium ambrosioides L.: желтое маслянистое вещество, полученное методом согласно Примеру 5 (номер партии: 20040129), поставленное Тяньцзиньской компанией Tasly Pharmaceutical Co., Ltd., хранившееся в герметичной мерной колбе и разбавленное растительным маслом до желаемой концентрации до применения для введения (например) животным.
2. Лекарство для позитивного контроля
Ранитидин (номер партии: 030836): приобретено у Shijiazhuang No. 4 Pharmaceutical Co., Ltd.
3. Реактивы
3.1. Растительное масло: продающееся на рынке натуральное смешанное сивушное масло, номер партии: 03110405.
3.2. Уксусная кислота: приобретена у Тяньцзиньского завода по выпуску реактивов Tianhe, номер партии: 20030722.
3.3. 2% Китайская тушь: приобретена у Пекинского химического завода Xizhong, номер партии: 980301 и разведена 5% раствором гуммиарабика.
3.4. Штамм HP: штамм согласно международному стандарту 26695.
3.5. Питательная среда: культура на агаре Columbia, полученная от компании Oxoid, Великобритания.
3.6. Антибиотики: хлоргидрат ванкомицин, аполимиксин, В, амфотерицин В производства компании Sigma.
3.7. Газовая смесь (5% O2, 10% CO2, 85% N2): Пекинская компания Pulaikesi Practical Gas Co., Ltd.
4. Подопытные животные
4.1. Km-мыши весом 18-22 г, поровну самцов и самок.
4.2. Крысы Уистара весом 160-220 г, поровну самцов и самок. Подопытные животные были предоставлены Ветеринарной лабораторией Тяньцзиньского фармацевтического исследовательского института (номер свидетельства: W-J Tianjin Experimental Animal Quality R Authorized No. 001).
Все животные были помещены под наблюдением в условиях с центральным кондиционированием воздуха (согласно стандарту на предельный уровень, Tianjin Experimental Facility Authorized No. 012). Мышам и крысам давали водопроводную воду и особое полное сбалансированное питание, приобретенное у Тяньцзиньской компании Huarong Experimental Animal Technology Co., Ltd.
Методы и результаты
1. Действие на язву желудка у крыс, спровоцированную прижиганием уксусной кислотой
Для данного эксперимента было отобрано восемьдесят крыс Уистара весом 200-220 г, поровну самцов и самок, которых произвольно поделили на 8 групп по 10 крыс в группе. Крысам раз в день в течение 13 дней постоянно вводили лекарства, например, в дозировке, приведенной в таблице 2, а крысам из модельной контрольной группы вводили, например, такое же количество растительного масла. Модель была создана через 2 часа после третьего введения. Крыс не кормили в течение 24 часов до создания модели, после чего их усыпили эфиром, выбрили им брюшка и дезинфицировали. Вдоль мечевидной срединной линии был сделан небольшой надрез. Желудок был осторожно извлечен, под наружную оболочку желудка вблизи областей пилорических желез ввели 10 мкл 40% уксусной кислоты. Затем желудок поместили обратно в брюшную полость и зашили разрез. После операции вводили лекарства. Крыс не кормили в течение 24 часов после последнего введения лекарства, после чего животных умертвили, предварительно усыпив уратаном. Брюшную полость вскрыли, извлекли желудок целиком и вскрыли его вдоль большой кривизны желудка. Содержимое желудка промыли физиологическим раствором, после чего желудок на 10 минут поместили в 1% формальдегид, а затем измерили диаметры изъязвлений с помощью точных мерных вилок и вычислили площади язв. С помощью микрошприца вводили тушь, пока ее уровень не достигнул поверхности слизистой оболочки желудка, после чего зафиксировали объем введенной туши. Степень язвы выразили в пересчете на площадь изъязвлений и объем введенной туши. Согласно результатам (см. таблицу 2) площадь язвы, а также объем введенной туши уменьшился в группах, которым вводили образец эфирного масла из Chenopodium ambrosioides L., что указывает на то, что лекарство оказывает существенное действие на ускорение заживления язвы.
| Таблица 2 | ||||
| Действие эфирного масла из Chenopodium ambrosioides L. на язву желудка, спровоцированную прижиганием уксусной кислотой (±SD, n=10) | ||||
| Группы | Дозировка (мг/кг) | Площадь язвы (мм2) | Объемы туши, введенной в область язвы (мкл) | |
| Модельная контрольная группа | - | 24,52±11,29 | 7,74±3,83 | |
| Ранитидин | 200 | 8,08±5,72** | 2,85±2,63** | |
| Высокая дозировка | 20 | 10,57±5,45** | 3.25±1,24** | |
| Эфирное масло из Chenopodium ambrosioides L. | Умеренная дозировка | 10 | 8,93±6,64** | 2,27±1,84** |
| Низкая дозировка | 5 | 8,71±5,41** | 1,67±1,29*** | |
| По сравнению с модельной контрольной группой *р<0,05, **р<0,01, ***р<0,001. |
2. Действие на язву желудка, вызванную перевязкой пилоруса у крыс
Для данного эксперимента было отобрано восемьдесят крыс Уистара весом 160 г, поровну самцов и самок, которых произвольно поделили на 8 групп по 10 крыс в группе. Крысам раз в день в течение 3 дней постоянно вводили лекарства, например, в дозировке, приведенной в таблице 3, а крысам из модельной контрольной группы вводили, например, такое же количество растительного масла. Животных усыпили через 2 часа после последнего введения (крыс не кормили в течение 48 ч перед введением), выбрили им брюшка и дезинфицировали. Ниже мечевидной срединной линии был сделан небольшой надрез. Желудок был осторожно извлечен, а затем снова помещен в брюшную полость после перевязки пилоруса, после чего разрез зашили. После операции крысам на давали есть и пить в течение 6 часов и затем умертвили их, предварительно усыпив. Брюшную полость вскрыли, кардиальный отдел желудка перевязали, извлекли весь желудок и вскрыли его вдоль большой кривизны желудка. Содержимое желудка промыли физиологическим раствором, после чего желудок на 10 минут поместили в 1% формальдегид, а затем измерили диаметры изъязвлений с помощью точных мерных вилок. Степень язвы выразили в пересчете на общую площадь изъязвлений у каждой крысы и отнесли к 5 стадиям согласно методу Okabe в качестве индекса язвы. Согласно результатам (см. таблицу 3) индексы язвы в группах, которым вводили лекарство, значительно ниже, чем в модельной контрольной группе, что указывает на то, эфирное масло из Chenopodium ambrosioides L. способно значительно ингибировать развитие язвы желудка, вызванной перевязкой пилоруса.
| Таблица 3 | |||
| Действие эфирного масла из Chenopodium ambrosioides L. на язву желудка, вызванную перевязкой пилоруса (, n=10) | |||
| Группы | Дозировка (мг/кг) | Индекс язвы | |
| Модельная контрольная группа | - | 2,7±1,8 | |
| Ранитидин | Высокая из дозировка | 200 | 0,8±0,6** |
| Эфирное масло из Chenopodium ambrosioides L. | Умеренная дозировка | 20 | 0,9±0,6* |
| Низкая дозировка | 10 | 1,0±0,8* | |
| 5 | 0,9±0,6* | ||
| По сравнению с модельной контрольной группой *р<0,05, **р<0,01, |
Примечание: Стандарт оценки индекса я