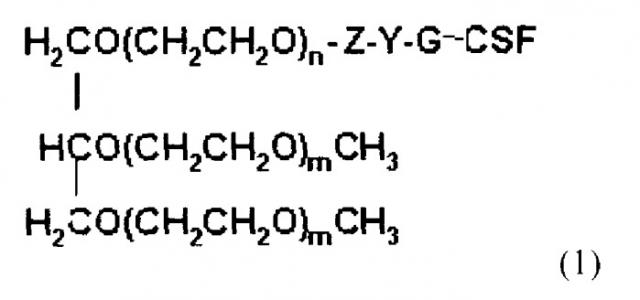Конъюгат полиэтиленгликоля-г-ксф
Иллюстрации
Показать всеИзобретение относится к медицине и касается конъюгата трехветвистого ПЭГ-Г-КСФ общей формулы (1), в котором отношение связывания трехветвистого полиэтиленгликоля (ПЭГ) и Г-КСФ составляет 1:1 (моль/моль), где ПЭГ имеет среднюю молекулярную массу от 20000 до 45000 Дальтон; включающей его фармацевтической композиции и способу его получения. Изобретение обеспечивает длительный период полувыведения in vivo, увеличенную AUC (площадь под кривой концентрация-время) и улучшенную пролиферативную активность в отношении нейтрофилов и лейкоцитов. 4 н. и 5 з.п. ф-лы, 11 ил., 4 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к конъюгату трехветвистого ПЭГ-Г-КСФ.
Уровень техники
Колониестимулирующие факторы (КСФ), как гликопротеины, влияющие на продукцию, деление и активность гематопоэтических клеток, классифицируют на гранулоцит-колониестимулирующий фактор (Г-КСФ), макрофаг-колониестимулирующий фактор (М-КСФ), гранулоцит-макрофаг-колониестимулирующий фактор (ГМ-КСФ), мультиколониестимулирующий фактор (мульти-КСФ) и так далее.
Известно, что Г-КСФ усиливает высвобождение зрелых нейтрофилов в периферическую кровь, способствуя продукции и делению предшественника нейтрофилов в костном мозге; стимулирует фагоцитарную активность, активируя зрелые нейтрофилы; проявляет антителозависимую клеточноопосредованную цитотоксичность; генерирует супероксиды; усиливает реактивность по отношению к хемотактическому фактору.
Гранулоцит-колониестимулирующий фактор человека (чГ-КСФ) был впервые выделен из клеточной линии 5637 карциномы мочевого пузыря Welt с соавторами в 1985, а рекомбинантный чГ-КСФ (рчГ-КСФ) был получен клонированием гена из кДНК-библиотеки опухолевой клетки Nagata с соавторами, Souza с соавторами в 1986. Используемый в настоящее время в клинических испытаниях рчГ-КСФ представляет собой филграстим, содержащий метионин, связанный по N-терминальному концу белка, без гликозилирования, продуцируемый Escherichia coli, и ленограстим с гликозилированием, продуцируемый клеткой животного.
В случае клинического применения рчГ-КСФ, рчГ-КСФ необходимо вводить один раз или более в день при снижении лейкоцитов, поскольку рчГ-КСФ обладает короткой продолжительностью фармакологического действия. Поэтому проведены многочисленные исследования с целью повышения полупериода циркуляции рчГ-КСФ с использованием водорастворимого полимера, чтобы тем самым разработать лекарственное средство, обладающее продолжительной активностью и высокой стабильностью, и уменьшить частоту введения.
При этом полиэтиленгликоль представляет собой водорастворимый полимер, который является сильногидрофильным и может увеличить растворимость в момент связывания с белком, применяемым для лечения. Также полиэтиленгликоль эффективен для увеличения молекулярного количества связанного с ним белка, и при этом сохраняются основные биологические функции, такие как ферментативная активность и связывание с рецептором. Так полиэтиленгликоль может уменьшать почечную фильтрацию и эффективно защищать белок от протеолитического фермента, разрушающего белок. Следовательно, проведены многочисленные исследования с целью нахождения способов модификации белка с использованием полиэтиленгликоля, поскольку он обладает преимуществами, так как предотвращает разложение белка, повышает стабильность и время циркуляции белка и уменьшает иммуногенность.
В патенте Кореи № 0508358 раскрыты конъюгаты и способ их получения, где конъюгаты обладают биологической активностью и находятся в форме связывания биосовместимого полимера с тиолом цистеинового остатка Г-КСФ при молярном отношении полимер:Г-КСФ в плане стехиометрии равном 0,7~1,3:1, предпочтительно 1:1. Но, поскольку остаток цистеина Г-КСФ, который не образует дисульфидные связи в Г-КСФ, представляет собой основную связывающую область с рецептором Г-КСФ, конъюгат, использующий цистеиновый остаток, обладает недостатком, заключающимся в том, что его фактический пролиферативный эффект, оказываемый на нейтрофилы, мал. Также, поскольку конъюгаты немедленно агрегируют, чтобы связать ПЭГ с цистеиновыми остатками Г-КСФ, существует недостаток, заключающийся в том, что необходимо добавлять малое количество ДСН (додецилсульфата натрия) к конъюгату, чтобы предотвратить агрегацию с целью безопасного хранения, и удалять ДСН ультрафильтрацией для введения in vivo.
В патенте Кореи № 0507796 раскрыты ПЭГ-гомодимерные конъюгаты, связывающие биологически активный полипептид и ПЭГ, для увеличения времени полувыведения in vivo полипептида. В частности, описано, что гомодимер связывает аминогруппу лициновых остатков двух молекул биоактивного полипептида с ПЭГ для увеличения остаточного времени и поддержания биологической активности в течение продолжительного времени. Однако конъюгаты обладают меньшей активностью, чем моно-ПЭГ-конъюгаты вследствие конъюгации избыточных ПЭГов, и физикохимические и биологические характеристики конъюгатов не однородны вследствие неспецифической конъюгации.
Также известен способ связывания рчГ-КСФ с линейным СКМ-МПЭГ (сукцинимидилкарбоксиметиловым сложным эфиром метокси-ПЭГ). Моноконъюгаты ПЭГ-Г-КСФ, полученные данным способом, имеют 3 типа позиционных изомеров, модифицированных по N-терминальному остатку, остаткам лицина 35 и лицина 45. В частности, конъюгат, модифицированный по лицину 35, обладает недостатком отщепления ПЭГов из конъюгата (патент Кореи № 0248111, патент США № 5824784).
В патенте США № 5951974 раскрыты конъюгаты связывания линейного СК-ПЭГ (полиэтиленгликоль-N-сукцинимидкарбоната) с альфа-интерфероном генной рекомбинации. Конъюгаты состоят из ковалентных конъюгатов уретановой связи по ε-аминогруппе лициновых остатков интерферона, α-аминогруппе N-терминальных цистеиновых остатков и аминогруппе гистидиновых остатков. Однако конъюгаты обладают недостатком отщепления ПЭГов из конъюгата вследствие нестабильности уретановой связи конъюгатов.
Обычно применяемый линейный полиэтиленгликоль имеет молекулярную массу примерно 1000~25000 Дальтон, но имеет ограничение при связывании многих линейных больших молекул с белком или пептидом, касающееся сохранения их активности вследствие ограниченных биологически активных областей белка и пептида.
В патенте Кореи № 0254097 раскрыты конъюгаты, связывающие двухветвистый ПЭГ лициновой скелетной структуры с альфа-интерфероном генной рекомбинации. Конъюгаты обладают способностью предотвращать связывание ПЭГ с множеством частей интерферона и имеют в 2 раза большую молекулярную массу по ПЭГ по сравнению с таковой линейного ПЭГ, поскольку два линейных ПЭГа связываются с единственной частью интерферона. Однако двухветвистый ПЭГ может быть гидролизован в одноцепной для безопасного хранения или для взаимодействия в щелочных условиях, поскольку двухветвистый ПЭГ, имеющий лициновую скелетную структуру, содержит две уретановые связи в ПЭГ.
В общем известно, что биологическая активность, устойчивость и так далее конъюгатов связывания ПЭГ с белком генной рекомбинации зависит от размера и участка, модифицированного в ПЭГ. Однако до сих пор не было известно, влияет ли размер ПЭГ в конъюгатах, связывающих ПЭГ и рчГ-КСФ, на биологическую активность белка. Следовательно, в данной области существует необходимость в преодолении недостатков известного способа путем контроля размера ПЭГ, и связывание с различными скелетными структурами ПЭГ не должно уменьшать биоактивность Г-КСФ и должно увеличивать стабильность связывающих участков.
Раскрытие изобретения
Задача настоящего изобретения заключается в том, чтобы обеспечить конъюгаты трехветвистого полиэтиленгликоля (ПЭГ)-Г-КСФ, получаемые конъюгацией трехветвистого ПЭГ и Г-КСФ, обладающие высокой стабильностью и биоактивностью, характерной для Г-КСФ, такой же или же большей, чем у самого Г-КСФ и известных в данной области конъюгатов ПЭГ-Г-КСФ; способ их получения; и содержащие их фармацевтические композиции.
Для решения вышеупомянутой задачи настоящее изобретение предоставляет конъюгаты трехветвистого полиэтиленгликоля (ПЭГ)-Г-КСФ, полученные конъюгацией производных трехветвистого ПЭГ и Г-КСФ.
Настоящее изобретение также предоставляет способ получения конъюгатов трехветвистого ПЭГ-Г-КСФ, включающий конъюгацию производных трехветвистого ПЭГ и Г-КСФ.
Настоящее изобретение также предоставляет фармацевтическую композицию, включающую конъюгаты.
Настоящее изобретение также предоставляет способ лечения нейтропении, предотвращения нейтропении или содействия увеличению числа нейтрофилов во время мобилизации гематопоэтических стволовых клеток в периферическую кровь и трансплантации гематопоэтических стволовых клеток, включающий введение конъюгата настоящего изобретения в качестве эффективного ингредиента.
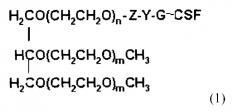
Конъюгаты трехветвистого ПЭГ-Г-КСФ настоящего изобретения могут быть получены конъюгацией трехветвистого полиэтиленгликоля (ПЭГ), представленного следующей общей формулой (1):
где n представляет собой целое число от 1 до 1000;
m представляет собой целое число от 10 до 1000;
Z представляет собой (CH2)S или (CH2)SNHCO(CH2)S в качестве линкера Г-КСФ и ПЭГ, где S представляет собой целое число от 1 до 6;
Y представляет собой амидную связь, образованную объединением NH2-функциональной группы в Г-КСФ и функциональной группы производного ПЭГ.
ПЭГ имеет среднюю молекулярную массу от 200 до 45000 Дальтон, предпочтительно от 20000 до 45000 Дальтон, более предпочтительно от 23000 до 43000 Дальтон. Поскольку эффективное с точки зрения лечения время может быть изменено согласно молекулярной массе ПЭГ, средняя молекулярная масса ПЭГ, использованного в настоящем изобретении, может быть изменена в зависимости от времени, необходимого для лечения.
Ниже подробно описан способ получения конъюгата трехветвистого ПЭГ-Г-КСФ настоящего изобретения, включающий конъюгацию производных трехветвистого ПЭГ и Г-КСФ.
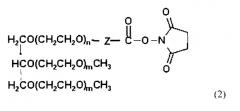
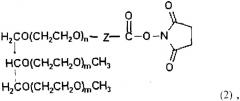
Конъюгаты трехветвистого ПЭГ-Г-КСФ общей формулы (1) получают формируя ковалентную связь между производным трехветвистого ПЭГ следующей общей формулы (2) и Г-КСФ, где ПЭГ имеет среднюю молекулярную массу от 200 до 45000 Дальтон, предпочтительно от 20000 до 45000 Дальтон, более предпочтительно от 23000 до 43000 Дальтон:
где n представляет собой целое число от 1 до 1000;
m представляет собой целое число от 10 до 1000;
Z представляет собой (CH2)S или (CH2)SNHCO(CH2)S в качестве линкера Г-КСФ и ПЭГ, где S представляет собой целое число от 1 до 6; и
функциональная группа, которая химически реагирует с белками и пептидами, содержащими Г-КСФ, представляет собой N-гидроксисукцинимид.
Производные трехветвистого ПЭГ настоящего изобретения активируют большие молекулы, имеющие ветвистую структуру, в которой объединены три линейные биологически рецептивные большие молекулы. Все три OH- (гидроксильные) области в глицериновой скелетной структуре полимеризованы с молекулами, образованными звеньями этиленгликоля, и конец одной области активирован в виде функциональной группы. Другие две области, за исключением активированной области, замещены монометоксигруппами, чтобы предотвратить дополнительные реакции. Когда получают вышеупомянутые производные ветвистого ПЭГ, размер каждого линейного ПЭГ можно свободно контролировать способом, известным в данной области.
Производные трехветвистого ПЭГ в настоящем изобретении могут быть использованы как известные в данной области производные ПЭГ с функциональной группой, химически реагирующей с белком и пептидом. Производные ПЭГ общей формулы (2) (с N-гидроксисукцинимидом) являются предпочтительными в терминах выхода конъюгата настоящего изобретения.
Г-КСФ в настоящем изобретении может быть выделен из организма млекопитающего или синтезирован способом, известным в данной области, таким как гДНА-клонирование, кДНА-клонирование и так далее. Также Г-КСФ может коммерчески распространяться на рынке.
Также, ковалентная связь между Г-КСФ и производными трехветвистого ПЭГ может быть сформирована при низкой температуре. Реакцию завершают добавлением кислот, и полученные коньюгаты трехветвистого ПЭГ-Г-КСФ могут быть очищены способом, известным в данной области, таким как способ очистки с использованием катионообменной смолы.
В настоящем изобретении реакционное молярное отношение Г-КСФ к производному трехветвистого ПЭГ составляет от 1:0,5 до 1:50. Предпочтительное молярное отношение Г-КСФ к производному трехветвистого ПЭГ составляет от 1:0,5 до 1:5, поскольку выход моно-ПЭГ-Г-КСФ-конъюгата уменьшается с увеличением молярного отношения полиэтиленгликоля к Г-КСФ.
Настоящее изобретение также предоставляет фармацевтическую композицию для лечения или предотвращения симптомов, вызванных пониженной гематопоэтической функцией или пониженной иммунологической функцией. В частности, клинические испытания с использованием конъюгата настоящего изобретения в качестве действующего показали, что число нейтрофилов уменьшалось и симптомы ослаблялись или контролировались в случае заболеваний, возникших в ходе лечения, такого как противораковая химиотерапия или радиотерапия; в случае инфекционных заболеваний, вызванных бактериями, вирусом и грибом; в случае других инфекционных заболеваний; заболеваний, вызванных генетической или экологической причиной, таких как тяжелая хроническая нейтропения и лейкемия; или в случае гериатрических заболеваний, вызванных старением. Например, симптомы, вызванные пониженной гематопоэтической функцией или пониженной иммунологической функцией, представляют собой нейтропению, вызванную противораковой химиотерапией опухоли кроветворной системы или солидного рака, нейтропению, вызванную миелодиспластическим синдромом, нейтропению, вызванную апластической анемией, конгенитальную идиопатическую нейтропению и нейтропению, вызванную лечением вируса иммунодефицита человека.
Композиция может состоять из конъюгатов ПЭГ-Г-КСФ настоящего изобретения или фармацевтически приемлемых разбавителя, антисептиков, солюбилизатора, эмульгатора, адьюванта и/или носителя.
Композиции настоящего изобретения могут быть составлены в виде агента для инъекций, капсулы, таблетки, жидкого лекарственного средства, драже, мази, глазной мази, примочки для глаз, агента для трансдермальной абсорбции, пасты, припарки, аэрозолей и так далее.
Также эффективная доза Г-КСФ весьма мала и составляет 0,1~500 мкг (предпочтительно 5~50 мкг). Также лекарственное средство, включающее 0,1~500 мкг Г-КСФ, может вводиться взрослому обычно от 1 до 7 раз в неделю. Таким образом, эффективная доза фармацевтической композиции настоящего изобретения может быть рассчитана исходя из известного вводимого количества Г-КСФ и молекулярной массы ПЭГ, использованного в настоящем изобретении. Эффективная доза фармацевтической композиции настоящего изобретения может быть изменена, но обычно раз в неделю, и композиция может быть введена один или несколько раз в день в пределах диапазона дневной эффективной дозы.
Следующие примеры служат дополнительной иллюстрацией настоящего изобретения и предполагается, что объем настоящего изобретения никоим образом не ограничен ими.
Конъюгаты трехветвистого ПЭГ-Г-КСФ настоящего изобретения более фармацевтически стабильны, чем конъюгаты линейного или двухветвистого ПЭГ-Г-КСФ в смысле отщепления ПЭГов из конъюгатов ПЭГ-Г-КСФ и формирования агрегатов конъюгатов. Также конъюгаты настоящего изобретения могут быть использованы без дополнительного отделения позиционных изомеров, поскольку конъюгаты состоят из позиционных изомеров со сходными активностями. Также композиция настоящего изобретения обладает эффектами непрерывной продукции нейтрофилов и увеличенным временем полувыведения in vivo.
Описание чертежей
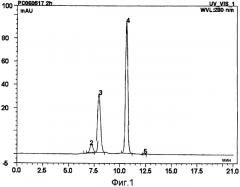
На Фиг.1 представлен схематичный чертеж, иллюстрирующий аналитические результаты для смеси, сформированной для получения конъюгатов трехветвистого ПЭГ, имеющего MW 23000 Да, и Г-КСФ, по примеру 1, полученные эксклюзионной высокоэффективной жидкостной хроматографией.
На Фиг.2 представлен схематичный чертеж, иллюстрирующий аналитические результаты для смеси, сформированной для получения конъюгатов трехветвистого ПЭГ, имеющего MW 43000 Да, и Г-КСФ, по примеру 2, полученные эксклюзионной высокоэффективной жидкостной хроматографией.
На Фиг.3 представлен схематичный чертеж, иллюстрирующий аналитические результаты для смеси, сформированной для получения конъюгатов линейного ПЭГ, имеющего MW 10000 Да, и Г-КСФ, по сравнительному примеру 1, полученные эксклюзионной высокоэффективной жидкостной хроматографией.
На Фиг.4 представлен схематичный чертеж, иллюстрирующий аналитические результаты чистоты моноконъюгатов трехветвистого ПЭГ-Г-КСФ, отделенных от смеси примера 1, полученные эксклюзионной высокоэффективной жидкостной хроматографией.
На Фиг.5 представлен схематичный чертеж, иллюстрирующий аналитические результаты чистоты моноконъюгатов трехветвистого ПЭГ-Г-КСФ, отделенных от смеси примера 2, полученные эксклюзионной высокоэффективной жидкостной хроматографией.
На Фиг.6 представлен схематичный чертеж, иллюстрирующий аналитические результаты чистоты моноконъюгатов линейного ПЭГ-Г-КСФ, отделенных от смеси сравнительного примера 1, полученные эксклюзионной высокоэффективной жидкостной хроматографией.
На Фиг.7 представлен схематичный чертеж, иллюстрирующий аналитические результаты для моноконъюгатов трехветвистого ПЭГ-Г-КСФ, отделенных от смеси примера 1, полученные с использованием масс-спектрометрии матрично-активированной лазерной десорбции-ионизации (MALDI-TOF).
На Фиг.8 представлен схематичный чертеж, иллюстрирующий аналитические результаты для моноконъюгатов трехветвистого ПЭГ-Г-КСФ, отделенных от смеси примера 2, полученные с использованием масс-спектрометрии матрично-активированной лазерной десорбции-ионизации (MALDI-TOF).
На Фиг.9 представлен схематичный чертеж, иллюстрирующий аналитические результаты для моноконъюгатов линейного ПЭГ-Г-КСФ, отделенных от смеси сравнительного примера 1, полученные с использованием масс-спектрометрии матрично-активированной лазерной десорбции-ионизации (MALDI-TOF).
На Фиг.10 представлен схематичный чертеж, иллюстрирующий аналитические результаты для позиционных изомеров, включающих моноконъюгаты трехветвистого ПЭГ-Г-КСФ, отделенные от смеси примера 1, полученные с использованием ионообменной хроматографии.
На Фиг.11 представлен схематичный чертеж, иллюстрирующий аналитические результаты для биологической активности позиционных изомеров моноконъюгатов трехветвистого ПЭГ-Г-КСФ, отделенных от смеси примера 1 согласно экспериментальному примеру 1, определенной способом экспериментального примера 2.
<Пример 1> Получение конъюгатов трехветвистого полиэтиленгликоля (ПЭГ MW 23000 Да)-Г-КСФ
10 мг рчГ-КСФ (Dong-A Pharm. Co., Ltd.) фильтровали, используя 50 мМ натрий-боратного буферного раствора с pH 8,5. Затем 9,2 мг трехветвистого ПЭГ, содержащего N-гидроксисукцинимид (NOF Corporation, Япония) и имеющего молекулярную массу 23000 Да, прибавляли к раствору в молярном соотношении рчГ-КСФ:трехветвистый ПЭГ 1:0,75. Далее раствор перемешивали при 4°C в течение 90 мин. Реакцию останавливали прибавлением 100 мМ HCl, чтобы придать раствору pH 4, и разбавлением стерильной дистиллированной водой, взятой в объеме, в 5 раз превышающем объем раствора. Затем проводили катионообменную хроматографию смеси с использованием SP-Sepharose Fast Flow (Amersham Pharmacia Biotech), уравновешенного 20 мМ натрий-ацетатного буферного раствора (pH 4), и отделяли конъюгат трехветвистого ПЭГ-Г-КСФ. Смесь фракционировали, используя концентрационный градиент хлорида натрия (NaCl) от 0 до 1 М. Молярное отношение трехветвистого ПЭГ к Г-КСФ в конъюгатах трехветвистого ПЭГ-Г-КСФ подтверждали ВЭЖХ и SDS-PAGE. Далее, исключали ди- или более (три-, тетра-, …) конъюгаты трехветвистого ПЭГ-Г-КСФ, непрореагировавший Г-КСФ, оставшийся после реакции, и так далее. Далее, элюаты концентрировали и стерильно фильтровали, получая моноконъюгат трехветвистого ПЭГ-Г-КСФ, в котором конъюгированы Г-КСФ и трехветвистый ПЭГ (MW 23000 Да) (или названы как монотрехветвистый ПЭГ-Г-КСФ-конъюгат).
Реакционная смесь состояла из 35,4% монотрехветвистый ПЭГ-Г-КСФ-конъюгата (моно-ПЭГ-Г-КСФ-конъюгата), примерно 59,4% Г-КСФ, немодифицированного ПЭГом, и других компонентов [ди-трехветвистый ПЭГ-Г-КСФ-конъюгата (ди-ПЭГ-Г-КСФ-конъюгат) и N-гидроксисукцинимида (NHS)], как подтверждено эксклюзионной высокоэффективной жидкостной хроматографией (см. Фиг.1, где 1 и 2 представляют ди-ПЭГ-Г-КСФ-конъюгат, 3 представляет моно-ПЭГ-Г-КСФ-конъюгат, 4 представляет Г-КСФ, немодифицированный ПЭГом, и 5 представляет NHS-уходящую группу из трехветвистого ПЭГ). Также чистоту монотрехветвистый ПЭГ-Г-КСФ-конъюгата, отделенного от смеси, определяли эксклюзионной высокоэффективной жидкостной хроматографией (см. Фиг.4, где 2 представляет ди-ПЭГ-Г-КСФ-конъюгат и 3 представляет моно-ПЭГ-Г-КСФ-конъюгат), и молекулярную массу измеряли масс-спектрометрией матрично-активированной лазерной десорбции/ионизации с времяпролетным анализатором (MALDI-TOF) (см. Фиг.7: аналитический результат для монотрехветвистого ПЭГ-Г-КСФ по методу MALDI-TOF/MS). Также позиционные изомеры отделяли с использованием аналитической колонки с катионообменной смолой (SP-5WP, TOSOH) для подтверждения того, что соотношение для каждого позиционного изомера составляло 54%:33%:10% (см. Фиг.10). Также подтверждено, что каждый позиционный изомер имеет весьма сходную активность в эксперименте на биологическую активность каждого позиционного изомера (см. Фиг.11).
<Пример 2> Получение конъюгатов трехветвистого полиэтиленгликоля (ПЭГ MW 43000 Да)-Г-КСФ
10 мг рчГ-КСФ (Dong-A Pharm. Co., Ltd.) фильтровали, используя 50 мМ натрий-боратного буферного раствора с pH 8,5. Затем 17,2 мг трехветвистого ПЭГ с N-гидроксисукцинимидом (NOF Corporation, Япония) и молекулярной массой 43000 Да прибавляли к раствору, чтобы создать молярное соотношение рчГ-КСФ:трехветвистый ПЭГ 1:0,75. Далее раствор перемешивали при 4°C в течение 90 мин. Реакцию останавливали прибавлением 100 мМ HCl, чтобы придать раствору pH 4, и разбавлением стерильной дистиллированной водой, взятой в объеме в 5 раз превышающем объем раствора. Затем проводили катионообменную хроматографию смеси с использованием SP-Sepharose Fast Flow (Amersham Pharmacia Biotech), уравновешенного 20 мМ натрий-ацетатного буферного раствора (pH 4), и выделяли из нее конъюгат трехветвистого ПЭГ-Г-КСФ. Смесь фракционировали, используя концентрационный градиент хлорида натрия (NaCl) от 0 до 1 М. Молярное отношение трехветвистого ПЭГ к Г-КСФ в конъюгатах трехветвистого ПЭГ-Г-КСФ подтверждали ВЭЖХ и SDS-PAGE. Далее исключали ди- или более (три-, тетра-, …) конъюгаты трехветвистого ПЭГ-Г-КСФ, непрореагировавший Г-КСФ, оставшийся после реакции, и так далее. Далее элюаты концентрировали и стерильно фильтровали, получая моноконъюгат трехветвистого ПЭГ-Г-КСФ, в котором конъюгированы Г-КСФ и трехветвистый ПЭГ (MW 43000 Да) (или названы как монотрехветвистый ПЭГ-Г-КСФ-конъюгат).
Реакционная смесь состояла из 18,7% монотрехветвистого ПЭГ-Г-КСФ-конъюгата (моно-ПЭГ-Г-КСФ-конъюгата), примерно 40,1% Г-КСФ, немодифицированного ПЭГом, и других компонентов [ди-трехветвистый ПЭГ-Г-КСФ-конъюгата (ди-ПЭГ-Г-КСФ-конъюгата) и N-гидроксисукцинимида (NHS)], как подтверждено эксклюзионной высокоэффективной жидкостной хроматографией (см. Фиг.2, где 2 представляет ди-ПЭГ-Г-КСФ-конъюгат, 3 представляет моно-ПЭГ-Г-КСФ-конъюгат и 4 представляет Г-КСФ, немодифицированный ПЭГом). Также чистоту монотрехветвистого ПЭГ-Г-КСФ-конъюгата, отделенного от смеси, определяли эксклюзионной высокоэффективной жидкостной хроматографией (см. Фиг.5, где 1 представляет олиго-ПЭГ-Г-КСФ-конъюгат, 2 представляет ди-ПЭГ-Г-КСФ-конъюгат и 3 представляет моно-ПЭГ-Г-КСФ-конъюгат), и молекулярную массу измеряли масс-спектрометрией матрично-активированной лазерной десорбции/ионизации с времяпролетным анализатором (MALDI-TOF) (см. Фиг.8: аналитический результат для монотрехветвистого ПЭГ-Г-КСФ по методу MALDI-TOF/MS).
<Сравнительный пример 1> Получение конъюгатов линейного полиэтиленгликоля (ПЭГ MW 10000 Да)-Г-КСФ
10 мг рчГ-КСФ (Dong-A Pharm. Co., Ltd.) фильтровали, используя 50 мМ натрий-боратного буферного раствора с pH 8,5. Затем 5,2 мг линейного ПЭГ с N-гидроксисукцинимидом (NOF Corporation, Япония) и молекулярной массой 13000 Дальтон прибавляли к раствору, чтобы создать молярное соотношение рчГ-КСФ: линейный ПЭГ 1:0,75. Далее раствор перемешивали при 4°C в течение 90 мин. Реакцию останавливали прибавлением 100 мМ HCl, чтобы придать раствору pH 4, и разбавлением стерильной дистиллированной водой, взятой в объеме, в 5 раз превышающем объем раствора. Затем поводили катионообменную хроматографию смеси с использованием SP-Sepharose Fast Flow (Amersham Pharmacia Biotech), уравновешенного 20 мМ натрий-ацетатного буферного раствора (pH 4), и выделяли из нее конъюгат линейного ПЭГ-Г-КСФ. Смесь фракционировали, используя концентрационный градиент хлорида натрия (NaCl) от 0 до 1 М. Молярное отношение линейного ПЭГ к Г-КСФ в конъюгате линейного ПЭГ-Г-КСФ подтверждали ВЭЖХ и SDS-PAGE. Далее исключали ди- или более (три-, тетра-, …) конъюгаты линейного ПЭГ-Г-КСФ, непрореагировавший Г-КСФ, оставшийся после реакции, и так далее. Далее элюаты концентрировали и стерильно фильтровали, получая моноконъюгат линейного ПЭГ-Г-КСФ, в котором конъюгированы Г-КСФ и линейный ПЭГ (MW 13000 Да) (или названы как монолинейный ПЭГ-Г-КСФ-конъюгат).
Реакционная смесь состояла из 45,6% монолинейного ПЭГ-Г-КСФ-конъюгата (моно-ПЭГ-Г-КСФ-конъюгата), примерно 45,9% Г-КСФ, немодифицированного ПЭГом, и других компонентов [ди-линейного ПЭГ-Г-КСФ-конъюгата (ди-ПЭГ-Г-КСФ-конъюгата) и N-гидроксисукцинимида (NHS)], как подтверждено эксклюзионной высокоэффективной жидкостной хроматографией (см. Фиг.3, где 1 представляет олиго-ПЭГ-Г-КСФ-конъюгат, 2 представляет ди-ПЭГ-Г-КСФ-конъюгат, 3 представляет моно-ПЭГ-Г-КСФ-конъюгат и 4 представляет Г-КСФ, немодифицированный ПЭГом). Также чистоту монолинейного ПЭГ-Г-КСФ-конъюгата, отделенного от смеси, определяли эксклюзионной высокоэффективной жидкостной хроматографией (см. Фиг.6, где 1 представляет олиго-ПЭГ-Г-КСФ-конъюгат, 2 представляет ди-ПЭГ-Г-КСФ-конъюгат, 3 представляет моно-ПЭГ-Г-КСФ-конъюгат и 4 представляет Г-КСФ, немодифицированный ПЭГом), и молекулярную массу измеряли масс-спектрометрией матрично-активированной лазерной десорбции/ионизации с времяпролетным анализатором (MALDI-TOF) (см. Фиг.9).
<Сравнительный пример 2> Получение конъюгатов линейного полиэтиленгликоля (ПЭГ MW 20000 Да)-Г-КСФ
10 мг рчГ-КСФ (Dong-A Pharm. Co., Ltd.) фильтровали, используя 50 мМ натрий-боратного буферного раствора с pH 8,5, и затем 8,0 мг линейного ПЭГ, содержащего N-гидроксисукцинимид (NOF Corporation, Япония) и имеющего молекулярную массу 20000 Да, прибавляли к раствору, чтобы создать молярное соотношение рчГ-КСФ: линейный ПЭГ 1:0,75. Далее раствор перемешивали при 4°C в течение 90 мин. Реакцию останавливали прибавлением 100 мМ HCl, чтобы придать раствору pH 4, и разбавлением стерильной дистиллированной водой, взятой в объеме, в 5 раз превышающем объем раствора. Затем проводили катионообменную хроматографию смеси с использованием SP-Sepharose Fast Flow (Amersham Pharmacia Biotech), уравновешенного 20 мМ натрий-ацетатного буферного раствора (pH 4), и выделяли из нее конъюгат линейного ПЭГ-Г-КСФ. Смесь фракционировали, используя концентрационный градиент хлорида натрия (NaCl) от 0 до 1 М. Молярное отношение линейного ПЭГ к Г-КСФ в конъюгате линейного ПЭГ-Г-КСФ подтверждали ВЭЖХ и SDS-PAGE. Далее исключали ди- или более (три-, тетра-, …) конъюгаты линейного ПЭГ-Г-КСФ, непрореагировавший Г-КСФ, оставшийся после реакции, и так далее. Далее элюаты концентрировали и стерильно фильтровали, получая моноконъюгат линейного ПЭГ-Г-КСФ, в котором конъюгированы Г-КСФ и линейный ПЭГ (MW 20000 Да) (или названы как монолинейный ПЭГ-Г-КСФ-конъюгат).
<Сравнительный пример 3> Получение конъюгатов двухветвистого полиэтиленгликоля (ПЭГ MW 20000 Да, лициновая скелетная структура)-Г-КСФ
10 мг рчГ-КСФ (Dong-A Pharm. Co., Ltd.) фильтровали, используя 50 мМ натрий-боратного буферного раствора с pH 8,5, и затем 9,1 мг двухветвистого ПЭГ, содержащего N-гидроксисукцинимид (Nektar, США) и имеющего молекулярную массу 20000 Да, прибавляли к раствору, чтобы создать молярное соотношение рчГ-КСФ:двухветвистый ПЭГ 1:0,75. Далее раствор перемешивали при 4°C в течение 90 мин. Реакцию останавливали прибавлением 100 мМ HCl, чтобы придать раствору pH 4, и разбавлением стерильной дистиллированной водой, взятой в объеме, в 5 раз превышающем объем раствора. Затем проводили катионообменную хроматографию смеси с использованием SP-Sepharose Fast Flow (Amersham Pharmacia Biotech), уравновешенного 20 мМ натрий-ацетатного буферного раствора (pH 4), и выделяли из нее конъюгат двухветвистого ПЭГ-Г-КСФ. Смесь фракционировали, используя концентрационный градиент хлорида натрия (NaCl) от 0 до 1 М. Молярное отношение двухветвистого ПЭГ к Г-КСФ в конъюгате двухветвистого ПЭГ-Г-КСФ подтверждали ВЭЖХ и SDS-PAGE. Далее исключали ди- или более (три-, тетра-, …) конъюгаты двухветвистого ПЭГ-Г-КСФ, непрореагировавший Г-КСФ, оставшийся после реакции, и так далее. Далее элюаты концентрировали и стерильно фильтровали, получая моноконъюгат двухветвистого ПЭГ-Г-КСФ, в котором конъюгированы Г-КСФ и двухветвистый ПЭГ (MW 20000 Да) (или названы как моно двухветвистый ПЭГ-Г-КСФ-конъюгат).
<Сравнительный пример 4> Получение конъюгатов двухветвистого полиэтиленгликоля (ПЭГ MW 20000 Да, глицериновая скелетная структура)-Г-КСФ
10 мг рчГ-КСФ (Dong-A Pharm. Co., Ltd.) фильтровали, используя 50 мМ натрий-боратного буферного раствора с pH 8,5. Затем 8,0 мг двухветвистого ПЭГ, содержащего N-гидроксисукцинимид (NOF, Япония) и имеющего молекулярную массу 20000 Да, прибавляли к раствору, чтобы создать молярное соотношение рчГ-КСФ:двухветвистый ПЭГ 1:0,75. Раствор перемешивали при 4°C в течение 90 мин. Затем реакцию останавливали прибавлением 100 мМ HCl, чтобы придать раствору pH 4, и разбавлением стерильной дистиллированной водой, взятой в объеме, в 5 раз превышающем объем раствора. Затем проводили катионообменную хроматографию смеси с использованием SP-Sepharose Fast Flow (Amersham Pharmacia Biotech), уравновешенного 20 мМ натрий-ацетатного буферного раствора (pH 4), и выделяли из нее конъюгат двухветвистого ПЭГ-Г-КСФ. Смесь фракционировали, используя концентрационный градиент хлорида натрия (NaCl) от 0 до 1 М. Молярное отношение двухветвистого ПЭГ к Г-КСФ в конъюгате двухветвистого ПЭГ-Г-КСФ подтверждали ВЭЖХ и SDS-PAGE. Далее исключали ди- или более (три-, тетра-, …) конъюгаты двухветвистого ПЭГ-Г-КСФ, непрореагировавший Г-КСФ, оставшийся после реакции, и так далее. Далее элюаты концентрировали и стерильно фильтровали, получая моноконъюгат двухветвистого ПЭГ-Г-КСФ, в котором конъюгированы Г-КСФ и двухветвистый ПЭГ (MW 20000 Да) (или названы как моно двухветвистый ПЭГ-Г-КСФ-конъюгат).
<Сравнительный пример 5> Получение конъюгатов монометоксиполиэтиленгликоля-Г-КСФ со связью по N-терминальному α-аминоостатку
Указанный конъюгат получали способом, описанным в патенте Кореи № 0248111 и в патенте США № 5824784. Данный способ кратко описан ниже.
100 мМ фосфата натрия, содержащего 20 мМ NaCNBH3, и 5 мг/мл рчГ-КСФ перемешивали при 4°C. Затем 5-кратное мольное количество линейного метоксиполиэтиленгликоль-(мПЭГ)-альдегида (Nektar, США) прибавляли к раствору, который перемешивали в течение 10 ч. Реакцию останавливали прибавлением 100 мМ HCl, чтобы придать раствору pH 4, и разбавлением стерильной дистиллированной водой, взятой в объеме, в 5 раз превышающем объем раствора. Затем проводили катионообменную хроматографию смеси с использованием SP-Sepharose Fast Flow (Amersham Pharmacia Biotech), уравновешенного 20 мМ натрий-ацетатного буферного раствора (pH 4), и выделяли из нее конъюгат линейного ПЭГ-Г-КСФ. Смесь фракционировали, используя концентрационный градиент хлорида натрия (NaCl) от 0 до 1 М. Далее элюаты концентрировали и стерильно фильтровали, получая моноконъюгат мПЭГ-Г-КСФ, в котором конъюгированы Г-КСФ и линейный ПЭГ (MW 20000 Да) (или названы как монолинейный ПЭГ-Г-КСФ-конъюгат).
<Сравнительный пример 6> Получение конъюгатов монометоксиполиэтиленгликоля-Г-КСФ со связью по тиольной группе цистеинового остатка Г-КСФ
Указанный конъюгат получали способом, описанным в патенте Кореи № 0508358. Данный способ кратко описан ниже.
1 мг рчГ-КСФ (Dong-A Pharm. Co., Ltd.) прибавляли к 1 мл натрий-фосфатного буферного раствора (0,1 М), имеющего pH 8,5, и к данному раствору прибавляли 52,6 мг полиэтиленгликольмалеимида (NOF, Япония). Затем раствор перемешивали в течение 1 ч при комнатной температуре. Затем производные ПЭГ, оставшиеся после реакции, удаляли из раствора с использованием centricon 30 (Amicon, США). Затем раствор концентрировали и стерильно фильтровали, получая моно-мПЭГ-Г-КСФ-конъюгат.
Испытания по определению свойств и фармакологической активности проводили, используя полученные выше конъюгаты; результаты приведены ниже.
<Экспериментальный пример 1> Аналитическое разделение позиционных изомеров конъюгатов трехветвистого ПЭГ-Г-КСФ
100 мкг монотрехветвистого ПЭГ-Г-КСФ-конъюгата примера 1 вводили в аналитическую колонку с катионообменной смолой (SP-5WP, TOSOH), уравновешенной 25 мМ натрий-ацетатного буфера (pH 4,0, регулировали ледяной уксусной кислотой), и каждый позиционный изомер конъюгатов отделяли, используя 100 мМ натрий-ацетатного буфера (pH 7,8). Устанавливали, что соотношение позиционных изомеров составляло примерно 54%:33%:10% (см. Фиг.10).
<Экспериментальный пример 2> Анализ биологической активности позиционных изомеров конъюгатов трехветвистого ПЭГ-Г-КСФ
Относительные биологические активности позиционных изомеров конъюгатов трехветвистого ПЭГ-Г-КСФ примера 1 измеряли способом, применяемым для Г-КСФ.
Клеточный штамм NFS-60, культивированный в среде роста RPMI 1640, содержащей 10% FBS и 1 нг/мл rmIL-3, промывали 3 раза используемой для тестирования средой RPMI 1640, содержащей 5% FBS. Затем клеточный штамм разводили в 100 мл (2×105 клеток/мл) и помещали в 96-луночный планшет. Далее образец разводили средой для тестирования, получая образец с концентрацией 200 нг/мл и еще 9 образцов, полученных 5-кратным градиентным разведением 200 нг/мл, и образцы распределяли в 3 лунки, каждая 100 мл, на концентрацию в 96-луночных планшетах, содержащих растворы с клетками.
Каждую лунку культивировали в инкубаторе при 37°C и 5% CO2 в течение 48 ч, и в каждую лунку добавляли 40 мкл MTS. Спустя 2 ч ELISA-ридером измеряли поглощение образца при 490 нм. Значение EC50 рассчитывали по кривой доза-ответ с использованием линейного регрессионного анализа прямой линии, включающей точки стандартной кривой, и определяли активности позиционных изомеров (см. Фиг.11). Конъюгаты трехветвистого ПЭГ-Г-КСФ настоящего изобретения содержат позиционные изомеры, имеющие сходные активности. То есть нет необходимости удалять некоторые позиционные изомеры, обладающие относительно низкой активностью, поскольку конъюгаты трехветвистого ПЭГ-Г-КСФ настоящего изобретения состоят из конъюгатов с единообразными активностями.
<Экспериментальный пример 3> Фармакокинетическое испытание конъюгатов трехветвистого ПЭГ-Г-КСФ
Фармакодинамическое испытание проводили путем подкожной инъекции каждого из: Г-КСФ, конъюгатов ПЭГ-Г-КСФ примера 1 и конъюгатов ПЭГ-Г-КСФ примера 2 тестовым крысам (Sprague Dawley), которые имели массу тела 240-260 г. После введения в количестве 400 мкг на крысу, у крыс отбирали образцы крови во временных точках 0 мин, 30 мин, 1 ч, 2 ч, 3 ч, 4 ч, 8 ч, 12 ч, 1 день, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней и 7 дней после введения. Затем количественно анализировали концентрации конъюгатов Г-КСФ в образце, используя набор для иммуносорбентного анализа с применением фиксированных ферментов (ELISA) (Biosource, США).
Период полувыведения из крови конъюгатов ПЭГ-Г-КСФ примера 1 и примера 2 возрастал в 3 и 10,8 раза соответственно, по сравнению с таковым для Г-КСФ, и площади под кривой концентрации - время для крови конъюгатов примера 1 и примера 2 - также возрастали в 7,6 и 23,4 раза соответственно по сравнению с таковыми для Г-КСФ [Таблица 1: Фармакокинетическое испытание конъюгатов трехветвистого ПЭГ-Г-КСФ и Г-КСФ на крысе (крыса Sprague Dawley)]. Данным испытанием установлено, что фармакокинетика конъюгата ПЭГ-Г-КСФ зависит от размера ПЭГ.
| Таблица 1 | |||
| рчГ-КСФ | Пример 1 | Пример 2 | |
| Cmax (ч) | 1383,2 | 1676,8 | 1710,6 |
| Tmax (ч) | 1,5 | 12 | 36 |
| T1/2 (ч) | 2,9 | 8,7 | 31,2 |
| AUC (нг*ч/мл) | 6246,9 | 47420,3 | 146196,1 |
| *Сокращения в приведенной выше таблице имеют следующие значения:Tmax: время достижения максимальной концентрацииCmax: максимальная концентрацияT1/2: период полувыведенияAUC: пл |