Композиция для доставки нуклеиновых кислот в клетки млекопитающих
Иллюстрации
Показать всеИзобретение относится к медицине и касается композиции для доставки нуклеиновых кислот в клетки млекопитающих в присутствии и в отсутствие сыворотки в ростовой среде. Композиция включает поликатионный амфифил и нейтральный фосфолипид и образует комплекс с нуклеиновой кислотой. Изобретение обеспечивает высокую эффективность и низкую токсичность композиции, и способность доставлять в клетки млекопитающих как короткие, так и протяженные нуклеиновые кислоты. 2 ил., 3 табл.
Реферат
Изобретение относится к области биотехнологии, медицины и химико-фармацевтической промышленности и касается композиции для транспорта нуклеиновых кислот в клетки млекопитающих.
Генная терапия представляет собой фундаментальный подход к лечению наследственных или приобретенных заболеваний путем доставки «терапевтических» нуклеиновых кислот, способных воздействовать на клетку или ткани на генетическом уровне. Для генной терапии главным условием коррекции заболевания является эффективная доставка нуклеиновых кислот в клетки-мишени, создание условий для экспрессии генов и обеспечение их длительного функционирования [1-4]. Нуклеиновая кислота должна преодолеть огромное число барьеров, прежде чем она достигнет своей цели, а система ее доставки должна защитить ее от разрушительного воздействия ферментов, способствовать проникновению внутрь клетки, а в некоторых случаях и дальнейшей экспрессии в ядре. Кроме того, система доставки должна быть не токсичной, не иммуногенной и биосовместимой.
Среди методов доставки генетического материала в эукариотические клетки заметное место занимает липофекция - перенос нуклеиновых кислот с помощью катионных амфифилов. Катионные амфифилы и липосомы на их основе образуют с молекулами нуклеиновых кислот электростатические комплексы, которые защищают нуклеиновые кислоты от деградации под действием клеточных ферментов, а их проникновение в клетку происходит по механизму эндоцитоза. К катионным амфифилам относят обширный круг химических веществ, имеющих общие структурные черты: наличие положительно заряженного и гидрофобного доменов, связанных спейсером различной длины [5-7]. Гидрофильный положительно заряженный домен необходим для связывания с молекулой нуклеиновой кислоты, а гидрофобный - для ее инкапсулирования. Среди липофильных полиаминов производные тетраамина - спермина - наиболее эффективно связывают и упаковывают ДНК [8, 9] и поэтому лучше переносят ее в клетки. На основе спермина были созданы коммерческие препараты для трансфекции [10-13].
В водном окружении катионные амфифилы могут формировать различные структурные фазы, включая мицеллярную, ламелярную, кубическую и инвертированную гексагональную. Добавление ДНК к катионным амфифилам приводит к образованию комплексов, которые также имеют как ламелярную, так и гексагональную фазу. Ламелярная фаза - конденсированная глобулярная структура, состоящая из монослоев ДНК, которые упакованы между бислоями катионных амфифилов. Инвертированная гексагональная фаза состоит из ДНК, покрытых монослоями, образованными катионными амфифилами, сгруппированными в димерную гексагональную сетку. В экспериментах по доставке катионные амфифилы часто смешивают с так называемыми липидами-помощниками, подобными 1,2-ди-О-олеоилфосфатидилэтаноламину (DOPE) или холестерину, так как такие липиды способны переходить из ламелярной фазы в инвертированную гексагональную, которая способствует улучшению доставки нуклеиновой кислоты [14].
Одной из главных проблем эффективного транспорта нуклеиновых кислот является потеря трансфицирующей активности системами доставки в присутствии сыворотки крови. Эта потеря связана с нестабильностью, агрегацией и деградацией систем доставки под действием макромолекул, находящихся в крови, что является основным препятствием для успешного их применения в условиях in vivo. Поэтому необходимым условием при анализе эффективности систем доставки нуклеиновых кислот в условиях in vitro является биологический скрининг в присутствии сыворотки крови в ростовой среде.
Наиболее близкой к заявляемой композиции - прототипом - является композиция для доставки нуклеиновых кислот в клетки млекопитающих Lipofectamine®2000 (Липофектамин), выпускаемая фирмой Invitrogene (США) [15]. Композиция Lipofectamine®2000 состоит из смеси катионного липида N-[2,3-ди(олеилокси)проп-1-ил]-N-[2-(6-спермилкарбониламино)этил]-N,N-диметиламмоний трифторацетата и нейтрального фосфолипида 1,2-ди-О-олеоилфосфатидилэтаноламина (DOPE) в соотношении 1:3 по массе.
Недостатком известной композиции является цитотоксичность и недостаточно высокая трансфицирующая активность.
Технической задачей изобретения является снижение цитотоксичности и повышение трансфицирующей активности композиции для доставки нуклеиновых кислот в клетки млекопитающих как в присутствии, так и в отсутствие сыворотки в ростовой среде.
Поставленная техническая задача достигается предлагаемой композицией, содержащей поликатионный амфифил в качестве компонента, связывающего и упаковывающего нуклеиновую кислоту, нейтральный фосфолипид в качестве структурообразующего и промотирующего компонента при следующем содержании компонентов, мол.%:
поликатионный амфифил - 30-75
нейтральный фосфолипид - 70-25
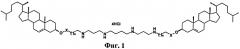
В качестве поликатионного амфифила используют одно из соединений (1-3), выраженное общей формулой, представленной на фиг.1, где n=3 для амфифилов 1 и 2, n=5 для амфифила 3; Х= >С=O (карбонильная группа) для 1, Х=-NH-СО- (карбаматная группа) для амфифилов 2 и 3.
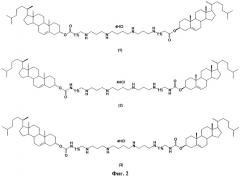
Поликатионные амфифилы 1-3, структурные формулы которых представлены на фиг.2, представляют собой 1,22-бис(холест-5-ен-3β-илоксикарбонил)-5,9,14,18-тетраазакозан тетрагидрохлорид (1) или 1,22-бис(холест-5-ен-3β-илоксикарбониламино)-5,9,14,18-тетраазадокозан тетрагидрохлорид (2) или 1,26-бис(холест-5-ен-3β-илоксикарбониламино)-7,11,16,20-тетраазагексакозан тетрагидрохлорид (3). Поликатионные амфифилы 1-3 описаны в литературе [16], однако сведения об их способности доставлять нуклеиновые кислоты в клетки млекопитающих к настоящему времени в литературных источниках отсутствуют. В структуру поликатионных амфифилов 1-3 входит остаток спермина для связывания и компактизации молекулы нуклеиновой кислоты, остаток холестерина для формирования гидрофобного окружения. Для связывания гидрофобной и сперминовой частей используют биодеградируемый линкер сложноэфирного или уретанового типа.
Структурообразующий нейтральный липид 1,2-ди-О-олеоилфосфатидилэтаноламин (DOPE) обладает структурообразующими и промотирующими свойствами, однако не может самостоятельно переносить нуклеиновые кислоты, так как не имеет в своей структуре катионной группировки, необходимой для связывания и компактизации нуклеиновых кислот.
На основе поликатионных амфифилов 1-3 и нейтрального фосфолипида DOPE были приготовлены варианты композиции с различным содержанием поликатионного амфифила, которое варьировалось от 30 до 75 мол.% по молям от общего количества липидов в композиции (молярные проценты определяют в расчете на общее число молей липида в композиции).
Заявляемую композицию получают следующим образом. Раствор поликатионного амфифила (1-3) и нейтрального фосфолипида DOPE, взятые в определенном соотношении в подходящем органическом растворителе (например, этиловый спирт, хлороформ) упаривают в вакууме до образования липидной пленки. Полученную липидную пленку гидратируют в необходимом количестве воды, а затем озвучивают на ультразвуковой бане до получения однородной смеси. Озвучивание можно заменить экструзией через поликарбонатную мембрану с размером пор от 50 до 200 нм.
Полученная таким способом композиция способна образовывать комплексы с нуклеиновыми кислотами, обладающие высокой трансфицирующей активностью.
Для изучения способности предлагаемой композиции доставлять нуклеиновые кислоты в клетки млекопитающих использовали 25-звенный олигодезоксирибонуклеотид 5′-dTACAGTGGAATTGTATGCCTATTA-3′, модифицированный флуоресцеинизотиоционатом (FITC) по 5′-концу, плазмидную ДНК (pEGFP-C2, «Clontech» (Германия)) и 21-звенную двухцепочечную РНК (siPHK), последовательность смысловой цепи 5′-GCGCCGAGGUGAAGUUCGATT-3′, антисмысловой цепи - 5′-UCGAACUUCACCUCGGCGCGG-3′.
Для формирования комплексов нуклеиновых кислот с предлагаемой композицией смесь растворов нуклеиновой кислоты и композиции, рассчитанных в соответствии с соотношением отрицательных зарядов фосфатных групп к положительным зарядам аминогрупп (соотношение P/N), выдерживали при комнатной температуре в течение 20 мин.
Эффективность проникновения нуклеиновых кислот в клетки млекопитающих исследовали в экспериментах по трансфекции клеток с использованием предлагаемых композиций FITC-меченным олигонуклеотидом, плазмидной ДНК, кодирующей зеленый флуоресцирующий белок (EGFP), и короткой интерферирующей РНК, направленной против матричной РНК гена, кодирующего EGFP.
Сопоставительный анализ заявляемой композиции с известным и широко используемым прототипом - Lipofectamine®2000 показал, что предлагаемая композиция обладает следующими преимуществами.
1) Заявляемая композиция с высокой эффективностью доставляет в клетки млекопитающих короткие и протяженные нуклеиновые кислоты как в присутствии, так и в отсутствие сыворотки в ростовой среде, что позволяет рассматривать ее как перспективный агент для трансфекции клеток.
2) Заявляемая композиция доставляет нуклеиновые кислоты более эффективно, чем индивидуальные поликатионные амфифилы.
3) Заявляемая композиция не требует сложной процедуры приготовления: для получения рабочего раствора достаточно подвергнуть ультразвуковой обработке или экструзии гидратированную липидную пленку, состоящую из поликатионного амфифила и DOPE, взятых в соответствующей пропорции.
4) Заявляемая композиция обладает низкой токсичностью для клеток.
5) Заявляемая композиция стабильна при хранении как в сухом виде, так и в виде готовой для использования водной эмульсии.
Поиск по источникам научно-технической и патентной литературы показал, что заявляемая композиция, состоящая из поликатионного амфифила (1-3) и нейтрального фосфолипида, способная доставлять нуклеиновые кислоты в клетки млекопитающих, в известных источниках не описана.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение композиции
Раствор поликатионного амфифила (1-3) и нейтрального фосфолипида DOPE в определенном соотношении в подходящем органическом растворителе упаривали в вакууме до образования липидной пленки. Полученную липидную пленку гидратировали в необходимом количестве автоклавированной деионизированной воды в течение 3-6 часов, а затем озвучивали на ультразвуковой бане до получения однородной смеси. Озвучивание можно заменить экструзией через поликарбонатную мембрану с размером пор от 50 до 200 нм.
В результате получили несколько вариантов композиции со следующим соотношением компонентов, мол. %:
Пример 2. Доставка в клетки FITC-меченного олигонуклеотида с использованием заявляемой композиции.
Исследование проникновения FITC-меченного олигонуклеотида в клетки НЕК 293 проводили с помощью проточной цитофлоуметрии. Эффективность доставки оценивали по количеству трансфицированных клеток от общего количества клеток в образце. Клетки высаживали в 24-луночные планшеты (2×105 клеток на лунку) и культивировали в течение суток при 37°С в атмосфере, содержащей 5% СО2. Перед проведением трансфекции для экспериментов в присутствии или в отсутствие сыворотки среду в лунках заменяли на 200 мкл среды DMEM, содержащей 10% FBS, или DMEM, не содержащей сыворотку, соответственно. Одну из композиций №1-№11 в среде OptiMEM смешивали с раствором FITC-меченного олигонуклеотида (конечная концентрация олигонуклеотида в лунке 1 мкМ) в этой же среде в соответствии с выбранным соотношением P/N (отношение количества отрицательных зарядов фосфатных групп к количеству положительных зарядов атомов азота) и инкубировали 20 минут при комнатной температуре. Затем образовавшиеся комплексы добавляли к клеткам и инкубировали в течение 4 ч. По окончании инкубации клетки промывали PBS (300 мкл), добавляли 40 мкл раствора трипсина и инкубировали 1-2 мин (37°С, 5% СO2). По окончании инкубации в лунки добавляли 200 мкл DMEM с 10% сыворотки, клетки суспендировали и переносили в пробирки. Полученную клеточную суспензию центрифугировали при 1000-1200 об/мин, 4°С, отбирали среду и клетки промывали 0,5 мл PBS. Затем клетки фиксировали путем суспендирования в 600 мкл 2% раствора формальдегида в PBS. Анализ уровня трансфекции клеток проводили на флуоцитометре FC500 (Beckman-Coulter), определяя число FITC-положительных клеток в популяции и средний уровень флуоресценции клеток, определяемый при длине волны возбуждения 488 нм. В качестве агентов сравнения использовали коммерческую композицию Lipofectamine®2000 и индивидуальные Амфифилы 1-3.
Результаты доставки в клетки НЕК 293 FITC-меченного олигонуклеотида с композициями №1-№9 в присутствии сыворотки в ростовой среде представлены в таблице 1.
| Таблица 1 | ||
| Агент трансфекции | Количество трансфицированных клеток, % | Количество доставленного олигонуклеотида (средняя флуоресценция клеток в популяции), RFU |
| Lipofectamine2000 | 61,3 | 8,1 |
| Амфифил 3 | 90,0 | 68,3 |
| Композиция №1 | 91,1 | 100,7 |
| Композиция №2 | 89,5 | 70,8 |
| Композиция №3 | 99,5 | 77,4 |
| Композиция №4 | 93,1 | 80,5 |
| Композиция №5 | 92,8 | 83,6 |
| Композиция №6 | 92,3 | 73,4 |
| Композиция №7 | 89,5 | 74,1 |
| Композиция №8 | 97,5 | 81,1 |
| Композиция №9 | 92,8 | 83,9 |
Из таблицы 1 видно, что заявляемая композиция наиболее эффективно доставляет FITC-меченный олигонуклеотид в клетки и обеспечивает эффективное накопление олигонуклеотида практически во всех клетках популяции (максимальное число трансфицированных клеток 99,5%). Следует отметить, что предложенная композиция обладает в 6-10 раз большей эффективностью (количество доставленного в клетки олигонуклеотида), чем коммерческий агент трансфекции Lipofectamine®2000 и проявляет синергизм, поскольку превосходит по эффективности индивидуальный Амфифил 3.
Пример 3. Трансфекция клеток НЕК 293 плазмидной ДНК с использованием предлагаемой композиции.
Исследование доставки плазмидной ДНК в клетки НЕК 293 проводили с помощью проточной цитофлоуметрии. Эффективность трансфекции оценивали по количеству клеток, в которых происходит экспрессия зеленого флуоресцентного белка (EGFP) от общего количества клеток в популяции. Клетки высаживали в 24-луночные планшеты (1,2×105 клеток на лунку для клеток НЕК 293) и культивировали в течение суток при 37°С в атмосфере, содержащей 5% СО2. Перед проведением трансфекции для экспериментов в присутствии или в отсутствие сыворотки среду в лунках заменяли на 200 мкл среды DMEM, содержащей 10% FBS, или DMEM, не содержащей сыворотку, соответственно. Одну из композиций №1-№11 в среде OptiMEM смешивали с раствором ДНК плазмиды pEGFP-C2 (0,5 мкг в лунке) в этой же среде в определенном соотношении P/N, полученную смесь добавляли к клеткам и инкубировали в течение 24 ч. Через 4 часа среду в лунках со средой без сыворотки заменяли среду на DMEM с 10% сывороткой. По окончании инкубации клетки обрабатывали и анализировали, как описано в примере 2. Результаты трансфекции клеток плазмидной ДНК pEGFP-C2 композициями №1-№3 в присутствии и в отсутствие сыворотки в ростовой среде представлены в таблице 2.
| Таблица 2 | |||
| Агент трансфекции | Наличие 10% сыворотки в ростовой среде | Количество трансфицированных клеток, % | Количество экспрессированного белка (средняя флуоресценция) |
| Lipofectamine 2000 | - | 28,4 | 38,5 |
| + | 32,0 | 54,6 | |
| Амфифил 3 | - | 53,5 | 68,3 |
| + | 40,2 | 25 | |
| Композиция №1 | + | 46,8 | 39,1 |
| Композиция №2 | + | 41,6 | 33 |
| Композиция №3 | - | 65,6 | 42,5 |
| + | 82,0 | 62,9 |
Представленные данные показывают, что заявляемая композиция эффективно доставляет плазмидную ДНК в эукариотические клетки и обеспечивает высокий уровень экспрессии трансгенного белка. Следует отметить, что предлагаемая композиция обеспечивает более чем двукратное увеличение числа трансфицированных клеток, а также 1,5-кратное увеличение уровня экспрессии трангена по сравнению с прототипом (Lipofectamine2000) и проявляет синергизм, поскольку значительно превосходит по эффективности индивидуальный Амфифил 3.
Пример 4. Трансфекция клеток ВНК IR-780 малой интерферирующей РНК с использованием предлагаемой композиции.
Исследование проникновения siPHK, направленной на подавление синтеза зеленого флуоресцирующего белка EGFP, проводили на клетках линии ВНК IR-780, стабильно экспрессирующих этот белок. Так как в качестве мишени для siPHK была выбрана мРНК, кодирующая белок EGFP, эффективность доставки siPHK в цитоплазму можно определить по уменьшению флуоресценции клеток, определяемой этим белком.
Клетки высаживали в 24-луночные планшеты (0,15×105 клеток на лунку для клеток ВНК IR-780) и культивировали в течение суток при 37°С в атмосфере, содержащей 5% СO2. Перед проведением трансфекции для экспериментов в присутствии или в отсутствие сыворотки среду в лунках заменяли на 200 мкл среды DMEM, содержащей 10% FBS, или DMEM, не содержащей сыворотку, соответственно. Композицию при соответствующем соотношении P/N в среде OptiMEM смешивали с раствором siPHK (с конечной концентрацией siPHK в лунке 50 нМ) в этой же среде и выдерживали 20 мин при комнатной температуре, образовавшиеся комплексы добавляли к клеткам и инкубировали в течение 72 ч. Через 4 часа в лунки со средой без сыворотки добавляли равный объем среды DMEM, содержащей 20% сыворотки. По окончании инкубации клетки обрабатывали, как описано в примере 2.
Результаты по трансфекции клеток короткой интерферирующей РНК с композициями №1-№3 и №8-№11 в присутствии и в отсутствие сыворотки в ростовой среде, определенные по уровню снижения экспрессии белка EGFP, представлены в таблице 3.
| Таблица 3 | ||
| Агент трансфекции | Наличие 10% сыворотки в ростовой среде | Ингибирование биосинтеза белка GFP, % |
| Lipofectamine | - | 19,1 |
| + | 23,4 | |
| Амфифил3 | - | 23,3 |
| + | 27,4 | |
| Композиция №1 | - | 19,8 |
| + | 34,3 | |
| Композиция №2 | - | 14,0 |
| + | 26,5 | |
| Композиция №3 | - | 8,0 |
| + | 14,7 | |
| Композиция №8 | + | 26,9 |
| Композиция №9 | + | 29,8 |
| Композиция №10 | + | 13,3 |
| Композиция №11 | + | 27,5 |
Из данных, приведенных в таблице 3, видно, что предлагаемая композиция обеспечивает эффективную доставку в клетки малых интерферирующих РНК, что выражается в снижении уровня экспрессии гена-мишени. Эффективность доставки малых интерферирующих РНК увеличивается в присутствии сыворотки в ростовой среде, что является несомненным достоинством предлагаемой композиции. Следует отметить, что уровни трансфекции малых интерферирующих РНК несколько превосходят или близки уровням трансфекции в присутствии Lipofectamine 2000 и поликатионного амфифила 3, однако использование композиции обеспечивает меньший токсический эффект на клетки и лучшую их выживаемость.
Таким образом, предлагаемая композиция, состоящая из поликатионного амфифила и нейтрального фосфолипида, взятых в экспериментально подобранном, оптимальном соотношении, позволяет обеспечить эффективное накопление в клетках млекопитающих коротких и протяженных нуклеиновых кислот в присутствии сыворотки, что позволяет использовать ее в качестве агента для доставки нуклеиновых кислот в клетки млекопитающих в условиях как in vitro, так и in vivo.
Композиция для доставки нуклеиновых кислот в клетки млекопитающих, содержащая агент для трансфекции нуклеиновых кислот и нейтральный фосфолипид 1,2-ди-О-олеоилфосфатидилэтаноламин, отличающаяся тем, что в качестве агента для трансфекции она содержит одно из соединений поликатионного амфифила общей формулы где X=CO, n=3 для (1); X=NHCO, n=3 для (2); X=NHCO, n=5 для (3), при следующем соотношении компонентов, мол.%:
| поликатионный амфифил | 30,0-75,0 |
| нейтральный фосфолипид | 70,0-25,0 |