Соединения бора, пригодные при борнейтронозахватной терапии
Иллюстрации
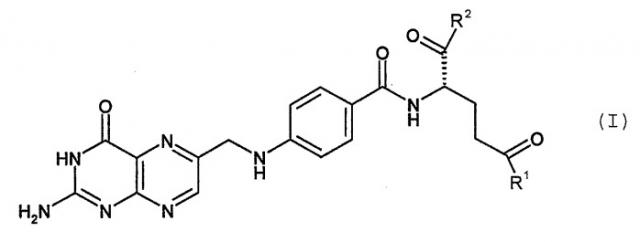
Показать всеИзобретение относится к соединению формулы (I)
где один из R1 и R2 представляет собой -NH-X-Y-Z, а другой представляет собой -ОН; где Х представляет собой -(СН2)m-, где m равно 0, 1, 2, 3 или 4; Y представляет собой карборан, где, по меньшей мере, один атом бора представляет собой 10В; и Z представляет собой Н; и его фармацевтически приемлемым солям, сольватам и стереоизомерам. Также предложены фармацевтические композиции, применение соединения формулы (I) и способ получения соединения формулы (I). Технический результат - получение соединений, пригодных для использования в борнейтронозахватной терапии. 6 н. и 9 з.п. ф-лы, 3 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым борсодержащим соединениям, к фармацевтическим композициям, содержащим указанные соединения, к терапевтическому применению указанных соединений и к способу получения указанных соединений.
Уровень техники
Борнейтронозахватная терапия (BNCT) представляет собой форму радиационной терапии, требующую двух компонентов: 10B и низкоэнергетических тепловых нейтронов. 10B вводят субъекту, который должен лечиться, в форме борсодержащего соединения, которое аккумулируется в опухоли. Субъект, который должен лечиться, затем облучается низкоэнергетическими тепловыми нейтронами из ядерного реактора или циклотрона.
Когда низкоэнергетические тепловые нейтроны соударяются с 10B, они генерируют α-частицу и 7Li. Тепловые нейтроны имеют относительно низкую энергию. Однако при генерировании 7Li и α-частицы генерируется достаточная энергия для разрушения клетки. Поскольку α-частица и 7Li являются относительно большими, они переносятся в ткани только примерно на 5-10 мкм, то есть на расстояние, соответствующее диаметру клетки опухоли. Таким образом, BNCT можно использовать для селективного облучения опухолей, в то же время сводя к минимуму радиационное повреждение доброкачественной ткани.
Главный проблемой при BNCT является нахождение нетоксичной молекулы носителя для атома бора, которая будет концентрироваться в клетках опухоли, для обеспечения достаточной селективности. Такие соединения предпочтительно должны доставлять средние концентрации 10B 15-30 мкг/г (м.д., то есть миллионных долей) в опухоли с высокой селективностью (в идеале отношения опухоль - кровь и опухоль - нормальные ткани >5) и с низкой токсичностью для получения высокого терапевтического отношения. Один из подходов представляет собой использование борсодержащих нуклеозидов, нуклеотидов или олигонуклеотидов (Европейский патент EP 1113020 A2). Другой подход представляет собой использование нуклеозидов и олигонуклеотидов, содержащих борированный фосфорамидат (заявка на Международный патент WO 94/01440 Al). Кроме того, приготавливают карборанилпиримидины для использования при BNCT. Сообщается также о пурин- и пиримидин-нуклеозидах, содержащих карборанильную группу, соединенную с пуриновым или пиримидиновым основанием. Также осуществляют синтез нидокарборан-кобаламиновых конъюгатов, которые могут быть пригодными для использования при нейтронозахватной терапии, (H.P.C. Hogenkamp et al., Nuclear Medicine and Biology (2000), 27, 89-92).
Два агента для захвата нейтронов на боре, находящиеся в настоящее время в фазе I/II клинических испытаний, представляют собой динатрий меркапто-клозододекарборат (BSH) и 1-4-дигидроксиборилфенилаланин (BPA). Хотя BSH и BPA, как показано, являются безопасными и эффективными на животных моделях, оба эти агента имеют только умеренную селективность относительно опухолевых клеток и низкое время удерживания в опухоли. Кроме того, BSH имеет ограниченную химическую стабильность из-за его тенденции к окислению на воздухе, и BPA, хотя и является химически нетоксичным, содержит только низкий массовый процент бора (5%), так что необходимы большие количества этих лекарственных средств для достижения терапевтической концентрации бора в опухолевой ткани.
Leamon, C.P. and Reddy, J.A., Advanced Drug Delivery Reviews, 56 (2004) 1127-1141, описывают рецептор фолата и конъюгаты фолат-лекарственное средство для терапевтических целей.
Заявка на Международный патент WO 00/45857 описывает использование физиологически совместимого соединения, состоящего из остатка комплекса Gd3+ и специфичного к опухоли остатка биологического или синтетического происхождения, для получения препаратов для захвата нейтронов и светодинамической терапии.
Сущность изобретения
Целью настоящего изобретения является создание соединений, пригодных для использования при борнейтронозахватной терапии (BNCT).
Другой целью является создание таких соединений, имеющих высокий уровень бора по массе и/или являющихся селективными относительно клеток опухоли. Другой целью является создание таких соединений, являющихся стабильными и/или нетоксичными.
Еще одной целью настоящего изобретения является создание фармацевтических композиций, содержащих указанные соединения, и обеспечение использования указанных соединений в терапии.
Дополнительной целью является создание способа получения указанных соединений из известных исходных материалов.
Указанные выше цели, а также другие цели настоящего изобретения, которые должны быть понятны специалисту в данной области после изучения описания ниже, достигают посредством соединения формулы (I)
где
один из R1 и R2 представляет собой -NH-X-Y-Z, -O-X-Y-Z или -S-X-Y-Z, а другой представляет собой -OH, -NH-X-Y-Z, -O-X-Y-Z или -S-X-Y-Z;
где
X представляет собой -(CH2)m-, где m равно 0, 1, 2, 3 или 4, или - (CH2)p-O-(CH2)q-, где p и q независимо равны 1, 2, 3 или 4;
Y представляет собой боран или карборан, где, по меньшей мере, один атом бора представляет собой 10B и
Z представляет собой H или гидрофилизирующую группу, такую как аминометил, 2-аминоэтил, 3-аминопропил, 1,3-пропандиол-2-ил-метоксил, этиленгликоксил или диэтиленгликоксил;
и его фармацевтически приемлемых солей, сольватов и стереоизомеров.
Предпочтительно содержание 10B в боране или карборане Y выше, чем природное изотопное содержание 10B. Например, более чем 10% или более чем 20%, предпочтительно более чем 25%, более предпочтительно более чем 50% или более чем 75%, атомов бора, присутствующих в боране или карборане Y, могут представлять собой 10B.
Соединения формулы (I) могут находиться в форме фармацевтически приемлемой соли. Такие соли представляют собой, например, соли, образованные с минеральными кислотами, такими как хлористоводородная кислота; соли аммония, образованные с аминами, такими как триэтиламин, или основное лекарственное средство; соли щелочных металлов, такие как соли натрия или калия; или соли щелочноземельных металлов, такие как соли кальция или магния.
Соединения формулы (I) могут находиться в форме фармацевтически приемлемых сольватов, например гидратов, а также в несольватированных формах.
Когда в молекуле присутствует один или несколько стереоцентров, соединения формулы (I) могут находиться в форме фармацевтически приемлемой стереоизомерной смеси, например смеси диастереомеров и/или смеси энантиомеров. Диастереомеры представляют собой стереоизомеры, у которых молекулы не являются зеркальными отражениями друг друга. Энантиомеры представляют собой стереоизомеры, у которых молекулы представляют собой зеркальные отражения друг друга. Кроме того, соединения формулы (I) могут находиться в форме фармацевтически приемлемого одного стереоизомера, например одного энантиомера и/или диастереомера. Соединения формулы (I) могут также находиться в форме фармацевтически приемлемой рацемической смеси, например эквимолярной смеси энантиомеров.
Боран определяется здесь как полиэдрический боран, см. Gmelin Handbook of Inorganic and Organometallic Chemistry (8th ed. 1991). Карборан определяется здесь как соединение, где, по меньшей мере, один атом углерода включается в полиэдрический боран. Карбораны можно синтезировать в соответствии с описанием в Carboranes (R. Grimes ed. 1970), Gmelin Handbook of Inorganic and Organometallic Chemistry (8th ed. 1991) и Science 1972, 78, 462.
Соединения формулы (I) пригодны для использования в BNCT. Соединения формулы (I) содержат остаток фолиевой кислоты, то есть значительную часть молекулы фолиевой кислоты. Указанные соединения дополнительно содержат борсодержащий остаток и, необязательно, линкер. Линкер определяется как остаток, расположенный между остатком фолиевой кислоты и борсодержащим остатком. Борсодержащий остаток определяется как группа, содержащая бор, и может представлять собой боран или карборан. Быстро растущие клетки, такие как опухолевые клетки, демонстрируют повышенное потребление фолиевой кислоты и структурно родственных соединений.
BNCT можно использовать для терапии широкого диапазона опухолей. Опухоли можно классифицировать гистологически в соответствии с принципами, определенными в World Health Organization (World Health Organization, International Histological Classification of Tumours, 1967-1978). Типы опухолей, которые можно лечить с использованием BNCT с помощью соединений формулы (I), выше, включают в себя опухоли, возникающие в центральной нервной системе, предпочтительно глиому, такую как глиобластому, глиосаркому, анапластическую астроцитому, низкодифференцированную астроцитому, пилолитическую астроцитому, олигодендроглиому или глиому ствола головного мозга; менингиому; периферическую нейроэпителиому; примитивную нейроэктодермальную опухоль; нейробластому; герминому; питуитарную опухоль; метастатическую опухоль головного мозга или артериовенозную аномалию. Соединения формулы (I) можно также использовать при BNCT для терапии, среди прочего, злокачественных опухолей или метастатических опухолевых процессов, предпочтительно меланомы, рака простаты, рака печени, рака легких, рака груди или саркомы.
Используемый термин "борнейтронозахватная терапия" (BNCT) означает способ терапии опухоли, включающий в себя стадии введения борсодержащего соединения субъекту, который должен подвергаться терапии, и облучения указанного субъекта тепловыми нейтронами.
Используемый термин "опухоль" определяется в соответствии с Dorland's Illustrated Medical Dictionary, 26th edition, 1985, Saunders, то есть как рост ткани, в которой размножение клеток является неконтролируемым и прогрессирующим. Неконтролируемое размножение определяется как состояние, отличающееся от нормального размножения клеток, например состояние, при котором скорость размножения клеток значительно увеличивается. Используемый термин "прогрессирующий" в этом контексте определяется как развитие или усиление тяжести. Опухолевая клетка определяется как клетка в указанной ткани.
Используемый термин "терапия" определяется в соответствии с Dorland's Illustrated Medical Dictionary, 26th edition, 1985, Saunders, то есть как лечение заболевания. Используемые термины "терапевтический" и "терапевтически" должны рассматриваться соответствующим образом. Используемые слова "терапия опухоли" определяются, таким образом, как лечение заболевания, вызываемого опухолью или связанного с ней.
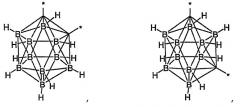
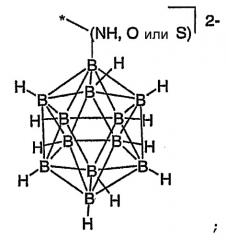
Боран или карборан, представляющий собой Y из формулы (I), может представлять собой
или
где
* означает положение связи с X или Z;
M представляет собой кобальт, кобальт-57 или железо; и
X является таким, как определено выше.
Примеры соединений формулы (I) представляют собой N2-(4-{[(2-амино-4-оксо-3,4-дигидроптеридин-6-ил)метил]амино}бензоил)-N-{3-[(1R,9S)-2,3,4,5,6,7,8,10,11,12-декаборабицикло[7.2.1]додек-1-ил]пропил}-α-глютамин и N2-(4-{[(2-амино-4-оксо-3,4-дигидроптеридин-6-ил)метил]амино}бензоил)-N- [3-(2,3,4,5,6,7,8,10,11,12-декаборабицикло[7.2.1]додек-1-ил)пропил]-L-глютамин.
В одном из вариантов осуществления в соединении формулы (I) R1 представляет собой -NH-X-Y-Z, -O-X-Y-Z или -S-X-Y-Z, и R2 представляет собой OH. Такое соединение близко напоминает структуру фолиевой кислоты и может, таким образом, сохранять все биологические активности, проявляемые фолиевой кислотой, или их часть.
В одном из вариантов осуществления в соединении формулы (I), по меньшей мере, один атом углерода представляет собой 11C. Такой вариант осуществления делает возможным детектирование соединения посредством методики томографии позитронного излучения (PET).
Альтернативно остаток Y соединения формулы (I) может представлять собой гадолинийсодержащий остаток.
Цели настоящего изобретения дополнительно достигаются с помощью способа получения соединения формулы (I), где соединение формулы NH2-X-Y-Z, OH-X-Y-Z или SH-X-Y-Z, где X, Y и Z являются такими, как определено по отношению к формуле (I), взаимодействует с фолиевой кислотой.
Фармацевтические препараты
Цели настоящего изобретения также достигаются с помощью фармацевтической композиции, содержащей соединение формулы (I) и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
Для клинического использования борсодержащие соединения формулы (I) по настоящему изобретению соответствующим образом приготовлены в виде фармацевтических композиций для парентерального введения. Также специалистом в области препаратов может рассматриваться ректальный, пероральный или любой другой способ введения. Таким образом, борсодержащее соединение формулы (I) приготавливается вместе, по меньшей мере, с одним фармацевтически и фармакологически приемлемым носителем или вспомогательным веществом. Носитель может находиться в форме твердого, полутвердого или жидкого разбавителя.
Растворы для парентерального введения можно приготовить в виде раствора соединения по настоящему изобретению в фармацевтически приемлемом растворителе. Эти растворы могут также содержать стабилизирующие ингредиенты и/или ингредиенты буферов и распределяются в виде стандартных единичных доз в форме ампул или флаконов. Растворы для парентерального введения можно также приготовить в виде сухих препаратов, которые должны разбавляться с помощью соответствующего растворителя непосредственно перед использованием.
При приготовлении фармацевтических композиций для перорального введения в соответствии с настоящим изобретением борсодержащее соединение (соединения) формулы (I), которое необходимо приготовить, смешивают с твердыми порошкообразными ингредиентами, такими как лактоза, сахароза, сорбит, маннит, крахмал, амилопектин, производные целлюлозы, желатин или другой соответствующий ингредиент, а также с разрыхляющими агентами и смазывающими агентами, такими как стеарат магния, стеарат кальция, стеарилфумарат натрия и полиэтиленгликолевые воски. Затем смесь перерабатывают в виде гранул или прессуют в таблетки.
Мягкие желатиновые капсулы можно приготавливать с капсулами, содержащими смесь активного соединения или соединений по настоящему изобретению, растительного масла, жира или другого соответствующего носителя для мягких желатиновых капсул. Твердые желатиновые капсулы могут содержать активное соединение в сочетании с твердыми порошкообразными ингредиентами, такими как лактоза, сахароза, сорбит, маннит, картофельный крахмал, кукурузный крахмал, амилопектин, производные целлюлозы или желатин.
Единичные стандартные дозы для ректального введения можно приготовить (i) в форме суппозиториев, которые содержат активное вещество (вещества), смешанное с нейтральной жирной основой; (ii) в форме желатиновой капсулы для ректального введения, которая содержит активное вещество в смеси с растительным маслом, парафиновым маслом или другим соответствующим носителем для желатиновых капсул для ректального введения; (iii) в форме готовой для использования микроклизмы или (iv) в форме сухого препарата для микроклизмы, который должен разбавляться соответствующим растворителем непосредственно перед введением.
Жидкие препараты для перорального введения можно приготовить в форме сиропов или суспензий, например растворов или суспензий, содержащих активное соединение и оставшуюся часть препарата, состоящую из сахара или сахарных спиртов, и смеси этанола, воды, глицерина, пропиленгликоля и полиэтиленгликоля. Если это желательно, такие жидкие препараты могут содержать подкрашивающие агенты, ароматизирующие агенты, сахарин и карбоксиметилцеллюлозу или другой агент для повышения вязкости. Жидкие препараты для перорального введения могут также приготавливаться в форме сухого порошка, который должен разбавляться соответствующим растворителем перед использованием.
В одном из аспектов настоящего изобретения борсодержащее соединение формулы (I) можно вводить в пределах 24 часов перед нейтронным облучением субъекта, который должен лечиться, как правило, за 30-60 минут до нейтронного облучения. В дополнительном аспекте настоящего изобретения дозировка борсодержащего соединения может быть импульсной. Типичная доза борсодержащего соединения формулы (I) находится в пределах от 0,01 до 100 мг на кг массы тела.
Терапия
Цели настоящего изобретения достигаются также с помощью соединения формулы (I) для использования при терапии или посредством применения соединения формулы (I) для получения лекарственного средства для использования при терапии опухолей.
В одном из вариантов осуществления лекарственное средство может предназначаться для терапии опухолей, возникающих в центральной нервной системе, предпочтительно глиомы, такой как глиобластомы, глиосаркомы, анапластической астроцитомы, низкодифференцированной астроцитомы, пилолитической астроцитомы, олигодендроглиомы или глиомы ствола головного мозга; менингиомы; периферической нейроэпителиомы; примитивной нейроэктодермальной опухоли; нейробластомы; герминомы; питуитарной опухоли; метастатической опухоли головного мозга или артериовенозной аномалии.
Альтернативно лекарственное средство можно использовать для лечения злокачественных опухолей или метастатических опухолевых процессов, предпочтительно меланомы, рака простаты, рака печени, рака легких, рака груди или саркомы.
Один из полезных вариантов осуществления настоящего изобретения осуществляется также с помощью соединения формулы (I), где, по меньшей мере, один атом углерода представляет собой 11C, для использования при диагностике, или посредством использования соединения формулы (I), где, по меньшей мере, один атом углерода представляет собой 11C, с целью получения лекарственного средства для использования в томографии позитронного излучения (PET).
Цели дополнительно достигают посредством способа лечения опухоли, где фармацевтически и фармакологически эффективное количество соединения формулы (I) вводят субъекту, нуждающемуся в таком лечении, в сочетании с борнейтронозахватной терапией.
Указанная терапия опухоли может представлять собой терапию опухолей, возникающих в центральной нервной системе, предпочтительно глиомы, такой как глиобластома, глиосаркома, анапластическая астроцитома, низкодифференцированная астроцитома, пилолитическая астроцитома, олигодендроглиома или глиома ствола головного мозга; менингиомы; периферической нейроэпителиомы; примитивной нейроэктодермальной опухоли; нейробластомы; герминомы; питуитарной опухоли; метастатической опухоли головного мозга или артериовенозной аномалии.
Альтернативно указанная терапия опухоли может представлять собой терапию злокачественных опухолей или метастатических опухолевых процессов, предпочтительно меланомы, рака простаты, рака печени, рака легких, рака груди или саркомы.
Один из полезных вариантов осуществления настоящего изобретения дополнительно осуществляют с помощью способа диагностики опухоли, где фармацевтически и фармакологически эффективное количество соединения формулы (I), где, по меньшей мере, один атом углерода представляет собой 11C, вводят субъекту, который должен диагностироваться, в сочетании с томографией позитронного излучения.
Терапия, рассмотренная выше, может применяться как единственный вид терапии или может включать в себя в дополнение к борнейтронозахватной терапии обычную хирургию или химиотерапию. Такая химиотерапия может включать в себя один или несколько из следующих категорий противоопухолевых агентов:
(i) антипролиферативные/антинеопластические лекарственные средства и их сочетания, как используется в медицинской онкологии, такие как алкилирующие агенты (например, цисплатин, карбоплатин, циклофосфамид, азотная горчица, мельфалан, хлорамбуцил, бусульфан и нитрозомочевины); антиметаболиты (например, антифолиаты, такие как фторпиримидины, подобные 5-фторурацилу, и тегафур, ральтитрексед, метотрексат, цитозин арабинозид и гидроксимочевина); противоопухолевые антибиотики (например, антрациклины, подобные адриамицину, блеомицину, доксорубицину, дауномицину, эпирубицину, идарубицину, митомицину-C, дактиномицину и митрамицину); антимитотические агенты (например, алкалоиды барвинка, подобные винкристину, винбластину, виндезину и винорельбину, и таксоиды, подобные таксолу и таксотере) и инигибиторы топоизомеразы (например, эпиподофиллотоксины, подобные этопозиду и тенипозиду, амсакрину, топотекану и камптотецину);
(ii) цитостатические агенты, такие как антиэстрогены (например, тамоксифен, торемифен, ралоксифен, дролоксифен и йодоксифен), отрицательные регуляторы рецепторов эстрогенов (например, фульвестрант), антиандрогены (например, бикалутамид, флутамид, нилутамид и ципротерон ацетат), антагонисты LHRH (лютеинизирующего релизинг-гормона) или агонисты LHRH (например, гозерелин, лейпрорелин и бузерелин), прогестероны (например, мегестрол ацетат), инигибиторы ароматаз (например, анастрозол, летрозол, воразол и экземестан) и инигибиторы 5α-редуктазы, такие как финастерид;
(iii) агенты, которые ингибируют инвазию раковых клеток (например, инигибиторы металлопротеиназ, подобные маримастату, и инигибиторы функций рецепторов плазминогенных активаторов урокиназы);
(iv) инигибиторы функций фактора роста, например, такие инигибиторы включают в себя антитела к факторам роста, антитела к рецепторам факторов роста (например, антитело анти-erbb2 трастузумаб [Herceptin™] и антитело анти-erbb1 цетуксимаб), инигибиторы фарнезилтрансферазы, инигибиторы тирозинкиназы и инигибиторы серин/треонинкиназы, например инигибиторы семейства эпидермальных факторов роста (например, инигибиторы тирозинкиназы семейства EGFR, такие как N-(3-хлор-4-фторфенил)-7-метокси-6-(3-морфолинопропокси)хиназолин-4-амин (гефитиниб), N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амин (эрлотиниб) и 6-акриламидо-N-(3-хлор-4-фторфенил)-7-(3-морфолинопропокси)хиназолин-4-амин), например инигибиторы семейства тромбоцитарных факторов роста, и например инигибиторы семейства факторов роста гепатоцитов;
(v) антиангиогенные агенты, такие как те, которые ингибируют эффекты фактора роста эндотелия сосудов, (например, антитело против фактора роста клеток эндотелия сосудов бевацизумаб [Avastin™], соединения, такие как те, которые описаны в заявках на Международный патент WO 97/22596, WO 97/30035, WO 97/32856 и WO 98/13354), и соединения, которые работают посредством других механизмов (например, линомид, инигибиторы функций интегрина αvβ3 и ангиостатин);
(vi) агенты, повреждающие сосуды, такие как Combretastatin A4 и соединения, описанные в заявках на Международный патент WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 и WO 02/08213;
(vii) антисмысловая терапия, например, такая, которая направлена на мишени, перечисленные выше, такие как ISIS 2503, антисмысловые анти-ras;
(viii) подходы генной терапии, включая, например, подходы к замене абберантных генов, таких как подходы с абберантным p53 или абберантным BRCA1 или BRCA2, с GDEPT (ген-направленная ферментная терапия с помощью пролекарств), такие как те, которые используют цитозиндеаминазу, тимидинкиназу или фермент бактериальную нитроредуктазу, и подходы с увеличением толерантности пациента к химиотерапии или радиационной терапии, такие как мультимедикаментозная генная терапия устойчивости;
(ix) подходы с иммунотерапией, включая, например, подходы ex-vivo и in-vivo для увеличения иммуногенности клеток опухоли пациента, такие как трансфицирование цитокинами, такими как интерлейкин 2, интерлейкин 4 или фактор стимулирования колоний гранулоцитов макрофагов, подходы с понижением анергии T-лимфоцитов, подходы с использованием трансфицированных иммунных клеток, таких как цитокин-трансфицированные дендритные клетки, подходы с использованием цитокин-трансфицированных линий опухолевых клеток и подходы с использованием антиидиотипических антител.
Примеры
Получение соединений в соответствии с настоящим изобретением
Все используемые растворители являются чистыми для анализа, и для реакций используют коммерчески доступные безводные растворители. Реакции, как правило, осуществляют в инертной атмосфере азота или аргона.
Спектры 1H ЯМР регистрируют на ЯМР спектрометре Varian Unity+ 400, снабженном 5 мм ячейкой для образца BBO с Z-градиентами, или на ЯМР спектрометре Varian Gemini 300, снабженном 5 мм ячейкой для образца BBI, или ЯМР спектрометре Bruker Advance 400, снабженном 60 мкл двойной проточной ячейкой для образца с обратным потоком, с Z-градиентами, или на ЯМР спектрометре Bruker DPX400, снабженном 4-ядерной ячейкой для образца, снабженном Z-градиентом. Если нет специальных указаний в примерах, спектры регистрируют на 400 МГц для протона. Используют следующий эталонный сигнал: средняя линия CDCl3 δ 7,26 (1H).
Масс-спектры регистрируют на ЖХМС Waters, состоящего из Alliance 2795 (ЖХ), Waters PDA 2996 и ZQ одиночного квадрупольного масс-спектрометра. Масс-спектрометр снабжен электрораспылительным источником ионов (ESI), работающим в режиме положительных или отрицательных ионов. Напряжение на капилляре равно 3 кВ, и напряжение на конусе равно 30 В. Масс-спектрометр сканирует в пределах m/z 100-700 со временем сканирования 0,3 сек. Разделение осуществляют либо на Waters X-Terra MS C8 (3,5 мкм, 50 или 100×2,1 мм внутренний диаметр) или на ACE 3 AQ (100×2,1 мм внутренний диаметр), полученной от ScantecLab. Скорости потока регулируют как 1,0 или 0,3 мл/мин соответственно. Температуру колонки устанавливают на 40°C. Прикладывают линейный градиент, используя систему с нейтральной или кислой подвижной фазой, начиная от 100% A (A: 10 мМ NH4OAC в 5% MeCN, или 8 мМ HCOOH в 5% MeCN), заканчивая при 100% B (MeCN).
Альтернативно масс-спектр регистрируют на ЖХ-МС Waters, состоящем из разделительного модуля Alliance 2690, детектора поглощения на двух длинах волн Waters 2487 Dual 1 (220 и 254 нм) и одинарного квадрупольного масс-спектрометра Waters ZQ. Масс-спектрометр снабжен электрораспылительным источником ионов (ESI), работающем в режиме положительных или отрицательных ионов. Напряжение на капилляр равно 3 кВ, и напряжение на конусе равно 30 В. Масс-спектрометр сканирует в пределах m/z 97-800 со временем сканирования 0,3 или 0,8 сек. Разделение осуществляют на Chromolith Performance RP-18e (100×4,6 мм). Прикладывают линейный градиент начиная от 95% A (A: 0,1% HCOOH (водн.)) заканчивая при 100% B (MeCN) через 5 минут. Скорость потока: 2,0 мл/мин.
Анализ ВЭЖХ осуществляют на системе Agilent HP1000, состоящей из микровакуумного дегазатора G1379A, двойного насоса G1312A, луночного планшета с автоматическим отбором образцов G1367A, термостатированного отделения для колонки G1316A и детектора с диодной матрицей G1315B. Колонка: X-Terra MS, Waters, 3,0×100 мМ, 3,5 мкм. Температуру колонки устанавливают на 40°C и скорость потока на 1,0 мл/мин. Детектор с диодной матрицей сканируют в пределах 210-300 нм, шаг и ширину пика устанавливают на 2 нм и 0,05 мин соответственно. Прикладывают линейный градиент начиная от 100% A (A: 10 мМ NH4OAc в 5% MeCN) и заканчивая при 100% B (B: MeCN) через 4 мин.
Типичная процедура извлечения после реакции состоит из экстрагирования продукта растворителем, таким как этилацетат, из промывки водой с последующей сушкой органической фазы над MgSO4 или Na2SO4, фильтрования и концентрирования раствора в вакууме.
Тонкослойную хроматографию (ТСХ) осуществляют на пластинах для ТСХ Merck (Silica gel 60 F254) и пятна визуализируют с помощью УФ. Флэш-хроматографию осуществляют на Combi Flash® Companion™ с использованием колонок для флэш-хроматографии с нормальной фазой RediSep™. Типичные растворители, используемые для флэш-хроматографии, представляют собой смеси хлороформа/метанола, дихлорметана/метанола, гептана/этилацетата, хлороформа/метанола/NH3 (водн.) и дихлорметана/метанола/NH3 (водн.).
Препаративную хроматографию осуществляют на системе ВЭЖХ с автоочисткой Waters с детектором с диодной матрицей.
Колонка: XTerra MS C8, 19×300 мм, 10 мкм. Градиент с помощью MeCN/0,1 M NH4OAc в 5% MeCN в воде MilliQ, осуществляют от 20% до 60% MeCN, через 13 мин. Скорость потока: 20 мл/мин. Альтернативно очистку осуществляют на системе полупрепаративной ВЭЖХ Shimadzu LC-8A с детектором УФ-видимого света Shimadzu SPD-10A, снабженной колонкой Waters Symmetry® (C18, 5 мкм, 100×19 мм). Градиент с помощью MeCN/0,1% трифторуксусной кислоты в воде MilliQ осуществляют от 5% до 100% MeCN через 15 мин. Скорость потока: 10 мл/мин.
Используются следующие сокращения:
| DMAP | 4-диметиламинопиридин; |
| DMF | N,N-диметилформамид; |
| EDC | 1-этил-3-(3-диметиламинопропил)карбодиимид; |
| EtOAc | этилацетат; |
| HCl | хлористый водород; |
| CH2Cl2 | дихлорметан; |
| CDCl3 | дейтерированный хлороформ; |
| Эфир | простой диэтиловый эфир; |
| MeCN | ацетонитрил; |
| Na2CO3 | карбонат натрия; |
| NaOH | гидроксид натрия; |
| Na2SO4 | сульфат натрия; |
| QHSO4 | тетрабутиламмоний персульфат; |
| к.т. | комнатная температура. |
Используемые исходные материалы либо являются доступными из коммерческих источников, либо получаются в соответствии с процедурами, известными из литературы, и имеют экспериментальные данные в соответствии с теми, которые опубликованы.
Пример 1. Получение ди-трет-бутил-[3-(2,3,4,5,6,7,8,10,11,12-декаборабицикло[7.2.1]додек-1-ил)пропил]имидодикарбоната
К перемешиваемой смеси QHSO4 (3,04 г, 8,96 ммоль) и 1 M водного раствора NaOH (18 мл) добавляют CH2Cl2 (20 мл) с последующим добавлением по каплям 1-(3-бромпропил)-2,3,4,5,6,7,8,10,11,12-декаборабицикло[7.2.1]додекана (Tetrahedron Lett. 1996, 37(38), 6905-6908) (2,16 г, 8,15 ммоль) в CH2Cl2 (15 мл). Полученный раствор нагревают с обратным холодильником в течение 2 часов и охлаждают до к.т. Добавляют воду (10 мл). Водный слой экстрагируют CH2Cl2 (30 мл). Объединенные органические слои промывают водой (10 мл), сушат над Na2SO4 и концентрируют. Остаток перемешивают с эфиром (30 мл). Осадок экстрагируют сухим эфиром (2×20 мл) и объединенные экстракты концентрируют в вакууме. Сырой продукт очищают с помощью флэш-хроматографии. Выход: 62% (2,21 г).
1H ЯМР (400 МГц, CDCl3): δ м.д. 3,35 (т, 2H, J=7,07 Гц), 2,62 (с, 1H), 1,68-1,56 (м, 4H), 1,49-1,44 (м, 18H).
ЖХ/МС (ESI) m/z 402 (M+1).
Пример 2. Получение 3-(2,3,4,5,6,7,8,10,11,12-декаборабицикло[7.2.1]додек-1-ил)-пропан-1-амина
Ди-трет-бутил [3-(2,3,4,5,6,7,8,10,11,12-декаборабицикло[7.2.1]додек-1-ил)пропил]имидодикарбонат из Примера 1 (2,21 г, 5,50 моль) растворяют в насыщенном растворе HCl в EtOAc (100 мл). Раствор перемешивают в течение ночи при к.т., а затем выпаривают. Белый пухлый осадок промывают сухим эфиром. Осадок затем растворяют в воде и раствор подщелачивают водным насыщенным раствором Na2CO3 (40 мл). Водный слой экстрагируют эфиром и объединенные органические экстракты промывают насыщенным раствором соли (3×10 мл). Удаление растворителя в вакууме дает свободный амин. Выход: 76% (841 мг).
1H ЯМР (400 МГц, CDCl3): δ м.д. 2,62 (с, 1H), 2,54-2,42 (м, 2H), 1,69-1,58 (м, 2H), 1,44-1,33 (м, 2H).
ЖХ/МС (ESI) m/z 202 (M+1).
Пример 3. Получение N 2-(4-{[(2-амино-4-оксо-3,4-дигидроптеридин-6-ил)метил]амино}бензоил)-N-{3-[(1R,9S)-2,3,4,5,6,7,8,10,11,12-декаборабицикло[7.2.1]додек-1-ил]пропил}-α-глютамина и N 2-(4-{[(2-амино-4-оксо-3,4-дигидроптеридин-6-ил)метил]амино}бензоил)-N-[3-(2,3,4,5,6,7,8,10,11,12-декаборабицикло[7.2.1]додек-1-ил)пропил]-L-глютамина
и
Фолиевую кислоту (1,84 г, 4,17 ммоль), EDC (799 мг, 4,17 ммоль) и DMAP (509 мг, 4,17 ммоль) растворяют в сухом DMF (200 мл). Раствор перемешивают в течение 3 часов при 20°C в атмосфере аргона. Затем добавляют раствор 3-(2,3,4,5,6,7,8,10,11,12-декаборабицикло[7.2.1]додек-1-ил)пропан-1-амина из Примера 2 (839 мг, 4,17 ммоль) в DMF (40 мл) и смесь перемешивают в течение 1 дня. Растворитель удаляют в вакууме. Остаток дважды промывают смесью эфир/CH2Cl2. Сырой материал очищают с помощью препаративной ВЭЖХ. Выход: 7,5% (190 мг).
ЖХ/МС (ESI) m/z 623 (M-1) для обоих изомеров. Время удерживания при 12-минутном способе: 8,48 и 8,78 мин (в этом случае используют изократический способ с 2,5 мМ водным раствором уксусной кислоты).
Исследования in vitro соединений по настоящему изобретению
Четыре различных линии опухолевых клеток человека, включая линию клеток глиомы человека U343mga, линию клеток гепатокарциномы человека Hep3B, линию клеток аденокарциномы груди человека MCF7 и линию клеток саркомы человека 4SS, используют для исследования in vitro очищенного материала из Примера 3 (далее обозначается как BF). Клетки помещают на пластиковые планшеты для культуры тканей без покрытия и культивируют при 37°C в инкубаторах с увлажненным воздухом, уравновешенным 5% CO2. Их выращивают в рекомендованной среде для культивирования тканей, дополненной 10% FCS и PEST (пенициллин, 100 МЕ/мл и стрептомицин, 100 мг/мл). Для пересева клеток клетки трипсинизируют в солевом буфере (PBS) без кальция и магния).
В итоге, как будет показано ниже в Примерах 4-6, BF демонстрирует многообещающие результаты в исследованиях in vitro с превосходством по отношению к BPC относительно потребления, накопления и удерживания в опухолевых клетках без каких-либо следов токсичности.
Пример 4. Потребление BF клетками
Клетки U343mga помещают на чашки Петри при 75% плотности клеток и инкубируют вместе с одним веществом из борной кислоты (BA), бора, конъюгированного с витамином B12 (BB), 1-4-дигидроксиборил-фенилаланином (BPA) или BF, растворенным в среде для культуры тканей в течение 6 часов. Все четыре борированных соединения добавляют и растворяют в среде для культуры тканей при эквимолярных концентрациях относительно содержания бора (5×10-4 M бора). Инкубирование прекращают посредством удаления борсодержащей среды для культуры тканей и посредством добавления холодного буфера PBS для отмывки избытка среды с клеток. Клетки немедленно харвестируют посредством соскребывания их с пластиковой чашки, используя резиновый скребок. Их собирают в холодном PBS и осаждают посредством центрифугирования.
Образцы клеток отбирают для анализа на общее содержание белка в соответствии со стандартной процедурой Брэдфорда. Лепешки клеток обрабатывают для анализа на бор с помощью плазмы тлеющего разряда на постоянном токе - атомно-эмиссионной спектроскопии (DCP-AES). Образцы (50-130 мг) дигерируют при 60°C с помощью серной кислоты/азотной кислоты (1/1). Добавляют Triton X-100 и воду с получением концентраций 50 мг ткань/мл, 15% объем/объем кислоты в целом и 5% объем/объем Triton X-100. Концентрации бора основываются на известном эталонном образце.
Результаты показаны в Таблице 1 ниже. Ковалентная связывание фолиата с бором в форме BF приводит к активному потреблению в линии клеток глиобластомы человека U343mga, которое превышает потребление бора как борной кислоты (BA), бора-фенилаланина (BPA) или бора, конъюгированного с витамином B12 (BB).
| Таблица 1 Потребление различных борированных соединений клетками. Содержание бора выражается как функция от общего содержания белка в клетках (мкг бора/г клеточного белка) в клетках U343mga для различных борированных соединений в двух параллельных экспериментах (опыт 1 и опыт 2) (7,2 и 7,7 мкг бора/мл среды для культуры в опыте 1 и 2 соответственно) | ||
| Борированное соединение | Опыт 1 | Опыт 2 |
| BA | 8 | - |
| BB | - | 60 |
| BPA | 65 | 38 |
| BF | 560 | 440 |
Пример 5. Потребление BF различными опухолевыми клетками
Четыре различных линии опухолевых клеток человека, U343mga Hep3B, MCF7 и 4SS, помещают в чашки Петри при 40-50% (низкой) и 90-100% (высокой) плотности (конфлюентности) клеток и инкубируют вместе с BF, растворенным в среде для культуры тканей в течение 6 часов, как описано. Инкубирование прекращают посредством удаления борсодержащей среды и добавления холодного буфера PBS для отмывки избытка среды от клеток. Клетки немедленно харвестируют посредством соскребывания их с пластиковой чашки с использованием резинового скребка, собирают в холодном PBS и осаждают посредством центрифугирования. Анализ общего содержания белка и бора осуществляют в соответствии со стандартными процедурами (см. выше).
Результаты показаны в Таблице 2 ниже. BF, как обнаружено, являю