Способ получения имино-амидных -аллильных комплексов никеля
Иллюстрации
Показать всеИзобретение относится к способу получения имино-амидных π-аллильных комплексов никеля. Способ включает взаимодействие Ni(allyl)2 с дииминовыми лигандами в молярных соотношениях 1:1. Процесс ведут в среде растворителя при температуре от -30° до 0°. Технический результат - изобретение позволяет получить имино-амидные π-аллильные комплексы никеля, которые могут быть использованы в каталитических превращениях низших олефинов. 1 з.п. ф-лы.
Реферат
Предлагаемое изобретение относится к элементоорганической химии, в частности к способу получения имино-амидных π-аллильных комплексов никеля. Относительно недавно было показано, что комплексы никеля с дииминовыми лигандами позволяют проводить широкий спектр каталитических превращений низших олефинов - от димеризации до высокомолекулярной полимеризации [L.K.Johnson, С.М.Killian, M. Brookhart // J. Am. Chem. Soc. 1995, v 117, N 18, p.6414-6415.]. Особо важно, что на этих комплексах никеля возможно получать α-олефиновые продукты [С.М.Killian, D.J.Tempel, L.K.Johnson, M.Brookhart // J. Am. Chem. Soc. 1996, v 118, N 46, p.11664-11665; С.M.Killian, L.K.Johnson, M.Brookhart // Organometallics 1997, v16, N 10, p.2005-2007; P.Preishuber-Pflugl, M.Brookhart // Macromolecules 2002, v 35, N 16, p.6074-6076.]. Дииминовые лиганды позволяют широко варьировать как геометрические, так и донорно-акцепторные свойства каталитически-активных комплексов, что позволяет контролировать свойства получаемых катализаторов [S.A.Svejda, М.Brookhart // Organometallics 1999, v 18, N 1, p.65-74.]. Это послужило отличным стимулом для синтеза большого числа новых дииминовых лигандов и создания металлокомплексов с различными переходными металлами [Р.Chavez, I.G.Rios, A.Kermagoret, R.Pattacini, A.Meli, C.Bianchni, G.Giambastiani, P.Braunstein, // Organometallics 2009, v 28, N 6, p.1776-1784; S.O.Ojwach, I.A.Guzei, L.L.Benade, S.F.Mapolie, J.Darkwa // Organometallics 2009, v 28, N 7, p.2127-2133; Т.K.Goswami, M.Roy, M.Nethaji, A.R.Chakravarty, // Organometallics 2009, v 28, N 7, p.1992-1994; S.-W.Lai, Q.K.-W.Chan, J.Han, Y.-G.Zhi, N.Zhu, C.-M.Che, // Organometallics 2009, v 28, N 1, p.34-37; D.Wang, S.Li, X.Liu, W.Gao, D.Cui // Organometallics 2008, v 27, N 27, p.6531-6538.].
Имино-амидные комплексы переходных металлов в целом можно рассматривать как перспективные исходные реагенты для получения полиядерных металлоорганических комплексов.
Известен способ получения имино-амидных комплексов никеля путем взаимодействия литийпроизводного дииминового лиганда с бромидами переходных металлов, например никеля [J.Zhang, Z.Ke, F.Bao, J.Long, H.Gao, F.Zhu, Q.Wu. // Journal of Molecular Catalysis A: Chemical 2006, v 249, N 1-2, p.31-39]. Способ заключается в предварительной обработке дииминового соединения бутиллитием, и последующим взаимодействием полученного промежуточного продукта с бромидом никеля. Недостатком способа является проведение процесса как минимум в двухстадийном исполнении, использование литийорганических соединений. Кроме того, низкая растворимость бромида никеля в органических средах требует длительного времени на проведение второй стадии реакции. Для уменьшения времени проведения второй стадии реакции вместо бромида никеля можно использовать бис-трифенилфосфиновый бромидный комплекс никеля, но в этом случае процесс становиться трехстадийным. Кроме того, по данной схеме невозможно получить аллильные имино-амидные комплексы переходных металлов.
Для упрощения получения имино-амидных комплексов никеля предлагается использовать каталитические свойства переходного металла, образующего комплекс, что позволяет провести трансформацию дииминового лиганда в имино-амидный непосредственно внутри координационной сферы комплекса.
Известен способ получения имино-амидных комплексов гафния и циркония [H.Tsurugi, R.Ohnishi, H.Kaneko, Т.K.Panda, K.Mashima.// Organometallics 2009, v 28, N 3, p.680-687]. Суть способа заключается во взаимодействии металлоорганического соединения М(CH2Ph) (где M=Zr, Hf) с дииминовым лигандом (арил- или циклогексилзамещенный диазобутадиен) в толуоле при температуре -78°С. В процессе реакции происходит бензилирование дииминового лиганда с образованием имино-амидного комплекса металла. В данном случае процесс формирования имино-амидного комплекса можно отобразить следующей схемой:
Данный способ позволяет получать только комплексы циркония и гафния.
Литературный поиск способов формирования имино-амидных π-аллильных комплексов никеля результатов не дал.
Реализовать возможность получения имино-амидных π-аллильных комплексов никеля предлагается с использованием принципиально нового способа формирования комплекса путем трансформации дииминовых лигандов в координационной сфере π-аллильного никелевого комплекса. В качестве исходных реагентов выступают бис-π-аллильный комплекс никеля (Ni(allyl)2) и дииминовый лиганд, в молярных соотношениях 1:1, при этом процесс ведут в среде растворителя при температуре от -30° до 0°. В качестве растворителя используют диэтиловый эфир, тетрагидрофуран или толуол.
Способ заключается в получении Ni(allyl)2 в диэтиловом эфире и последующем взаимодействии полученного комплекса с дииминовым лигандом. В качестве дииминового лиганда может выступать гетероароматическое азотсодержащее соединения, например фенантролин. При этом происходит деароматизация одного гетероароматического кольца, что также демонстрируется впервые. Реакцию между Ni(allyl)2 и дииминовым лигандом можно проводить в диэтиловом эфире, тетрагидрофуране, толуоле. Температура, при которой протекает реакция лежит в пределах -30-0°С. Ниже приведены примеры, демонстрирующие возможности предлагаемого метода в конкретных условиях и с конкретными соединениями.
Пример 1.
К раствору 3 ммоль (0,423 г) Ni(allyl)2 в 50 мл диэтилового эфира при температуре -5°С медленно прикапывают охлажденный до -5°С раствор 3 ммоль (0,54 г) фенантролина-1,10 в 50 мл диэтилового эфира. Прикапывание ведут в течение 30 минут при интенсивном перемешивании. Реакционную смесь ярко-зеленого цвета перемешивают 2 часа поддерживая температуру около -5°С, затем фильтруют. Из полученного фильтрата удаляют эфир в вакууме. Полученный ярко-зеленый порошок растворяют в 20 мл пентана при темепературе 20-25°С, раствор помещают в морозильник -30°С на 3 суток. Из раствора выпали зеленые кристаллы в виде тонких зеленых игл, которые отделяют от маточника фильтрованием при -30°С. Полученные кристаллы сушат в вакууме 6 часов, Р=10-2 mmHg, T=20-25°С. Кристаллы стабильны в аргоне, на воздухе быстро разлагаются.
Выход 0.632 г (1,9 ммоль), 65,7%.
Полученное соединение идентифицировано методами гетероядерной двумерной ЯМР-спектроскопии, ИК-спектроскопии, МАСС-спектрометрии и рентгеноструктурного анализа. Полученный имино-амидный π-аллильный комплекс представляет собой соединение 1, формирующееся по реакции, изображенной на схеме 1.
Схема 1.
Данные, полученные для комплекса 1:
Температура плавления 82-90°С.
Данные элементного анализа:
C18H18N2Ni (321,04): рассчитано: С 67.34, Н 5.65, N 8.73, Ni 18.28; найдено: С 67.50, Н 6.05, N 8.93.
HRMS: C18H18N2Ni: рассчитано: 320.0823, измерено: 320.0822.
HRMS: C15H13N2Ni (M+-C3H5): рассчитано: 279.0432, измерено: 279.04223.
MS (70 eV): m/z (%) = 39(36.9), 58(45.7), 98(28.5), 140(53.2), 180(74.3), 238(100.0), 279(80.5), 320(3.5).
IR (KBr) cm-1: 3407(vs), 3021(m), 2915(m), 1637(s), 1616(s), 1589(s), 1542(s), 1506(s), 1463(s), 1396(s), 1376(s), 1124(s), 989(vs), 904(s), 846(s), 804(s), 786(s), 728(d), 711(s), 673(s), 646(s).
1H NMR (500 MHz, [D8]THF, 297 K): δ=8.31 (m, 1H, CH1), 7.94 (m, 1H, CH2), 7.14 (m, 1H, CH3), 6.75 (d, 3JHH=3.48 Hz, 1H, CH5), 6.26 (d, 3JHH=9.64 Hz, 1H, CH6), 6.24 (m, 1H, CH8), 5.28 (dd, 3JHH=4.9 Hz, 3JHH=9.65 Hz, 1H, CH9), 4.32 (m, 1H, CH10), 2.34 (m, 1H, CH213), 2.57 (m, 1H, CH213'), 5.96 (m, 1H, CH14), 4.95 (m, 2H, CH215), 2.57 (d, 2JHH=13.00 Hz, 1H, СН216), 3.09 (dd, 3JHH=3.09 Hz, 2JHH=12.73 Hz, 1H, СН216'), 5.67 (m, 1H, CH17), 2.14 (d, 2JHH=12.8 Hz, 1H, CH218), 2.78 (d, 2JHH=6.61 Hz, 1H, CH218') ppm.
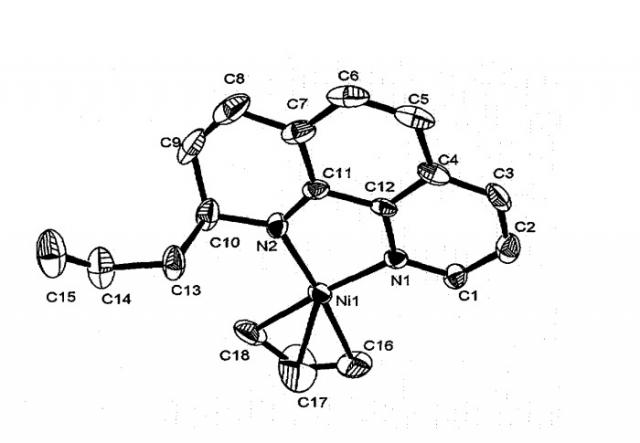
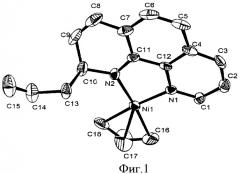
13C NMR (125 MHz, [D8]THF, 297 K): δ=148.93 (d, 1JCH=180.6 Hz, Cl), 138,22 (d, 1JCH=161.26 Hz, C2), 121.51 (d, 1JCH=157.74 Hz, C3), 130,93 (s, C4), 128.27 (d, 1JCH=157.75 Hz, C5), 105.22 (d, 1JCH=168.22 Hz, C6), 116.67 (s, C7), 125.65 (d, 1JCH=157.74 Hz, C8), 123.57 (d, 1JCH=158.9 Hz, C9), 63.96 (C10), 155.77 (s, C11), 143.58 (s, C12), 49.56 (C13), 136.17 (C14), 116.37 (t, 1JCH=154.26 Hz, C15), 55.28 (C16), 109.95 (d, 1JCH=59.9 Hz, C17), 48.42 (C18) ppm. (нумерация атомов совпадает с нумерацией на рисунке, приведенном ниже)
Структура комплекса по данным рентгеноструктурного анализа изображена на рисунке.
Молекулярная структура комплекса 1. Избранные длины связей [Å] и углы [°]: Ni-N1=1.921(3), Ni-N2=1.896(3), Ni-C17=1.969(6), N1-Ni-N2=85.14(12), N2-Ni-C18=100.97 (16), N1-Ni-C17a=133.6(3), N1-Ni-C17b=136.4(4), N2-Ni-C17=136.3(2), Ni-N2-C11=112.5(2), Ni-N1-C12=111.5(2).
Пример 1 демонстрирует возможность трансформации молекулы фенантролина-1,10 в координационной сфере никеля с образованием имино-амидного π-аллильного комплекса никеля 1. Реакция протекает с достаточно большим выходом, за короткое время в одну стадию.
Пример 2.
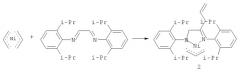
К раствору 4 ммоль (0,564 г) Ni(allyl)2 в 100 мл диэтилового эфира при температуре -5°С медленно прикапывают охлажденный до -5°С раствор 4 ммоль (1,50 г) (2,6-диизопропилфенил)диазабутадиена в 100 мл диэтилового эфира. Прикапывание ведут в течение 30 минут при интенсивном перемешивании. Реакционную смесь ярко-красного цвета перемешивают 2 часа, поддерживая температуру около -5°С, затем фильтруют. Из полученного фильтрата удаляют эфир в вакууме. Полученный ярко-красный порошок растворяют в 50 мл пентана при температуре -5°С, раствор помещают в морозильник -30°С на 5 суток. Из раствора выпали ярко-красные кристаллы в виде тонких пластинок, которые отделяют от маточника фильтрованием при -30°С. Полученные кристаллы сушат в вакууме 6 часов, Р=10-2 mmHg, T=20-25°С. Кристаллы стабильны в аргоне, на воздухе быстро разлагаются.
Выход 1.07 g (2,08 mmol), 52,0%.
Полученное соединение идентифицировано методами гетероядерной двумерной ЯМР-спектроскопии, ИК-спектроскопии, МАСС-спектрометрии и рентгеноструктурного анализа. Полученный имино-амидный π-аллильного комплекс никеля представляет собой соединение 2, формирующееся по реакции, изображенной на схеме 2.
Схема 2.
Температура плавления 60-65°С.
Данные элементного анализа:
C32H46N2Ni (517.41): рассчитано С 74.28, Н 8.96, N 5.41, Ni 11.34; найдено С 75.16, Н 8.20, N 4.92.
HRMS: C32H46N2Ni рассчитано - 516.3014, измерено - 516.29939 (-2mmu)
MS (70 eV): m/z (%)=41(24.9), 59(13.9), 186(13.0), 228(43.2), 418(33.4), 434(42.9), 476(100.0), 516(74.8).
IR (KBr) cm-1: 3052(m), 3012(s), 2960(s), 2923(s), 2865(s), 2740(m), 2688(s), 1932(s), 1913(s), 1872(s), 1847(s), 1812(s), 1783(s), 1762(s), 1602(N=C, s) 1571(s), 1461(d), 1363(s), 1355(s), 1313(vs), 1253(s), 1105(s), 1076(vs), 987(vs), 919(s), 892(s), 794(s), 754(d), 568(s), 532(s).
1H NMR (500 MHz, [D8]THF, 297 К): δ=6.95 (d, 3JHH=7.12 Hz, 1H, CH3), 6.86 (m, 1H, CH4), 6.98 (d, 3JHH=6.87 Hz 1H, CH5), 4.37(d, 2JHH=26.34 Hz, 1H, CH27), 4.55 (d, 2JHH=26.34 Hz, 1H, CH27'), 7.20 (m, 3H, CH11-CH13), 1.44 (d, 2JHH=4.96 Hz, 1H, CH215), 1.59 (d, 2JHH=12.90 Hz, 1H, CH215'), 5.34(m, 1H, CH16), 1.43 (d, 2JHH=7.96 Hz, 1H, CH217), 1.62 (d, 2JHH=12.94 Hz, 1H, CH217'), 4.50 (m, 1H, CH18), 1.38 (m, 3Н, СН319), 1.40 (m, 3Н, СН320), 3.86 (m, 1H, CH21), 1.31 (m, 6H, СН322, СН323), 2.88 (m, 2Н, СН24), 5.73 (m, 1H, CH25), 5.01 (m, 2H, CH26), 3.32 (m, 1H, CH27), 1.29 (m, 6H, СН328, СН329), 3.61 (m, 1H, СН30), 1.22 (m, 6H, СН331, СН332) ppm.
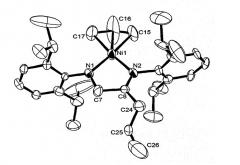
13С NMR (125 MHz, [D8]THF, 297 К): δ - 157.84(С1), 147.87(С2), 123.43(С3), 123.06(С4), 123.54(С5), 146.33(С6), 72.82(С7), 191.36(С8), 146.67(С9), 139.26(С10), 124.41(С11), 127.33(С12), 124.67(С13), 139.61(С14), 50.62(С15), 106.39(С16), 53.61(С17), 28.44(С18), 26.16(С19), 26.34(С20), 28.30(С21), 24.49(С22), 25.16(С23), 37.65(С24), 132.44(С25), 119.48(С26), 29.09(С27), 24.14(С28), 24.23(С29), 29.29(С30), 24.42(С31), 24.57(С32) ppm. (нумерация атомов изображена на рисунке 2)
Рисунок 2. Нумерация атомов в комплексе 2, соответствующая отнесению сигналов в спектрах ЯМР.
Структура комплекса 2 по данным рентгеноструктурного анализа изображена на рисунке 3.
Рисунок 3. Молекулярная структура комплекса 2. Избранные длины связей [Å] и углы [°]: Ni-N1=1.847(9), Ni-N2=1.883(10), Ni-C15=2.019(15), Ni-C16=1.881(19), Ni-C17=2.011(18), C24-C25=1.447(19), C25-C26=1.19(4); N1-Ni-N2=85.0(4), N1-Ni-C16=138.2 (16), N2-Ni-C16=136.8(9), Ni-N1-C7=113.9(8), Ni-N2-C8=116.4(8).
Пример 2 демонстрирует возможность трансформации не ароматических диазобутадиеновых дииминовых лигандов в координационной сфере никеля с образованием имино-амидного π-аллильного комплекса никеля 2. Реакция протекает с достаточно большим выходом, за короткое время в одну стадию.
Пример 3. То же, что и пример 1, в качестве растворителя для проведения реакции использовали тетрагидрофуран, выход комплекса 1 составил 57.3%.
Пример 4. То же, что и пример 1, в качестве растворителя для проведения реакции использовали толуол, выход комплекса 1 составил 32%.
Пример 5. То же, что и пример 2, в качестве растворителя для проведения реакции использовали тетрагидрофуран, выход комплекса 2 составил 15.7%.
Примеры 3, 4, 5 демонстрируют влияние растворителя, в котором проводится реакция на выход конечного продукта.
1. Способ получения имино-амидных π-аллильных комплексов никеля путем взаимодействия Ni(allyl)2 с дииминовыми лигандами в молярных соотношениях 1:1, при этом процесс ведут в среде растворителя при температуре от -30 до 0°.
2. Способ по п.1, отличающийся тем, что в качестве растворителя используют диэтиловый эфир, тетрагидрофуран или толуол.