Способы ослабления высвобождения медиаторов воспаления и пептиды, применяемые для этой цели
Иллюстрации
Показать всеИзобретение относится к ингибированию или снижению уровня высвобождения медиаторов воспаления из воспалительных клеток путем подавления механизма, ассоциированного с высвобождением медиаторов воспаления из гранул воспалительных клеток путем использования вариантов пептида MANS. В соответствии с этим настоящее изобретение относится к внутриклеточному механизму передачи сигнала, который позволяет обнаруживать несколько новых внутриклеточных мишеней для фармакологического лечения расстройств, ассоциированных с секрецией медиаторов воспаления из везикул воспалительных клеток. 24 з.п. ф-лы, 8 табл., 15 ил.
Реферат
Перекрестная ссылка на родственную заявку
В настоящей заявке испрашивается приоритет заявки на патент США рег. № 60/833239, поданной 26 июля 2006 и вводимой во всей своей полноте в настоящее описание посредством ссылки.
Область, к которой относится изобретение
Настоящее изобретение относится к пептидам или пептидным композициям и к способам их применения для ослабления (или ингибирования, или снижения уровня) высвобождения медиаторов из воспалительных клеток, стимулируемого в процессе воспаления. Настоящее изобретение также относится к применению этих пептидов или пептидных композиций для модуляции механизма внутриклеточной передачи сигнала регуляции секреции медиаторов воспаления из воспалительных клеток.
Предшествующий уровень техники
Воспалительные лейкоциты синтезируют ряд медиаторов воспаления, которые находятся внутри клеток в изолированном виде и сохраняются в цитоплазматических мембраносвязанных гранулах. Примерами таких медиаторов являются, но не ограничивается ими, миелопероксидаза [MPO] в нейтрофилах (см., например, Borregaard N, Cowland J. B. Granules of the human neutrophilic polymorphonuclear leukocyte. Blood 1997; 89:3503-3521), пероксидаза эозинофилов [EPO] и основный мажорный белок [MBP] в эозинофилах (см., например, Gleich G J. Mechanisms of eosinophil-associated inflammation. J. Allergy Clin. Immunol. 2000; 105:651-663), лизоцим в моноцитах/макрофагах (см., например, Hoff T, Spencker T, Emmendoerffer A., Goppelt-Struebe M. Effects of glucocorticoids on the TPA-induced monocytic differentiation. J. Leukoc Biol. 1992; 52:173-182; and Balboa M A, Saez Y, Balsinde J. Calcium-independent phospholipase A2 is required for lysozyme secretion in U937 promonocytes. J. Immunol. 2003; 170:5276-5280) и гранзим в природных клетках-киллерах (NK) в цитотоксических лимфоцитах (см., например, Bochan MR, Goebel WS, Brahmi Z. Stably transfected antisense granzyme B and perforin constructs inhibit human granule-mediated lytic ability. Cell Immunol. 1995; 164:234-239; Gong J.H., Maki G, Klingemann H.G. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells. Leukemia 1994; 8:652-658; Maki G, Kiingemann H.G, Martinson J.A, Tarn Y.K. Factors regulating the cytotoxic activity of the human natural killer cell line, NK-92. J. Hematother Stem Cell Res. 2001; 10:369-383; and Takayama H, Trenn G, Sitkovsky M.V. A novel cytotoxic T lymphocyte activation assay. J. Immunol. Methods 1987; 104:183-190). Такие медиаторы высвобождаются в области поражения и участвуют в развитии воспаления и репарации ткани, например, в легких и в каких-либо других органах. Известно, что лейкоциты высвобождают эти гранулы по механизму экзоцитоза (см., например, Burgoyne R.D, Morgan A. Secretory granule exocytosis. Physiol. Rev. 2003; 83:581-632; and Logan M.R, Odemuyiwa S.O, Moqbel R. Understanding exocytosis in immune and inflammatory cells: the molecular basis of mediator secretion. J. Allergy Clin. Immunol. 2003; 111:923-932), однако более точное описание регуляторных молекул и специфических путей, участвующих в процессе экзоцитоза, не приводится.
Некоторые экзогенные стимуляторы могут вызывать дегрануляцию лейкоцитов по механизму, который включает активацию протеинкиназы С и последующие события фосфорилирования (см., например, Burgoyne R.D, Morgan A. Secretory granule exocytosis. Physiol. Rev. 2003; 83:581-632; Logan M.R, Odemuyiwa S.O, Moqbel R. Understanding exocytosis in immune and inflammatory cells: the molecular basis of mediator secretion. J. Allergy Clin. Immunol. 2003; 111:923-932; Smolen J.E, Sandborg R.R. Ca2+-induced secretion by electropermeabilized human neutrophils: the roles of Ca2+, nucleotides and protein kinase C. Biochim Biophys Acta 1990; 1052:133-142; Niessen H.W, Verhoeven A.J. Role of protein phosphorylation in the degranulation of electropermeabilized human neutrophils. Biochim, Biophys. Acta 1994; 1223:267-273; and Naucler C, Grinstein S, Sundler R., Tapper H. Signaling to localized degranulation in neutrophils adherent to immune complexes. J. Leukoc. Biol. 2002; 71:701-710).
Белок MARCKS (где используемое здесь обозначение MARCKS означает «миристоилированный богатый аланином субстрат киназы С» («Myristoylated Alanine-Rich C Kinase Substrate») представляет собой часто встречающуюся мишень фосфорилирования протеинкиназы С (PKC), и экспрессируется в лейкоцитах на высоком уровне (см., например, Aderem A.A., Albert K.A., Keum M.M., Wang J.K., Greengard P Cohn Z.A. Stimulus-dependent myristoylation of a major substrate for protein kinase C. Nature 1988; 332:362-364; Thelen M, Rosen A, Nairn A.C., Aderem A. Regulation by phosphorylation of reversible association of a myristoylated protein kinase C substrate with the plasma membrane. Nature 1991; 351:320-322; and Hartwig J.H., Thelen M, Rosen A, Janmey P.A, Nairn A.C, Aderem A. MARCKS is an actin filament crosslinking protein regulated by protein kinase C and calcium-calmodulin. Nature 1992; 356:618-622). Белок MARCKS механистически участвует в процессе экзоцитозной секреции муцина бокаловидными клетками, которые выстилают дыхательные пути (см., например, Li et al., J. Biol. Chem. 2001; 276:40982-40990; и Singer et al., Nat. Med. 2004; 10:193-196). MARCKS миристоилируется посредством амидной связи у N-концевой аминокислоты в аминокислотной последовательности белка MARCKS в положении альфа-аминогруппы глицина, который присутствует у N-конца (то есть в положении 1) аминокислотной последовательности. В эпителиальных клетках дыхательных путей миристоилированная N-концевая область MARCKS, очевидно, является неотъемлемой частью секреторного процесса. Термин «N-конец белка MARCKS» означает пептид MANS, содержащий последовательность миристоил-GAQFSKTAAKGEAAAERPGEAAVA (SEQ ID NO:1), которая представляет собой последовательность, состоящую из L-аминокислот. Кроме того, описанные здесь пептидные фрагменты пептида MANS также предпочтительно состоят из L-аминокислот. Очевидно, что указанный механизм заключается в связывании миристоилированного белка MARCKS, то есть с мембранами внутриклеточных гранул.
Было показано, что N-концевой миристоилированный пептид, присутствующий у N-конца MARCKS, блокирует секрецию муцина и связывание MARCKS с мембранами муциновых гранул в бокаловидных клетках (см., например, Singer et al., Nat. Med. 2004; 10:193-196). Этот пептид содержит 24 аминокислоты белка MARCKS начиная с N-концевого глицина белка MARCKS, который является миристоилированным посредством амидной связи и известен как миристоилированная альфа-N-концевая последовательность (MANS), то есть миристоил-GAQFSKTAAKGEAAAERPGEAAVA (SEQ ID NO:1). В публикации Vergeres et al., J. Biochem. 1998, 330; 5-11, сообщается, что N-концевой глициновый остаток белков MARCKS миристоилируется посредством реакции, катализируемой миристоил- CoA:протеин-N-миристоилтрансферазой (NMT).
При воспалительных заболеваниях, таких как астма, ХОБЛ и хронический бронхит; при наследственных заболеваниях, таких как кистозный фиброз; при аллергических состояниях (атопии, аллергическом воспалении); при бронхиэктазе и при различных острых инфекционных респираторных заболеваниях, таких как пневмония, ринит, грипп или насморк, а также артрите или аутоиммунных заболеваниях воспалительные клетки обычно присутствуют на участках поражения или инфицирования, ассоциированных с воспалительными патологическими состояниями, либо мигрируют в дыхательные участки, а в частности указанные клетки присутствуют в дыхательных или воздухоносных путях либо мигрируют в дыхательные пути пациентов, страдающих указанными заболеваниями. Такие воспалительные клетки могут играть значительную роль в патологии заболеваний посредством поражения ткани, вызываемого медиаторами воспаления, высвобождаемыми из этих клеток. Одним из примеров такого поражения или деструкции ткани при хроническом воспалении может служить поражение ткани у пациентов с кистозным фиброзом, где медиаторы, высвобождаемые из нейтрофилов (например, миелопероксидаза [MPO]), индуцируют слущивание эпителиальной ткани дыхательных путей.
MARCKS, то есть белок массой приблизительно 82 кД, имеет три эволюционно консервативных области (Aderem et al, Nature 1988; 332:362-364; Thelen et al., Nature 1991; 351:320-322; Hartwig et al., Nature 1992; 356:618-622; Seykora et al., J. Biol. Chem. 1996; 271:18797-18802), а именно N-конец, домен сайта фосфорилирования (или PSD) и домен множественной гомологии 2 (MH2). Последовательности человеческих кДНК белка MARCKS известны и приводятся в публикации Harlan et al., J.Biol. Chem. 1991, 266:14399 (GenBank рег. № M68956), а также в публикации Sakai et al, Genomics 1992, 14:175. Эти последовательности также описаны в заявке WO 00/50062, которая во всей своей полноте вводится в настоящее описание посредством ссылки. N-концевая альфа-аминокислотная последовательность, содержащая 24 аминокислотных остатка, вместе с молекулой миристиновой кислоты, присоединенной посредством амидной связи к N-концевому глициновому остатку, участвует в связывании MARCKS с клеточными мембранами (Seykora et al., J. Biol. Chem. 1996; 271:18797-18802) и, вероятно, с кальмодулином (Matsubara et al., J. Biol. Chem. 2003; 278:48898-48902). Указанная последовательность из 24 аминокислот известна как пептид MANS.
Описание сущности изобретения
Участие белка MARCKS в высвобождении медиаторов воспаления из гранул инфильтрующихся лейкоцитов играет важную роль в развитии воспалительных заболеваний всех тканей и органов, включая болезни легких, характеризующиеся воспалением дыхательных путей, таким как астма, ХОБЛ и кистозный фиброз. Однако воспаление и секреция слизи в дыхательных путях происходят по двум отдельным и независимым механизмам (Li et al., J. Biol. Chem. 2001; 276:40982-40990; Singer et al., Nat. Med. 2004; 10:193-196). Продуцирование и секреция слизи могут индуцироваться различными факторами, включая медиаторы, высвобождаемые воспалительными клетками, однако прямой связи между избытком слизи и развитием воспаления пока не установлено.
В одном из аспектов изобретения, пептид MANS может играть определенную роль в снижении скорости и/или уровня высвобождения медиаторов воспаления из гранул или везикул в воспалительных лейкоцитах.
В другом аспекте изобретения, пептиды, присутствующие на N-конце MARCKS, а особенно у N-концевой последовательности, состоящей из 24 аминокислот, то есть активные смежные пептидные фрагменты, присутствующие в N-концевой последовательности MARCKS, состоящей из 1-24 аминокислот и имеющей глицин в положении 1, а также N-концевые амиды таких фрагментов, такие как N-концевые амиды уксусной кислоты и/или С-концевые амиды таких фрагментов, например C-концевые амиды аммиака, могут ингибировать или снижать скорость и/или уровень высвобождения медиаторов воспаления из воспалительных лейкоцитов. Такое ингибирование или снижение уровня высвобождения включает ингибирование MARCKS-ассоциированного высвобождения медиаторов воспаления из воспалительных лейкоцитов.
В другом аспекте изобретения, пептиды, присутствующие на N-конце MARCKS, а особенно у N-концевой последовательности, состоящей из 1-24 аминокислот, то есть активные смежные пептидные фрагменты, присутствующие в N-концевой последовательности MARCKS, состоящей из 1-24 аминокислот и имеющей глицин в положении 1, а также N-концевые амиды таких фрагментов, такие как N-концевые амиды уксусной кислоты и/или С-концевые амиды таких фрагментов, например C-концевые амиды аммиака, могут ингибировать скорость и/или уровень высвобождения медиаторов воспаления, например медиаторов воспаления идентифицированных в настоящей заявке, путем подавления процесса дегрануляции воспалительных лейкоцитов.
В другом аспекте изобретения, пептид MANS и его активные фрагменты, а также активные амиды таких описанных здесь фрагментов могут конкурировать с нативным белком MARCKS за связывание с мембраной воспалительных клеток, что будет приводить к ослаблению (снижению или подавлению) MARCKS-опосредуемого высвобождения медиаторов воспаления из гранул или везикул, содержащих такие медиаторы воспаления и присутствующих в указанных воспалительных клетках.
Клетки лейкоцитарного типа и их модели, которые секретируют содержимое специфических гранул в ответ на индуцированную форболовым эфиром активацию PKC, могут быть использованы для in vitro иллюстрации эффективности пептидов согласно изобретению и замещенных пептидов (например, альфа-N-амидов, C-концевых амидов и сложных эфиров) согласно изобретению.
Снижение уровня высвобождения мембраносвязанных медиаторов воспаления под действием соединений и композиций согласно изобретению может быть продемонстрировано с использованием человеческих лейкоцитарных клеточных линий. Так, например, нейтрофилы, выделенные из человеческой крови, могут быть использованы для иллюстрации ослабления или ингибирования высвобождения миелопероксидазы (MPO). Клон 15 человеческой промиелоцитарной клеточной линии HL-60 может быть использован для иллюстрации ослабления высвобождения или ингибирования высвобождения или секреции пероксидазы эозинофилов (EPO) под действием соединений и композиций согласно изобретению (см., например, Fischkoff S.A. Graded increase in probability of eosinophilic differentiation of HL-60 promyelocyte leukemia cells induced by culture under alkaline conditions. Leuk Res 1988; 12:679-686; Rosenberg H.F., Ackerman S. J., Tenen D.G. Human eosinophil cationic protein: molecular cloning of a cytotoxin and helminthotoxin with ribonuclease activity. J. Exp. Med. 1989; 170:163-176; Tiffany H.L., Li F, Rosenberg H.F. Hyperglycosylation of eosinophil ribonucleases in a promyelocytic leukemia cell line and in differentiated peripheral blood progenitor cells. J. Leukoc. Biol. 1995; 58:49-54; and Badewa A.P., Hudson C.E., Heiman A.S. Regulatory effects of eotaxin, eotaxin-2, and eotaxin-3 on eosinophil degranulation and superoxide anion generation. Exp. Biol. Med. 2002; 227:645-651). Клеточная линия моноцитарного лейкоза U937 может быть использована для иллюстрации ослабления высвобождения или ингибирования высвобождения или секреции лизоцима под действием соединений и композиций согласно изобретению (см., например, Hoff T, Spencker T, Emmendoerffer A., Goppelt-Struebe M. Effects of glucocorticoids on the TPA- induced monocytic differentiation. J. Leukoc. Biol. 1992; 52:173-182; Balboa M. A., Saez Y, Balsinde J. Calcium-independent phospholipase A2 is required for lysozyme secretion in U937 promonocytes. J. Immunol. 2003; 170:5276-5280; and Sundstrom C, Nilsson K. Establishment and characterization of a human histiocytic lymphoma cell line (U-937). Int. J. Cancer 1976; 17:565-577). Лимфоцитарная клеточная линия клеток природных киллеров NK-92 может быть использована для иллюстрации ослабления или ингибирования высвобождения гранзима под действием соединений и композиций согласно изобретению (см., например, Gong J.H., Maki G, Klingemann H.G. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells. Leukemia 1994; 8:652-658; Maki G, Klingemann H.G., Martinson J.A., Tam Y.K. Factors regulating the cytotoxic activity of the human natural killer cell line, NK-92. J Hematother Stem Cell Res 2001; 10:369-383; and Takayama H, Trenn G, Sitkovsky M.V. A novel cytotoxic T lymphocyte activation assay. J Immunol Methods 1987; 104:183-190). В методе ингибирования или ослабления высвобождения медиатора воспаления in vitro, например, описанного в настоящей заявке, клетки каждого типа предварительно инкубируют с пептидным соединением или с пептидной композицией согласно изобретению при различных концентрациях, а затем эти клетки инкубируют со стимулятором высвобождения медиаторов воспаления, таким как форболовый эфир. Процент ингибирования высвобождения медиатора воспаления определяют по отношению к высвобождению медиатора в отсутствие пептидного соединения или пептидной композиции, например, спектрофотометрическим методом определения концентрации высвобождаемого медиатора.
Для того чтобы продемонстрировать важное значение соответствующей аминокислотной последовательности, присутствующей в пептидах согласно изобретению, относительную способность к ингибированию или снижению уровня медиатора воспаления, высвобождаемого пептидом, идентичным последовательности белка MARCKS, состоящего из 24 аминокислот в N-концевой области (то есть пептидом MANS с миристоилированной альфа-N-концевой последовательностью) сравнивают со способностью к ингибированию или снижению уровня медиатора воспаления, высвобождаемого под действием пептида, содержащего те же самые 24 аминокислотных остатка, которые присутствуют в MANS, но по сравнению с порядком расположения аминокислотных остатков в последовательности MANS, расположены в произвольном порядке (то есть пептида RNS, иначе называемого «пептидом с рандомизированной N-концевой последовательностью). В клетках каждого из оцениваемых типов пептид MANS, но не пептид RNS ослабляет высвобождение медиаторов воспаления в зависимости от концентрации в течение периода времени от 0,5 до 3,0 часа. Полученные результаты дают основание предполагать, что соответствующая аминокислотная последовательность, присутствующая в пептидах согласно изобретению, которая находится в белке MARCKS в установленном порядке, в частности в его N-концевой области, а более конкретно последовательность его 24 аминокислотных остатков в N-концевой области, участвует по меньшей мере в одном внутриклеточном пути ингибирования дегрануляции лейкоцитов.
Настоящее изобретение относится к новому применению пептидной последовательности, состоящей из 24 аминокислот, и к альфа-N-концевой ацетилированной пептидной последовательности, миристоилированного полипептида, также известного как пептид MANS и их активных фрагментов, где указанные активные фрагменты могут быть выбраны из группы пептидов, имеющих от 4 до 23 смежных аминокислотных остатков аминокислотной последовательности пептида MANS, и где указанные фрагменты могут быть миристоилированными у N-конца в том случае, если они не начинаются с N-концевого глицина в положении 1 SEQ ID NO:1, или где указанные фрагменты могут быть ацилированными у N-конца C2- C12-ацильными группами, включая группу, ацилированную у N-конца, и/или C-концевую группу, амидированную группой NH2.
Настоящее изобретение также относится к новому способу блокирования MARCKS-ассоциированных клеточных секреторных процессов, а в частности процессов, которые заключаются в MARCKS-ассоциированном высвобождении медиаторов воспаления из воспалительных клеток, в путях стимуляции которых участвует субстрат протеинкиназы С (PKC) для белка MARCKS и в которых происходит высвобождение содержимого из внутриклеточных везикул или гранул.
Настоящее изобретение относится к способу ингибирования экзоцитозного высвобождения по меньшей мере одного медиатора воспаления по меньшей мере из одной воспалительной клетки, где указанный способ включает контактирование по меньшей мере одной воспалительной клетки, содержащей по меньшей мере один медиатор воспаления, присутствующий во внутриклеточной везикуле, по меньшей мере с одним пептидом, выбранным из группы, состоящей из пептида MANS и его описанного здесь активного фрагмента в количестве, эффективном для снижения уровня высвобождения медиатора воспаления из воспалительной клетки, по сравнению с уровнем высвобождения медиатора воспаления из воспалительной клетки того же типа, наблюдаемым в отсутствие по меньшей мере одного пептида.
Настоящее изобретение также относится к способу ингибирования высвобождения по меньшей мере одного медиатора воспаления по меньшей мере из одной воспалительной клетки в ткани или физиологической жидкости индивидуума, где указанный способ включает введение в ткань и/или физиологическую жидкость индивидуума, содержащие по меньшей мере одну воспалительную клетку, включающую по меньшей мере один медиатор воспаления, присутствующий во внутриклеточной везикуле, терапевтически эффективного количества фармацевтической композиции, содержащей по меньшей мере один пептид, выбранный из группы, состоящей из пептида MANS и его описанного здесь активного фрагмента в количестве, терапевтически эффективном для снижения уровня высвобождения медиатора воспаления по меньшей мере из одной воспалительной клетки, по сравнению с уровнем высвобождения медиатора воспаления по меньшей мере из одной воспалительной клетки того же типа в отсутствие по меньшей мере одного пептида. Более конкретно, ингибирование высвобождения медиатора воспаления включает блокирование или снижение уровня высвобождения медиатора воспаления из воспалительной клетки.
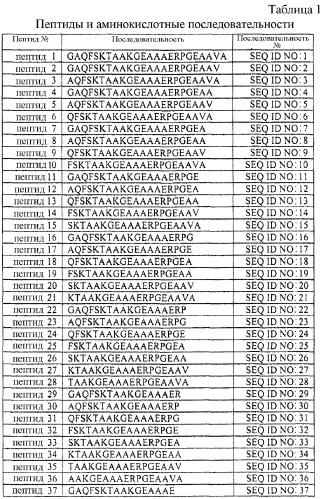
Более конкретно, настоящее изобретение относится к способу снижения воспаления у индивидуума, где указанный способ включает введение терапевтически эффективного количества фармацевтической композиции, содержащей пептид MANS (то есть N-миристоил- GAQFSKTAAKGEAAAERPGEAAVA (SEQ ID NO:1)) или его активный фрагмент. Такой активный фрагмент имеет длину по меньшей мере в четыре, а предпочтительно, по меньшей мере в шесть аминокислот. Используемый здесь термин «активный фрагмент» белка MARCKS означает фрагмент, который влияет (ингибирует или ослабляет) на опосредуемое белком MARCKS высвобождение, например опосредуемое белком MARCKS высвобождение медиатора воспаления. Активный фрагмент может быть выбран из группы, состоящей из GAQFSKTAAKGEAAAERPGEAAV (SEQ ID NO:2); GAQFSKTAAKGEAAAERPGEAA (SEQ ID NO:4); GAQFSKTAAKGEAAAERPGEA (SEQ ID NO:7); GAQFSKTAAKGEAAAERPGE (SEQ ID NO:11); GAQFSKTAAKGEAAAERPG (SEQ ID NO:16); GAQFSKTAAKGEAAAERP (SEQ ID NO:22); GAQFSKTAAKGEAAAER (SEQ ID NO:29); GAQFSKTAAKGEAAAE (SEQ ID NO:37); GAQFSKTAAKGEAAA (SEQ ID NO:46); GAQFSKTAAKGEAA (SEQ ID NO:56); GAQFSKTAAKGEA (SEQ ID NO:67); GAQFSKTAAKGE (SEQ ID NO:79); GAQFSKTAAKG (SEQ ID NO:92); GAQFSKTAAK (SEQ ID NO:106); GAQFSKTAA (SEQ ID NO:121); GAQFSKTA (SEQ ID NO:137); GAQFSKT (SEQ ID NO:154); GAQFSK (SEQ ID NO:172); GAQFS (SEQ ID NO:191) и GAQF (SEQ ID NO:211). Эти пептиды не содержат миристоильной группы у N-концевой аминокислоты, то есть либо не содержат химической группы, либо содержат немиристоильную химическую группу у N-концевой аминокислоты и/или химическую группу у С-концевой аминокислоты, например описанную здесь N-концевую ацетильную группу и/или С-концевую амидную группу. Присутствие гидрофобной N-концевой миристоильной группы в пептидах MANS и в их N-концевых миристоилированных фрагментах может приводить к повышению их способности проникать в плазматические мембраны, а вероятно, и к повышению их проницаемости в плазматических мембранах, а также, возможно, к сообщению этим пептидам растворимости в клетках. После введения гидрофобной миристоильной группы в липидный бислой мембраны эти липиды могут иметь коэффициент распределения или кажущуюся константу ассоциации до 104 М-1 или унитарную свободную энергию связывания Гиббса, составляющую примерно 8 ккал/моль (см., например, Peitzsch, R. M., and McLaughlin, S. 1993, Binding of acylated peptidas and fatty acids to phospholipid vesicles: pertinence to myristoylated proteins. Biochemistry. 32:10436-10443), где указанные величины являются достаточными, по меньшей мере частично, для распределения пептида MANS и миристоилированных фрагментов пептида MANS в плазматической мембране клетки, а дополнительные функциональные группы и их взаимодействия в пептиде MANS (который является миристоилированным) и в миристоилированых фрагментах пептида MANS могут потенцировать их относительную способность к проникновению в мембрану. Каждый из этих фрагментов может иметь коэффициенты распределения и аффинности по отношению к мембранам, которые по своей структуре являются репрезентативными. Эти фрагменты могут быть получены методами пептидного синтеза, известными специалистам, такими как твердофазный пептидный синтез (см., например, методы, описанные в публикациях Chan, Weng C. and White, Peter D.Eds., Fmoc Solid Phase Peptide Synthesis: A Practical Approach, Oxford University Press, New York, New York (2000); и Lloyd-Williams, P. et al. Chemical Approaches to the Synthesis of Peptides and Proteins (1997)), и могут быть очищены методами, известными специалистам, такими как жидкостная хроматография высокого давления. Молекулярная масса каждого пептида может быть подтверждена с помощью масс-спектроскопии, где каждый пептид имеет пик с соответствующей молекулярной массой. Эффективность отдельных пептидов и их комбинаций (например, комбинаций из 2 пептидов, комбинаций из 3 пептидов, комбинаций из 4 пептидов) в способах согласно изобретению может быть легко определена без излишнего экспериментирования в соответствии с процедурами, описанными в примерах, представленных в настоящей заявке. Предпочтительная комбинация содержит два пептида, при этом предпочтительное молярное отношение указанных пептидов может составлять от 50:50 (то есть 1:1) до 99,99-0,01, где указанное отношение может быть легко определено с применением процедур, описанных в примерах, представленных в настоящей заявке.
Предпочтительно, пептид MANS или его активный фрагмент присутствуют в фармацевтической композиции, которая может быть использована для блокирования воспаления. Настоящее изобретение также относится к способам ингибирования клеточного секреторного процесса у индивидуума, где указанный способ включает введение терапевтически эффективного количества соединения, содержащего пептид MANS или его активный фрагмент, ингибирующего медиатор воспаления у индивидуума. Такое введение обычно выбирают из группы, состоящей из местного введения, парентерального введения, ректального введения, внутрилегочного введения, введения путем ингаляции и интерназального введения или перорального введения, где указанное внутрилегочное введение обычно осуществляют с помощью аэрозоля, инсуффлятора, ингалятора с дозирующим клапаном или небулайзера .
Введение композиции, содержащей ингибирующее дегрануляцию количество пептида MANS или ингибирующее дегрануляцию количество его активного фрагмента, например фармацевтической композиции пептида MANS или его активного фрагмента, человеку или животному обеспечивает контактирование пептида MANS или его активного фрагмента, присутствующего по меньшей мере на участке, или в ткани или на ткани, или в слое или на слое, содержащем физиологическую жидкость, с поверхностью ткани, в которой присутствуют воспалительные гранулоцитарные клетки или в которую они проникают, что позволяет пептиду MANS или его активному фрагменту контактировать с воспалительной гранулоцитарной клеткой. В одном из аспектов изобретения, введение такой композиции может быть осуществлено при первых признаках или при первом обнаружении воспаления или при первом ощущении воспаления человеком или животным или при первом заметном изменении степени воспаления у человека или животного в целях ослабления воспаления, которое наблюдается в отсутствие пептида MANS или его активного фрагмента. В другом аспекте изобретения, такое введение может быть осуществлено в процессе воспаления ткани у человека или животного для ослабления уровня прогрессирования воспаления, которое происходит в отсутствие пептида MANS или его активного фрагмента. Хотя количество и частота вводимой дозы могут быть определены в соответствии с клинической оценкой и зависят от типа заболевания или источника воспаления, от степени поражения ткани и от возраста и массы пациента, однако предполагается, что доза фармацевтической композиции может быть снова введена через 3-8 часов, а предпочтительно через 6-8 часов после первого введения фармацевтической композиции.
Настоящее изобретение также относится к способам ослабления воспаления у индивидуума, где указанные способы включают введение терапевтически эффективного количества соединения, которое ингибирует MARCKS-ассоциированное высвобождение медиаторов воспаления, в результате чего уровень высвобождения по меньшей мере одного медиатора воспаления у индивидуума снижается по сравнению с уровнем, который наблюдается в отсутствие такой обработки. Используемый здесь термин «ослабление», по существу, означает уменьшение степени воспаления. Предпочтительно, высвобождение медиаторов воспаления ингибируется или блокируется описанными здесь способами.
В другом своем варианте, настоящее изобретение относится к способам ослабления воспаления у индивидуума, где указанные способы включают введение терапевтически эффективного количества соединения, которое ингибирует MARCKS-ассоциированное высвобождение медиаторов воспаления, в результате чего степень воспаления у индивидуума снижается по сравнению со степенью воспаления, наблюдаемой в отсутствие такой обработки. Настоящее изобретение также относится к способам ослабления или ингибированния воспаления у индивидуума, где указанные способы включают введение терапевтически эффективного количества пептида MANS или его активного фрагмента для ингибирования медиатора воспаления в зоне воспаления. Термин «ингибирование» означает снижение уровня секреции медиаторов воспаления. Термин «полное ингибирование» означает снижение уровня секреции медиаторов воспаления до нулевого значения. Как указывалось выше, активный фрагмент имеет длину по меньшей мере четыре, а предпочтительно, по меньшей мере шесть аминокислот. Термин «процесс экзоцитоза» означает экзоцитоз, то есть процесс клеточной секреции или экскреции, при котором вещества, содержащиеся в везикуле, присутствующей внутри клетки, высвобождаются из клетки путем слияния мембраны везикулы с внешней клеточной мембраной. Термин «дегрануляция» означает высвобождение содержимого клеточных гранул. Термин «ингибирование дегрануляции» означает снижение уровня высвобождения медиаторов воспаления, содержащихся в гранулах воспалительной клетки. Таким образом, количеством пептида MANS и/или его активного фрагмента, ингибирующим дегрануляцию, является количество этих пептидов, достаточное для снижения уровня высвобождения медиаторов воспаления, содержащихся в гранулах, по сравнению с уровнем высвобождения указанных медиаторов в отсутствие такого пептида.
В эталонном пептиде GAQFSKTAAKGEAAAERPGEAAVA (SEQ ID NO:1), начиная с N-конца: в положении 1 присутствует G; в положении, смежном с положением 1, в котором присутствует G, то есть в положении 2, присутствует А; в положении, смежном с положением 2, в котором присутствует А, то есть в положении 3, присутствует Q; в положении, смежном с положением 3, в котором присутствует Q, то есть в положении 4, присутствует F; в положении, смежном с положением 4, в котором присутствует F, то есть в положении 5, присутствует S; в положении, смежном с положением 5, в котором присутствует S, то есть в положении 6, присутствует K; в положении, смежном с положением 6, в котором присутствует K, то есть в положении 7, присутствует T; в положении, смежном с положением 7, в котором присутствует T, то есть в положении 8, присутствует А; в положении, смежном с положением 8, в котором присутствует A, то есть в положении 9, присутствует А; в положении, смежном с положением 9, в котором присутствует A, то есть в положении 10, присутствует K; в положении, смежном с положением 10, в котором присутствует K, то есть в положении 11, присутствует G; в положении, смежном с положением 11, в котором присутствует G, то есть в положении 12, присутствует E; в положении, смежном с положением 12, в котором присутствует E, то есть в положении 13, присутствует А; в положении, смежном с положением 13, в котором присутствует A, то есть в положении 14, присутствует А; в положении, смежном с положением 14, в котором присутствует A, то есть в положении 15, присутствует А; в положении, смежном с положением 15, в котором присутствует A, то есть в положении 16, присутствует E; в положении, смежном с положением 16, в котором присутствует E, то есть в положении 17, присутствует R; в положении, смежном с положением 17, в котором присутствует R, то есть в положении 18, присутствует P; в положении, смежном с положением 18, в котором присутствует P, то есть в положении 19, присутствует G; в положении, смежном с положением 19, в котором присутствует G, то есть в положении 20, присутствует E; в положении, смежном с положением 20, в котором присутствует E, то есть в положении 21, присутствует А; в положении, смежном с положением 21, в котором присутствует A, то есть в положении 22, присутствует А; в положении, смежном с положением 22, в котором присутствует A, то есть в положении 23, присутствует V; и в положении, смежном с положением 23, в котором присутствует V, то есть в положении 24, присутствует А, где положением 24 является С-концевое положение эталонного пептида.
«Вариант» эталонного пептида или вариант сегмента эталонного пептида, состоящего из 4-23 аминокислот, представляет собой пептид, который имеет аминокислотную последовательность, отличающуюся от аминокислотной последовательности эталонного пептида или от аминокислотной последовательности сегмента эталонного пептида, соответственно, по меньшей мере в одном положении аминокислоты аминокислотной последовательности эталонного пептида или сегмента эталонного пептида, соответственно, но при этом сохраняет муцин- или слизь-ингибирующую активность, которая обычно в 0,1-10 раз, предпочтительно, в 0,2-6 раз, а более предпочтительно, в 0,3-5 раз превышает указанную активность эталонного пептида или его сегмента, соответственно. «Вариант» эталонной аминокислотной последовательности или вариант сегмента эталонной аминокислотной последовательности, состоящей из 4-23 аминокислот, представляет собой аминокислотную последовательность, которая отличается от эталонной аминокислотной последовательности или от сегмента эталонной аминокислотной последовательности по меньшей мере на одну аминокислоту, соответственно, имеет аминокислотную последовательность пептида, которая сохраняет муцин- или слизь-ингибирующую активность кодируемой аминокислотной последовательности указанного эталонного пептида или сегмента, соответственно, где указанная активность обычно в 0,1-10 раз, предпочтительно, в 0,2-6 раз, а более предпочтительно, в 0,3-5 раз превышает активность указанного пептида или его сегмента эталонной последовательности, соответственно. Вариант пептида с заменой или вариант аминокислотной последовательности с заменой может отличаться от аминокислотной последовательности (то есть не совпадать с данной последовательностью) эталонного пептида или от эталонной аминокислотной последовательности одной или несколькими аминокислотными заменами, введенными в эталонную аминокислотную последовательность; вариант пептида с делецией или вариант аминокислотной последовательности с делецией может отличаться от аминокислотной последовательности (то есть не совпадать с данной последовательностью) эталонного пептида или от эталонной аминокислотной последовательности одной или несколькими аминокислотными делециями, введенными в эталонную аминокислотную последовательность; вариант пептида с добавлениями или вариант аминокислотной последовательности с добавлениями может отличаться от аминокислотной последовательности (то есть не совпадать с данной последовательностью) эталонного пептида или от эталонной аминокислотной последовательности одной или несколькими аминокислотными добавлениями, введенными в эталонную последовательность. Вариант пептида или вариант аминокислотной последовательности может быть получен в результате замены одной или нескольких аминокислот (например, замены по меньшей мере 1, 2, 3, 4, 5, 6, 7 или 8 аминокислот), введенной в эталонную последовательность, либо он может быть получен в результате делеции одной или нескольких аминокислот (например, по меньшей мере 1, 2, 3, 4, 5, 6, 7 или 8 аминокислот), введенной в эталонную последовательность, либо он может быть получен в результате добавления одной или нескольких аминокислот (например, по меньшей мере 1, 2, 3, 4, 5, 6, 7 или 8 аминокислот), введенной в эталонную последовательность, или их комбинаций в любом порядке. Вариант пептидного сегмента из 4-23 аминокислот с заменой или вариант последовательности сегмента из 4-23 аминокислот с заменой может отличаться от эталонного пептидного сегмента (то есть не совпадать с ним), состоящего из 4-23 аминокислот, или эталонной последовательности, состоящей из 4-23 аминокислот одной или несколькими аминокислотными заменами, введенными в эталонную последовательность аминокислотного сегмента; вариант пептидного сегмента из 4-23 аминокислот с делецией или вариант последовательности сегмента из 4-22 аминокислот с делецией может отличаться от эталонного пептидного сегмента (то есть не совпадать с ним) из 5-23 аминокислот или от эталонной аминокислотной последовательности сегмента из 4-23 аминокислот одной или несколькими аминокислотными делециями, введенными в эталонную последовательность аминокислотного сегмента; и вариант пептидного сегмента из 4-23 аминокислот с добавлением или вариант аминокислотной последовательности сегмента из 4-23 аминокислот с добавлением может отличаться от эталонного пептидного сегмента (то есть не совпадать с ним) из 4-22 аминокислот или от эталонной последовательности из 4-22 аминокислот одной или несколькими аминокислотными добавлениями, введенными в эталонную аминокислотную последовательность. Вариант пептида из 4-23 аминокислот или вариант аминокислотной последовательности из 4-23 аминокислот может быть получен в результате замены одной или нескольких аминокислот (например, замены по меньшей мере 1, 2, 3, 4, 5, 6, 7 или 8 аминокислот), введенной в сегмент эталонной аминокислотной последовательности из 4-23 аминокислот, либо он может быть получен в результате делеции одной или нескольких аминокислот (например, делеции по меньшей мере 1, 2, 3, 4, 5, 6, 7 или 8 аминокислот), введенной в соответствующую более крупную эталонную аминокислотную последовательность, либо он может быть получен в результате добавления одной или нескольких аминокислот (например, делеции по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8 аминокислот), введенной в соответствующую меньшую по размеру эталонную аминокислотную последовательность, либо он может быть получен в результате комбинированных модификаций. Предпочтительно, вариант пептида или аминокислотной последовательности отличается от эталонного пептида или от сегмента эталонного пептида, или эталонной аминокислотной последовательности, или от сегмента эталонной аминокислотной последовательности, соответственно, менее чем на 10 аминокислотных замен, делеций и/или добавлений, более предпочтительно, менее чем на 8 аминокислотных замен, делеций и/или добавлений, еще более предпочтительно, менее чем на 6 аминокислотных замен, делеций и/или добавлений, еще более предпочтительно, менее чем на 5 аминокислотных замен, делеций и/ил