Снижение количества в-клеток с использованием cd37-специфических и cd20-специфических связывающих молекул
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и иммунологии. Предложены варианты антитела, специфичного к CD37 человека, каждый из которых содержит вариабельный участок легкой и тяжелой цепи. Описана кодирующая нуклеиновая кислота и вектор экспрессии на ее основе. Раскрыты: клетка-хозяин, содержащая вектор, способ получения антитела с использованием клетки, а также композиция для снижения количества В-клеток и способ лечения заболеваний, связанных с аберрантной активностью В-клеток, с использованием СD37-специфических антител. Использование изобретения обеспечивает специфическую гибель 80% клеток BJAB при концентрации антитела 10 мкг/мл, а также увеличивает выживаемость мышей Daudi, по сравнению с обработкой ритуксимабом. Это может найти применение для лечения различных опухолей. 7 н. и 32 з.п. ф-лы, 52 ил., 7 табл.
Реферат
Настоящая заявка заявляет приоритет согласно §119 35 U.S.C. заявки на патент США № 60/702499, поданной 25 июля 2005 г., заявки на патент США № 60/798344, поданной 16 мая 2006 г., каждая из которых в полном объеме включена ссылкой.
Область техники, к которой относится изобретение
Настоящее изобретение в основном относится к способам снижения количества В-клеток у индивидуума с использованием CD37-специфических связывающих молекул. В частности, изобретение относится к способам снижения количества В-клеток с использованием только одних CD37-специфических связывающих молекул или комбинации CD37-специфических связывающих молекул и CD20-специфических связывающих молекул, в некоторых случаях синергической комбинации. Изобретение дополнительно относится к веществам и способам лечения заболеваний, включающих аномальную активность В-клеток.
Уровень техники
В обычной роли иммунная система человека защищает организм от повреждений в результате воздействия чужеродных веществ и патогенов. Один путь, посредством которого иммунная система защищает организм, заключается в продукции специализированных клеток, называемых В-лимфоцитами, или В-клетками. В-клетки продуцируют антитела, которые связываются с чужеродным веществом или патогеном и в некоторых случаях опосредуют его разрушение.
В то же время в некоторых случаях иммунная система человека и, в частности, В-лимфоциты иммунной системы человека становятся поврежденными и приводят к развитию заболевания. Существуют многочисленные злокачественные опухоли, патогенез которых включает неконтролируемую пролиферацию В-клеток. Также имеются многочисленные аутоиммунные заболевания, в развитии которых принимает участие продукция В-клетками антител, которые вместо связывания с чужеродными веществами и патогенами связываются с системами организма. Такие антитела в некоторых случаях называют аутоантителами. Кроме того, имеются многочисленные аутоиммунные и воспалительные заболевания, которые включают патологию В-клеток, например, в виде неадекватной презентации антигена В-клетками для Т-клеток, или других путей, в которых принимают участие В-клетки. Например, у мышей, склонных к аутоиммунным заболеваниям с дефицитом В-клеток, не происходит развития аутоиммунного заболевания почек, васкулита или продукции аутоантител. Смотри Shlomchic et al., J. Exp. Med., 180: 1295-306 (1994). Интересно, что у тех же мышей, склонных к аутоиммунным заболеваниям, которые имеют В-клетки, но с недостаточностью продукции иммуноглобулинов, происходит развитие заболеваний в эксперименте, как описано Chan et al., J. Exp. Med., 189: 1639-48 (1999), этот факт указывает на то, что В-клетки играют существенную роль в развитии аутоиммунных заболеваний.
В-клетки можно идентифицировать по молекулам на их клеточной поверхности. CD20 была первой человеческой дифференцировочной, специфической для В-клеток поверхностной молекулой, идентифицированной с помощью моноклональных антител. Она представляет собой негликозилированный, гидрофобный В-клеточный трансмембранный фосфопротеин массой 35 кДа, у которого оба - амино- и карбоксиконцы - расположены внутри клетки. Смотри Einfeld et al., EMBO J., 7: 711-17 (1998). CD20 экспрессируется всеми нормальными зрелыми В-клетками, но не экспрессируется предшественниками В-клеток или плазматическими клетками. Природные лиганды для CD20 не установлены, и полностью еще не понятна функция CD20 в биологии В-клеток.
Другой дифференцировочной, специфической для В-клеток поверхностной молекулой является CD37. CD37 представляет сильно гликозилированный белок массой 40-52 кДа, который относится к четырехмерному трансмембранному семейству клеточных поверхностных антигенов. Он пересекает клеточную мембрану четыре раза, образуя две внеклеточные петли и располагая свои амино- и карбоксиконцы в цитоплазме. CD37 интенсивно экспрессируется на нормальных продуцирующих антитела (slg+) В-клетках, но не экспрессируется на предшественниках В-клеток или плазматических клетках. Экспрессия CD37 на покоящихся и активированных Т-клетках, моноцитах и гранулоцитах является низкой, и отсутствует сколько-нибудь детектируемая экспрессия CD37 на природных клетках-киллерах, тромбоцитах или эритроцитах. Смотри Belov et al., Cancer Res., 61(11): 4483-4489 (2001); Schwartz-Albiez et al., J. Immunol., 140(3): 905-914 (1988) и Link et al., J. Immunol., 137(9): 3013-3018 (1988). Помимо нормальных В-клеток, почти все злокачественные клетки, производные В-клеток, являются позитивными на экспрессию CD37, включая CLL, NHL и волосатоклеточной лейкемии [Moore et al., Journal of Pathology, 152: 13-21 (1987); Merson and Brochier, Immunology Letters, 19: 269-272 (1988) и Faure et al., American Journal of Dermatopathology, 12(3) (1990)]. CD37 принимает участие в регуляции функции В-клеток, поскольку было установлено, что у мышей с отсутствием CD37 имеются низкие уровни IgG1 в сыворотке крови и нарушения у них гуморального ответа на вирусные антигены и модельные антигены. Оказалось, что он функционирует как неклассическая костимуляторная молекула или при непосредственном воздействии на презентацию антигена посредством образования комплекса с молекулами МНС класса II. Смотри Knobeloch et al., Mol. Cell Biol., 20(15): 5363-5369 (2000). Также вероятно, что CD37 играет роль в передаче сигналов TCR. Смотри Van Spriel et al., J. Immunol., 172: 2953-2961 (2004).
Проводили исследования и разрабатывали лекарственные препараты на основе концепции, что дифференцировочные, специфические для В-клеток поверхностные молекулы, такие как CD37 или CD20, могут сами представлять мишени для антител, которые будут связываться с ними и опосредовать разрушение В-клеток, приводящих к развитию злокачественных или аутоиммунных заболеваний, которые имеют на их поверхности CD37 или CD20. Названные средствами «иммунотерапии» антитела, полученные (или на основе полученных антител) на животных, отличных от человека, которые связываются с CD37 или CD20, вводили пациентам для истощения В-клеток, приводящих к развитию злокачественных или аутоиммунных заболеваний.
Одно антитело против CD37 метили 135I и проводили его тестирование в клинических испытаниях для лечения NHL. Смотри Press et al., J. Clin. Oncol., 7(3): 1027-1038 (1989); Bernstein et al., Cancer Res. (Suppl.), 50: 1017-1021 (1990); Press et al., Front. Radiat. Ther. Oncol., 24: 204-213 (1990); Press et al., Adv. Exp. Med. Biol., 303: 91-96 (1991) и Brown et al., Nucl. Med. Biol., 24: 657-663 (1997). Антитело, МВ-1, представляет собой мышиное моноклональное IgG1-антитело, у которого отсутствуют опосредуемые Fс эффекторные функции, такие как антителозависимая клеточная цитотоксичность (ADCC), и МВ-1 не подавляет рост опухолей на модели ксенотрансплантатов в условиях in vivo, если только в него не введена изотопная метка (Buchsbaum et al., Cancer Res., 52(83): 6476-6481 (1992)). Наблюдали благоприятное распределение 135I-МВ-1 у пациентов с лимфомой при низкой опухолевой нагрузке (<1 кг), и лечение данных пациентов приводило к полной ремиссии опухолей в течение 4-11 месяцев (Press et al., 1989 и Bernstein et al., 1990).
Кроме того, исследовали иммуноконъюгат, состоящий из лекарственного препарата адриамицина, связанного с G28-1, другим антителом против CD37, на мышах и наблюдали эффекты, проявляющиеся через интернализацию и внутриклеточное высвобождение препарата. Смотри Braslawsky et al., Cancer Immunol. Immunother., 33(6): 367-374 (1991).
Различные научно-исследовательские группы применяли антитела против CD20 для лечения связанных с В-клетками заболеваний. Один способ лечения состоит из применения антител против CD20, полученных в виде радионуклиодов, для лечения В-клеточной лимфомы (например, антител против CD20, меченных 131I), а также в виде меченных 89Sr для облегчения болей в костях, вызванных метастазами злокачественной опухоли простаты и молочной железы [Endo, Gan To Kagaku Ryoho, 26: 744-748 (1999)].
Другая группа исследователей разработала химерное моноклональное антитело против CD20, состоящее из вариабельных областей тяжелой и легкой цепей мышиного происхождения, слитых с константными областями тяжелой цепи человеческого IgG1 и человеческой легкой цепи каппа. Сообщалось, что химерное антитело сохраняло способность к связыванию с CD20 и способность опосредовать ADCC и фиксировать комплемент. Смотри Liu et al., J. Immunol., 139: 3521-26 (1987). Еще одно химерное анти-CD20-антитело было получено из IDEC гибридомы C2B8, и оно было названо ритуксимабом. Полагают, что механизм противоопухолевого действия ритуксимаба заключается в комбинации нескольких активностей, включая ADCC, фиксацию комплемента и «запуск» сигналов, способствующих апоптозу злокачественных В-клеток, хотя большой размер химерного антитела препятствует оптимальной диффузии молекулы в лимфоидные ткани, которые содержат злокачественные В-клетки, что ограничивает его противоопухолевую активность. ADCC представляет собой опосредуемую клетками реакцию, в которой неспецифические цитотоксические клетки, которые экспрессируют Fc-рецепторы (FcR) (например, природные клетки-киллеры (NK), нейтрофилы и макрофаги) распознают связанное антитело на клетке-мишени и затем вызывают лизис клетки-мишени. Фиксация комплемента или комплемент-зависимая цитотоксичность (CDC) представляет способность молекулы лизировать мишень в присутствии комплемента. Путь активации комплемента инициируется связыванием вначале первого компонента системы комплемента (C1q) c молекулой (например, антителом, связанным со «своим» антигеном). Большой размер молекулы ритуксимаба препятствует оптимальной диффузии молекулы в лимфоидные ткани, которые содержат злокачественные В-клетки, что ограничивает его противоопухолевую активность.
Как правило, ритуксимаб, вводимый в виде курса инфузий раз в 4 недели, в настоящее время применяют для лечения низких стадий лимфомы или фолликулярной не-ходжкинской лимфомы [McLaughlin et al., Oncology, 12: 1763-1777 (1998); Leget et al., Curr. Opin. Oncol., 10: 548-551 (1998)] и на стадиях рецидивирования III/IV фолликулярной лимфомы [White et al., Pharm. Sci. Technol. Today, 2: 95-101 (1999)]. Другие заболевания, поддающиеся лечению ритуксимабом, включают фолликулярную центральноклеточную лимфому (FCC), покровноклеточную лимфому (MCL), диффузную крупноклеточную лимфому (DLCL) и мелкоклеточную лимфоцитарную лимфому (SLL) [Nguyen et al., Eur. J. Haematol., 62: 76-82 (1999)]. Ритуксимаб, вводимый курсом инфузий раз в неделю, также применяют для лечения СLL [Lin et al., Sem. Oncol., 30: 483-92 (2003)].
Также антитела против CD20 использовали для лечения пациентов, страдающих аутоиммунными заболеваниями, ассоциированными с продукцией В-клетками аутоантител. Например, было показано, что ритуксимаб обладает высокой лечебной эффективностью в снижении количества CD20+ В-клеток у пациентов с аутоиммунными/воспалительными заболеваниями, включая RА [Edwards, N. Engl. J. Med., 350: 2546-2548 (2004); Cambridge et al., Arthritis Rheum., 48: 2146-54 (2003)]. Пациенты с RА в течение продолжительного времени получали метотрексат (МТХ) и курс инфузий ритуксимаба из 4 введений (Edwards, смотри выше). У данных пациентов отмечали повышенные реакции по оценочной шкале American College of Rheumatology (ACR) по сравнению с контрольными группами.
В испытаниях по оценке лечения системной красной волчанки (SLE) [Leandro et al., Arthritis Rheum., 46: 2673-2677 (2002)] пациентам вводили две инфузии с высокой дозой ритуксимаба, и было показано снижение числа В-клеток и улучшение состояния пациентов. Во втором исследовании для уменьшения числа В-клеток при SLE [Looney et al., Arthritis Rheum., 50: 2580-2589 (2004)] пациентам вводили одну инфузию в дозе 100 мг/м2 (низкая доза), одну инфузию в дозе 375 мг/м2 (промежуточная доза) или в виде 4 инфузий (с интервалом 1 неделя) в дозе ритуксимаба 375 мг/м2 (высокая доза). У данных пациентов наблюдали снижение количества В-клеток и улучшенную оценку состояния в баллах, но лечение не приводило к изменению уровня аутоантител. Были проведены испытания ритуксимаба при макроглобулинемии Вальденстрема [Treon et al., Immunotherap., 24: 272-279 (2000)], и у пациентов наблюдали повышение уровня гематокрита (НСТ) и количества тромбоцитов (PLT) после 4 инфузий ритуксимаба.
Недавние сообщения по оценке лечения ритуксимаба у пациентов, страдающих рассеянным склерозом, аутоиммунным заболеванием, поражающим центральную нервную систему, показали, что курс лечения приводит к истощению периферических В-клеток, но оказывает слабое действие на уровень В-клеток в спинномозговой жидкости. Смотри Monson et al., Arch. Neurol., 62: 258-264 (2005).
Дополнительные публикации, касающиеся применения ритуксимаба, включают: Stashi et al. «Rituximab chimeric anti-CD20 monoclonal antibody treatment for adults with chronic idiopathic thrombocytopenic purpura» Blood 98: 952-957 (2001); Matthews, R. «Medical Heretics» New Scientist (7 Apr., 2001); Leandro et al. «Clinical outcome in 22 patients with rheumatoid arthritis treated with В lymphocyte depletion» Ann. Rheum. Dis. 61: 833-888 (2002); Leandro et al. «Lymphocyte depletion in rheumatoid arthritis: early evidence for safety, efficacy and dose response. Arthritis and Rheumatism 44(9): S370 (2001); Leandro et al. «An open study of B lymphocyte depletion in systemic lupus erythematosus», Arthritis Rheum. 46: 2673-2677 (2002); Edwards et al. «Sustained improvement in rheumatoid arthritis following a protocol designed to deplete B lymphocytes» Rheumatology 40: 205-211 (2001); Edwards et al. «B-lymphocyte depletion in rheumatoid arthritis and other autoimmune disorders» Biochem. Soc. Trans. 30(4): 824-828 (2002); Edwards et al. «Efficacy and safety of rituximab, B-cell targeted chimeric monoclonal antibody: a randomised, placebo controlled trial in patients with rheumatoid arthritis» Arthritis Rheum. 46: S197 (2002); Levine et al. «IgM antibody-related polyneuropathies: B-cell depletion chemotherapy using rituximab» Neurology 52: 1701-1704 (1999); DeVita et al. «Efficacy of selective B-cell blockade in treatment of rheumatoid arthritis» Arthritis Rheum. 46: 2029-2033 (2002); Hidashida et al. «Treatment of DMARD-refractory rheumatoid arthritis with rituximab». Presented at Annual Scientific Meeting of the American College of Rheumatology; October 24-29; New Orleans, La. 2002; Tusca № et al. «Successful treatment of infliximab-refractory rheumatoid arthritis with rituximab». Presented at Annual Scientific Meeting of the American College of Rheumatology; October 24-29; New Orleans, La. 2002.
Проблемы, связанные с лечением ритуксимабом, остаются. Например, у большинства пациентов со злокачественными опухолями после лечения ритуксимабом возникают рецидивы, как правило, в течение 6-12 месяцев, и сообщалось о реакциях на инфузии препарата со смертельным исходом. Данные фатальные реакции развивались после проявления комплекса реакций на инфузию, включающего гипоксию, инфильтраты в легких, острый респираторный дистресс-синдром, инфаркт миокарда, фибрилляцию желудочков или кардиогенный шок. Также сообщалось об острой почечной недостаточности, для купирования которой требовался диализ, со случаями смертельного исхода при использовании синдрома лизиса опухоли после лечения ритуксимабом, с мукокожными реакциями, в некоторых случаях с фатальным исходом. Кроме того, для внутривенной инъекции требуются высокие дозы ритуксимаба, поскольку молекула является крупной, примерно 150 кДа, и, как уже отмечалось выше, проникновение в лимфоидные ткани, где находится большое количество опухолевых клеток, ограничено.
В результате того, что нормальные зрелые В-клетки также экспрессируют CD37 и CD20, количество нормальных В-клеток снижается под действием лечения антителами против CD37 (Press et al., 1989) или антителами против CD20 [Reff et al., Blood, 83: 435-445 (1994)]. Однако после окончания лечения нормальные В-клетки могут регенерироваться из предшественников В-клеток, негативных на CD37 и CD20; следовательно, у пациентов после лечения антителами против CD37 и CD20 отсутствует значительная иммуносупрессия.
Технология моноклональных антител и методы генной инженерии позволили получать молекулы иммуноглобулинов для диагностики и лечения заболеваний у человека. Инженерию белков применяли для повышения аффинности антитела для «своего» антигена со сведением до минимума проблем, связанных с иммуногенностью, и для изменения эффекторных функций антител. Структура домена иммуноглобулинов подвергается методам генной инженерии в том плане, что антигенсвязывающие домены и домены, ответственные за эффекторные функции, можно менять между иммуноглобулинами различных классов и подклассов. Обзор по структуре и функциям иммуноглобулинов приведен, например, у Harlow et al., Eds., Antibodies: a laboratory manual, chapter 14, Cold Spring Harbor Laboratory, Cold Spring Harbor (1988). Глубокое введение в эту проблему, а также подробную информацию почти обо всех аспектах рекомбинантной технологии антител можно найти в книге «Recombinant Antibodies» (John Wiley & Sons, NY, 1999). Исчерпывающее обобщение подробных лабораторных протоколов генной инженерии антител можно найти у R. Kontermann and S. Dubel (eds.) «The antibody engineering lab manual» (Springer Verlag, Heidelberg/New York, 2000).
Недавно были сконструированы более мелкие молекулы иммуноглобулинов для преодоления проблем, связанных с терапией целыми молекулами иммуноглобулинов. Одноцепочечные фрагменты Fv (scFv) содержат вариабельную область тяжелой цепи антитела, связанную коротким пептидом-линкером с вариабельной областью легкой цепи антитела [Huston et al., Proc. Natl. Acad. Sci. USA, 85: 5879-5883 (1988)]. В дополнение к вариабельным областям каждая из цепей антитела имеет одну или более константных областей. Легкие цепи имеют одну константную область. Таким образом, легкие цепи имеют одну вариабельную область и одну константную область. Тяжелые цепи имеют несколько константных областей. Тяжелые цепи в IgG-, IgA- и IgD-антителах имеют три константные области, обозначаемые CH1, CH2 и CH3, и тяжелые цепи в IgМ- и IgЕ-антителах имеют четыре константные области, обозначаемые CH1, CH2, CH3 и СН4. Таким образом, тяжелые цепи имеют одну вариабельную область и три или четыре константные области.
Также тяжелые цепи иммуноглобулинов можно разделить на три функциональные области: Fd-область (фрагмент, включающий VH и СН1, т.е. два N-концевых домена тяжелой цепи), шарнирную область и Fс-область («кристаллизуемый фрагмент», полученный из константных областей и образовавшийся после расщепления пепсином). Fd-область в комбинации с легкой цепью образует Fab («антигенсвязывающий фрагмент»). Поскольку антиген будет стереохимически взаимодействовать с антигенсвязывающей областью на аминоконце каждого Fab, молекула IgG является двухвалентной, т.е. она может связываться с двумя молекулами антигена. Fс содержит домены, которые взаимодействуют с рецепторами иммуноглобулина на клетках и с первоначальными элементами каскада комплемента. Таким образом, как правило, считается, что Fс-фрагмент ответственен за эффекторные функции иммуноглобулина, такие как связывание комплемента и связывание с Fс-рецепторами.
За счет небольшого размера молекул scFv они имеют очень высокий клиренс из плазмы крови и тканей и обладают более эффективным проникновением в ткани по сравнению с целыми молекулами иммуноглобулинов. У scFv с противоопухолевым действием имело место более быстрое проникновение в опухоль и более равномерное распределение в массе опухоли по сравнению с соответствующим химерным антителом [Yokota et al., Cancer Res., 52, 3402-3408 (1992)]. Слияние scFv с другой молекулой, такой как токсин, обладает преимуществом способности к специфическому связыванию с антигеном, а небольшой размер scFv способствует доставке токсина в ткань-мишень [Chaudary et al., Nature, 339: 394 (1989); Batra et al., Mol. Cell. Biol., 11: 2200 (1991)].
Несмотря на преимущества молекул scFv существует несколько недостатков при их применении. Несмотря на то что высокий клиренс scFv может привести к снижению токсических эффектов в нормальных клетках, такой высокий клиренс может препятствовать доставке минимально эффективной дозы в ткань-мишень. Ставится под сомнение производство адекватных количеств scFv для введения пациентам за счет трудностей, возникающих при экспрессии и выделении scFv, которые оказывают отрицательное влияние на выход продукта. Во время экспрессии молекулы scFv теряют стабильность и часто подвергаются агрегации за счет связывания вариабельных областей из разных молекул. Кроме того, уровни получения молекул scFv в экспрессирующих системах млекопитающих являются низкими, что ограничивает эффективное получение молекул scFv для применения в терапии [Davis et al., J. Biochem. Chem., 256: 10410-10418 (1990); Traunecker et al., EMBO J., 10: 3655-3659 (1991)]. Разрабатывали стратегии для повышения продукции, включая введение сайтов гликозилирования в вариабельные области [Jost, C.R., патент США № 5888773; Jost et al., J. Biol. Chem., 69: 26267-26273 (1994)].
Другим недостатком применения scFv для терапии является отсутствие у них эффекторной функции. scFv без проявления цитолитических функций, ADCC и комплемент-зависимой цитотоксичности (CDC), связанных с константной областью иммуноглобулина, могут быть не эффективными для лечения заболеваний. Несмотря на то что разработка технологии применения scFv началась более чем 12 лет тому назад, в настоящее время отсутствуют продукты на основе scFv, разрешенные для лечения.
Альтернативно было высказано предположение, что слияние scFv с другой молекулой, такой как токсин, может иметь преимущество специфической антигенсвязывающей активности, а небольшого размера scFv способствует доставке токсина к ткани-мишени. Chaudary et al., Nature, 339: 394 (1989); Batra et al., Mol. Cell. Biol., 11: 2200 (1991). Таким образом, конъюгация или слияние токсинов с scFv были предложены в качестве альтернативной стратегии для обеспечения эффективных, антиген-специфических молекул, но введение таких конъюгатов или химерных молекул может ограничиваться ввиду явления высокой и/или неспецифической токсичности за счет наличия группы токсина в таких препаратах. Токсические эффекты могут включать повышение активности ферментов печени выше физиологического уровня и сосудистый синдром, а также проявление других нежелательных эффектов. Кроме того, иммунотоксины сами по себе являются иммуногенными при введении хозяину, и антитела хозяина, продуцированные против иммунотоксинов, также будут ограничивать потенциальную применимость при повторных терапевтических курсах лечения.
Другие генно-инженерные рекомбинантные белки, называемые малыми модуляторными иммунофармацевтическими (SMIPTM) продуктами, описаны в совместных патентных публикациях США 2003/133939, 2003/0118592 и 2005/0136049 и совместных международных патентных публикациях WO02/056910, WO2005/037989 и WO2005/017148, которые включены здесь ссылкой. Продукты SMIPTM представляют собой новые, на основе связывающего домена иммуноглобулинов рекомбинантные белки, которые содержат связывающий домен для «своей» структуры, такой как антиген, противорецептор или тому подобное; шарнирную область полипептида IgG1, IgA или IgЕ или мутантную шарнирную область полипептида IgG1, содержащую ноль, один или два остатка цистеина; и области СН2 и СН3 иммуноглобулина. Продукты SMIPTM способны к проявлению ADCC и/или CDC.
Несмотря на то что проводились интенсивные исследования по терапии, основанной на применении антител, в данной области остается потребность в усовершенствованных способах лечения заболеваний, ассоциированных с аномальной активностью В-клеток. Описанные и заявленные здесь способы по настоящему изобретению обеспечивают такие усовершенствованные способы, а также их преимущества.
Сущность изобретения
Настоящее изобретение относится к способам снижения количества В-клеток с использованием CD37-специфических связывающих молекул. В некоторых способах по изобретению применение комбинаций CD37-специфических связывающих молекул (одной или более CD37-специфических связывающих молекул) и CD20-специфических связывающих молекул (одной или более CD20-специфических связывающих молекул) приводит к повышенному снижению количества В-клеток. В некоторых из данных способов комбинации являются синергическими. В близком аспекте изобретение относится к способу лечения индивидуума, имеющего заболевание или с подозрением на наличие заболевания, ассоциированного с аномальной активностью В-клеток.
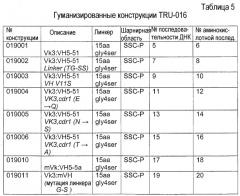
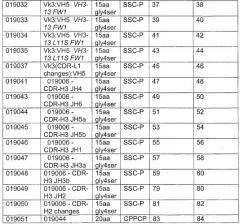
Также настоящее изобретение относится к гуманизированным CD37-специфическим связывающим молекулам (например, гуманизированным конструкциям TRU-016) и способам снижения количества В-клеток с использованием таких молекул. В некоторых вариантах осуществления способов по изобретению предусматривается применение комбинаций гуманизированных конструкций TRU-016 с одной или более CD37-специфическими связывающими молекулами. В другом аспекте изобретение относится к способам лечения индивидуумов, имеющих заболевание или с подозрением на наличие заболевания, ассоциированного с аномальной активностью В-клеток. Связанные аспекты изобретения относятся к способам профилактики любого такого заболевания и способам ослабления симптома, связанного с заболеванием, включающим введение дозы гуманизированной CD37-специфической связывающей молекулы, эффективной для лечения и профилактики такого заболевания или ослабления симптома такого заболевания.
«Аномальная активность В-клеток» относится к активности В-клеток, которая отличается от нормального, правильного или предполагаемого характера. Например, аномальная активность В-клеток может включать неадекватную пролиферацию клеток, ДНК или другие клеточные компоненты которых стали поврежденными или дефектными. Аномальная активность В-клеток может включать пролиферацию клеток, характеристики которой связаны с заболеванием, вызванным, опосредуемым или возникшим в результате неадекватно высоких уровней деления клеток, неадекватно низких уровней апоптоза или обоих факторов вместе. Для таких заболеваний может быть характерна, например, единичная или множественная локальная аномальная пролиферация клеток, групп клеток или ткани(й), независимо от того, являются они раковыми или не раковыми, доброкачественными или злокачественными. Аномальная активность В-клеток также может включать аномальную продукцию антител, такую как продукция аутоантител, или очень повышенную продукцию антител, как правило, желаемых при нормальных уровнях. Предполагается, что аномальная активность В-клеток может иметь место в некоторых субпопуляциях В-клеток и отсутствовать в других субпопуляциях. Также аномальная активность В-клеток может включать неадекватную стимуляцию Т-клеток, возникающую в результате неадекватной презентации В-клетками антигена для Т-клеток, или осуществляемую другими путями с участием В-клеток.
«Лечение» или «проведение лечения» относится к терапевтическому лечению или профилактическому/превентивному лечению. В результате терапевтического лечения может ослабиться, по меньшей мере, один симптом заболевания у индивидуума, получающего лечение, или может замедлиться прогрессирование заболевания у индивидуума, или оно может привести к предупреждению начала развития дополнительных связанных заболеваний.
«Терапевтически эффективная доза» или «эффективная доза» CD20-специфической связывающей молекулы относится к количеству соединения, достаточному для того, чтобы привести к ослаблению одного или более симптомов заболевания, которое лечится. По отношению к отдельному активному ингредиенту, вводимому одному, терапевтически эффективная доза относится к данному одному ингредиенту. По отношению к комбинации терапевтически эффективная доза относится к объединенным количествам активных ингредиентов, которые приводят к проявлению терапевтического эффекта, независимо от того, вводят их последовательно или одновременно. В изобретении, в частности, предусматривается, что одну или более специфических связывающих молекул можно вводить согласно способам по изобретению, каждую в эффективной дозе.
«Индивидуум, имеющий заболевание или с подозрением на наличие заболевания, ассоциированного с аномальной активностью В-клеток», представляет собой индивидуума, у которого заболевание или симптом нарушения могут быть вызваны аномальной активностью В-клеток, могут обостриться в результате аномальной активности В-клеток или могут ослабиться при соответствующей регуляции активности В-клеток. Примерами таких заболеваний является В-клеточное злокачественное заболевание (например, В-клеточная лимфома, В-клеточная лейкемия или В-клеточная миелома), заболевание, для которого характерна продукция аутоантител, или заболевание, характеризующееся несоответствующей презентацией антигена В-клетками для Т-клеток, или вызванное другими путями с участием В-клеток.
В одном примерном аспекте у индивидуума, подвергающегося лечению способами по изобретению, отмечается ответная реакция на лечение, которая сильнее или выше по сравнению с реакцией в ответ на лечение ритуксимабом. Реакция, которая является сильнее по сравнению с таковой, наблюдаемой при лечении ритуксимабом, относится к проявлению клинической ответной реакции, когда лечение способом по изобретению приводит к клинической ответной реакции у пациента, которая сильнее по сравнению с клинической ответной реакции у пациента, получающего лечение ритуксимабом, таким как ритуксан. Более высокая ответная реакция оценивается при сравнении клинических показателей, хорошо известных в данной области и описанных здесь. Примерные показатели включают, но не ограничиваются этим, продолжительность снижения количества В-клеток, снижение количества В-клеток в целом, снижение количества В-клеток в биологической пробе, уменьшение размера опухолей, уменьшение количества опухолей уже имеющихся и/или появляющихся после лечения, и более высокая ответная реакция по оценке самих пациентов и врачей, например, с использованием международного прогностического индекса. Улучшение может иметь место по одному или более чем одному клиническому показателю. Более сильная реакция при применении способа по изобретению может быть за счет неадекватной реакции на предшествующее или настоящее лечение ритуксимабом, например, в результате проявления токсичности и/или неадекватной эффективности лечения ритуксимабом.
В-клеточные злокачественные заболевания включают В-клеточные лимфомы [такие как различные формы болезни Ходжкина, не-ходжкинская лимфома (NHL) или лимфомы центральной нервной системы], лейкемии [такие как острая лимфобластная лейкемия (ALL), хроническая лимфоцитарная лейкемия (СLL), волосистоклеточная лейкемия и хроническая миелобластная лейкемия] и миеломы (такие как множественная миелома). Дополнительные В-клеточные злокачественные заболевания включают мелкоклеточную лимфоцитарную лимфому, В-клеточную пролимфоцитарную лейкемию, лимфоплазмоцитарную лимфому, лимфому маргинальной зоны селезенки, плазмоцитарную миелому, солитарную плазмоцитому костей, внекостную плазмоцитому, экстранодулярную В-клеточную лимфому маргинальной зоны, связанной со слизистой лимфоидной ткани (MALT), нодулярную В-клеточную лимфому маргинальной зоны, фолликулярную лимфому, покровноклеточную лимфому, диффузную крупноклеточную В-клеточную лимфому, крупноклеточную В-клеточную лимфому средостения (тимуса), внутрисосудистую крупноклеточную В-клеточную лимфому, первичную эффузионную лимфому, лимфому Беркитта/лейкемию, пролиферации В-клеток неопределенного злокачественного значения, лимфоматоидный грануломатоз и лимфопролиферативное нарушение после трансплантации.
Нарушения, характеризующиеся продукцией аутоантител, часто расценивают в качестве аутоиммунных заболеваний. Аутоиммунные заболевания включают, но не ограничиваются этим: артрит, ревматоидный артрит, юношеский ревматоидный артрит, остеоартрит, полихондрит, псориатический артрит, псориаз, дерматит, полимиозит/дерматомиозит, миозит с включениями, воспалительный миозит, токсический эпидермальный некролиз, системную склеродерму и склероз, синдром CREST, реакции, связанные с воспалительным заболеванием кишечника, болезнь Крона, язвенный колит, респираторный дистресс-синдром, респираторный дистресс-синдром взрослых (ARDS), менингит, энцефалит, увеит, колит, гломерулонефрит, аллергические состояния, экзему, астму, состояние с инфильтрацией Т-клеток и хронические воспалительные реакции, атеросклероз, аутоиммунный миокардит, недостаточность адгезии лейкоцитов, системную красную волчанку (SLE), подострую кожную красную волчанку, дискоидную волчанку, миелитную волчанку, энцефалитную волчанку, диабет с началом в юношеском возрасте, рассеянный склероз, аллергический энцефаломиелит, нейромиелит зрительного нерва, ревматическую лихорадку, хорею Сиденгама, иммунные реакции, связанные с гиперчувствительностью немедленного или замедленного типа, опосредуемые цитокинами и Т-лимфоцитами, туберкулез, саркоидоз, грануломатоз, включая грануломатоз Вегенера и болезнь Хуга-Штраусса, агранулоцитоз, васкулит (включая васкулит/ангиит при гиперчувствительности, ANCA и ревматоидный васкулит), апластическую анемию, анемию Диамонда-Блэкфана, иммунную гемолитическую анемию, включая аутоиммунную гемолитическую анемию (AIHA), пернициозную анемию, чистую аплазию эритроцитов (PRCA), недостаточность фактора VIII, гемофилию А, аутоиммунную нейтропению, панцитопению, лейкопению, заболевания с диапедезом лейкоцитов, воспалительные заболевания центральной нервной системы (ЦНС), синдром множественного повреждения органов, тяжелую псевдопаралитическую миастению, заболевания, опосредуемые комплексом антиген-антитело, антигломерулярное базальное мембранное заболевание, синдром антител против фосфолипидов, аллергический нейрит, болезнь Бехчета, синдром Кастельмана, синдром Гудпасчера, миастенический синдром Ламберта-Итона, синдром Рейно, синдром Шегрена, синдром Стивенса-Джонсона, отторжение трансплантата солидного органа, болезнь трансплантат против хозяина (GVHD), пемфигоид буллезный, пузырчатку, аутоиммунные полиэндокринопатии, серонегативные спондилоартропатии, болезнь Рейтера, синдром негнущегося человека, гигантоклеточный артериит, иммунный комплексный нефрит, опосредуемые IgА нефропатии, опосредуемые IgМ полинейропатии или опосредуемую IgМ нейропатию, идиопатическую тромбоцитопеническую пурпуру (ITP), тромбоцитопеническую тромбогемолитическую пурпуру (ТTP), пурпуру Геноха-Шенлейна, аутоиммунную тромбоцитопению, аутоиммунное заболевание семенников и яичников, включая аутоиммунный орхит и оофорит, первичный гипотиреоидизм, аутоиммунные эндокринные заболевания, включая аутоиммунный тиреоидит, хронический тиреоидит (тиреоидит Хашимото), подострый тиреоидит, болезнь Аддисона, болезнь Граве, аутоиммунные полижелезистые синдромы (или полижелезистые эндокринопатические синдромы), диабет типа I, также называемый сахарным инсулинозависимым диабетом (IDDM) и синдром Шихана, аутоиммунный гепатит, лимфоидную интерстициальную пневмонию (HIV), бронхолит (нетрансплантантный) против NSIP, синдром Гийена-Барре, васкулит крупных сосудов (включая ревматическую полимиалгию и гигантоклеточный артериит (Такасу), васкулит средних сосудов (включая болезнь Кавасаки и полиартеритнодозный), полиартерит (PAN), анкилозирующий спондилит, болезнь Бергера (опосредуемая IgА нефропатия), быстропрогрессирующий гломерулонефрит, первичный цирроз желчных протоков, брюшную спру (глютеновую энтеропатию), криоглобулинемию, криоглобулинемию, связанную с гепатитом, амиотрофический боковой склероз (ALS), заболевание коронарной артерии, семейную средиземноморскую лихорадку, микроскопический полиангиит, синдром Когана, синдром Вискотта-Олдрича и облитерирующий тромбоангиит.
Ревматоидный артрит (RA) представляет собой хроническое заболевание, характеризующееся воспалением суставов, приводящее к развитию отека, боли и потери функции. У пациентов с RA, как правило, в течение продолжительного периода времени имеет место прогрессирующая деструкция суставов, деформация, отсутствие трудоспособности и преждевременная смерть.
Болезнь Крона и близкое заболевание, язвенный колит, представляют два основных вида заболеваний, которые относятся к группе заболеваний, называемых воспалительным заболеванием кишечника (IBD). Болезнь Крона представляет хроническое заболевание, которое вызывает воспаление пищеварительного или желудочно-кишечного тракта (ЖКТ). Несмотря на то что оно может охватывать площадь ЖКТ от ротовой полости до ануса, чаще всего оно поражает тонкий кишечник и/или ободочную кишку. При язвенном колите поражение ЖКТ ограничивается ободочной кишкой.
Для болезни Крона могут быть характерны антитела против антигенов нейтрофилов, т.е. «перинуклеарные антитела против нейтрофилов» (pANCA), и Saccharomyces cervisiae, т.е. «антитела против Saccharomyces cervisiae» (ASCA). У многих пациентов с язвенным колитом имеются антитела pANCA в крови, но не антитела ASCA, в то время как у многих других пациентов с болезнью Крона имеются антитела ASCA, но антитела pANCA отсутствуют. Одним методом оценки болезни Крона является индекс активности болезни Крона (CDAI), основанный на 18 переменных баллах, собранных врачами. Значения CDAI, равные 150 и ниже, ассоциированы с заболеванием на стадии покоя; значения выше указывают на активную форму заболевания, и значения выше 450 имеют место при тяжелой форме заболевания [Best et al., «Development of a Crohn's disease activity index», Gastroenterology 70: 439-444 (1976)]. Однако в первоначальном исследовании некоторые исследователи применяют «субъективный показатель», равный 200-250, в качестве показателя состояния здоровья.
Системная красная волчанка (SLE) представляет собой аутоиммунное заболевание, вызванное рецидивирующими повреждениями кровеносных сосудов во многих органах, включая почки, кожу и суставы. У пациентов с SLE нарушенное взаимодействие Т-клеток и В-клеток приводит к продукции ауто