Способ определения концентрации нанобактерий в воде
Иллюстрации
Показать всеИзобретение относится к биотехнологии и микробиологии. Определяют количество нанобактерий в почечном камне человека. Отделяют от него фиксированную массу, механически размельчают до порошкообразного состояния и делят на j=5 весовых долей pj. Высыпают в j=5 стерилизованных сосудов, добавляют воду, пропущенную через фильтр с размером пор, не превышающим 0,05 мкм. Задают концентрации нанобактерий от 102 до 106 клеток в 1 мл, изменяя объем Vj воды или весовые доли pj порошкообразного минерального образования в каждом из сосудов с использованием формулы. Перемешивают и разливают в j измерительные ячейки. Добавляют питательную среду - фетальную плодовую сыворотку теленка в соотношении 1:9. В каждую ячейку вводят два электрода, затем помещают измерительные ячейки со смесью в автоклав, в котором поддерживают постоянную температуру в диапазоне 30°С≤Т≤40°С. Периодически измеряют импеданс смеси (R) и определяют момент времени измерения (t) до тех пор, пока не начнет наблюдаться резкое падение импеданса смеси. Строят калибровочный график зависимости времени изменения импеданса (tимпj) от концентрации нанобактерий в исходной пробе (lgnj). После чего для исследуемой воды также проводят вышеуказанные этапы способа. Полученные значения времени импеданса (tимпj) проецируют на калибровочный график зависимости на ось (tимпj), затем на ось (lgnj). Изобретение позволяет определить концентрацию нанобактерий в воде (nк). 3 ил.
Реферат
Изобретение относится к области контроля качества воды, в частности питьевой, и может быть использовано в экологических службах, санэпидстанциях, в медицинских учреждениях для осуществления объективного и достоверного санитарно-микробиологического анализа питьевой воды, а также для обеспечения безопасности и безвредности воды в централизованных системах питьевого водоснабжения, для соблюдения гигиены и санитарии и для принятия мер по предотвращению попадания с водой нанобактерий в организм человека и животных. Нанобактерии относятся к α 2 подгруппы протеобактерий аналогов Brucella, Bartonella. Эти бактерии открыты Робертом Фольком в конце прошлого столетия. Они имеют самый наименьший размер из всех известных в настоящее время видов и родов бактерий, лежащий в диапазоне от десятка до сотен нанометров. За свой малый размер этот вид протеобактерий получил название нанобактерий.
Этот вид бактерий вызывает многие заболевания у человека и животных [1].
Известен способ контроля минеральных образований на наличие в них бактерий, например, в почечных, зубных камнях человека и животных [1].
Способ основан на том, что контролируемый твердый минерал, например зубной камень человека, после специальной подготовки помещают в электронный микроскоп, где идентифицируют нанобактерии по их овальной форме и размерам и затем подсчитывают их количество в 1 см3, определяя таким образом их концентрацию в исследуемом минерале. Способ является достоверным и точным.
Его основной недостаток состоит в том, что его можно применять для контроля количества нанобактерий только в твердых минералах. Контролировать же количество и концентрацию нанобактерий в жидких средах, например в воде, таким способом невозможно.
Наиболее близким к заявляемому способу является способ определения концентрации нанобактерий в воде [2].
По способу-прототипу воду набирают в пенициллиновые простерилизованные флаконы емкостью в 20 мл, пропускают через ультрапористый фильтр с диаметром пор не более 0,2 мкм. К фильтрату добавляют 2 мл 10%, также пропущенного через ультрапористый фильтр, раствора молибденово-кислого аммония. Исследуемую воду выдерживают в течение 8-10 часов при комнатной температуре. Для подсчета нанобактерий в 1 мл питьевой воды используется широко применяемый в медицине подсчет форменных элементов в счетной камере с использованием, например, сетки Горяева.
С помощью смесителя для эритроцитов емкостью в 1,0 мл набирают 1,0 мл фильтрата питьевой воды и помещают ее под счетную камеру с сеткой Горяева. Подсчет ведется в 5 больших квадратах. Площадь малого квадрата равна 1/400 мм2. Объем малого квадрата равен 1/4000 мм3. Большой квадрат состоит из 16 малых квадратов. Высота камеры равна 1/10 мм и соответствует объему 16 малых квадратов.
Подсчитывают все клетки с нанобактериями, расположенные внутри квадрата, кроме того, суммируя их с количеством тех нанобактерий, у которых больше половины размера попадает в клетки квадрата. Клетки, лежащие частью больше, чем половина их размера вне квадрата, не учитываются. Лучшие результаты дает подсчет нанобактерий в 5 больших квадратах в разных частях сетки Горяева, что позволяет уменьшить неточность от неравномерного распределения нанобактерий.
Подсчет числа нанобактерий в 1,0 мл воды ведется с использованием световой микроскопии, например, на микроскопе Biolam (Ломо), в диапазоне увеличения 900-1600.
Недостатком способа-прототипа является низкая точность и достоверность определения концентрации нанобактерий.
Эти недостатки обусловлены тем, что не имеется достаточно убедительных доказательств того, что под оптическим микроскопом, который не позволяет идентифицировать нанобактерии в капле воды, подсчитываются именно нанобактерии, а не некоторые взвешенные механические или органические частицы, прошедшие через ультрапористый фильтр.
Цель данного изобретения состоит в разработке достоверного и точного способа определения концентрации нанобактерий в питьевой воде.
Это достигается тем, что в способе определения концентрации нанобактерий в питьевой воде, включающем в себя пропускание воды через ультрапористый фильтр, предварительно используя электронный микроскоп, при увеличении, например, в 5 тыс. раз, выбирают минеральное образование, состоящее из колоний нанобактерий, отделяют от упомянутого минерального образования из почечного камня человека некоторую фиксированную массу, например в 10 мг, определяют количество нанобактерий в единице веса или в единице объема упомянутого минерального образования, механически размельчают это минеральное образование до порошкообразного состояния, затем делят размельченное минеральное образование на j=5 разных весовых долей pj и высыпают эти доли j=5 в стерилизованные сосуды, добавляют питьевую воду, пропущенную через фильтр с размером пор, не превышающим 0,05 мкм, задают концентрации нанобактерий от 102 до 106 в 1 мл, изменяя объем воды Vj или весовые доли pj порошкообразного минерального образования в каждом из сосудов с использованием формулы
,
где nj - заданная концентрация нанобактерий в каждом j-м образце воды, клеток/мл,
pj - вес минерального образования, засыпанного в j-й стерилизованный сосуд, г,
nm - количество нанобактерий в 1 грамме минерала, клеток/г,
Vj - объем образца воды, мл.
После разлива воды в каждую из j измерительных ячеек, с размером ячеек, например, 2×2×3 см, добавляют питательную среду, в качестве которой используют фетальную плодовую сыворотку (теленка) в соотношении 1:9, в каждую ячейку вводят два электрода в виде пластин из неокисляющегося электропроводного материала, например нержавеющей стали, шириной, например, 1 см, установленных друг от друга на фиксированном расстоянии, например в 10 мм, помещают измерительные ячейки со смесью в автоклав, в котором поддерживают постоянную температуру Т в диапазоне 30°С≤Т≤40°С, затем периодически, например через каждый час, измеряют импеданс смеси (R) и определяют момент времени измерения (t) до тех пор, пока не начнет наблюдаться резкое падение импеданса смеси, фиксируют этот момент времени (tимпj), затем строят калибровочный график зависимости времени изменения импеданса (tимпj) от концентрации нанобактерий в исходной пробе (lgnj), после чего исследуемую воду также пропускают через ультрапористый фильтр с диаметрами пор 0,22≤d≤<0,25 мкм, смешивают исследуемую воду с питательной средой, в качестве которой используют фетальную плодовую сыворотку (теленка) в соотношении 1:9, и полученную смесь заливают в измерительные ячейки, в каждую измерительную ячейку вводят два электрода из неокисляющегося электропроводного материала, например нержавеющей стали, в виде пластин шириной, например, 1 см, установленных друг от друга на фиксированном расстоянии, например в 10 мм, помещают измерительные ячейки со смесью в автоклав, в котором поддерживают постоянную температуру Т в диапазоне 30°С≤Т≤40°С, затем периодически, например через каждый час, измеряют импеданс смеси (R) и определяют момент времени измерения (t) до тех пор, пока не начнет наблюдаться резкое падение импеданса смеси, фиксируют этот момент времени (tимпj), после чего из калибровочного графика зависимости путем проекции значений времени импеданса на ось (tимпj), затем на ось (lgnj) определяют концентрацию нанобактерий в водопроводной воде nк.
При реализации заявляемого способа размер пор фильтра выбирают исходя из того, что диаметры нанобактерий лежат в диапазоне 0,05≤d≤0,22 мкм [3]. При этом если выбрать фильтр с диаметром пор менее чем 0,22 мкм, то не все нанобактерии из контролируемой воды попадут в стерилизованные сосуды. Если выбрать фильтр диаметром пор более чем 0,25 мкм, то в стерилизованные сосуды попадут не только нанобактерии, но и другие виды бактерий, так как размер остальных известных бактерий, значительно больше 0,25 мкм. Поэтому через фильтр с диаметрами пор d, лежащими в диапазоне 0,22≤d≤0,25 мкм, могут пройти только нанобактерии, остальные же микроорганизмы будут отфильтрованы.
В качестве примера приведем способ контроля концентрации нанобактерий в питьевой воде, взятой из крана и пропущенной через ультрапористый фильтр для микробиологических целей, с размером пор, лежащим в диапазоне 0,22≤d≤0,25 мкм.
Для фильтрования жидкостей с частицами размером от 10-1 до 10-3 мкм нами использовались разнообразные фильтры из ультрапористых материалов - мембранные, целлафильные, ультратонкие фильтры, изготовленные из специально обработанной нитроцеллюлозы и ацетилцеллюлозы (целлофана). Результаты во всех случаях были аналогичны. Это позволяет сделать вывод о том, что состав фильтра не оказывает существенного влияния на реализацию заявляемого способа.
В качестве минерального образования, содержащего нанобактерии, можно было взять любые минеральные образования, состоящие из колоний нанобактерий, например, зубные, почечные, желчные камни или иные образования, содержащие нанобактерии [3].
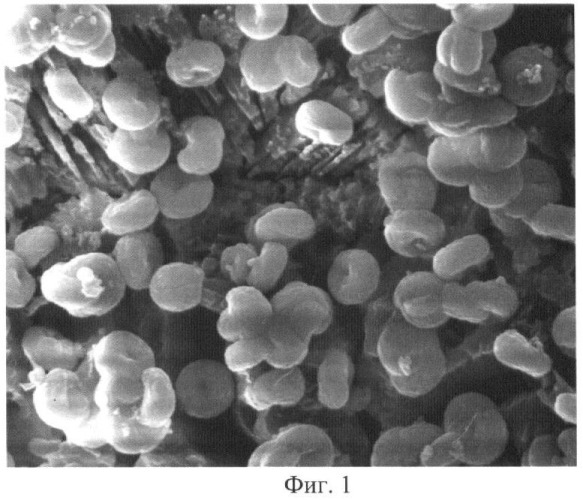
Нами был взят один из нескольких почечных камней человека. В том, что взятое минеральное вещество состоит из колоний нанобактерий, убедились, предварительно исследовав частичку почечного камня под электронным микроскопом Philips-SEM-515.
На фиг.1 изображена фотография фрагмента поверхности почечного камня, снятая при помощи электронного микроскопа.
При увеличении под электронным микроскопом в 5 тысяч раз мы по форме и размерам идентифицировали нанобактерии, а также одновременно с этим определили и их концентрацию nm в выбранном почечном камне.
Определение концентрации нанобактерий в почечном камне осуществлялось с помощью электронного микроскопа. Для этого на исследуемой поверхности почечного камня выделялся квадрат со стороной а (в нашем случае мы выбирали а=0,1 мм=10-2 см). Подсчитывали количество нанобактерий Ns в квадрате размером а2 (в нашем случае эта величина была равной Ns=155). Вдоль одной стороны квадрата с площадью а2 размещается нанобактерий. В элементарном кубе размером а3 количество нанобактерий В нашем случае Nv=155×12,44≅1,92×103 нанобактерий. В единице объема зубного камня находится nv нанобактерий (в нашем случае клеток/см. В 1 грамме почечного камня будет содержаться нанобактерий, где d - плотность почечного камня, г/см3. В нашем случае плотность почечного камня была равна d=1,2 г/см3, клеток/г.
Нанобактерии имели характерную для них сфероидную форму и характерный для них диаметр 0,05-0,2 мкм. Размеры всех остальных известных бактерий значительно превышают эти величины. После того как при помощи электронного микроскопа было достоверно доказано наличие колоний нанобактерий в выбранном почечном камне и определена их концентрация nm, которая оказалась равной 1,6×109 нанобактерий в 1 грамме, от почечного камня человека отделили 10 миллиграмм. С помощью механического воздействия (фарфоровой ступы) измельчили этот минерал до порошкообразного состояния и разделили его на j=5 разных весовых частей, равных соответственно p1=0,1 мг; p2=0,6 мг; р3=1,3 мг; р4=3 мг; р4=5 мг, и высыпали эти дозы в j=5 стерилизованных сосудов.
Количество простерилизованных сосудов j, используемых в дальнейшем для построения калибровочного графика, должно быть не меньше 5, так как при меньшем числе точек, по которым строится любой, в том числе и калибровочный график, невозможно корректно построить кривую.
В сосуды с порошком минерального состава залили различные объемы Vj воды, пропущенной через ультрапористый фильтр с размером пор, не превышающим 0,05 мкм.
Такой размер пор выбран для предотвращения попадания дополнительного количества нанобактерий в образцы воды, разлитой в стерилизованные сосуды, так как размер диаметров нанобактерий лежит в диапазоне от 0,05 до 0,2 микрометра [3]. Затем мы задались различными концентрациями nj нанобактерий в диапазоне значений 102≤nj≤106 (n1=102 клеток/мл; n2=103 клеток/мл; n3=104 клеток/мл; n4=105 клеток/мл; n5=106 клеток/мл). Для получения таких концентраций в разные сосуды были залиты различные объемы воды Vj, которые определили, используя выражение
,
где nj - заданная концентрация нанобактерий в каждом j-м образце воды, клеток/мл,
pj - вес минерального образования, засыпанного в j-й стерилизованный сосуд, г,
nm - количество нанобактерий в 1 грамме минерала, клеток/г,
Vj - объем образца воды, мл.
Они оказались равными соответственно V1=1,6×103 мл; V2=9,6×102 см3; V3=2,08×102 мл; V4=4,8×10 мл; V5=8 мл.
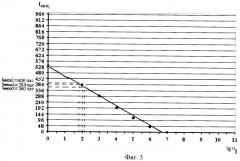
После подготовки образцов воды с различными концентрациями нанобактерий в них эти образцы смешивались с питательной для нанобактерий средой, в качестве которой используют фетальную плодовую сыворотку (теленка) в соотношении объемных частей, равном 1:9. Затем полученные смеси разливали в измерительные ячейки, которые были выполнены в виде одинаковых прямоугольных ванночек из диэлектрического материала (стекла) размером 2×2×3 см, вводили в каждую измерительную ячейку два электрода, установленных друг от друга на фиксированном расстоянии, равном 10 мм. Электроды были выполнены в виде пластин шириной 1 см из нержавеющей стали. Был измерен импеданс смесей, попавших в промежуток между электродами. После этого измерительные ячейки помещали в автоклав и устанавливали в нем постоянную температуру Т=37°С, а затем периодически через 1 час измеряли импеданс смеси, находящейся между электродами, и момент времени измерения. Процедуру измерений импеданса и времени осуществляли до тех пор, пока не начинало наблюдаться резкое падение импеданса смеси. Это время в каждой из 5 измерительных ячеек было разным. В ячейке №1, где концентрация нанобактерий была равна n1=102 клеток/мл, это время tимп1 было равно 384 час, В ячейке №2, где концентрация нанобактерий была равна n2=103 клеток/мл, это время tимп2 было равно 288 час. В ячейке №3, где концентрация нанобактерий была равна n3=104 клеток/мл, это время tимп3 было равно 192 час. В ячейке №4, где концентрация нанобактерий была равна n4=105 клеток/мл, это время tимп4 было равно 120 час. В ячейке №5, где концентрация нанобактерий была равна n5=106 клеток/мл, это время tимп5 было равно 48 час. По этим данным был построен калибровочный график (фиг.3). Эти данные обозначены на фиг.3 черными точками.
Изменения импеданса происходят в питательной среде по мере того, как ее химический состав преобразуется в результате роста и метаболической активности микроорганизмов. Под действием микроорганизмов заряженные конечные продукты метаболизма выделяются в ростовую среду. В основном незаряженные или слабозаряженные субстраты превращаются в сильнозаряженные конечные продукты: белки утилизируются до аминокислот, углеводы и жиры - до органических кислот и т.д. Образующиеся метаболиты имеют меньший размер и, таким образом, более подвижны. Эти электрохимические процессы приводят к существенным изменениям импеданса. Когда количество микроорганизмов достигает порога около 106-107 клеток/мл, наблюдаются экспоненциальные изменения импедансного сигнала. Концентрация нанобактерий, равная 10-10, при которой происходит экспоненциальное изменение импедансного сигнала, может быть определена из калибровочного графика (см. фиг.3) по точке пересечения упомянутого графика с осью lgnj.
Время, необходимое для достижения значимого изменения импеданса, называется временем определения импеданса (tимпj). Значение (tимпj) обратно пропорционально начальной концентрации нанобактерий в исследуемой пробе. Ход кривых импедансного сигнала соответствует и отражает кривую роста нанобактерий в исследуемой пробе.
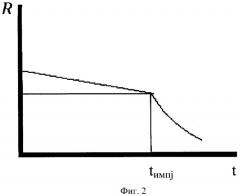
Для пояснения сущности изобретения на фиг.2 приведен качественный график зависимости импеданса смеси от времени t, нахождения нанобактерий в питательной смеси.
Как следует из графика на фиг.2, импеданс смеси в течение достаточно продолжительного времени изменяется очень медленно. Затем, когда количество микроорганизмов достигает порога около 106-107 клеток/мл, наблюдаются экспоненциальные изменения импедансного сигнала. Крутизна наклона зависимости импеданса смеси с некоторого момента времени tимпj резко изменяется.
Под временем резкого падения импеданса смеси понимали точку на графике зависимости импеданса смеси от времени, начиная с которой крутизна графика зависимости импеданса от времени резко изменялась (см. фиг.2).
После определения моментов tимпj времен импеданса для каждой из выбранных концентраций нанобактерий в пробах воды строили калибровочный график зависимости логарифма числа нанобактерий в исходный момент времени lgnj от времени определения импеданса tимпj в исходной пробе j (см. фиг.3). Процедура построения калибровочного графика описана выше.
После построения калибровочного графика контролируемую питьевую воду также пропускали через ультрапористый фильтр с диаметрами пор d, лежащими в диапазоне 0,22≤d≤0,25 мкм. Смешивали такой же фиксированный объем этой питьевой воды, равный в 1 мл, с питательной средой для нанобактерий, в качестве которой используют фетальную плодовую сыворотку (теленка), в тех же объемных соотношениях, что и при построении калибровочного графика, то есть 1:9. Полученную смесь заливали в три аналогичные измерительные ячейки размером 2×2×3 см и вводили в них два электрода, установленных друг от друга на фиксированном расстоянии, равном 10 миллиметрам. Электроды были выполнены в виде пластин из нержавеющей стали шириной 1 см. В каждой из ванночек измеряли импеданс смеси, попавшей в промежуток между электродами. Периодически через 1 час измеряли импеданс смеси в каждой из трех ванночек, находящейся между электродами, и момент времени измерения импеданса. Данную процедуру производили до тех пор, пока не начало наблюдаться резкое падение импеданса смеси. Фиксировали эти моменты во всех трех ванночках tимпк времени. Они оказались равными соответственно tимпк1=408 час; tимпк2=384 час, tимпк3=360 час. Затем из калибровочного графика зависимости по значению времени tимпк1, tимпк2, tимпк3 определяли количество нанобактерий в контролируемой питьевой воде nк1, nк2, nк3. Определение этих величин по калибровочного графика осуществлялось путем проекции значений tимпк1=408 час; tимпк2=384 час, tимпк3=360 час на калибровочный график и затем на ось lgnj (см. фиг.3, пунктирные линии). Они оказались равными nк1=1,9×102 клеток/мл; nк2=2×102 клеток/мл; nк3=2,1×102 клеток/мл соответственно.
Для сравнения результатов определения концентрации нанобактерий по заявляемому способу со способом-прототипом из той же контролируемой питьевой воды были взяты 3 дозы объемом 1 мл и помещены под световой Biolam (Ломо). Подсчет предполагаемых нанобактерий осуществляли с использованием сетки Горяева при увеличении 1600.
Из всех 80 малых квадратов (содержащихся в 5 больших квадратах) было получено в первом образце воды 15 точек (предположительно нанобактерий), во втором образце воды было подсчитано 600 точек (предположительно нанобактерий), а в третьем образце воды было подсчитано 200 точек (предположительно нанобактерий). Определение концентрации nj в 1 мл предполагаемых нанобактерий по способу-прототипу дало следующие результаты:
n1=15:80×4000=750 клеток/мл;
n2=500:80×4000=30000 клеток/мл;
n3=200:80×4000=10000 клеток/мл.
Т.е. все три образца одной и той же питьевой воды при контроле по способу- прототипу показали разный результат, и ни один из этих результатов не совпал с истинным значением концентрации нанобактерий, определенных по заявляемому способу
Таким образом, заявляемый способ определения концентрации нанобактерий, по сравнению со способом-прототипом имеет высокую достоверность и точность определения концентрации нанобактерий.
Источники информации
1. В.Т.Волков, Г.В.Смирнов, Н.Н.Волкова, Медведев М.А. НАНОБАКТЕРИЯ» (перспективы исследований)// г.Томск, изд. Твердыня», 2003 г., 359 с., ил.
2. В.Т.Волков, Г.В.Смирнов, Н.Н.Волкова, Ю.И.Сухих. «Болезни биоминерализации» (новейшая экология) / г.Томск, Издательский дом «Тандем-Арт», 2004 г., с.361-364.
3. Д.Г.Смирнов. Нанобактерии - как биоиндикатор экологического неблагополучия среды или заболевания человека // Известия ТПУ, 2006, №8, с.45-50.
Способ определения концентрации нанобактерий в воде(nк), заключающийся в пропускании воды через ультрапористый фильтр, характеризующийся тем, что предварительно выбирают минеральное образование из почечного камня человека, состоящее из колоний нанобактерий, отделяют от него фиксированную массу, определяют количество нанобактерий в единице веса минерального образования, механически размельчают это минеральное образование до порошкообразного состояния, делят размельченное минеральное образование на j=5 весовых долей pj, высыпают в j=5 стерилизованных сосудов, добавляют воду, пропущенную через фильтр с размером пор, не превышающих 0,05 мкм, задают концентрации нанобактерий от 102 до 106 клеток в 1 мл, изменяя объем Vj воды или весовые доли pj порошкообразного минерального образования в каждом из сосудов с использованием формулы: где nj - концентрация нанобактерий в каждом j-м образце воды, кл/мл;pj - вес минерального образования, помещенного в j-й образец воды, г;nm - количество нанобактерий в 1 г минерала, клеток/г;Vj - объем образца воды, мл,затем перемешивают их содержимое и разливают в j измерительные ячейки, добавляют питательную среду, в качестве которой используют фетальную плодовую сыворотку теленка в соотношении 1:9, в каждую ячейку вводят два электрода в виде пластин из неокисляющегося электропроводного материала, установленных друг от друга на фиксированном расстоянии, помещают измерительные ячейки со смесью в автоклав, в котором поддерживают постоянную температуру в диапазоне 30°С≤Т≤40°С, затем периодически измеряют импеданс смеси (R) и определяют момент времени измерения (t) до тех пор, пока не начнет наблюдаться резкое падение импеданса смеси, фиксируют этот момент времени (tимпj), затем строят калибровочный график зависимости времени изменения импеданса (tимпj) от концентрации нанобактерий в исходной пробе (lgnj), после чего исследуемую воду также пропускают через ультрапористый фильтр с диаметрами пор 0,22≤d≤0,25 мкм, смешивают исследуемую воду с питательной средой, в качестве которой используют фетальную плодовую сыворотку теленка в соотношении 1:9, полученную смесь заливают в измерительные ячейки, в каждую измерительную ячейку вводят два электрода в виде пластин из неокисляющегося электропроводного материала, установленных друг от друга на фиксированном расстоянии, помещают измерительные ячейки со смесью в автоклав, в котором поддерживают постоянную температуру в диапазоне 30°С≤T≤40°С, затем периодически измеряют импеданс смеси (R) и определяют момент времени измерения (t) до тех пор, пока не начнет наблюдаться резкое падение импеданса смеси, фиксируют этот момент времени (tимпj), после чего из калибровочного графика зависимости путем проекции значений времени импеданса на ось (tимпj), затем на ось (lgnj), определяют концентрацию нанобактерий в воде (nк).