Спектрофотометрический способ определения антирадикальной активности низкомолекулярных антиоксидантов в экстрактах пищевых и лекарственных растений
Иллюстрации
Показать всеИзобретение относится к области исследования биологических материалов, а именно к спектрофотометрическим способам определения антирадикальной активности экстрактов пищевых и лекарственных растений. Способ содержит измельчение растений, экстракцию этанолом спирторастворимых компонентов, центрифугирование смеси и декантацию спиртового экстракта, приготовление серии спиртовых растворов экстракта при различном разведении и раствора ДФПГ в этаноле; смешивание полученных растворов в соотношении, при котором концентрация ДФПГ в смеси равна 10-5÷10-4 моль/л и определение коэффициента разбавления исходного экстракта, соответствующего концентрации антиоксидантов ЕС50; приготовление рабочего раствора соляной кислоты в этаноле, смешивание его с раствором ДФПГ и экстракта в соотношении, при котором концентрация соляной кислоты в реакционной системе равна 1÷10 ммоль/л, концентрация ДФПГ - равна таковой в опыте по определению коэффициента разбавления, соответствующего ЕС50, а концентрация антиоксидантов равна 0,5÷2,0·ЕС50, регистрируют кинетические кривые падения оптической плотности полученных смесей при длине волны облучения, равной 515÷520 нм, определение начальной скорости реакции антиоксидантов с ДФПГ, сравнивают полученный результат с таковыми, полученными для других экстрактов при одинаковых значениях температуры реакционной среды и начальных концентраций всех компонентов. Способ обеспечивает максимальное приближение условий исследования к реальным процессам, протекающим в клеточных мембранах. 5 ил., 2 табл.
Реферат
Изобретение относится к области использования спектрофотометров для анализа и исследования биологических материалов, а именно к спектрофотометрическим способам определения антирадикальной активности экстрактов пищевых и лекарственных растений.
Известен спектрофотометрический способ определения антирадикальной активности антиоксидантов (Silva В.A., Ferreres F, Malva J.O., Dias A.C.P. // Food Chemistry., 2005, v.90, N.1-2, P.157-167, прототип), содержащий:
- приготовление серии спиртовых растворов экстракта при различном разведении;
- приготовление раствора 2,2-дифенил-1-пикрилгидразила (ДФГТГ) в этаноле;
- смешивание спиртового экстракта растений с раствором ДФПГ;
- регистрацию изменения оптической плотности раствора во времени.
Недостатки известного способа:
- реакция низкомолекулярных антиоксидантов с ДФПГ в полученной смеси протекает настолько быстро, что фиксация изменения оптической плотности на начальных стадиях реакции невозможна;
- не может быть определена начальная скорость реакции;
- параметр, характеризующий антирадикальную активность антиоксидантов (АО), некорректен, поскольку слабо с ней связан: он соответствует отношению изменения оптической плотности раствора за первые пять минут исследования к изменению оптической плотности раствора по окончании реакции в опыте, в котором оптическая плотность раствора падает на 50% по окончании реакции по отношению к ее первоначальному значению; в то время как в условиях эксперимента известного способа реакция протекает, в основном, за период времени, меньший пяти минут от момента смешивания реагентов.
Технический результат изобретения заключается в разработке спектрофотометрического способа определения антирадикальной активности антиоксидантов (АО) в экстрактах пищевых и лекарственных растений при исследовании кинетики быстрых реакций между антиоксидантами и стабильным хромоген-радикалом: 2,2-дифенил-1-пикрилгидразилом (ДФПГ), в исключении влияния органических кислот экстракта на процесс исследования и в максимальном приближении условий исследования к реальным процессам, протекающим в биологических объектах - клеточных мембранах - с участием низкомолекулярных антиоксидантов.
Технический результат достигается тем, что готовят серию спиртовых растворов экстракта при различном разведении и раствор ДФПГ в этаноле; полученные растворы смешивают в соотношении, при котором концентрация ДФПГ в смеси равна 10-5÷10-4 моль/л и определяют коэффициент разбавления исходного экстракта, соответствующий концентрации антиоксидантов ЕС50, при которой концентрация ДФПГ в реакционной системе падает по окончании реакции (20÷40 мин от смешивания реагентов при Т=293 К) на 50% по отношению к избранному первоначальному значению концентрации ДФПГ; готовят рабочий раствор соляной кислоты в этаноле, смешивают его с раствором ДФПГ и экстракта в соотношении, при котором концентрация соляной кислоты в реакционной системе равна 1÷40 ммоль/л, концентрация ДФПГ - равна таковой в опыте по определению коэффициента разбавления, соответствующего ЕС50, a концентрация антиоксидантов равна 0,5÷2,0·ЕС50 (ЕС50 - начальная концентрация антиоксидантов в реакционной системе, которая определяется начальной концентрацией ДФПГ и соответствует 50%-ному падению концентрации ДФПГ), регистрируют кинетические кривые падения оптической плотности полученных смесей при длине волны облучения, равной 515÷520 нм, определяют начальную скорость реакции антиоксидантов с ДФПГ и сравнивают полученный результат с таковыми, полученными для других экстрактов при одинаковых значениях температуры реакционной среды и начальных концентраций всех компонентов.
Изобретение поясняется графическими материалами фиг.1÷5 и таблицами 1 и 2.
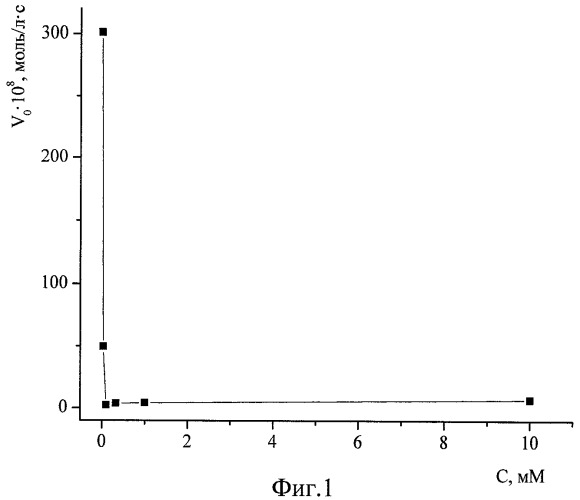
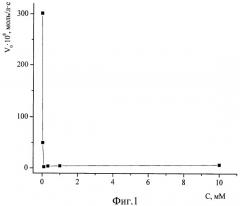
Фиг.1. Зависимость начальной скорости реакции спиртового экстрактов пижмы обыкновенной с ДФПГ в этаноле от концентрации в реакционной среде соляной кислоты. [ДФПГ]0=6,5·10-5 М, [АО]0=ЕС50, Т=293 К.
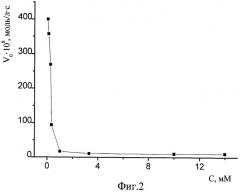
Фиг.2. Зависимость начальной скорости реакции спиртовых экстрактов апельсина обыкновенного с ДФПГ в этаноле от концентрации в реакционной среде соляной кислоты. [ДФПГ]0=6,5·10-5 М, [АО]0=ЕС50, Т=293 К.
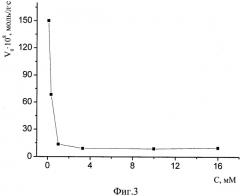
Фиг.3. Зависимость начальной скорости реакции спиртового экстрактов пижмы обыкновенной с ДФПГ в этаноле от концентрации в реакционной среде соляной кислоты. [ДФПГ]0=6,5·10-5 М, [АО]0=ЕС50, Т=293 К.
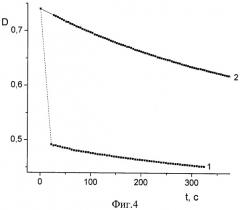
Фиг.4 Кинетические кривые взаимодействия АО пижмы обыкновенной с ДФПГ без введения кислоты (кривая 1) и в присутствии соляной кислоты (кривая 2).
Фиг.5. График зависимости относительного падения оптической плотности растворов от величины, обратной коэффициенту разбавления экстракта.
Таблица 1. Определение относительного падения оптической плотности раствора ДФПГ после 30 минут реакции с АО экстракта яблока различной концентрации.
Таблица 2. Антирадикальная активность антиоксидантов в спиртовых экстрактах пищевых и лекарственных растений. [ДФПГ]0=6,5·10-5 М, [АО]0=ЕС50, Т=293 К.
Исследованием уровня техники установлено, что спектрофотометрических способов определения антирадикальной активности низкомолекулярных антиоксидантов в экстрактах пищевых и лекарственных растений, содержащих смешивание его с раствором ДФПГ и экстракта в соотношении, при котором концентрация соляной кислоты в реакционной системе равна 1÷10 ммоль/л, концентрация ДФПГ равна таковой 10-5÷10-4 моль/л в опыте по определению коэффициента разбавления экстракта, соответствующего ЕС50, а концентрация антиоксидантов равна 0,5÷2,0·ЕС50, регистрацию кинетических кривых падения оптической плотности полученных смесей при длине волны облучения, равной 515÷520 нм, определение начальной скорости реакции антиоксидантов с ДФПГ, сравнение полученного результата с таковыми, полученными для других экстрактов при одинаковых значениях температуры реакционной среды и начальных концентраций всех компонентов, не обнаруживается.
Известен спектрофотометрический способ определения антирадикальной активности антиоксидантов (Silva B.A., Ferreres F, Malva J.O., Dias A.C.P. // Food Chemistry., 2005, v.90, N.1-2, P.157-167, прототип).
Однако сравнение свойств совокупности признаков известного способа и заявляемого показывает, что
- в известном способе реакция антиоксидантов с ДФПГ протекает настолько быстро, что фиксация ее кинетических параметров крайне затруднена, а заявляемый способ позволяет наблюдать начальное превращение компонентов благодаря 10÷50-кратному снижению скорости реакции;
- в известном способе определение начальной скорости реакции практически недостижимо, а заявляемый способ предлагает оптимальные условия для ее определения;
- условия эксперимента в известном способе далеки от реальных процессов, протекающих в биологических мембранах живых организмов, а в заявляемом способе - максимально к ним приближены.
Сущность заявляемого изобретения заключается в следующем.
Вопросам изучения антиоксидантной (АОА) и антирадикальной (АРА) активности индивидуальных веществ, синтетических и натуральных препаратов, биологических жидкостей во всем мире посвящено большое количество исследований. Биологически совместимые вещества, обладающие антиоксидантными свойствами, в живых организмах способны ингибировать процессы окислительной деструкции биологических мембран и биополимеров (нуклеиновые кислоты, белки). В липидной фазе радикальные окислительные процессы происходят по цепному разветвленному механизму, что обусловливает высокую опасность неингибированного процесса для клетки и организма в целом. Так, окисление липопротеидных комплексов плазмы крови является важным звеном в процессе атерогенеза, который приводит к развитию сердечно-сосудистых заболеваний. Отрицательное воздействие ионизирующих излучений на живые организмы основано на запуске ими свободнорадикальных процессов. Повреждение ДНК радикалами является одной из главных причин наследственных мутаций, и, по-видимому, злокачественного перерождения клеток. Старения организмов в результате воздействия на них свободных радикалов в настоящее время является общепризнанным.
По этой причине в лечебной медицинской и ветеринарной практике все большее место занимают синтетические и натуральные препараты с антиоксидантными и антирадикальными свойствами.
Старение и порча растительных и животных масел, а также жиросодержащих продуктов также связано с протеканием свободнорадикальных окислительных процессов, в результате которых образуются токсичные соединения (перекиси, альдегиды, кетоны и т.д.). Поэтому для предотвращения быстрой порчи указанных выше продуктов в них вводят антиоксиданты.
Исходя из сказанного выше, разработка и совершенствование методов количественного, качественного и кинетического анализа антиоксидантов весьма актуальны для медицины, ветеринарии, пищевой, фармацевтической и смежных с ними отраслей промышленности, а также для научно-исследовательской практики в области фармацевтической, биологической, биоорганической, пищевой химии, химии растительного сырья.
Среди различных по механизму действия групп антиоксидантов важнейшая роль принадлежит так называемым антирадикальным антиоксидантам - веществам, взаимодействующим со свободными радикалами с образованием продуктов, не способных к реакциям продолжения цепи окисления либо ведущие эту цепь с меньшей скоростью. К этой группе АО относятся фенолы, ароматические амины, тиолы, каротиноиды (последние, наряду с этим, обладают и свойствами тушителей электронных возбужденных состояний). Следует отметить, что в сухой биомассе высших растений фенольные соединения занимают второе место по массовой доле вещества после углеводов.
Прямые методы оценки антиоксидантной активности (АОА) как индивидуальных химических соединений, так и композиций сложного состава основаны на изучении влияния антиоксидантов на кинетику модельных реакций окисления углеводородов, жирных кислот или биологических материалов. На практике, однако, очень часто пользуются непрямыми методами, в которых изучаются параметры, связанные с антиокислительной активностью антирадикальных антиоксидантов. К их числу относится метод, основанный на взаимодействии АО со стабильным хромоген-радикалом 2,2-дифенил-1-пикрилгидразилом (ДФПГ).
В видимой области спектра ДФПГ в органических растворителях имеет широкий максимум поглощения при длинах волн 515÷520 нм, который исчезает при взаимодействии радикала с веществами - донорами атомов водорода или свободными радикалами иного строения (Бучаченко А.Л., Вассерман А.М. Стабильные радикалы. Электронное строение, реакционная способность и применение. М.: Химия, 1973. - 408 с.: Розанцев Э.Г. Свободные иминоксильные радикалы. М.: Химия, 1970. - 216 с.: Nishimura N. and Moriya Т. // Bull. Chem. Soc. Jap. 1977. Vol. 50(8). P.1969-1974).
Реакция ДФПГ с антирадикальными антиоксидантами происходит по последовательно-параллельному механизму. На первом этапе (лимитирующая стадия реакции) молекула антиоксиданта отдает радикалу самый подвижный атом водорода:
На втором этапе образовавшийся в реакции (1) радикал антиоксиданта атакует новую молекулу ДФПГ в пара-положении фенильного заместителя:
В результате этого также образуется неокрашенный продукт реакции. Реакция (1) может протекать по двум независимым механизмам (Litwinienko G., Ingold K.U. // J. Org. Chem. 2004. Vol.69. P.5888 - 5896): HAT (hydrogen atom transfer) и SPLET (sequential proton loss - electron transfer). Первый, основанный на непосредственном отрыве атома водорода от молекулы АО, протекает с наибольшей скоростью в неполярных растворителях. Второй, основанный на передаче электрона молекулой ионизированного фенольного АО молекуле ДФПГ, преобладает в растворителях, имеющих высокое сродство к протону.
Почти во всех органических растворителях реакция протекает с большой скоростью, что затрудняет кинетические исследования, вынуждая авторов исследований ограничиваться лишь нахождением количества АО в растительном экстракте. Кроме того, в наиболее часто используемых органических растворителях (метанол, этанол) наибольшую скорость имеет механизм реакции SPLET, в то время как в липидной фазе в процессе ингибирования перекисного окисления липидов антиоксиданты взаимодействуют с радикалами по механизму HAT, что ставит под сомнение адекватность любых сопоставлений антиоксидантной активности вытяжек из растений с их реакционной способностью в отношении ДФПГ (Litwinienko G., Ingold K.U. // J. Org. Chem. 2003. Vol.68. P.3433-3438).
Попытку создания кинетического метода анализа антирадикальных свойств экстрактов растений, предпринятую в прототипе, нельзя назвать удачной. Кинетический параметр (отношение глубины превращения радикала за первые пять минут реакции к глубине превращения радикала по окончании реакции), предложенный в прототипе, является некорректным, поскольку быстрая фаза процесса всегда длится менее пяти минут.
Мы предлагаем использовать начальную скорость реакции при определенных, фиксированных значениях начальной концентрации ДФПГ и суммы антиоксидантов, в качестве кинетического параметра для сравнения АРА экстрактов различных растений.
В соответствии с законами формальной кинетики
где V0 - начальная скорость реакции, (kэфф)0 - эффективная (кажущаяся) константа скорости реакции в начальный момент времени, m и n - эффективные (кажущиеся) частные порядки реакции по ДФПГ и АО соответственно. Для фенольных АО n=m=1. Таким образом, V0 линейно связана с (kэфф)0.
По своему физическому смыслу (kЭфф)0 есть сумма констант скоростей взаимодействия индивидуальных антиоксидантов с ДФПГ на первой стадии, умноженных на их мольную долю в сумме АО данного экстракта:
где (C1)0, (С2)0, …, (Сn)0; k1, k2, …, kn - начальные концентрации индивидуальных АО и соответствующие им константы скорости реакции с ДФПГ на первой стадии.
kэфф является переменной, монотонно убывающей величиной, поскольку в ходе реакции меняется состав АО в сторону уменьшения доли наиболее активных соединений, быстро расходующихся в начале процесса.
Значение величины V0, как и (kЭфф)0, определяется, главным образом, величинами констант скорости и мольной долей в сумме АО наиболее активных компонентов, которые и вносят наибольший вклад в антиоксидантные свойства экстракта.
То, что вычисление V0 позволяет «увидеть» самые активные АО, дает преимущества этой величине по сравнению с временем полупревращения ДФПГ (t1/2), предложенным в качестве кинетического параметра в [16]. В последнем случае из-за изменения состава АО в ходе реакции время полупревращения будет обратно пропорционально не (kЭфф)0, а некому среднему значению kэфф<(kЭфф)0 за период от смешивания реагентов до t1/2. Это значение kЭфф будет соответствовать тому моменту, когда самые активные антиоксиданты уже израсходовались.
Отличительными преимуществами предлагаемых нами условий проведения реакции ДФПГ с экстрактивными веществами растений являются следующие:
1. Значительное 10÷50-кратное снижение скорости реакции за счет введения в среду соляной кислоты в подобранной оптимальной концентрации 1÷40 мМоль/л позволяет наблюдать процесс, начиная с самых малых глубин превращения компонентов, когда еще не израсходовались наиболее активные антиоксиданты, без применения специального оборудования для исследования кинетики быстрых реакций, а также в условиях создания многократного избытка по АО над ДФПГ (кинетика псевдопервого порядка). Зависимость начальной скорости реакции спиртового экстрактов пижмы обыкновенной с ДФПГ в этаноле от концентрации в реакционной среде соляной кислоты демонстрирует фиг.1. Аналогичные зависимости для спиртовых экстрактов плодов апельсина и грейпфрута изображены на фиг.2 и 3 соответственно. Условия проведения этих экспериментов: [ДФПГ]0=6,5·10-5 М, [АО]0=ЕС50, Т=293 К. Эти иллюстрации показывают, что при концентрации соляной кислоты в реакционной среде в интервале 1÷10 ммоль/л наблюдается минимум величин скоростей реакций антиоксидантов всех исследованных экстрактов с ДФПГ в среде этанола. При концентрациях НС1, превышающих 20 мМ, наблюдается резкое и значительное падение оптической плотности реакционной системы при λ=515÷520 нм, что затрудняет вычисление начальной скорости. Аналогичные результаты получены при экспериментах с водным извлечением из чая "Каркаде". Фиг.4 демонстрирует кинетические кривые взаимодействия АО пижмы обыкновенной с ДФПГ без введения кислоты (кривая 1) и в присутствии соляной кислоты (кривая 2). Если без добавления кислоты в самом начале процесса наблюдается такое резкое падение оптической плотности радикала (обозначено пунктирной линией), что анализировать такую кривую не представляется возможным даже в условиях недостатка по АО, то в случае 1 мМ раствора HCl в этаноле наблюдается плавное снижение концентрации радикала, что обеспечивает высокую точность измерений и удобство в работе.
2. Подавление механизма SPLET реакции ДФПГ с экстрактивными веществами растений в предложенных нами условиях реакции приводит к тому, что АО реагируют с радикалом только по механизму HAT, по которому они взаимодействуют в липидной фазе с радикалами, ведущими цепи перекисного окисления.
3. Исключается влияние на кинетику реакции органических кислот, которые содержатся в экстрактах растений в различных концентрациях и имеют различные значения pKa.
Описание способа и необходимое оборудование
Реактивы: спирт этиловый, очищенный перегонкой (tкип=77,4°C (азеотропная смесь с водой), кислота соляная х.ч. (фиксанал), 2,2-дифенил-1-пикрилгидразил (ДФПГ).
Оборудование
1. Двухлучевой спектрофотометр, позволяющий записывать кинетические кривые падения оптической плотности в автоматическом режиме, снабженный термостатируемыми кюветодержателями (типа Спекорд М40), а также компьютером с установленным на нем управляющим программным обеспечением и программами, позволяющими производить математическую обработку кинетических кривых (Microcal Origin 7.0, SYSTAT TableCurve 2D 5.01 или другие, сходные по функциональным возможностям).
2. Термостат, снабженный термометром и шлангами для присоединения термостатируемых кюветодержателей.
3. Стеклянные или кварцевые кюветы для спектрофотометра.
Методика проведения анализа
1. Приготовление рабочего раствора ДФПГ в этаноле концентрации [ДФПГ]р, превышающей выбранную начальную концентрацию ДФПГ в реакционной смеси.
2. Приготовление серии разбавлений экстракта пищевого или лекарственного растения этанолом.
3. Приготовление рабочего раствора соляной кислоты в этаноле. Фиксанал с концентрированной соляной кислотой, предназначенный для приготовления одного литра 0,1 М раствора HCl, выливают в мерную посуду емкостью 100 мл и объем доводят до метки этиловым спиртом. Из полученного раствора путем разбавления получают рабочий спиртовой раствор HCl, концентрация которого рассчитывается по формуле:
где Vсист - общий объем реакционной системы, мл; VHC1 - объем соляной кислоты, вводимый в реакционную систему, мл; [HCl]сист - концентрация соляной кислоты в реакционной системе, моль/л.
4. Стандартизация экстракта пищевого или лекарственного растения по концентрации веществ, активных в отношении ДФПГ, путем определения коэффициента разбавления исходного экстракта при его введении в реакционную смесь с выбранной начальной концентрацией ДФПГ [ДФПГ]0 10-5÷10-4 моль/л, необходимого для достижения степени конверсии ДФПГ, равной 50%, по окончании реакции (20÷40 мин с момента смешивания реагентов при Т=293 К).
В чистые пробирки наливают равные объемы ДФПГ, рассчитываемые по формуле:
Затем в пробирки приливают равные объемы спиртовых растворов экстракта из серии разведений, объем каждой из пробирок доводят этанолом до Vсист. В контрольном опыте вместо раствора экстракта в реакционную систему вводится идентичный объем этанола. Через 20÷40 мин после смешивания реагентов регистрируют оптическую плотность, после чего для каждого опыта (каждого коэффициента разбавления экстракта) производят подсчет падения концентрации ДФПГ относительно контроля:
где Dэксп - оптическая плотность реакционной системы по окончании реакции, Dконтр, - оптическая плотность контрольного раствора.
Далее строят график линейной зависимости величины PI от величины, обратной коэффициенту разбавления экстракта. Из графика определяют значение коэффициента разбавления экстракта, при котором РI=50%, что соответствует начальной концентрации антиоксидантов в реакционной смеси [АО]0=ЕС50.
5. Смешивание растворов ДФПГ, экстракта и соляной кислоты и запись кинетической кривой. В кювету спектрофотометра помещают спиртовой раствор растительного экстракта в объеме и разведении, соответствущем [АО]0=0,5÷2,0·ЕС50 в реакционной системе объема Vсист, добавляют раствор HCl в этиловом спирте в объеме VHC1, взятом при расчете по формуле (5) и раствор ДФПГ в объеме VДФПГ, рассчитанном по формуле (6), объем реакционной смеси доводят этанолом до Vсист, быстро перемешивают, после чего сразу начинают регистрировать кинетическую кривую падения оптической плотности радикала при λ=515÷520 нм. С точки зрения удобства проведения эксперимента, оптимально, если начальная оптическая плотность ДФПГ в реакционной системе выбирается в диапазоне 0,7-1,5.
6. Определение начальной скорости реакции как первой производной кинетической кривой падения концентрации ДФПГ в реакционной системе в начальный момент времени (программные средства Microcal Origin 7.0, SYSTAT TableCurve 2D 5.01 или другие, сходные по функциональным возможностям). Кинетические кривые падения оптической плотности ДФПГ при взаимодействии с АО экстрактов растений с высокой точностью описываются функцией вида
где Dдфпг - оптическая плотность раствора при λ=(515÷520) нм, t -
время от начала реакции, D∞, А1 А2, А3, а1 а2, а3 - параметры, подбираемые компьютерной программой. Таким образом, зная время от смешивания реагентов до начала регистрации кинетической кривой прибором и начальную оптическую плотность ДФПГ, можно аппроксимировать кривую на начальный момент и вычислить начальную скорость:
где εдфпг - молярный коэффициент экстинкции ДФПГ в этаноле, равный (1,15±0,02)·104 моль-1·см-1 (Foti М.С., Daquino С., Geraci С. // J. Org Chem. 2004. V.69. №7. P.2309-2314).
Применение уравнений (8) и (9) позволяет сгладить шумы на кинетических кривых и, таким образом, снизить погрешности при их дифференцировании, а также аппроксимировать кривые на момент t=0, поскольку на использованном нами оборудовании период от смешивания реагентов до начала регистрации кинетической кривой составлял около 20 с.
7. Сравнение начальных скоростей взаимодействия антиоксидантов различных экстрактов с ДФПГ. Прямое сравнение возможно только между результатами, полученными при одинаковых значениях начальных концентраций ДФПГ и АО, а также концентрации HCl в реакционной смеси и одинаковой температуре.
Способ осуществляется следующим образом.
Готовят серию разбавлений экстракта антиоксиданта этиловым спиртом, строят график зависимости величины PI от величины, обратной коэффициенту разбавления экстракта.
По графику определяют значение коэффициента разбавления экстракта, при котором PI=50%, смешивают растворы ДФПГ, экстракта и соляной кислоты, записывают кинетическую кривую.
Затем определяют начальную скорость реакции как первую производную кинетической кривой падения концентрации ДФПГ в реакционной смеси в начальный момент времени.
Итоговая процедура - сравнение начальных скоростей взаимодействия антиоксидантов различных экстрактов с ДФПГ.
Пример
Готовили серию разбавлений экстракта мякоти яблок этиловым спиртом в 1.3; 1.6; 2 и 3 раза.
В пять чистых пробирок налили по 2,4 мл 8,7·10-5 М раствора ДФПГ в этаноле и 0,15 мл раствора экстракта из приготовленной серии разбавлений, как указано в таблице 1. Объем реакционных систем в пробирках доводили до 3,2 мл этиловым спиртом и выдерживали 30 мин в термостате при Т=293 К без доступа света, после чего измеряли оптическую плотность Dэксп раствора из каждой пробирки в кювете толщиной 1 см. Контрольный опыт проводили таким же образом, за исключением того, что в систему вместо экстракта вводился аналогичный объем этанола. Значения величин падения оптической плотности растворов в каждом из опытов относительно контроля (в процентах), рассчитанные по формуле
,
где Dэксп - оптическая плотность реакционной системы в через 30 мин после начала реакции, Dконтр - оптическая плотность контрольного раствора, приведены в таблице 1.
Из графика зависимости относительного падения оптической плотности растворов в опытах от величины, обратной коэффициенту разбавления экстракта (Фиг.5) следует, что в указанных выше условиях проведения эксперимента падение оптической плотности ДФПГ за первые 30 мин реакции без добавления кислоты составляет 50% при разбавлении исходного экстракта в 1/0,92=1,09 раза.
Для определения значения искомого кинетического параметра V0 в термостатируемую (Т=293 К) кювету налили 0,15 мл экстракта мякоти яблок, разбавленного в 1,09 раза этанолом, 0,35 мл 3·10-2 М раствора HCl в этиловом спирте и 0,3 мл этилового спирта, после чего прилили 2,4 мл 8,7·10-5 М раствора ДФПГ в этаноле, предварительно термостатированного при 293 К, быстро перемешали реакционную систему и тотчас же запустили программу непрерывной записи оптической плотности при λ=517 нм. Время регистрации кинетической кривой падения оптической плотности ДФПГ в ходе реакции - около 5 минут. Кинетическую кривую с помощью буфера обмена компьютера в виде последовательности пар чисел перенесли в программное средство Microcal Origin 7.0, к колонке времени прибавили 19 секунд - время от смешивания реагентов до начала регистрации кинетической кривой спектрофотометром. После построения графического изображения кривой с помощью кнопок программного меню ANALYSIS - FIT EXPONENTIAL DECAY- THIRD ORDER определяли значения параметров функции, описывающей данную кривую и вычисляли начальную скорость реакции:
(так как в данном случае значение члена А3/а3 на много порядков меньше A1/a1 и А2/а2, при вычислениях он не учитывался);
Повторная запись кинетической кривой:
(по причине, указанной выше, учитывался только первый член многочлена, стоящего в скобках).
Таким образом, среднее значение начальной скорости реакции
ПРИМЕЧАНИЕ. Параметры а1, а2 и а3 в программе Origin обозначены как t1, t2 и t3 соответственно. Так как буква t является обозначением времени в формулах, была произведена замена t на a во избежание путаницы.
Результаты определения антирадикальной активности антиоксидантов в спиртовых экстрактах некоторых пищевых и лекарственных растений ([ДФПГ]0=6,5·10-5 М, [АО]0=ЕС50, Т=293 К) приведены в таблице 2. Видно, что чем больше начальная скорость реакции, тем выше антирадикальная активность антиоксидантов. Наибольшей антирадикальной активностью среди исследованных антиоксидантов обладают лимон и яблоко сорта “Гольден”.
| Таблица 1 | ||||
| № пробирки | К (коэфф. разбавления) | K-1 | Dэксп | PI, % |
| 1 | 1,0 (не разбавленный) | 1,0 | 0,34 | 55 |
| 2 | 1,3 | 0,77 | 0,45 | 40 |
| 3 | 1,6 | 0,63 | 0,49 | 35 |
| 4 | 2,0 | 0,5 | 0,56 | 25 |
| 5 | 3,0 | 0,33 | 0,62 | 17 |
| Контроль | Чистый этанол (95%) | 0 | 0,75 | 0 |
| Таблица 2 | ||
| № п.п. | Растение | V0·108, моль/л·с |
| 1 | Пижма обыкновенная (листья) | 5,0 |
| 2 | Чеснок (луковицы) | 6,6 |
| 3 | Лук (луковицы) | 10,1 |
| 4 | Виноград (плоды) | 7,5 |
| 5 | Яблоко (сорт «Гольден») | 11,5 |
| 6 | Лимон (плоды) | 12,5 |
| 7 | Апельсин (плоды) | 10,6 |
| 8 | Грейпфрут (плоды) | 9,1 |
Спектрофотометрический способ определения антирадикальной активности низкомолекулярных антиоксидантов в экстрактах пищевых и лекарственных растений, содержащий приготовление серии спиртовых растворов экстракта при различном разведении, приготовление раствора (ДФПГ1) 2,2-дифенил-1-пикрилгидразила ДПФГ в этаноле; смешивание спиртового экстракта растений с раствором 2,2-дифенил-1-пикрилгидразила; регистрацию изменения оптической плотности полученного раствора во времени, определение коэффициента разбавления исходного экстракта, соответствующего концентрации антиоксидантов ЕС50, при которой концентрация ДФПГ в реакционной системе падает по окончании реакции на 50% по отношению к избранному первоначальному значению концентрации ДФПГ в растворе; построение кинетических кривых, отличающийся тем, что приготавливают раствор соляной кислоты в этаноле, смешивают спиртовые растворы экстракта растения, соляной кислоты и 2,2-дифенил-1-пикрилгидразила в соотношении, при котором концентрация соляной кислоты равна 1÷10 ммоль/л, концентрация 2,2-дифенил-1-пикрилгидразила равна 10-5÷10-4 моль/л, а концентрация антиоксидантов - 0,5÷2,0·ЕС50, регистрируют кинетические кривые падения оптической плотности полученных смесей при длине волны облучения, равной 515÷520 нм, определяют начальную скорость реакции низкомолекулярных антиоксидантов с 2,2-дифенил-1-пикрилгидразилом и сравнивают результаты, полученные для экстрактов при одинаковых значениях температуры реакционной среды и одинаковых начальных концентрациях всех компонентов.